Resumos
Foram analisadas 664 amostras de leite de 83 vacas primíparas da raça Holandesa. As amostras foram colhidas no primeiro e no sétimo dia após o parto. Das 664 amostras analisadas, 488 (73,50%) foram bacteriologicamente negativas e 176 (26,50%), positivas para microrganismos aeróbios. Foi observado um alto índice de mastite clínica (20,48%). Os agentes isolados com maior freqüência foram os Staphylococcus spp coagulase negativo (64,20%), Staphylococcus spp coagulase positivo (8,52%), Streptococcus spp (7,96%), Actinomyces pyogenes (4,55%), Mycoplasma bovigenitalium (3,40%) e Escherichia coli (2,84%). Foi observado um maior índice de isolamento de patógenos no primeiro dia (17,62%) em relação ao sétimo (8,88%).
bovina; mastite; vacas primíparas; etiologia
A total of 664 foremilk samples from 83 Holstein cows were cultured. Quarter samples were collected at parturition and 7 days post the first parturition. From 664 milk samples examined, 488 (73.50%) were bacteriologically negative and 176 (26.50%) were positive. A high incidence (20.48%) of clinical mastitis was observed. The most frequently encountered isolates were coagulase negative staphylococci (64.20%), coagulase positive staphylococci (8.52%), streptococci (7.96%), Actinomyces pyogenes (4.55%), Mycoplasma bovigenitalium (3.40%) and Escherichia coli (2.84%). The frequency of mastitis pathogen isolation was highest at parturition (17.62%) and decreased markedly during the first week (8.88%).
Bovine; mastitis; primiparous cows; etiology
Etiologia das infecções intramamárias em vacas primíparas no período pós-parto1 1 Aceito para publicação em 22 de abril de 1998. Parte da dissertação de Mestrado em Sanidade Animal/UEL do primeiro autor. Projeto aprovado pelo CNPq. 2 Acadêmico de Mestrado em Sanidade Animal, Depto Med. Vet. Preventiva, Universidade Estadual de Londrina (UEL), Cx. Postal 6001, Londrina, PR 86051-990. 3 Depto Med. Vet. Prev., UEL. Autor para correspondência. 4 Depto Epidemiologia e Saúde Pública, Inst. Veterinária, UFRRJ, Km 47, Seropédica, RJ 23851-970. 5 Acadêmico da UEL, bolsista do PIBIC/CNPq.
Paulo Eduardo Pardo2 1 Aceito para publicação em 22 de abril de 1998. Parte da dissertação de Mestrado em Sanidade Animal/UEL do primeiro autor. Projeto aprovado pelo CNPq. 2 Acadêmico de Mestrado em Sanidade Animal, Depto Med. Vet. Preventiva, Universidade Estadual de Londrina (UEL), Cx. Postal 6001, Londrina, PR 86051-990. 3 Depto Med. Vet. Prev., UEL. Autor para correspondência. 4 Depto Epidemiologia e Saúde Pública, Inst. Veterinária, UFRRJ, Km 47, Seropédica, RJ 23851-970. 5 Acadêmico da UEL, bolsista do PIBIC/CNPq. , Elena Mettifogo3 1 Aceito para publicação em 22 de abril de 1998. Parte da dissertação de Mestrado em Sanidade Animal/UEL do primeiro autor. Projeto aprovado pelo CNPq. 2 Acadêmico de Mestrado em Sanidade Animal, Depto Med. Vet. Preventiva, Universidade Estadual de Londrina (UEL), Cx. Postal 6001, Londrina, PR 86051-990. 3 Depto Med. Vet. Prev., UEL. Autor para correspondência. 4 Depto Epidemiologia e Saúde Pública, Inst. Veterinária, UFRRJ, Km 47, Seropédica, RJ 23851-970. 5 Acadêmico da UEL, bolsista do PIBIC/CNPq. , Ernst Eckehardt Müller3 1 Aceito para publicação em 22 de abril de 1998. Parte da dissertação de Mestrado em Sanidade Animal/UEL do primeiro autor. Projeto aprovado pelo CNPq. 2 Acadêmico de Mestrado em Sanidade Animal, Depto Med. Vet. Preventiva, Universidade Estadual de Londrina (UEL), Cx. Postal 6001, Londrina, PR 86051-990. 3 Depto Med. Vet. Prev., UEL. Autor para correspondência. 4 Depto Epidemiologia e Saúde Pública, Inst. Veterinária, UFRRJ, Km 47, Seropédica, RJ 23851-970. 5 Acadêmico da UEL, bolsista do PIBIC/CNPq. , Elmiro Rosendo do Nascimento4 1 Aceito para publicação em 22 de abril de 1998. Parte da dissertação de Mestrado em Sanidade Animal/UEL do primeiro autor. Projeto aprovado pelo CNPq. 2 Acadêmico de Mestrado em Sanidade Animal, Depto Med. Vet. Preventiva, Universidade Estadual de Londrina (UEL), Cx. Postal 6001, Londrina, PR 86051-990. 3 Depto Med. Vet. Prev., UEL. Autor para correspondência. 4 Depto Epidemiologia e Saúde Pública, Inst. Veterinária, UFRRJ, Km 47, Seropédica, RJ 23851-970. 5 Acadêmico da UEL, bolsista do PIBIC/CNPq. , Melissa Buzinhani5 1 Aceito para publicação em 22 de abril de 1998. Parte da dissertação de Mestrado em Sanidade Animal/UEL do primeiro autor. Projeto aprovado pelo CNPq. 2 Acadêmico de Mestrado em Sanidade Animal, Depto Med. Vet. Preventiva, Universidade Estadual de Londrina (UEL), Cx. Postal 6001, Londrina, PR 86051-990. 3 Depto Med. Vet. Prev., UEL. Autor para correspondência. 4 Depto Epidemiologia e Saúde Pública, Inst. Veterinária, UFRRJ, Km 47, Seropédica, RJ 23851-970. 5 Acadêmico da UEL, bolsista do PIBIC/CNPq. , Maurício Yamaguti5 1 Aceito para publicação em 22 de abril de 1998. Parte da dissertação de Mestrado em Sanidade Animal/UEL do primeiro autor. Projeto aprovado pelo CNPq. 2 Acadêmico de Mestrado em Sanidade Animal, Depto Med. Vet. Preventiva, Universidade Estadual de Londrina (UEL), Cx. Postal 6001, Londrina, PR 86051-990. 3 Depto Med. Vet. Prev., UEL. Autor para correspondência. 4 Depto Epidemiologia e Saúde Pública, Inst. Veterinária, UFRRJ, Km 47, Seropédica, RJ 23851-970. 5 Acadêmico da UEL, bolsista do PIBIC/CNPq. e Júlio Cesar de Freitas3 1 Aceito para publicação em 22 de abril de 1998. Parte da dissertação de Mestrado em Sanidade Animal/UEL do primeiro autor. Projeto aprovado pelo CNPq. 2 Acadêmico de Mestrado em Sanidade Animal, Depto Med. Vet. Preventiva, Universidade Estadual de Londrina (UEL), Cx. Postal 6001, Londrina, PR 86051-990. 3 Depto Med. Vet. Prev., UEL. Autor para correspondência. 4 Depto Epidemiologia e Saúde Pública, Inst. Veterinária, UFRRJ, Km 47, Seropédica, RJ 23851-970. 5 Acadêmico da UEL, bolsista do PIBIC/CNPq.
ABSTRACT.- Pardo P.E., Mettifogo E., Müller E.E., Nascimento E.R., Buzinhani M., Yamaguti M. & Freitas J.C. 1998. [Etiology of intramammary infections in primiparous cows at postparturition.] Etiologia das infecções intramamárias em vacas primíparas no período pós-parto. Pesquisa Veterinária Brasileira 18(3/4):115-118. Depto Medicina Veterinária Preventiva/CCA, Universidade Estadual de Londrina, Campus Universitário, Cx. Postal 6001, Londrina, PR 86051-990, Brazil.
A total of 664 foremilk samples from 83 Holstein cows were cultured. Quarter samples were collected at parturition and 7 days post the first parturition. From 664 milk samples examined, 488 (73.50%) were bacteriologically negative and 176 (26.50%) were positive. A high incidence (20.48%) of clinical mastitis was observed. The most frequently encountered isolates were coagulase negative staphylococci (64.20%), coagulase positive staphylococci (8.52%), streptococci (7.96%), Actinomyces pyogenes (4.55%), Mycoplasma bovigenitalium (3.40%) and Escherichia coli (2.84%). The frequency of mastitis pathogen isolation was highest at parturition (17.62%) and decreased markedly during the first week (8.88%).
INDEX TERMS: Bovine, mastitis, primiparous cows, etiology.
RESUMO.- Foram analisadas 664 amostras de leite de 83 vacas primíparas da raça Holandesa. As amostras foram colhidas no primeiro e no sétimo dia após o parto. Das 664 amostras analisadas, 488 (73,50%) foram bacteriologicamente negativas e 176 (26,50%), positivas para microrganismos aeróbios. Foi observado um alto índice de mastite clínica (20,48%). Os agentes isolados com maior freqüência foram os Staphylococcus spp coagulase negativo (64,20%), Staphylococcus spp coagulase positivo (8,52%), Streptococcus spp (7,96%), Actinomyces pyogenes (4,55%), Mycoplasma bovigenitalium (3,40%) e Escherichia coli (2,84%). Foi observado um maior índice de isolamento de patógenos no primeiro dia (17,62%) em relação ao sétimo (8,88%).
TERMOS DE INDEXAÇÃO: bovina, mastite, vacas primíparas, etiologia.
INTRODUÇÃO
A mastite constitui-se na enfermidade mais comum em vacas leiteiras, acarretando prejuízos significativos ao produtor (Seykora & McDaniel 1985, Miller & Dorn 1987). Nas suas principais formas de apresentação, clínica e subclínica, a doença é causada por um grande número de microrganismos (Rainard & Poultrel 1982).
As medidas de controle da mastite restringem-se normalmente às vacas em lactação, destacando-se como medidas usuais a imersão dos tetos com solução anti-séptica, manutenção e desinfecção da ordenhadeira, descarte de animais crônicos e tratamento das vacas no período seco (Dodd 1983, Bramley & Dodd 1984). Com relação às novilhas, técnicos e produtores, via de regra, não adotam nenhuma medida preventiva por considerarem esta categoria de animais refratária às infecções da glândula mamária (Hallberg et al. 1995). Entretanto, muitos trabalhos têm demonstrado a ocorrência de infecções da glândula mamária em novilhas (Meaney 1981, Oliver & Mitchell 1983, Pankey et al. 1991, Boddie et al. 1987, Myllys 1995). Na fase de formação do tecido glandular, estas infecções podem acarretar diminuição na produção e qualidade do leite nas futuras lactações (Boddie et al. 1987, Trinidad et al. 1990, Matthews et al. 1992).
Vários patógenos da glândula mamária foram isolados de novilhas em diferentes faixas etárias. Entre os "patógenos maiores", destacam-se Staphylococcus aureus e Streptococcus agalactiae e entre os "patógeno menores", predominam os estafilococos coagulase negativos (ECN), além de coliformes e estreptococos responsáveis pelas mastites de meio ambiente (McDonald 1982, Oliver & Mitchell 1983, Daniel et al. 1986, Oliver 1987). No Brasil, poucos são os relatos sobre infecções intramamárias em novilhas (Costa et al. 1996).
Nos últimos anos, em função da importância que as infecções intramamárias em novilhas vem assumindo, diferentes medidas de controle têm sido pesquisadas. Medidas como a imersão dos tetos em solução anti-séptica a partir de sete dias antes do parto não diminuíram as infecções logo após o parto (Schultze 1985). Por outro lado, resultados obtidos com a infusão intramamária de antimicrobianos de longa ação no peri-parto, demonstraram uma diminuição das infecções imediatamente após o parto (Trinidad et al. 1990, Oliver et al. 1992, 1997). A manutenção das novilhas prenhes em ambiente limpo e seco, evitando ainda a superlotação e o controle de vetores foram medidas preventivas consideradas úteis (Shearer & Harmon 1993).
Este trabalho teve por objetivo o isolamento e a caracterização de microrganismos causadores de mastite em vacas primíparas na primeira semana após o parto.
MATERIAL E MÉTODOS
Foram pesquisados 83 animais de primeira cria da raça holandesa preto e branco de 12 propriedades de alta produtividade da Região Norte do Paraná. Nestas propriedades, as medidas usuais para o controle da mastite eram aplicadas somente nas vacas em lactação e nas vacas secas. Foram colhidas 332 amostras de leite na primeira ordenha após o parto e 332 no sétimo dia após o parto, totalizando 664 amostras. A colheita das amostras de leite foi precedida por limpeza e anti-sepsia dos tetos com álcool 70ºGL. As amostras acondicionadas em frascos de rosca foram congeladas a -20ºC nas propriedades. A caracterização da mastite clínica foi baseada na observação de sintomas nos animais como edema, hiperemia, aumento da temperatura e da sensibilidade, as alterações macroscópicas do leite, bem como sintomas sistêmicos.
No laboratório, o leite foi semeado em placas de ágar sangue ovino 5% e ágar MacConkey e as placas incubadas a 37º C em aerofilia por até cinco dias. Para o isolamento de micoplasma foi utilizado o ágar Hayflick modificado e as placas incubadas em microerofilia, com cerca de 10% de CO2, a 37ºC por até 14 dias. A identificação dos microrganismos foi realizada segundo as características culturais, morfológicas, tintoriais e bioquímicas (Edwards 1986, National Mastitis Council 1987, Carter 1988). A caracterização das cepas de micoplasma, foi realizada por meio do teste de imunofluorescência direta, utilizando conjugado de fluoresceína e anticorpo específico (FITC), contra as espécies de micoplasma comumente causadoras de mastite em bovinos (Whitford et al. 1994).
A diferença em relação ao número de amostras positivas no primeiro e sétimo dia foi analisada por meio do teste do X2 (Qui-quadrado), corrigido de Yates com a=0,05.
RESULTADOS E DISCUSSÃO
Das 83 vacas primíparas examinadas no período pós-parto, 17 (20,48%) apresentaram sinais de mastite clínica em um ou mais quartos, cujos resultados bacteriológicos são apresentados no Quadro 1. Nas infecções singulares, observa-se uma predominância dos SCN (35,29%), seguidos por Streptococcus spp (8,82%), Actinomyces pyogenes (7,35%), E. coli (7,35%), Mycoplasma bovigenitalium (5,88%), estafilococos coagulase positivos (ECP) em (4,41%) e Criptococcus neoformans (1,47%). Estes dados demonstram uma alta ocorrência de mastite clínica em vacas primíparas no início da lactação, bem como a participação dos ECN. Este índice é elevado se considerarmos que os ECN são denominados patógenos menores da glândula mamária e geralmente associados a infecções subclínicas (Matthews et al. 1992). Pesquisadores como Hodges et al. (1984) e Myllys (1995), associaram igualmente os ECN às mastites clínicas.
Nas 176 amostras com isolamento bacteriano, os ECN foram isolados em 64,2% (Fig. 1). Resultados próximos a estes foram encontrados por Myllys (1995). Boddie et al. (1987), Trinidad et al. (1990) e Hallberg et al. (1995) evidenciaram histologicamente alterações no tecido secretor, enquanto que Linde (1982), estimou as perdas na produção de leite em 10,3% nas infecções persistentes por ECN.
Distribuição em porcentagem dos microrganismos isolados das 176 amostras positivas de leite das vacas primíparas no 1º e 7º dia pós-parto. ECN: Estafilicocos coagulase negativos; ECP: Estafilococos coagulase positivos. *Outros: incluindo os demais patógenos e as associações.
Ressalta-se o isolamento de M. bovigenitalium nos quatro quartos de um animal com mastite clínica. Na literatura nacional consultada, não foi encontrada nenhuma referência sobre a participação deste patógeno em casos de mastite bovina.
Os demais patógenos listados no Quadro 1 são tradicionalmente isolados de mastite clínica em novilhas e em vacas (Lean et al. 1987, Oliver 1987, Shearer & Harmon 1993).
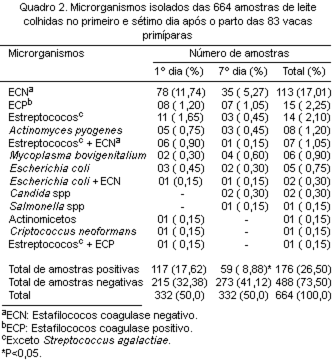
No Quadro 2, constam os resultados bacteriológicos das 664 amostras de leite examinadas. Das amostras estudadas, 176 (26,50%) apresentaram crescimento de microrganismos e 488 (73,50%) foram bacteriologicamente negativas. Índices próximos ou superiores a estes foram descritos por Oliver & Mitchell (1983), Daniel et al. (1986), Oliver (1987) e Fox et al. (1995).
Em relação ao período da colheita, foi observada uma diminuição significativa (P<0,05) no número de amostras positivas, de 117 (17,62%) no primeiro dia para 59 (8,88%) no sétimo dia após o parto. Este decréscimo provavelmente tenha ocorrido em função das ordenhas subseqüentes e da eliminação espontânea dos microrganismos.
Os microrganismos isolados da glândula mamária com maior frequência em relação ao total das amostras examinadas foram os ECN (17,01%), ECP (2,25%), estreptococos (exceto St. agalactiae) em 2,10%, Actinomyces pyogenes (1,20%) e M. bovigenitalium (0,90%). Nas infecções mistas predominou a associação de Streptococcus spp com ECN. Vários autores demonstraram igualmente a predominância dos ECN nas infecções intramamárias de novilhas, com percentuais variando de 11 a 49,0% das amostras (Oliver 1987, Fox et al. 1995, Costa et al. 1996).
Das 15 (8,52%) amostras de leite com ECP, 14 foram identificadas como S. aureus e uma como S. intermedius. A ocorrência de S. aureus em infecções intramamárias em novilhas tem sido relatada com índices variando de 2 a 50% (Pankey et al. 1991, Matthews et al. 1992). A transmissão de S. aureus ocorre principalmente durante a ordenha o que pode justificar o reduzido número de infecções nos animais estudados.
Os estreptococos foram isolados em 22 amostras, sendo 14 em cultura pura (7,96% das amostras positivas (Fig. 1) e 08 associadas ao ECN e ECP. E. coli foi isolada em cultura pura em 05 amostras (2,84% das amostras positivas, Fig. 1) e em 02 amostras associadas aos ECN. Em nenhuma amostra foi isolado St. agalactiae, provavelmente em função das medidas preventivas adotadas nas propriedades estudadas, como a imersão dos tetos, o tratamento de vacas secas e demais medidas de higiene e desinfecção. A presença deste patógeno em infecções intramamárias em novilhas está relacionada com a ocorrência nas vacas em lactação e com o manejo dos bezerros (Shearer & Harmon 1993). Em rebanhos com ausência de St. agalactiae e baixa ocorrência de S. aureus, os patógenos ambientais passam a representar um problema (Smith et al. 1985).
No Quadro 3, observou-se que 28,9% dos quartos apresentaram infecção somente no primeiro dia pós-parto, em 6,62% dos quartos as infecções persistiram e o número de novas infecções foi de 10,84%. Estes resultados sugerem que a primeira semana pós-parto é um período bastante dinâmico com relação à epidemiologia da mastite bovina. Apesar da diminuição da ocorrência de infecções intramamárias na primeira semana demonstrarem o caráter transitório de alguns microrganismos, deve-se ressaltar que a persistência e a ocorrência de novas infecções ainda permaneceram altas. A persistência e o índice de novas infecções pelos ECN (bactérias isoladas em maior número neste trabalho), sugerem perdas acentuadas na produção de leite.
Os dados obtidos dos rebanhos estudados mostram uma alta ocorrência de infecções intramamárias em vacas primíparas na primeira semana após o parto, acompanhada de alta porcentagem de mastites clínicas com predominância dos ECN, seguidos dos patógenos de meio ambiente. Considerando-se que os esquemas preventivos para o controle da mastite nestas propriedades estavam direcionados para as vacas em lactação e para as vacas secas, estes resultados justificam a adoção de medidas preventivas também para as novilhas no período que antecede o parto.
Agradecimentos.- Ao técnico de laboratório, José Aldevino de Carvalho, pelo auxílio na elaboração dos meios de cultura e na identificação bioquímica.
- Boddie B.S., Nickerson S.C., Owens W.E. & Watts J.L. 1987. Udder microflora in nonlactating heifers. Agri-Pract. Bov. Med. Immun. 22-25.
- Bramley, A.J. & Dodd, F.H. 1984. Reviews of the progress of dairy science: mastitis control-progress and prospects. J. Dairy Res. 51:481-512.
- Carter G.R. 1988. Fundamentos de Bacteriologia e Micologia Veterinária. Ed. Roca, Săo Paulo. 250p.
- Costa E.O., Melville P.A., Ribeiro A R., Watanabe E., Viani F.C. & White C.R. 1996. Prevalence of intramammary infections in primigravid Brazilian dairy heifers. Prev. Vet. Med. 29:151-155.
- Daniel R.C.W., Barnum D.A & Leslie K.E. 1986. Observations on intramammary infections in first calf heifers in early lactation. Can. Vet. J. 27:112-115.
- Dodd F.H. 1983. Mastitis: progress on control. J. Dairy Sci. 66:1773-1780.
- Edwards P.R. 1986. Identification of Enterobacteriaceae 4th ed. Elsevier Scientific Publishing Co., New York.
- Fox L.K., Chester S.T., Hallberg J.W., Nickerson S.C., Pankey J.W. & Weaver L.D. 1995. Survey of intramammary infections in dairy heifers at breeding age and first parturition. J. Dairy Sci. 78:1619-1628.
- Hallberg J.W., Dame K.J., Chester S.T., Miller C.C., Fox L.K., Pankey J.W., Nickerson S.C. & Weaver L.J. 1995. The visual appearence and somatic cell count of mammary secretions collected from primigravid heifers during gestation and early postpartum. J. Dairy Sci. 78:1629-1636.
- Hodges T., Jones Y.S. & Holland J.T.S. 1984. Characterization of Staphylococcus associated with clinical and subclinical bovine mastitis. N. Z. Vet. J. 32:141-145.
- Lean I.J., Edmondson A.J., Smith G. & Villanueva M. 1987. Corynebacterium pyogenes mastitis outbreak in unbred heifers in a California dairy. Cornell Vet. 77:367-373.
- Linde C. 1982. The effect of coagulase-negative staphylococci in the cow's udder on experimental induction of mastitis and milk production. Ph.D. Thesis, Swedish University of Agricultural Science, Uppsala.
- Matthews K.R., Harmon R.J. & Langlois B.E. 1992. Prevalence of Staphylococcus species during the periparturient period in primiparus and multiparus cows. J. Dairy Sci. 75:1835-1839.
- McDonald J.S. 1982. Experimental infection of the bovine mammary glands during the dry period. Proc. 21st Ann. Meeting National Mastitis Council, Louisville, Kentucky, p. 112.
- Meaney W.J. 1981. Mastitis levels in spring-calving dairy heifers. Irish Vet. J. 35:205-209.
- Miller G.Y. & Dorn C.R. 1987. An economic summary of the National Animal Health Monitoring System Data in Ohio. 91st Annu. Meet. Anim. Health Assoc., Ohio., p. 154-172.
- Myllys V. 1995. Staphylococci in heifer mastitis before and after parturition. J. Dairy Res. 62:51-60.
- National Mastitis Council 1987. Laboratory and Field Handbook on Bovine Mastitis. National Mastitis Council, Arlington, VA.
- Oliver S.P. 1987. Intramammary infections in heifers at parturition and during early lactation in a herd with a high prevalence of environmental mastitis. Tennessee Farm and Home Science 143:18-22.
- Oliver S.P. & Mitchell B.A. 1983. Intramammary infections in primigravid heifers near parturition. J. Dairy Sci. 66:1180-1183.
- Oliver S.P., Lewis M.J., Gillespie B.E. & Dowlen H.H. 1992. Influence of prepartum antibiotic therapy on intramammary infections in primigravid heifers during early lactation. J. Dairy Sci. 75 (2):406-414.
- Oliver S.P., Lewis M.J., Gillespie B.E, Dowlen H.H., Johnson D.L., Campbell M.H., Chester S.T. & Hallberg J.W. 1997. Mastitis pathogen isolation in heifers during early lactation after intrammary antibiotic therapy following the first milking of lactation. J. Dairy Sci. (Suppl. 1) 80:173.
- Pankey J.W., Drechsler P.A. & Wildman E.E. 1991. Mastitis prevalence in primigravid at parturition. J. Dairy Sci. 74:1550-1552.
- Rainard P. & Poultrel B.P. 1982. Dynamics on nonclinical bovine intramammary infections with major and minor pathogens. Am. J. Res. 43 (12):2144-2146.
- Schultze W.D. 1985. Control of news intramammary infection at calving by prepartum teat dipping. J. Dairy Sci. 68:2094-2099.
- Shearer J.K. & Harmon R.J. 1993. Mastitis in heifers. Vet. Clin. North Am. Food Anim. Pract. 9(3) :583-595.
- Seykora A.J. & McDaniel B.T. 1985. Udder and teat morphology related to mastitis resistence: a review. J. Dairy Sci. 68:2087-2093.
- Smith K.L., Todhunter D.A & Shoenberg P.S. 1985. Environmental mastitis: cause, prevalence, prevention. J. Dairy Sci. 68:1531-1553.
- Trinidad P., Nickerson S.C., Alley T.K. & Adkinson R.W. 1990. Efficacy of intramammary treatment in unbred and primigravid dairy heifers. J. Am. Vet. Med. Am. 197:465-470.
- Whitford H.W., Rosenbusch R.F. & Lauerman L.H. 1994. Mycoplasmosis in Animals: Laboratory Diagnosis. 1st ed. Iowa State University Press, Ames. 173p.
Datas de Publicação
-
Publicação nesta coleção
03 Set 1999 -
Data do Fascículo
Jul 1998
Histórico
-
Aceito
22 Abr 1998