Resumos
O vírus da Diarréia Viral Bovina (BVDV) possui distribuição mundial e é considerado um dos principais patógenos de bovinos. A infecção e as enfermidades associadas ao BVDV têm sido descritas no Brasil desde os anos 60. Diversos relatos sorológicos, clínico-patológicos e de isolamento do agente demonstram a ampla disseminação da infecção no rebanho bovino brasileiro. Além de sorologia positiva em níveis variáveis em bovinos de corte e leite, anticorpos contra o BVDV têm sido ocasionalmente detectados em suínos, javalis, caprinos, cervos e bubalinos. O BVDV tem sido freqüentemente detectado em fetos abortados, na capa flogística de animais persistentemente infectados (PI) oriundos de rebanhos com problemas reprodutivos, em amostras clínicas e/ou material de necropsia de animais com as mais diversas manifestações clínicas, em sêmen de touros de centrais de inseminação artificial, em fetos saudáveis coletados em matadouros e em soro bovino comercial e/ou cultivos celulares. Aproximadamente 50 isolados do vírus já foram caracterizados genética e/ou antigenicamente, enquanto um número semelhante de amostras aguarda caracterização. A maioria dos isolados caracterizados pertence ao genótipo BVDV-1, biotipo não-citopático (NCP), embora vários isolados de BVDV-2 (e alguns BVDV citopáticos CP) já tenham sido identificados. Os isolados brasileiros apresentam grande variabilidade antigênica, além de diferenças antigênicas marcantes quando comparados a cepas vacinais norte-americanas. Algumas vacinas polivalentes (BHV-1, PI-3, BRSV), contendo o BVDV inativado, têm sido utilizadas no rebanho brasileiro. No entanto, o uso de vacinação ainda é incipiente na maioria das regiões; apenas 2,5 milhões de doses foram comercializadas em 2003. A baixa reatividade sorológica cruzada entre os isolados brasileiros e as cepas vacinais tem estimulado laboratórios nacionais a desenvolver vacinas com isolados autóctones de BVDV-1 e 2. O conhecimento sobre a infecção pelo BVDV no Brasil tem aumentado consideravelmente nos últimos anos, à medida em que cresce o número de laboratórios envolvidos em diagnóstico e pesquisa sobre esse vírus. Diagnóstico sorológico, virológico ou molecular; estudos sobre epidemiologia sorológica e molecular, patogenia e produção de reagentes para diagnósitco têm contribuído para o aumento no conhecimento sobre a infecção pelo BVDV no país.
Vírus da Diarréia Viral Bovina; BVDV; epidemiologia; diagnóstico
Bovine viral diarrhea virus (BVDV) is one of the most important pathogens of cattle worldwide. BVDV infection and associated diseases have been reported in Brazil since the late 1960ties. Several serological, virological, clinical and pathological reports demonstrate the widespread distribution of BVDV infection among Brazilian cattle. In addition to variable levels of positive serology in beef and dairy cattle, BVDV antibodies have been occasionally detected in swine, wild boars, goats, cervids and water buffaloes. BVDV infection has been diagnosed in aborted fetuses, buffy coats of persistently infected (PI) animals, clinical specimens from animals suffering from different clinical syndromes, semen of bulls of artificial insemination (AI) centers, in healthy fetuses and in commercial fetal bovine serum and/or cultured cells. About 50 isolates have been genetically and/or antigenically characterized up to date, whilst roughly an equivalent number of isolates awaits characterization. Most of the characterized isolates belong to BVDV-1 genotype, non-cytopathic (NCP) biotype, yet some BVDV-2 (and some CP BVDV) have been identified as well. Brazilian BVDV isolates display a high antigenic variability and are markedly different from North American vaccine strains. A few inactivated, polyvalent vaccines are currently licensed in the country, yet vaccination is still incipient in many regions: only about 2.5 million doses were marketed in 2003. The low serological cross-reactivity between vaccine strains and field isolates has recently stimulated national industries to develop vaccines containing Brazilian BVDV-1 and BVDV-2 strains. The overall knowledge about BVDV infection in Brazil has grown considerably in the last years, due to an increasing number of laboratories performing diagnosis and research. Studies on the pathogenesis, serological and molecular epidemiology and production of reagents for diagnosis have contributed decisively for the recent growing knowledge on BVDV infections in the country.
Bovine viral diarrhea virus; BVDV; epidemiology; diagnostic
ARTIGO DE REVISÃO
A infecção pelo vírus da Diarréia Viral Bovina (BVDV) no Brasil - histórico, situação atual e perspectivas
Bovine viral diarrhea virus (BVDV) infection in Brazil: history, current situation and perspectives
Eduardo F. FloresI,* * Autor para correspondência. E-mail: flores@ccr.ufsm.br ; Rudi WeiblenI; Fernanda S. Flores VogelI; Paulo M. RoeheII; Amauri A. AlfieriIII; Edviges M. PitucoIV
IDepto Medicina Veterinária Preventiva, CCR, Universidade Federal de Santa Maria (UFSM), 97105-900 Santa Maria, RS, Brasil
IIInstituto de Pesquisas Veterinárias Desidério Finamor (IPVDF/Fepagro), Estrada do Conde 6000, Eldorado do Sul, RS 92990-000
IIILaboratório de Viroses de Bovídeos, Instituto Biológico de São Paulo, Av. Conselheiro Rodrigues Alves, 1.252, SP 04014-002
IVDepto Medicina Veterinária Preventiva, Universidade Estadual de Londrina, Rodovia Celso Garcia Cid 445 Km 380, Londrina, PR 86051-990
RESUMO
O vírus da Diarréia Viral Bovina (BVDV) possui distribuição mundial e é considerado um dos principais patógenos de bovinos. A infecção e as enfermidades associadas ao BVDV têm sido descritas no Brasil desde os anos 60. Diversos relatos sorológicos, clínico-patológicos e de isolamento do agente demonstram a ampla disseminação da infecção no rebanho bovino brasileiro. Além de sorologia positiva em níveis variáveis em bovinos de corte e leite, anticorpos contra o BVDV têm sido ocasionalmente detectados em suínos, javalis, caprinos, cervos e bubalinos. O BVDV tem sido freqüentemente detectado em fetos abortados, na capa flogística de animais persistentemente infectados (PI) oriundos de rebanhos com problemas reprodutivos, em amostras clínicas e/ou material de necropsia de animais com as mais diversas manifestações clínicas, em sêmen de touros de centrais de inseminação artificial, em fetos saudáveis coletados em matadouros e em soro bovino comercial e/ou cultivos celulares. Aproximadamente 50 isolados do vírus já foram caracterizados genética e/ou antigenicamente, enquanto um número semelhante de amostras aguarda caracterização. A maioria dos isolados caracterizados pertence ao genótipo BVDV-1, biotipo não-citopático (NCP), embora vários isolados de BVDV-2 (e alguns BVDV citopáticos [CP]) já tenham sido identificados. Os isolados brasileiros apresentam grande variabilidade antigênica, além de diferenças antigênicas marcantes quando comparados a cepas vacinais norte-americanas. Algumas vacinas polivalentes (BHV-1, PI-3, BRSV), contendo o BVDV inativado, têm sido utilizadas no rebanho brasileiro. No entanto, o uso de vacinação ainda é incipiente na maioria das regiões; apenas 2,5 milhões de doses foram comercializadas em 2003. A baixa reatividade sorológica cruzada entre os isolados brasileiros e as cepas vacinais tem estimulado laboratórios nacionais a desenvolver vacinas com isolados autóctones de BVDV-1 e 2. O conhecimento sobre a infecção pelo BVDV no Brasil tem aumentado consideravelmente nos últimos anos, à medida em que cresce o número de laboratórios envolvidos em diagnóstico e pesquisa sobre esse vírus. Diagnóstico sorológico, virológico ou molecular; estudos sobre epidemiologia sorológica e molecular, patogenia e produção de reagentes para diagnósitco têm contribuído para o aumento no conhecimento sobre a infecção pelo BVDV no país.
Termos de Indexação: Vírus da Diarréia Viral Bovina, BVDV, epidemiologia, diagnóstico.
ABSTRACT
Bovine viral diarrhea virus (BVDV) is one of the most important pathogens of cattle worldwide. BVDV infection and associated diseases have been reported in Brazil since the late 1960ties. Several serological, virological, clinical and pathological reports demonstrate the widespread distribution of BVDV infection among Brazilian cattle. In addition to variable levels of positive serology in beef and dairy cattle, BVDV antibodies have been occasionally detected in swine, wild boars, goats, cervids and water buffaloes. BVDV infection has been diagnosed in aborted fetuses, buffy coats of persistently infected (PI) animals, clinical specimens from animals suffering from different clinical syndromes, semen of bulls of artificial insemination (AI) centers, in healthy fetuses and in commercial fetal bovine serum and/or cultured cells. About 50 isolates have been genetically and/or antigenically characterized up to date, whilst roughly an equivalent number of isolates awaits characterization. Most of the characterized isolates belong to BVDV-1 genotype, non-cytopathic (NCP) biotype, yet some BVDV-2 (and some CP BVDV) have been identified as well. Brazilian BVDV isolates display a high antigenic variability and are markedly different from North American vaccine strains. A few inactivated, polyvalent vaccines are currently licensed in the country, yet vaccination is still incipient in many regions: only about 2.5 million doses were marketed in 2003. The low serological cross-reactivity between vaccine strains and field isolates has recently stimulated national industries to develop vaccines containing Brazilian BVDV-1 and BVDV-2 strains. The overall knowledge about BVDV infection in Brazil has grown considerably in the last years, due to an increasing number of laboratories performing diagnosis and research. Studies on the pathogenesis, serological and molecular epidemiology and production of reagents for diagnosis have contributed decisively for the recent growing knowledge on BVDV infections in the country.
Index Terms: Bovine viral diarrhea virus, BVDV, epidemiology, diagnostic.
INTRODUÇÃO
O vírus da Diarréia Viral Bovina [Bovine viral diarrhea virus, BVDV] é um dos principais patógenos de bovinos e causa perdas econômicas significativas para a pecuária bovina em todo o mundo (Baker 1995). O BVDV pertence à família Flaviviridae, gênero Pestivirus, que abriga outros dois vírus antigenicamente relacionados: o vírus da Peste Suína Clássica [Classical swine fever virus, CSFV] e o vírus da Doença da Fronteira, de ovinos [Border disease virus, BDV] (Horzinek 1991). Os pestivírus são vírus pequenos (40-60nm), envelopados e contêm uma molécula de RNA linear, fita simples, polaridade positiva, de aproximadamente 12,5kb como genoma (Collett et al. 1989, Horzinek 1991). De acordo com a capacidade de produzir citopatologia em cultivo celular, os isolados de BVDV podem ser classificados em biotipos citopático [CP] e não-citopático [NCP]. A grande maioria dos vírus de campo são NCP; amostras CP são isoladas quase que exclusivamente de animais acometidos da Doença das Mucosas [DM], uma forma clínica severa da infecção (Brownlie 1990, Baker 1995). Os isolados do BVDV apresentam uma grande variabilidade antigênica, sendo que dois grupos antigênicos principais já foram identificados: BVDV tipo 1 e BVDV tipo 2. Os vírus do genótipo BVDV-1 representam a maioria dos vírus vacinais e das cepas de referência, enquanto os BVDV-2 foram identificados há pouco mais de uma década em surtos de Diarréia Viral Bovina [BVD] aguda severa e doença hemorrágica na América do Norte (Pellerin et al. 1994, Ridpath et al. 1994).
A infecção pelo BVDV tem sido associada a uma ampla variedade de manifestações clínicas: desde infecções inaparentes ou com sinais leves até doença aguda fatal. No entanto, a maioria das infecções em animais imunocompetentes parece cursar de forma subclínica. Enfermidade gastroentérica aguda ou crônica, doença respiratória em bezerros, síndrome hemorrágica com trombocitopenia, patologias cutâneas e imunossupressão estão entre as conseqüências mais freqüentes da infecção pelo BVDV (Brownlie 1990, Baker 1995).
Embora identificado originalmente de casos de doença gastroentérica, e freqüentemente associado com esse tipo de patologia, o BVDV é um vírus freqüentemente associado com fenômenos reprodutivos (Baker 1995). As conseqüências clínico-patológicas e epidemiológicas da infecção de fêmeas bovinas prenhes são marcantes. Em muitos rebanhos onde a infecção é endêmica, falhas reprodutivas representam os sinais mais evidentes - e por vezes, os únicos - da presença da infecção. A infecção antes ou após a cobertura ou inseminação artificial pode resultar em perdas reprodutivas como infertilidade temporária, retorno ao cio, mortalidade embrionária ou fetal, abortos ou mumificação, malformações fetais ou o nascimento de bezerros fracos e inviáveis (Brownlie 1990, Baker 1995). A infecção fetal entre os dias 40 e 120 de gestação com isolados NCP freqüentemente resulta na produção de bezerros imunotole-rantes, persistentemente infectados [PI] com o vírus. Os bezerros PI geralmente são soronegativos, podem ser clinicamente normais, e excretam o vírus continuamente em grandes quantidades em secreções e excreções (Brownlie 1990, Baker 1995). Por isso, são considerados o ponto-chave da epidemiologia da infecção e a sua identificação e descarte constituem-se em etapas essenciais para o controle e/ou erradicação do BVDV dos rebanhos (Dubovi 1992).
O BVDV tem distribuição mundial e a prevalência de anticorpos chega a atingir 70 a 80% dos animais e até 80% dos rebanhos na América do Norte e em alguns países europeus. Nesses países, que são livres de Febre Aftosa, o BVDV é considerado o agente viral mais importante de bovinos e tem sido alvo de numerosos estudos e de programas de controle e/ou erradicação durante décadas.
A infecção pelo BVDV no Brasil
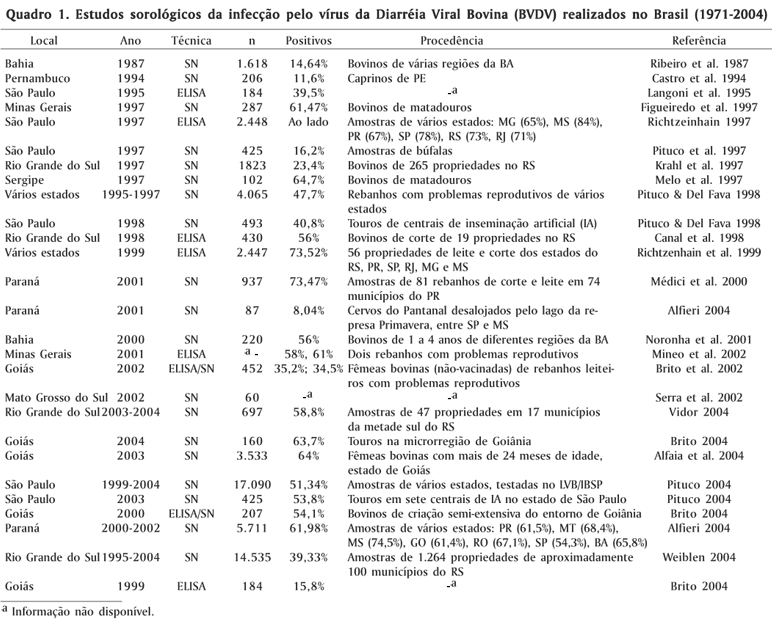
Vários relatos clínico-patológicos e sorológicos têm demonstrado a presença da infecção no país desde o final dos anos 60. O primeiro relato foi uma descrição de doença gastroentérica, com aspectos clínicos e patológicos compatíveis com a forma clássica da infecção, a Doença das Mucosas (Corrêa 1968). Os primeiros estudos sorológicos da infecção no Brasil datam do início da década de 70, no Rio Grande do Sul (Wizigmann et al. 1971). Desde então, diversos estudos sorológicos têm sido realizados em várias regiões, demonstrando a ampla distribuição da infecção no rebanho bovino brasileiro (Quadro 1). Do ponto de vista epidemiológico, os índices de soropositividade detectados na maior parte desses estudos devem ser interpretados com cautela, por várias razões: (1) Em geral, esses estudos não foram realizados a partir de amostragens planificadas, e sim com amostras viciadas, enviadas a laboratórios com outras finalidades; (2) Alguns estudos foram realizados com um número muito pequeno de amostras; (3) Vários desses foram realizados com amostras coletadas de rebanhos-problema (rebanhos com problemas reprodutivos, por exemplo); (4) Outros foram realizados em amostras de categorias específicas de animais (exemplo: touros de centrais de inseminação artificial); (5) A utilização de cepas de BVDV-1 nos testes de soro-neutralização (SN) certamente resultou na falha de detecção de anticorpos em amostras com títulos baixos a moderados contra o BVDV-2 (Flores et al. 2000); (6) A falta de padronização da técnica sorológica utilizada (SN versus ELISA; diferentes cepas virais, células e protocolos utilizados na SN); e (7) A maioria dos estudos desconsiderou a possibilidade de que parte da sorologia positiva pode ser devida à vacinação, sobretudo aqueles realizados a partir da década de 90. Por isso, os índices de positividade observados devem ser considerados indicadores da presença e prevalência da infecção nas sub-populações estudadas, e não no rebanho brasileiro.
Além desses, outros estudos epidemiológicos de relevância foram realizados no país. Oliveira (1996) realizou triagem em rebanhos com problemas reprodutivos no RS buscando animais PI, detectando 1,2% (12/1240) de amostras positivas (leucócitos, soro) para o vírus. Botton et al. (1998) examinaram amostras de soro de 1396 fetos coletados em matadouros, detectando anticorpos em 19 (1,36%) e vírus em 11 (0,79%). Embora aparentemente baixa, a prevalência de animais virêmicos observada é suficiente para manter o vírus na população (Baker 1995). Amostras de tanques coletivos de leite de 11.711 rebanhos do Estado do RS foram testadas pela técnica de SN adaptada para a detecção de anticorpos no leite, detectando-se 1.028 rebanhos com títulos neutralizantes >20 no leite; 180 propriedades apresentaram o leite com títulos de anticorpos >80, indicando infecção ativa e/ou a presença de animais PI (Brum et al. 2004). Em etapas posteriores, esses rebanhos deveriam ser investigados para a possível presença de animais PI.
De especial interesse são os estudos que detectaram sorologia positiva em outras espécies, como em suínos (Roehe et al. 1998), javalis cativos no RS (Flores 2004), caprinos (Castro et al. 1994), em rebanhos bubalinos com problemas reprodutivos no Estado de SP (Pituco et al. 1997) e em cervos desalojados de seu habitat por uma represa, na divisa entre São Paulo e Mato Grosso do Sul (Alfieri 2001). Um caso compatível com BVD aguda foi diagnosticado por imunoistoquímica em um cervídeo de zoológico no Rio Grande do Sul (Driemeier 2004). Embora o papel de outras espécies de animais domésticos e silvestres na epidemiologia do BVDV ainda não seja conhecido, algumas espécies silvestres têm merecido especial atenção em programas de combate à infecção nos Estados Unidos e Europa (Ridpath 2004).
Isolados brasileiros do BVDV
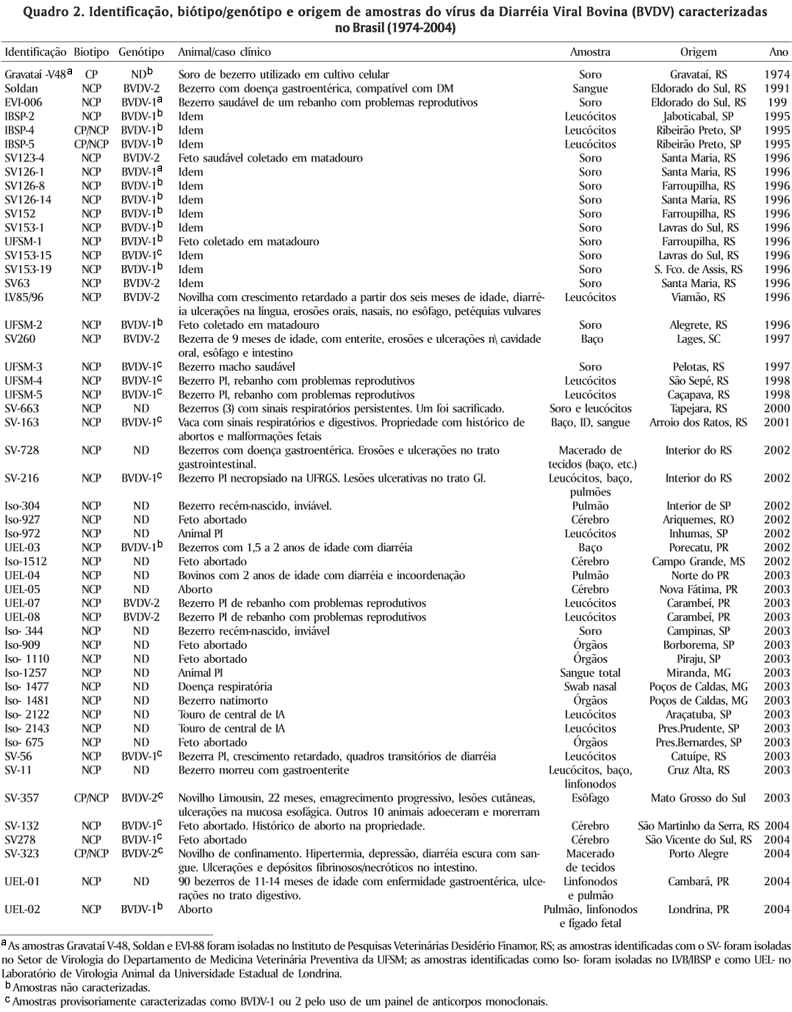
O primeiro isolamento do vírus no país foi realizado a partir do soro de um bezerro, coletado para ser utilizado em cultivos celulares (Vidor 1974). O vírus (Gravataí V-48) foi detectado pela citopatologia produzida (isolado CP) e identificado por imunofluorescência (FA). Infelizmente foi perdido posteriormente devido a problemas de conservação. A escassez de laboratórios com reagentes adequados (células livres de BVDV e de conjugados de boa qualidade), aliada a pouca importância dada à infecção pelo BVDV nos anos 70 a 90 são responsáveis pelo pequeno número de amostras isoladas naquela época. Somente a partir da metade da década de 90, com o início de um diagnóstico mais regular e sistemático em vários laboratórios, o número de isolados de BVDV (assim como outros agentes virais de bovinos) foi progressivamente aumentando. Infelizmente, ainda hoje o número de laboratórios que realizam isolamento do BVDV como diagnóstico de rotina é muito pequeno considerando-se a importância sanitária e econômica da infecção, as dimensões territoriais e a população bovina do país.
A relação dos isolados de BVDV caracterizados até o presente está apresentada no Quadro 2. Amostras isoladas de fetos abortados, de animais jovens (provavelmente animais PI) de rebanhos com problemas reprodutivos e de casos clínicos de doença gastroentérica representam a maioria dos isolados. Um número considerável dessas amostras foi isolado de fetos saudáveis coletados em matadouros, como parte de um estudo epidemiológico para verificar os índices de infecções fetais e também para obtenção de isolados para caracterização (Botton et al. 1998). A maioria dos isolados pertence ao biótipo NCP, refletindo a maior freqüência desse biótipo em infecções naturais; e ao genótipo BVDV-1, embora alguns isolados CP e do genótipo BVDV-2 também já tenham sido identificados. Algumas amostras virais ainda não foram ou estão presentemente sendo caracterizadas antigênica e/ou genotipicamente (Richtzenhain 2004).
O Laboratório de Viroses de Bovídeos do Instituto Biológico de São Paulo (LVB/IBSP) possui uma casuística significativa no diagnóstico de BVDV, recebendo material de vários estados brasileiros (Quadro 3). No período de 1999 a 2004, 59 amostras de BVDV haviam sido isoladas de materiais clínicos. Essas amostras eram oriundas de fetos abortados, leucócitos de animais de rebanhos com problemas reprodutivos, sêmen de touros de centrais de IA e encéfalos de animais com sinais neurológicos. Até o presente, estas amostras ainda não foram caracterizadas antigênica ou genotipicamente.
Além das amostras isoladas em cultivos celulares, disponíveis para caracterização e estudos posteriores, o BVDV tem sido detectado pelo uso de outras técnicas que não permitem a sua análise a posteriori. A técnica de PCR tem sido utilizada para pesquisar RNA de BVDV no encéfalo de bovinos com sinais neurológicos, com diagnóstico negativo para a raiva e para o herpesvírus bovino tipo 5. Em um estudo de 949 encéfalos analisados no LVB/IBSP, o BVDV foi detectado em 12 (1,26%) através de isolamento e/ou RT-PCR (Pituco 2004). Embora o BVDV tenha sido associado com doença neurológica (Blas-Machado et al. 2004) e seja freqüentemente isolado do cérebro de fetos abortados e natimortos (Quadros 2 e 3; Scherer et al. 2001), o seu possível envolvimento em doença neurológica de animais adultos ainda carece de confirmação. É possível que parte dos encéfalos positivos detectados neste estudo sejam de animais PI, que eventualmente desenvolveram enfermidade neurológica de outra etiologia.
A infecção pelo BVDV está freqüentemente associada a perdas reprodutivas. No LVB/IBSP, 1.462 amostras de fetos abortados, natimortos e/ou membranas fetais submetidas a PCR ou isolamento viral resultaram em 47 (3,2%) positivas. A ocorrência de falhas reprodutivas, principalmente abortamentos, natimortos e mal-formações, além do nascimento de bezerros fracos e inviáveis, é um indicativo da presença do BVDV nos rebanhos. Nesses casos, recomenda-se realizar uma triagem nos animais jovens, à busca de animais PI. No período de 1999 a 2004, foram testadas 7.248 amostras de sangue (capa flogística) de animais de rebanhos com problemas reprodutivos, detectando-se 30 amostras positivas (0,41%) (Quadro 3).
O monitoramento sistemático de touros de centrais de IA também é crítico no controle da infecção pelo BVDV, devido a possível disseminação do vírus pelo sêmen. O monitoramento de touros de centrais de IA no Estado de São Paulo (1999-2004), através do exame de 696 ejaculados por PCR ou isolamento, revelou 14 (2,01%) amostras positivas. No LVB/IBSP, o BVDV também foi detectado em fezes (2/16) de animais com doença gastroentérica; em secreções/suabes nasais (1/20) de animais com sinais respiratórios; e em órgãos (2/36) de animais necropsiados após curso clínico compatível com a infecção pelo BVDV.
Outro estudo analisou por PCR 138 amostras clínicas de casos compatíveis com BVDV (fetos abortados, natimortos, bezerros suspeitos de PI), provenientes de vários Estados (AL, GO, MG, MS, RS e SP), detectando 5 amostras positivas. Duas destas, uma originária de um bezerro com doença respiratória, outra de um bezerro com diarréia e erosões orais, foram caracterizadas como BVDV-1a. As outras três amostras positivas eram oriundas de fetos abortados e foram identificadas como BVDV-2 (Richtzenhain 2004).
A contaminação de cultivos celulares com pestivírus - particularmente o BVDV - constitui-se em um problema preocupante em laboratórios que utilizam células no diagnóstico e pesquisa virológica. Oliveira et al. (1996) realizaram uma triagem em cultivos primários e linhagens celulares; em soro de neonatos e em soro fetal bovino comercial, à procura de contaminação por pestivírus. Sete de 13 linhagens celulares de várias espécies; dois entre sete cultivos primários de células bovinas; oito amostras de soro de bezerros neonatos (8/80) apresentavam contaminação por BVDV ou outro pestivírus; enquanto 50% das amostras de soro bovino comercial apresentavam anticorpos anti-BVDV. No LVB/IBSP, o teste de rotina de partidas comerciais de soro fetal bovino revelou 4/113 (3,5%) amostras positivas. Esses estudos demonstram a importância de se realizar monitoramento contínuo de cultivos celulares e do soro utilizado nestes, para se detectar possíveis contaminações que possam interferir com o diagnóstico e/ou pesquisa.
A detecção de antígenos virais em cortes histológicos através de imunoistoquímica (IHC) também tem se constituído em uma importante ferramenta no diagnóstico e estudo da infecção pelo BVDV (Driemeier 2004).
Caracterização de isolados
O isolamento de vírus em cultivo celular permite que se disponha do agente para caracterização, principalmente nos aspectos antigênicos e genotípicos, que são de especial interesse epidemiológico. Os isolados de campo do BVDV podem ser divididos em dois grupos antigênicos distintos: BVDV-1 e BVDV-2. Além disso, os isolados de cada grupo apresentam uma grande variabilidade antigênica. Oliveira (1996), Botton et al. (1998) e Flores et al. (2000, 2001) demonstraram a grande variabilidade antigênica existente entre amostras brasileiras do BVDV utilizando anticorpos monoclonais (AcMs). Botton et al. (1998) também caracterizaram alguns isolados por neutralização cruzada, verificando uma baixa reatividade sorológica cruzada entre estes e as cepas vacinais norte-americanas Singer, NADL e Oregon. Flores et al. (2000) demonstraram que, além da possível implicação da eficácia das vacinas, a diversidade antigênica, e em especial, a existência de dois grupos antigênicos distintos, também possui implicações no diagnóstico sorológico. Como forma de minimizar esse impacto negativo, foi sugerida a inclusão de isolados locais dos dois genótipos (BVDV-1 e 2) tanto nas vacinas como nos testes de SN.
Além de diferenças antigênicas, vírus dos genótipos BVDV-1 e 2 podem ser distinguidos entre si por análise de uma seqüência de nucleotídeos na região 5' não-traduzida (5'UTR) do genoma (Pellerin et al. 1994, Ridpath et al. 1994). Essa análise permite agrupar os isolados nos respectivos genótipos e tem sido utilizada para se estudar a origem, evolução e epidemiologia do BVDV. Os vírus do genótipo BVDV-2 foram identificados pela primeira vez há mais de uma década em surtos de doença gastroentérica severa na América do Norte e por isso foram considerados agentes potencialmente novos e de alta virulência (Corapi et al. 1989, Pellerin et al. 1994). Entretanto, sabe-se que os BVDV-2 não são sinônimos de virulência e que provavelmente não sejam vírus novos. Os vírus desse genótipo representam aproximadamente 50% dos BVDV isolados nos Estados Unidos, foram retrospectivamente identificados há mais de 40 anos, e a grande maioria apresenta baixa virulência (Ridpath 2004).
No Brasil, a caracterização genotípica pioneira de isolados de BVDV foi realizada por Canal et al. (1998), que também demonstraram a presença do BVDV-2 no país. A amostra Soldan, isolada de um bezerro com diarréia sanguinolenta em 1991 no RS foi a primeira identificada como BVDV-2. Posteriormente, a análise filogenética de 21 isolados brasileiros revelou que 17 pertenciam ao genótipo BVDV-1 e quatro ao BVDV-2 (Gil 1998). Duas destas amostras foram isoladas de animais com doença gastroentérica e respiratória e as outras obtidas de fetos saudáveis em matadouros. Além disso, o anti-soro produzido contra cada uma dessas amostras demonstrou uma baixa reatividade sorológica cruzada frente a amostras de BVDV-1. Um estudo filogenético complementar, pela análise de uma seqüência do gene da proteína não-estrutural NS3, revelou que os BVDV-2 brasileiros (e sul-americanos) são geneticamente distintos dos BVDV-2 norte-americanos e europeus, constituindo um subgenótipo a parte, denominado provisoriamente de BVDV-2b (Flores et al. 2002). Caracterizações genotípicas de isolados mais recentes não têm sido publicadas, embora análises desta natureza estejam em andamento (Richtzenhain 2004). No SV/UFSM, os isolamentos de BVDV são seguidos de uma caracterização com um painel de anticorpos monoclonais.
A identificação do BVDV-2 no Brasil levou um laboratório multinacional, que anteriormente comercializava uma vacina contendo apenas o BVDV-1, a importar e comercializar uma vacina que contém vírus dos dois genótipos. Da mesma forma, alguns laboratórios nacionais estão desenvolvendo vacinas com isolados brasileiros de BVDV-1 e 2.
Além da caracterização antigênica e genética, alguns estudos têm enfocado outros aspectos da biologia do BVDV, como os mecanismos moleculares envolvidos na expressão do fenótipo citopático dos isolados CP (Gil 1998, Tobias et al. 1998, Quadros et al. 2005).
Desenvolvimento/padronização de técnicas diagnósticas
Embora a técnica padrão para o diagnóstico sorológico da infecção pelo BVDV seja a SN, outras técnicas têm sido avaliadas e utilizadas no país. Canal et al. (1998) relataram o desenvolvimento e a padronização de um teste ELISA para detecção de anticorpos contra o BVDV. O teste utiliza antígenos recombinantes produzidos em baculovírus e demonstrou sensibilidade de 97,6 % e especificidade de 99,4 % quando comparado com a SN. Paredes et al. (1999) avaliaram a capacidade de um teste de soro-neutralização de diferenciar a resposta sorológica entre os diferentes pestivírus.
Kreutz et al. (2000) produziram dois anticorpos monoclonais (mAbs) contra antígenos de um isolado brasileiro de BVDV-1. Os mAbs foram capazes de reconhecer antígenos de mais de 50 isolados de campo de BVDV-1 e BVDV-2 em testes de imunofluorescência, demonstrando ser adequados para uso em diagnóstico. Andrade et al. (2002) padronizaram a técnica de imunoperoxidase em monocamada de células para o diagnóstico do BVDV.
Estudos de patogenia
Estudos de patogenia têm sido conduzidos com isolados brasileiros de BVDV, com os objetivos de investigar a patogenicidade/virulência de vírus candidatos a cepas vacinais e também para se identificar amostras virais para uso em desafio em testes de vacinas (Brum et al. 2002b, Lima et al. 2004). Scherer et al. (2001) reproduziram os efeitos reprodutivos da infecção pelo BVDV (mortalidade fetal e perinatal, abortamentos, nascimento cordeiros inviáveis e persistentemente infectados) pela inoculação de uma amostra brasileira de BVDV-2 (SV-260) em ovelhas prenhes. Os autores demonstraram que a infecção pelo BVDV-2 em ovelhas prenhes é muito semelhante a infecção em vacas, sugerindo o uso dessa espécie como modelo para estudos de patogenia e proteção vacinal.
Brum et al. (2002a) reproduziram a infecção pelo BVDV-2 em bezerros de 45-60 dias de idade pela inoculação de dois isolados brasileiros (SV-260 e LV-96). Os animais apresentaram anorexia, depressão, hipertermia, sinais de infecção respiratória e diarréia profusa e morreram e/ou foram submetidos à eutanásia in extremis entre os dias 7 e 12pi. Os animais apresentavam úlceras e erosões no trato digestivo; equimoses e sufusões no baço, rúmen, intestino delgado e ceco; edema pulmonar. Em animais de oito meses de idade, o vírus provocou depressão, hipertermia e sinais moderados de infecção respiratória e digestiva, ulcerações na língua e na bochecha, mas os animais se recuperaram em poucos dias.
Relatos clínico-patológicos
Vários relatos clínico-patológicos de enfermidades compatíveis com o BVDV, alguns sem comprovação virológica, também indicam a ampla ocorrência da enfermidade no país. A primeira descrição clínica-patológica da enfermidade foi realizada por Corrêa (1968). No Rio Grande do Sul, foram relatados três surtos de doenças com quadro clínico-patológico compatível com a infecção pelo BVDV. Em um surto em vacas em lactação, os animais apresentaram sinais clínicos e lesões semelhantes às observadas na forma clássica da doença, com diarréia e úlceras na mucosa oral. Nesse surto, a morbidade foi de 8,9% e a mortalidade de 1,37%. Nos outros dois surtos, compatíveis com a forma hemorrágica, observaram-se lesões hemorrágicas nas mucosas e serosas do trato digestivo e, em alguns casos, em músculos, além de úlceras na mucosa do trato digestivo; a letalidade foi próxima a 10% (Schuch 2001).
Pilati et al. (1998) descreveram um caso de enfermidade gastroentérica fatal em uma bezerra de aproximadamente 8 meses de idade, associado a uma amostra de BVDV-2. A bezerra apresentou depressão, anorexia, atonia ruminal, fezes pastosas, escuras e fétidas, seguidas de diarréia escura, tenesmo, desidratação, respiração ofegante, corrimento nasal seropurulento e morte dez dias após o início da manifestação dos sinais clínicos. A macroscopia revelou a presença de úlceras profundas e confluentes na mucosa da língua, do terço anterior do palato e do esôfago, além de hiperemia da mucosa do rúmen e do intestino. Além dos casos publicados, informações de veterinários de campo indicam que provavelmente ocorra um número muito maior de casos, especialmente da forma reprodutiva, sem diagnóstico ou confirmação laboratorial.
Vacinas
A vacinação contra o BVDV tem sido utilizada com relativo sucesso para proteger animais da enfermidade clínica, reduzir a circulação de vírus e para tentar impedir a infecção fetal e a conseqüente produção de bezerros PI (Dubovi 1992). Mais de 150 vacinas, contendo o BVDV atenuado (vacinas vivas modificadas) ou inativado já foram licenciadas nos Estados Unidos. O uso de vacinas contra o BVDV no Brasil ainda é incipiente e é realizado de forma irregular nas diferentes regiões e sistemas de produção. A vacinação tem sido realizada com certa freqüência em rebanhos leiteiros e em criações intensivas e semi-intensivas de corte nas regiões sudeste e sul do Brasil. No entanto, comparando-se com o número de doses de vacinas anti-aftosa e com o rebanho bovino brasileiro (aprox. 195 milhões de cabeças), o número de doses comercializado anualmente (ao redor de 2,5 milhões de doses em 2003) revela que a vacinação contra o BVDV no rebanho brasileiro como um todo, é uma exceção mais do que regra.
Nos últimos anos, quatro vacinas contra o BVDV eram licenciadas e comercializadas no Brasil. Essas vacinas eram polivalentes (BVDV, BHV-1, PI-3 e BRSV) e continham antígenos inativados do BVDV. Essas vacinas são formuladas com isolados norte-americanos ou europeus; três dessas eram importadas e uma é produzida por um laboratório nacional. No início de 2004, a ocorrência de encefalopatia espongiforme (BSE) nos Estados Unidos levou o Ministério da Agricultura a emitir uma normativa suspendendo a importação de biológicos daquele país, situação que permanece até o momento da submissão desse artigo. Em contrapartida, novas vacinas - também polivalentes e inativadas, contendo adjuvante oleoso ou hidróxido de alumínio - foram importadas de países do Mercosul (Argentina e Uruguai) e Europa e começaram a ser comercializadas no país. As vacinas tradicionais - inclusive algumas que continuam sendo comercializadas - possuíam apenas o BVDV-1. As vacinas mais recentes - em sua maioria - tendem a incluir também o BVDV-2 em sua formulação.
A maior preocupação com a eficácia de vacinas contra o BVDV refere-se à grande variabilidade antigênica do vírus. Estudos realizados no país revelaram que, além da diversidade antigênica entre isolados locais, estes isolados apresentam uma baixa reatividade sorológica cruzada com as cepas norte-americanas utilizadas nas vacinas. Isto gerou questionamentos sobre a eficácia das vacinas em uso e sobre a necessidade de se reavaliar as estratégias de produção, licenciamento e usos de vacinas contra o BVDV no Brasil.
Vogel et al. (2001, 2002) avaliaram a eficácia de três vacinas comerciais inativadas contra o BVDV em bovinos e em ovinos. O estudo em bovinos limitou-se a avaliar a resposta sorológica frente a cepas-padrão e a diferentes isolados brasileiros de BVDV-1 e BVDV-2, enquanto o estudo em ovinos avaliou a capacidade dessas vacinas de proteger os fetos frente a desafio com isolados de BVDV-1 e 2. As vacinas induziram títulos de anticorpos baixos a moderados, principalmente frente a isolados brasileiros de BVDV-2 e não foram capazes de proteger os fetos da infecção, reforçando a idéia da necessidade da reformulação nas estratégias de formulação e utilização de vacinas contra o BVDV.
Silva et al. (2000) avaliaram a resposta imunológica de bovinos imunizados com uma vacina inativada contra o BVDV contendo uma associação de adjuvantes composta por hidróxido de alumínio + cloreto de dimetildiocatadecilamônio (DDA chloride), concluindo que essa vacina induziu uma resposta humoral e celular de maior magnitude quando comparada ao antígeno com hidróxido de alumínio.
Brum et al. (2002b) e Lima et al. (2004) avaliaram dois isolados CP de BVDV (BVDV-1 e BVDV-2) como candidatos a vírus vacinais. Esses isolados foram atenuados por passagens múltiplas em cultivo celular e testados em sua atenuação e imunogenicidade para bezerros e para ovelhas prenhes. Os vírus demonstraram ser atenuados para bezerros; induziram títulos altos de anticorpos neutralizantes contra o BVDV-1 e 2, e foram capazes de induzir proteção fetal frente a desafio com cepas heterólogas de BVDV em ovelhas prenhes. Embora até o presente vacinas atenuadas contra o BVDV não sejam licenciadas no país, essas cepas são promissoras para uso em vacinas em um futuro próximo.
Atendendo a demanda do mercado e orientando-se pelas informações epidemiológicas produzidas nos últimos anos, laboratórios nacionais estão atualmente desenvolvendo vacinas contra o BVDV. Uma característica comum das vacinas ora em desenvolvimento é a inclusão de isolados brasileiros de ambos os genótipos (BVDV-1 e 2). A legislação brasileira ainda não permite o uso de vacinas vivas modificadas contra o BVDV. Com isso, é provável que o uso de vacinas inativadas continue prevalecendo nos próximos anos, apesar do consenso de que as vacinas atenuadas possuem maior eficácia.
Perspectivas
A importância atribuída à Febre Aftosa durante décadas relegou outras enfermidades víricas de bovinos a um segundo plano. Com a erradicação da Febre Aftosa de muitas regiões, essas enfermidades vêm agora despertando interesse crescente de produtores, técnicos, pesquisadores, autoridades sanitárias e sobretudo de laboratórios produtores de vacinas. O conhecimento sobre a infecção pelo BVDV no país vem crescendo consideravelmente, à medida que aumenta o número de laboratórios envolvidos em diagnóstico e pesquisa. A facilidade de comunicação e colaboração entre laboratórios, a disponibilidade de reagentes de qualidade para o diagnóstico e o interesse crescente da indústria de vacinas têm contribuído para esse crescimento. Medidas de combate à infecção têm sido adotadas por iniciativa voluntária, sem a interferência oficial. No entanto, o estabelecimento de um mercado comum no Mercosul, assim como a implementação de restrições sanitárias ao comércio internacional de produtos animais exigirão o estabelecimento de regras sanitárias oficiais em um futuro próximo. Por outro lado, o desenvolvimento de vacinas por laboratórios nacionais representa um avanço no combate à enfermidade. Etapas posteriores deverão envolver discussões sobre critérios de importação, licenciamento e utilização de vacinas, incluindo debates sobre a liberação do uso de vacinas atenuadas.
Recebido em 2 de junho de 2005.
Aceito para publicação em 5 de junho de 2005.
- Alfaia B.T., Barbosa A.C.V.C., Caixeta S.P.M.B., Rocha W.V. & Brito W.M.E.D. 2004. Prevalence and risk factors associated with BVDV infection in adult and non-vaccinated bovines females from Goiás, Brazil. Virus Rev. Res. 9(1):127.
- Alfieri A.A. 2004. Comunicação pessoal (Laboratório de Virologia Animal, Depto Med. Vet. Preventiva, CCA, Universidade Estadual de Londrina. E-mail: alfieri@uel.br).
- Andrade G.I., Lobato Z.I.P., Leite R.C. & Barbosa-Stancioli E.F. 2002. Padronização da técnica de imunoperoxidase para detecção do vírus da diarréia bovina a vírus em cultura de células. Arq. Bras. Med. Vet. Zootec. 54 (6):568-574.
- Baker J.C. 1995. The clinical manifestations of bovine viral diarrhea infection. Vet. Clin. North Am. 11(3):425-445.
- Blas-Machado U., Saliki J.T., Duffy J.C. & CaseltineS.L. 2004. Bovine viral diarrhea virus type 2- induced meningoencephalitis in a heifer. Vet. Pathol. 41(2):190-194.
- Botton S.A., Silva A.M., Brum M.C.S., Weiblen R. & Flores E.F. 1998. Antigenic characterization of Brazilian isolates of bovine viral diarrhea virus (BVDV) with monoclonal antibodies and by cross-neutralization. Braz. J. Med.Biol. Res. 31:1429-1438.
- Brito W.M.E.D. 2004. Comunicação pessoal (Laboratório de Virologia Animal, UFG, Goiânia. E-mail: wdbrito@iptsp.ufg.br).
- Brito W.M.E.D., Souza W.J., Vieira S., Linhares D.C.L., Barbosa A.C.V.C. & Alfaia, B.T. 2002. Serological study on bovine viral diarrhea in non vaccinated dairy herds with reproductive disorders from Goiás. Virus Rev. Res. 7(1):144.
- Brownlie J. 1990. The pathogenesis of bovine viral diarrhea virus infections. Rev. Sci. Tech. OIE 9:43-59.
- Brum M.C.S., Scherer C.F.C., Flores E.F., Weiblen R., Barros C.S.L. & Langohr I.M. 2002a. Enfermidade gastroentérica e respiratória em bezerros inoculados com amostras brasileiras do vírus da diarréia viral bovina tipo 2 (BVDV-2). Ciência Rural, Santa Maria, 32(5):803-820.
- Brum M.C.S., Weiblen R., Flores E.F., Pituco E.M., Tobias F.L. & Winkelmann E.R. 2002b. Proteção fetal frente a desafio com o vírus da Diarréia Viral Bovina (BVDV) em ovelhas imunizadas com duas amostras de vírus modificadas experimentalmente. Pesq. Vet. Bras. 22(2):64-72.
- Brum L.P.B., Flores E.F., Weiblen R., Scherer C.F.C.S, Kreutz L.C., Dürr J.W., Quadros V.L., Mazzutti K.C. & Pan K.A. 2004. Detecção de anticorpos contra o vírus da Diarréia Viral Bovina (BVDV) em amostras de tanques de leite de rebanhos leiteiros do Rio Grande do Sul, RS. Revta Bras. Cienc. Vet. 11(1/2):84-87.
- Canal C.W., Strasser M., Hertig C., Masuda A. & Peterhans E. 1998. Detection of antibodies to bovine viral diarrhea virus (BVDV) and characterization of genomes of BVDV from Brazil. Vet. Microbiol. 63:85-97.
- Castro R.S., Silva F.A.G., Frutuoso E.M. & Nascimento S.A. 1996. Anticorpos contra pestivírus e herpesvírus no estado de Pernambuco. Anais XXIII Congr. Bras. Med. Veterinária, Olinda, Pernambuco, p.252.
- Collett M.S., Moenning V. & Horzinek,M. 1989. Recent advances in pestivirus research. J. Gen. Virol. 70:253-266.
- Corapi W.V., French T.W. & Dubovi E.J. 1989. Severe thrombocytopenia in young calves experimentally infected with non cytopathic bovine viral diarrhea virus. J. Virol. 62:2823-2827.
- Correa W.V., Neto L.Z. & Barros H.M. 1968. Nota clínico-patológica de uma enfermidade das mucosas em São Paulo. Arqs Inst. Biol., São Paulo, 35(4):141-151.
- Dias F. C. & Samara S. I. 2003. Detecção de anticorpos contra o vírus da diarréia viral bovina no soro sangüíneo, no leite individual e no leite de conjunto em tanque de expansão de rebanhos não vacinados. Braz. J. Vet. Res. Anim. Sci. 40(3):161-168.
- Dubovi E.J. 1992. Genetic diversity and BVDV virus. Comp. Immun. Microb. Infect. Dis. 15(3):155-165.
- Driemeier D. 2004. Comunicação pessoal (Faculdade de Veterinária, UFRGS, Porto Alegre. E-mail: davetpat@vortex.ufrgs.br).
- Figueiredo H.C.P., Vieira P.R., Lage A.P. & Leite R.C. 1997. Prevalência de anticorpos contra o vírus da Diarréia Viral Bovina a vírus em Minas Gerais, Brasil. Revta Bras. Reprod. Animal l21: 11-15.
- Flores, E.F., Gil L.H.V., Botton S.A., Weiblen R., Ridpath J.L., Kreutz L.C., Pilati C., Driemeier D., Moojen V. & WendelsteinA.C. 2000. Clinical, pathological and antigenic aspects of bovine viral diarrhea virus (BVDV) type 2 isolates identified in Brazil. Vet. Microbiol. 77:175-183.
- Flores E.F. Ridpath J. F., Weiblen R., Vogel F.S.F. & Gil L.H.V.G. 2001. Phylogenetic analysis of Brazilian bovine viral diarrhea virus type 2 (BVDV) isolates: evidence for a subgenotype within BVDV-2. XII Natl Meet. Virology and IV Mercosul Meet. Virology, Caldas Novas, GO, Brazil. Summary PE-03.
- Flores E.F., Ridpath J., Vogel F.S.F., Weiblen R. & Gil L.H.V.G. 2002. Phylogenetic analysis of Brazilian bovine viral diarrhea virus type 2 (BVDV-2) isolates: evidence for a subgenotype within BVDV-2. Virus Res. 87:51-60.
- Flores E.F. 2004. Comunicação pessoal (Laboratório de Virologia, Depto Med. Vet. Preventiva, CCR, UFSM, Santa Maria, RS. E-mail: flores@ccr.ufsm.br).
- Gil L.H.V.G. 1998. Sequenciamento, análise filogenética e caracterização de polipeptídeos não-estruturais de amostras do vírus da Diarréia Viral Bovina (BVDV). Dissertação Mestrado em Medicina Veterinária, UFSM, Santa Maria, RS. 69p.
- Horzinek M.C. 1991. Pestivirus-taxonomic perspectives. Arch. Virol. (Suppl.) 3:1-5.
- Krahl M., Braga A.C., Oliveira L.G., Neto J.A.S.P., Prado J.A.P., Rosa J.C.A. & Wunder Júnior E. 1997. Pesquisa de anticorpos para leptospirose, Rinotraqueíte Infecciosa Bovina e Diarréia Viral Bovina em soros bovinos de propriedades rurais do Rio Grande do Sul. Anais 25ş Congr. Bras. Med. Veterinária, Gramado, RS. Soc. Bras. Med. Vet., INF 075, p.174.
- Kreutz L.C., Donis R., Lima M., Hoffmann A.N., Weiblen R., Garcez D.C. & Gil L.H.V. 2000. Production and characterization of monoclonal antibodies to Brazilian isolates of bovine viral diarrhea virus. Braz. J. Med. Biol. Res. 3(12):1459-1466.
- Langoni H., Paes A.C., Tonin F.B., Silva,A.V. & Denardi M.B. 1995. Prevalence of BVD, IBR and PI-3 in bovine by ELISA test. 5a Virológica, Ribeirão Preto, SP. Soc. Bras. Virologia, Resumo B43.
- Lima M.L., Flores E.F., Weiblen R., Vogel F.S.F. & Arenhart S. 2004. Caracterização de amostras atenuadas do vírus da Diarréia Viral Bovina (BVDV) tipos 1 e 2 para uso em vacinas. Pesq. Vet. Bras. 24:35-42.
- Médici K.C., Moscardi Jr E., Vicente K., Alfieri A.F. & Alfieri A.A. 2000. Identification of antibodies against bovine virus diarrhea virus in beef and dairy cattle herds in Parana State. Virus Rev. Res. 5(1):145.
- Melo C.B., Oliveira A.M., Figueiredo H.C.P., Leite R.C. & Lobato Z.I.P. 1997. Prevalência de anticorpos contra o Herpesvirus Bovino-1, vírus da diarréia viral bovina e vírus da leucose enzoótica bovina em bovinos do Estado do Sergipe, Brasil. Revta Bras. Reprod. Anim. 21(2):160-161.
- Mineo T.W.P., Montassier H.J., Björkman C., Näslund K. & Uggla A. 2002. Seroprevalence of bovine viral diarrhea virus and bovine herpesvirus type 1 in two abortion prone dairy herds in the Triangulo Mineiro Region. Virus Rev. Res. 7(1):145.
- Niskanen R. 1993. Relationship between the levels of antibodies to bovine viral diarrhea virus in bulk tank milk and the prevalence of cows exposed to the virus. Vet. Rec. 133:341-344.
- Noronha R., Campos S.G. & Sardi S. 2001. Serum neutralization test and viral isolation for bovine viral diarrhea virus in the state of Bahia. Virus Rev. Res. 6(1):146.
- Oliveira E.A.S. 1996. Caracterização antigênica de amostras de vírus da diarréia vírica bovina com anticorpos monoclonais. Dissertação de Mestrado, Curso de Pós-Graduação em Ciência Veterinária, Faculdade de Veterinária, UFRGS, Porto Alegre. 65p.
- Oliveira L.G., Oliveira E.A.S. & Silva L.H.T. 1996. Presença de Pestivirus e anticorpos contra Pestivirus em soros e cultivos celulares. Arq. Bras. Med. Vet. Zoot. 48(5):513-521.
- Paredes J.C.M., Oliveira E.A.S. & Oliveira L.G. 1999. Serum neutralization as a differential serological test for classical swine fever virus and other pestivirus infections. Arq. Bras. Med. Vet. Zootec. 51(5):403-408.
- Pellerin C., Van Den Hurk J. & Lecomte J. 1994. Identification of a new group of bovine viral diarrhea virus strains associated with severe outbreaks and high mortalities. Virology 203:260-267.
- Pilati C., Giongo L.C., Santos I.V., Weiblen R., Botton S.A. & Flores E.F. 1998. Enfermidade gastroentérica fatal associada com amostra não citopática do vírus da Diarréia Viral Bovina (BVDV). Anais do Simpósio Internacional sobre Herpesvírus Bovino (tipo 1 e 5) e Vírus da Diarréia Viral Bovina (BVDV), Santa Maria, RS. Laboratório de Virologia, UFSM, p.167.
- Pituco E.M. & Del Fava C. 1998. Situação do BVDV na América do Sul. Anais do Simpósio Internacional sobre Herpesvírus Bovino (tipo 1 e 5) e Vírus da Diarréia Viral Bovina (BVDV), Santa Maria, RS. Laboratório de Virologia, UFSM, p.49-57.
- Pituco E.M., Del Fava C. & Okuda L.H. 1997. Prevalência da infecção pelo vírus da diarréia bovina a vírus (BVD) em búfalos (Bubalus bubalis) no Vale do Ribeira, SP, Brasil. Arqs Inst. Biológico, São Paulo, 64(1):23-28.
- Pituco E.M. 2004. Comunicação pessoal (Laboratório de Viroses de Bovídeos, Instituto Biológico de São Paulo. E-mail: pituco@biologico.sp.gov.br).
- Quadros V.L., Mayer S.V., Vogel F.S.F., Weiblen R. & Flores E.F. 2005. Identification of the mechanism of expression of the polypeptide NS3 in 35 cytopathic isolates of bovine viral diarrhea virus. Braz. J. Med. Biol. Res. (Submetido)
- Ribeiro M.B., Galvão C.L., Costa A.R., Rodrigues F.M. & Suzart J.C.C. 1987. Infecções pelo vírus da rinotraqueíte infecciosa bovina/vulvovaginite pustular infecciosa, diarréia viral bovina e parainfluenza-3, detectadas por meio de avaliação sorológica no estado da Bahia. Bolm 11, EPABA, Salvador.
- Richtzenhain L.J. 1997. Em busca de respostas. Revta Criadores 808:40.
- Richtzenhain L.J. 2004. Comunicação pessoal (Depto Med. Vet. Preventiva e Saúde Animal, Fac. Med.Vet. Zootec., USP, São Paulo. E-mail: leonardo@usp.br).
- Richtzenhain L.J., Barbarini J.R., Umehara O., De Gracia A.S., Cortez A., Heinemann M.B., Ferreira F. & Soares R.M. 1999. Diarréia viral bovina: levantamento sorológico nos estados de Minas Gerais, Mato Grosso do Sul, São Paulo, Rio de Janeiro, Paraná e Rio Grande do Sul. Arqs Inst.Biológico, São Paulo, 66(1):107-111.
- Ridpath J., Bolin S. & Dubovi E. 1994. Segregation of bovine viral diarrhea virus into genotypes. Virology 205:66-74.
- Ridpath J. 2004. Comunicação pessoal (National Animal Disease Center, USDA, Ames, Iowa. E-mail: jridpath@nadc.ars.usda.gov).
- Roehe P.M., Oliveira E.A.S., Oliveira L.G. & Muñoz J.C.P. 1998. A situação do vírus da Diarréia Viral Bovina no País. Anais do Simpósio Internacional sobre Herpesvírus Bovino (tipo 1 e 5) e Vírus da Diarréia Viral Bovina (BVDV), Santa Maria, RS. Laboratório de Virologia, UFSM, p.30-48.
- Scherer C.F.C., Flores E.F., Weiblen R., Caron L., Irigoyen L.F., Neves J.P. & Maciel M.N. 2001. Experimental infection of pregnant ewes with bovine viral diarrhea virus type-2 (BVDV-2): effects on pregnancy and fetus. Vet. Microbiol. 77:285-299.
- Scherer C.F.C., Flores E.F., Weiblen R., Kreutz L.C., Dür J.W., Brum L.P., Quadros V.L. & Lima M. 2002. Técnica rápida de neutralização viral para a detecção de anticorpos contra o vírus da Diarréia Viral Bovina (BVDV) no leite. Pesq. Vet. Bras. 22(2):45-50.
- Schuch L.F.D. 2001. Diarréia Viral Bovina, p.64-72. In: Riet-Correa F., Schild A.L., Mèndez M.D.C. & Lemos R.A.A. (ed.) Doenças de Ruminantes e Eqüinos. Vol.1. Livraria Varela, São Paulo. 426p.
- Serra C.V., Pellegrin A.O., Lobato Z.I.P. & Barbosa-Stancioli E.F. 2002. Evaluation of bovine viral diarrhea virus infection in pantaneiro cattle herd using serological and RT-PCR assays. Virus Rev. Res. 7(1):144.
- Silva L.C. 2000. Evaluation of the humoral and cell mediated immune response of calves vaccinated with inactivated bovine virus diarrhea virus using the association of DDA chloride/aluminum hydroxide as adjuvant. Virus Rev. Res. 5(1):147.
- Tobias F.L., Odeon A., Pituco E.M., Weiblen R., Garcez D.C. & Flores E.F. 1998. Análise antigênica e molecular de amostras citopáticas do vírus da diarréia viral bovina. Ciência Rural, Santa Maria, 30(1):129-135.
- Vidor T. 1974. Isolamento e identificação do vírus da Doença das Mucosas no Rio Grande do Sul. Bolm Inst. Pesq. Vet. Desidério Finamor (Supl.Esp.) 2:51-58.
- Vidor T. 2004. Comunicação pessoal (Universidade Federal de Pelotas, Pelotas, RS. E-mail: tvidor@brturbo.com.br).
- Vogel F.S.F., Scherer C.F.C., Flores E.F., Weiblen R., Lima M. & Kunrath C.F. 2001. Resposta sorológica e avaliação de proteção fetal em ovelhas prenhes vacinadas contra o vírus da diarréia viral bovina (BVDV). Ciência Rural, Santa Maria, 31(5):831-838.
- Vogel F.S.F., Flores E.F., Weiblen R., Meyer S.V., Quadros V.L. & Oldoni I. 2002. Magnitude, duração e especificidade da resposta sorológica em bovinos vacinados contra o vírus da diarréia viral bovina. Ciência Rural, Santa Maria, 32(1):83-89.
- Weiblen R. 2004. Comunicação pessoal (Depto Med. Vet. Preventiva, UFSM, Santa Maria, RS. E-mail: rudi@ccr.ufsm.br).
- Wizigmann G., Vidor T. & Ricci Z.M.T. 1971. Investigações sorológicas sobre a ocorrência e incidência dos vírus PI-3, IBR e diarréia a vírus-enfermidade das mucosas no Estado do Rio Grande do Sul. Bolm Inst. Pesq. Vet. Desidério Finamor 1:52-58.
Datas de Publicação
-
Publicação nesta coleção
30 Set 2005 -
Data do Fascículo
Set 2005
Histórico
-
Aceito
05 Jul 2005 -
Recebido
02 Jun 2005