Resumos
Foram investigadas áreas de risco de leishmaniose visceral canina no município de Camaçari, Bahia. Um total de 278 cães distribuídos em 141 residências, pertencentes a 20 áreas de risco investigadas, foi examinado sorologicamente (ELISA). A soroprevalência geral foi 21,7% (56/258) depois da exclusão dos 20 cães usados no início do estudo para delimitar a área. Os resultados respectivos das análises univariada e multivariada dos fatores relacionados à infecção do cão por Leishmania chagasi, a captura e distribuição do vetor na área e a metodologia usada para localizar os focos caninos são discutidos.
Leishmaniose visceral; Leishmania chagasi; Lutzomyia longipalpis; controle; cães; epidemiologia; Brasil
Risk areas of canine visceral leishmaniasis in the city of Camaçari, Bahia, Brazil, were investigated. A total of 278 dogs from 141 homes pertaining to 20 investigated risk areas was serologically screened (ELISA). The general seroprevalence was 21.7% (56/258) after exclusion of 20 dogs used at the beginning of the survey to limit the study area. The respective results of the univariated and multivariated analysis of factors related to infection of dogs by Leishmania chagasi, to vector distribu-tion pattern in the area and to the methodology used to localize the canine focuses are discussed.
Visceral leishmaniasis; Leishmania infantum; Lutzomyia longipalpis; control; dogs; epidemiology; Brazil
Investigação de áreas de risco como metodologia complementar ao controle da leishmaniose visceral canina
Investigation of risk areas as complemental methodology for the control of canine visceral leishmaniasis
Fred S. JuliãoI; Bárbara M.P.S. SouzaI; Daniela S. FreitasI; Lídia S. OliveiraI; Daniela F. LarangeiraI; Artur G. Dias-LimaII; Verena M.M. SouzaII; Stella M. Barrouin-MeloI; Edson D. Moreira JrII; Bruno J.A.PauleI; Carlos R. FrankeI,* * Autor para correspondência: franke@ufba.br
ILaboratório de Infectologia Veterinária, Escola de Medicina Veterinária, Universidade Federal da Bahia (UFBA), Av. Adhemar de Barros 500, Ondina, Salvador, Bahia 40170-110, Brasil
IICentro de Pesquisa Gonçalo Moniz, FIOCruz, Rua Waldemar Falcão 121, Candeal, Salvador, Bahia 40296-710, Brasil
RESUMO
Foram investigadas áreas de risco de leishmaniose visceral canina no município de Camaçari, Bahia. Um total de 278 cães distribuídos em 141 residências, pertencentes a 20 áreas de risco investigadas, foi examinado sorologicamente (ELISA). A soroprevalência geral foi 21,7% (56/258) depois da exclusão dos 20 cães usados no início do estudo para delimitar a área. Os resultados respectivos das análises univariada e multivariada dos fatores relacionados à infecção do cão por Leishmania chagasi, a captura e distribuição do vetor na área e a metodologia usada para localizar os focos caninos são discutidos.
Termos de indexação: Leishmaniose visceral, Leishmania chagasi, Lutzomyia longipalpis, controle, cães, epidemiologia, Brasil.
ABSTRACT
Risk areas of canine visceral leishmaniasis in the city of Camaçari, Bahia, Brazil, were investigated. A total of 278 dogs from 141 homes pertaining to 20 investigated risk areas was serologically screened (ELISA). The general seroprevalence was 21.7% (56/258) after exclusion of 20 dogs used at the beginning of the survey to limit the study area. The respective results of the univariated and multivariated analysis of factors related to infection of dogs by Leishmania chagasi, to vector distribu-tion pattern in the area and to the methodology used to localize the canine focuses are discussed.
Index terms: Visceral leishmaniasis, Leishmania infantum, Lutzomyia longipalpis, control, dogs, epidemiology, Brazil.
INTRODUÇÃO
A leishmaniose visceral (LV) é uma zoonose endêmica no Brasil, com registros de casos em 19 Estados da Federação e uma incidência média anual de 2.550 casos humanos no período de 1984-2002. O Estado da Bahia, região nordeste do Brasil, registrou, no mesmo período, uma incidência média de 790 casos, sendo um dos estados mais atingidos pela doença (Brasil, 2003). A área de ocorrência da LV tem aumentado no Estado, especialmente na região semi-árida onde a doença já era conhecida. A partir do final da década de oitenta, municípios das regiões norte e oeste da Bahia tornaram-se endêmicos, provavelmente em decorrência da implantação de grandes projetos agrícolas, bem como, municípios ao leste, próximos a Salvador, capital do Estado, onde o progressivo adensamento populacional, decorrente da instalação de pólos industriais, foi seguido por registros freqüentes de casos autóctones de LV (Franke et al. 2002). Dentre os municípios pertencentes à Região Metropolitana de Salvador (RMS), Camaçari registra o maior número de casos humanos e caninos de LV, além do registro de um surto epidêmico da doença em 1991, quando 243 pessoas foram examinadas, resultando 30% de intra-dermorreação positiva para leishmania e uma sorologia positiva em 14% dos indivíduos; 460 cães foram incluídos na pesquisa sorológica apresentando reação positiva em 6,3% (Cunha et al. 1995). Camaçari dista 40 km do município de Salvador, que possui 2.500.000 habitantes (IBGE, 2000), com o qual mantém intensa migração pendular o que representa grave risco epidêmico, uma vez que Salvador é ainda considerada como área indene para LV. Segundos dados do inquérito sorológico amostral, fornecidos pelo Centro de Controle de Zoonoses de Camaçari (CCZC) a população canina do município apresentou uma soroprevalência de 0,35% (73/20.833) no período de 2002-2003.
As ações de controle da LV no Brasil incluem o diagnóstico e tratamento adequado dos casos humanos; controles químicos do vetor e controle do reservatório canino através de inquéritos sorológicos amostrais ou censitários seguidos da eutanásia dos cães soropositivos. Ao longo dos anos, a aplicação, muitas vezes, apenas parcial destas ações não proporcionou a redução da incidência da LV no país (Brasil 2003). O controle do reservatório canino tem sido um dos temas mais estudados e controversos quanto sua contribuição na redução da incidência da LV humana e canina (Palatnik-de-Sousa et al. 2001).
Os seguintes aspectos ainda deficientes no conjunto de ações de controles da LV canina são destacados na literatura: baixa sensibilidade do teste de imunofluorescência indireto, agravada pela ampla utilização de papel-filtro na colheita de sangue nos inquéritos sorológicos caninos; demora tanto no fornecimento do resultado diagnóstico, quanto na eutanásia dos cães soropositivos; ausência de técnica que avalie a infectividade dos cães examinados em inquéritos e a elevada taxa de reposição dos animais eutanasiados no âmbito das ações de controle. Estes fatores contribuem para prolongar a permanência de cães infectados na área, sustentando a continuidade do ciclo de transmissão do parasito (Braga et al. 1998, Palatnik-de-Sousa et al. 2001, 2004, Courtenay et al. 2002, Almeida et al. 2005, Lira et al. 2006). A realização de inquéritos sorológicos caninos (amostrais ou censitários), além de sua função de controle do reservatório canino em extensas áreas, tem papel fundamental na detecção de focos silenciosos da doença e na delimitação de regiões ou setores de maior prevalência, onde a execução das medidas de controle se faz mais necessária. No entanto, limitações no orçamento e na disponibilidade de pessoal capacitado reduzem a contribuição dos inquéritos a simples dados gerais de prevalência, pouco adicionando à compreensão das interações entre ambiente, hospedeiro, reservatório, vetor e aspectos socioeconô-micos próprios da região. No entanto, é justamente com base no conhecimento sobre estas interações locais que as estratégias de controle da LV devem ser elaboradas e continuamente ajustadas às subseqüentes alterações identificadas através de pesquisas específicas (Desjeux 2001).
Neste estudo, realizado no município de Camaçari, Bahia, a associação de diferentes formas de busca de casos caninos de LV, seguida do estudo epidemiológico das suas áreas de procedência, foi avaliada como proposta de uma possível metodologia complementar às medidas de controle da LV.
MATERIAL E MÉTODOS
O município de Camaçari (12º42'S e 38º28'O), com uma área de 762km2, conta com 161.727 habitantes (IBGE 2000), e uma população estimada em 41.000 cães, segundo dados do CCZC de 2003. O município pertence à Microrregião Homogênea de Salvador, Bahia, onde predomina o clima úmido com precipitação pluviométrica média anual superior a 1.600mm e temperatura média anual de 25ºC. O período de chuvas concentra-se entre os meses de abril a junho.
O estudo foi realizado no período de dezembro de 2002 a outubro de 2003, iniciando pela identificação de cães soropositivos para LV a partir de amostras de soro examinadas por ELISA no Laboratório de Infectologia Veterinária (LIVE), Escola de Medicina Veterinária da Universidade Federal da Bahia. As amostras foram obtidas através de três formas distintas: 1) amostras de soro de cães clinicamente suspeitos enviadas ao LIVE por clínicas veterinárias de Camaçari; 2) amostras de soro coletadas aleatoriamente por nossa equipe durante as campanhas de vacinação anti-rábica realizadas pelo CCZC; e 3) soros enviados ao LIVE pelo próprio CCZC.
Os cães soropositivos identificados nesta primeira fase amostral foram denominados de "caso índice" à medida que preenchiam um dos seguintes parâmetros de inclusão no estudo: presença de leishmania em cultura de biópsia esplênica ou valor de densidade ótica (DO) comparativamente superior ao primeiro quartil dos valores de DO registrados em 30 amostras de soro canino, provenientes da RMS, parasitologicamente positivas, previamente diagnosticados no LIVE. Para a punção esplênica usou-se agulha 40x12mm e seringa de 20mL estéreis, sendo precedida de sedação com Acepramazina 1% e assepsia local com álcool 70º. O material obtido foi cultivado em meio Schneider/NNN no Laboratório de Patologia e Bioinvestigação (LPBI) do Centro de Pesquisa Gonçalo Moniz/Fundação Oswaldo Cruz (CPqGM/FIOCruz). O período de observação do cultivo foi em média de quatro semanas, com avaliação semanal.
Após a identificação dos cães classificados como caso índice, procedeu-se a investigação da área de risco, definida como a área da circunferência com 200m de raio em torno da residência de cada um dos casos índice. Nestas áreas de risco foram realizadas as sorologias de todos os cães residentes com idade a partir de quatro meses; aplicou-se um questionário epidemiológico aos responsáveis pelos respectivos cães e foram instaladas armadilhas luminosas para verificar a presença do vetor Lutzomyia longipalpis.
Em todos os cães envolvidos no estudo procedeu-se a colheita de 4mL de sangue por punção venosa, com sistema a vácuo Monovet/Serum Z/9mL (Sarstedt Aktiengesellschaft & Co.). As amostras foram transportadas ao LIVE em caixa isotérmica, onde foram centrifugadas e os soros estocados a -20ºC até o momento do exame.
A sorologia foi realizada com um teste ELISA indireto previamente padronizado no LIVE. O extrato antigênico solúvel foi elaborado a partir da cepa Leishmania chagasi/LTCC-Leishmania Typing Culture Collection-WDCM731, isolada por punção esplênica de uma cadela residente no município de Camaçari, cultivada em meio Schneider e enviada para Laboratório de Pesquisas em Leishmanioses, Departamento de Imunologia do Instituto Oswaldo Cruz, Rio de Janeiro, para a identificação por eletroforese de enzimas. As promastigotas obtidas no cultivo foram centrifugadas a 2.500xg a 4ºC, durante 10 minutos, e lavadas três vezes com solução salina estéril. Em seguida, as promastigotas foram ressuspensas em solução salina com inibidor de proteases e sonicadas por ultra-som (Bronson, sonifier®) em cinco ciclos de 40 segundos e centrifugadas a 10.000xg a 5ºC, durante 30 minutos. O sobrenadante foi aliquotado e estocado a -20ºC até a sua utilização. A concentração protéica do antígeno foi determinada pelo método de Lowry (Bio-Rad, Laboratories, Inc., EUA). As microplacas com 96 poços (Costar®, Corning Incorporated, EUA) foram sensibilizadas com 100mL, por poço, do extrato antigênico (concentração de 10mg de proteínas por mL), diluído em tampão carbonato-bicarbonato 0,05 M, pH 9,6 e mantidas a 4ºC por 18 horas. Para o bloqueio utilizou-se 200mL de PBS, com 0,05% de Tween (PBS-T) e 5% de leite em pó desnatado. As placas foram mantidas a temperatura ambiente por uma hora e lavadas quatro vezes com PBS-T. Em todos os poços foram adicionados 100mL do soro na diluição de 1:400 em PBS-T com 5% de leite em pó desnatado, permanecendo as placas em temperatura ambiente por uma hora. Após quatro lavagens, adicionou-se 100mL da solução de imunoglobulinas G de coelho anti-cão conjugada com peroxidase (Sigma, Chemical Co., St. Louis, EUA), diluída em PBS-T com 5% de leite em pó desnatado, na concentração de 1:25.000, deixando-se as placas permanecerem à temperatura ambiente durante uma hora. As microplacas foram lavadas e a revelação da reação feita com Orto-phenylenediamine em tampão citrato-fosfato (pH 5,1) e peróxido de hidrogênio. A reação foi interrompida com 50mL de ácido sulfúrico 4M por poço e a leitura feita imediatamente em espectrofotômetro (Anthos Labtec Instruments, modelo 2010, Austria) com filtro de 492nm.
Para a definição do ponto de corte foram utilizados 101 soros caninos provenientes da Região Metropolitana de Salvador (RMS), Bahia, sendo 30 amostras de soro de cães comprovadamente positivos por cultivo esplênico para Leishmania sp. e 71 soros de cães clinica-mente sadios oriundos da cidade de Salvador, área considerada indene para LV. O cálculo do ponto de corte foi estabelecido seguindo metodologia previamente descrita (Griner 1981). O valor de DO de cada soro foi corrigido para permitir uma comparação entre as microplacas. A DO da amostra foi branqueada e dividida pelo valor de DO do controle positivo branqueado da respectiva microplaca e, posteriormente, multiplicado pela média das DO's dos controles positivos das microplacas utilizadas na análise dos 101 soros caninos. O ponto de corte foi estabelecido através da curva ROC (Receiver Operating Characteristics), utilizando-se os valores das DO's corrigidos. Para o ponto de corte escolhido, o teste ELISA apresentou resultado de 90% de sensibilidade, 100% de especificidade e 97% de eficiência.
Para investigar a presença de L. longipalpis nas áreas de risco, foi instalada em cada uma delas uma armadilha luminosa do tipo CDC, por um período máximo de duas noites, sendo ativadas no entardecer e examinadas na manhã seguinte. As armadilhas foram dispostas em abrigo de animais, na seguinte ordem de preferência: galinheiros, canis e abrigos de outros animais; e na ausência destes, foram dispostas no peridomicílio. Os espécimes capturados foram identificados no Laboratório de Entomologia e Parasitologia (LAPEN) do CPqGM/FIOCruz, Bahia.
Um questionário epidemiológico, previamente validado, foi aplicado aos responsáveis pelos cães envolvidos no estudo, visando obter informações sobre: presença de crianças até 12 anos de idade; idade dos cães; sexo; raça; comprimento do pêlo (curto d" 3cm e longo > 3cm); tempo de residência do cão na área (até 1 ano e mais de 1 ano); cão com acesso à rua; já ter ouvido falar sobre LV; caso de LV humana na vizinhança; caso prévio de LV canina na casa; presença de gatos, galinhas ou porcos no peridomicílio e presença de cão com LV eliminado no vizinho.
Os dados foram analisados através de comparações de pro-porções, pelo teste Qui quadrado, análise ajustada para a variável idade (cães de 4 meses a 1 ano, acima de 1 ano até 5 anos, e acima de 5 anos de idade) e análise multivariada (regressão logística) para calcular medidas de associação relativa (Odds ratio) entre os resultados da sorologia e as variáveis estudadas.
RESULTADOS
Foram identificados 20 cães índice e analisadas, conseqüentemente, 20 áreas de risco, abrangendo seis localidades no município de Camaçari. Quanto à origem destes cães índice: sete tratavam-se de casos clinicamente suspeitos enviados ao LIVE por clínicas veterinárias de Camaçari; 11 identificados durante as campanhas de vacinação anti-rábica realizadas pelo CCZC e dois enviados ao LIVE pelo próprio CCZC.
O estudo das 20 áreas de risco abrangeu 141 residências e 278 cães. Para a análise estatística, optou-se por subtrair da amostra os 20 cães índice que deram origem à delimitação de cada uma das áreas de risco, com a finalidade de evitar um possível viés de seleção. A soroprevalência da população canina das áreas de risco, após a exclusão dos 20 casos índices, resultou em 21,7% (56/258). Os resultados sorológico e parasitológico, bem como, o resultado da captura de vetor em cada uma das áreas de risco são apresentados no Quadro 1. Foi obtido resultado positivo em 70,3% (26/37) das culturas de punção esplênica, sendo que das 20 áreas de risco estudadas, em apenas uma (Jauá) o cão índice foi definido pelo critério sorológico em vista do resultado negativo na cultura de punção esplênica.
A presença de L. longipalpis foi confirmada em 50,0% (10/20) das áreas de risco. O vetor foi capturado em pelo menos uma das áreas de risco em cada das localidades estudadas (Quadro 1).
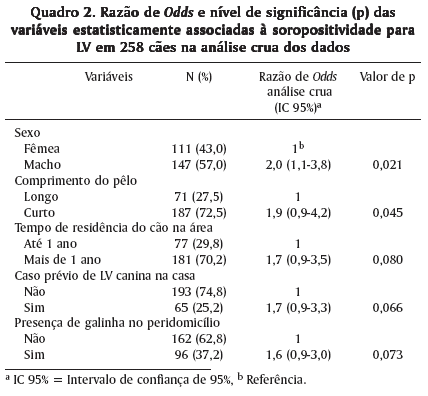
A análise crua não evidenciou associação estatística significante entre soropositividade e as seguintes variáveis: presença de crianças até 12 anos de idade; idade dos cães; raça, cão com acesso à rua; já ter ouvido falar em LV; caso de LV humana na vizinhança; presença de gatos ou porcos no peridomicílio; presença de cão com LV eliminado no vizinho. As variáveis que demonstraram significância estatística nesta análise foram sexo (p=0,021) e comprimento do pelo (p=0,045), enquanto as variáveis: tempo de residência do cão na casa (p=0,08), caso prévio de LV canina na casa (p=0,066) e presença de galinha no peridomicílio (p=0,073), ficaram próximas significância com IC = 95%.
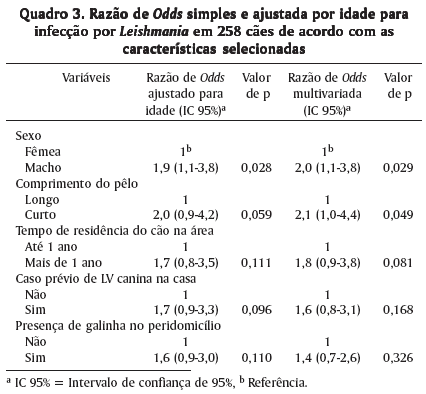
Análises ajustada para idade e multivariada foram realizadas nas variáveis constantes na Quadro 2 resultando signifi-cância estatística para sexo em ambas as análises (p=0,028 e p=0,029, respectivamente) e comprimento do pelo (p=0,049) para a análise multivariada (Quadro 3).
DISCUSSÃO
Foram investigadas 20 áreas de risco de LV canina, identifi-cadas seis localidades no município de Camaçari, Bahia no período de dezembro de 2002 a outubro de 2003. A média da soroprevalência, após a retirada dos 20 cães índice que deram início à investigação de cada uma das áreas de risco foi de 21,7% (56/258). No período de janeiro de 2002 a dezembro de 2003, o CCZC registrou no município, através de inquérito sorológico da população canina (utilizando o teste de imunofluorescência indireta), soroprevalência de 0,35% (73/20.833) de LV canina. A diferença entre a taxa de prevalência média das áreas de risco e a taxa de prevalência geral registrada pelo CCZC, obviamente decorre do teste diagnóstico empregado, da forma de localização dos cães soropositivos e da definição de população adotada. No entanto, esta diferença permite deduzir que existem áreas no município onde as populações humanas estão mais expostas à infecção em vista da elevada taxa de prevalência de LV canina registrada nas áreas de risco avaliadas em nosso estudo. A relação entre o incremento da prevalência de LV canina e o surgimento de casos humanos da doença tem sido evidenciada por outros autores (Ashford et al. 1998, Zulueta et. al. 1999, Gavgani et al. 2002,). No caso de Camaçari, se a escolha da estratégia desta zoonose considerar apenas a taxa de prevalência geral de LV canina do município (0,35%), o risco de infecção nas áreas onde a transmissão do parasito é mais intensa estará sendo subestimado. Por exemplo, segundo as orientações oficiais (Brasil 2003), áreas que apresentarem soroprevalência de LV canina inferior a 2% serão alvo de inquérito canino anual apenas por amostragem, ao contrário das áreas com prevalência igual ou superior a 2%, onde o inquérito censitário anual, abrangendo toda a população canina do município ou de uma fração deste, é a estratégia recomendada para o controle da LV humana. No inquérito canino por amostragem há sempre a possibilidade de não identificar algumas áreas de risco, permitindo a continuidade do ciclo de transmissão do parasito no município.
Problemas associados a atual execução dos inquéritos caninos como: o baixo desempenho diagnóstico do teste de imunofluorescência indireto utilizado pelos CCZs (Leontides et al. 2002, Scalone et al. 2002), a demora na divulgação dos resultados e a retirada tardia dos cães soropositivos das áreas trabalhadas (Cringoli et al, 2002), são apontados por diversos autores como prováveis causas dos resultados insatis-fatórios desta medida em reduzir o risco de infecção nas populações humanas e caninas (Desjeux 1992, Dye 1992, Gavgani et al. 2002, Moreira Jr et al. 2004), sendo que as conseqüências destes problemas se agravam de acordo com a abrangência do inquérito sorológico. Comparando os resultados deste estudo com os obtidos pelo CCZC se observa que em menos da metade do tempo e examinando um número de cães cerca de 75 vezes menor (20.833/278), foi possível identificar uma quantidade de cães soropositivos semelhante à registrada pelo CCZC em seu extenso inquérito. Estas proporções demonstram a possibilidade de aperfeiçoar as ações de controle da LV canina, adotando a metodologia de localização de cães soropositivos utilizada neste estudo como uma estratégia complementar aos inquéritos sorológicos tradicionais. As vantagens logísticas e de redução de custos advindas do levantamento da LV canina durante as campanhas de vacinação anti-rábica são evidentes. No entanto, a participação das clínicas veterinárias no monitoramento e controle da LV canina deverá ser buscada e, através de campanhas de conscientização, mobilizar os profissionais ligados à saúde e as populações locais em torno de uma ampla discussão sobre o impacto desta zoonose na saúde publica; a possibilidade de tratamento e acompanhamento de cães infectados e a necessidade de implantação da notificação compulsória dos casos de LV canina diagnosticados, no intuito de tornar mais eficiente as ações de controle da LV.
As capturas de L. longipalpis nas localidades de Vilas de Abrantes, Jauá, Arembepe, Barra do Pojuca e Loteamento Monte Negro, constituem os primeiros relatos da presença do vetor nestas localidades. Apenas a localidade de Monte Gordo conta com registro prévio de ocorrência de L. longipalpis (Cunha et al. 1995). A presença deste vetor próximo ao litoral é incomum na literatura brasileira (Dias-Lima 2004). Em uma área de risco em Arembepe, L. longipalpis foi capturado a menos de 100m de distância do mar e em cinco áreas de risco na localidade de Jauá o vetor se encontrava a uma distância média inferior a 2000 metros de distância do mar, demonstrando a adaptação do vetor ao ambiente litorâneo, o que representa um risco à saúde pública, considerando que o município de Camaçari apresenta elevada taxa de crescimento populacional e grande parte desse contingente humano concentra-se nas áreas litorâneas, onde as atividades de lazer e turismo contribuem, adicionalmente, com um incremento pendular na densidade das populações residentes.
As discordâncias quanto à significância de variáveis como sexo, comprimento do pêlo e raça, encontradas na literatura, refletem provavelmente o papel epidemiológico circunstancial que desempenham. Neste estudo os cães de pêlo curto e os cães machos apresentam maior chance de infecção por L. chagasi, enquanto que a raça não alcançou significância estatística. Resultados discordantes quanto à associação de soropositividade canina e comprimento de pêlo dos cães (Fisa et al. 1999, Leontides et. al. 2002, Moreira Jr et. al. 2003) e sexo (Zaffaroni et. al. 1999, Cringoli et. al. 2002, Leontides et. al. 2002, Cabrera et. al. 2003, França-Silva et. al. 2003, Moreira Jr et. al. 2003) são discutidos em estudos prévios enquanto que resultados anteriormente descritos na literatura não inclui a variável raça como significativa para ocorrência de LV (Leontides et. al. 2002, Moreira Jr et. al. 2003).
A associação entre soropositividade e cães que residiam em casas com registro prévio de LV canina, não apresentou significância em nenhuma das análises, apesar da análise crua apresentar p=0,066. Estes resultados apontam para a possível existência de outras variáveis de risco locais como a presença de outras espécies de animais domésticos e silvestres, ou mesmo a presença de humanos com infecção assinto-mática, atuando como reservatórios de L. chagasi e contribuindo na manutenção do ciclo de transmissão do parasito, mesmo após a eutanásia ou a morte natural do cão infectado como já citado por outros autores (Badaró 1988, Corredor et al. 1989, Mancianti et al. 1994, Dietze et. al. 1997, Ashford et al. 1998, Dereure et. al. 2003). Fato semelhante foi observado com crianças residindo em casas com registro prévio de LV humana, as quais apresentaram um risco três vezes maior de infecção (Jeronimo et. al. 2000).
Presença de galinhas no peridomicílio não foi significativa em nossas análises, embora alguns autores relatem seu envolvimento na epidemiologia da LV (Dye et al. 1991, Arias et al. 1996, Moreira Jr et al. 2003), em decorrência, provavelmente, do fato das galinhas representarem uma fonte de alimentação, não só para o vetor, como para alguns animais silvestres, potenciais reservatórios de L. chagasi, atraindo-os e mantendo-os no peridomicílio (Alexander et al. 2002).
Os resultados deste estudo apóiam a atual estratégia de intervenção focal preconizada no Manual de Vigilância e Controle de Leishmaniose Visceral (Brasil 2003), evidenciando a baixa eficiência de extensos inquéritos sorológicos, a diferenciada soroprevalência canina focal e a indicação da provável influência de fatores ambientais no incremento do risco de infecção em cães.
O registro de áreas ativas de risco de LV canina na região litorânea de Camaçari representa um novo desafio à vigilância epidemiológica, pois a exemplo da intensa dispersão da LV registrada em Belo Horizonte, esta área do litoral baiano apresenta também acentuada taxa de crescimento populacio-nal além de ser área de intenso trafego humano e animal, fatores que facilitam a disseminação local do parasito e sua posterior dispersão para área ainda indene (Bevilacqua et al. 2001). Resultados mais práticos quanto ao controle da LV deverão ser obtidos com o aprimoramento do conhecimento epidemiológico das características focais da LV, especialmente no tocante ao papel dos cães, humanos e animais silvestres, atuando como reservatórios insuspeitos, na continuidade do ciclo de transmissão de L. chagasi nas áreas onde as atuais medidas de controle são corretamente executadas.
Agradecimentos.- Aos Centros de Controle de Zoonoses dos municípios de Camaçari e Lauro de Freitas, à empresa Sarstedt Aktiengesellschaft & Co; ao Laboratório de Patologia e Bioinvestigação (LPBI/CPqGM/FIOCruz/BA); ao Laboratório de Pesquisas em Leishmanioses, Departamento de Imunologia do Instituto Oswaldo Cruz, Rio de Janeiro, e ao professor Dr. Paulo Henrique Palis Aguiar, pela contribuição na elaboração deste estudo.
Recebido em 4 de abril de 2007.
Aceito para publicação em 19 de junho de 2007.
- Alexander B., Carvalho R.L., McCallum H. & Pereira M.H. 2002. Role of the domestic chicken (Gallus gallus) in the epidemiology of urban visceral leishmaniasis in Brazil. Emerg. Infect. Dis. 8(12):1480-1485.
- Almeida M.A., Jesus E.E., Sousa-Atta M.L., Alves L.C., Berne M.E. & Atta A.M. 2005. Antileishmanial antibody profile in dogs naturally infected with Leishmania chagasi. Vet. Immunol. Immunopathol. 15;106(1-2):151-158.
- Arias J.R., Monteiro P.S. & Zicker F. 1996. The reemergence of visceral leishmaniasis in Brazil. Emerg. Infect. Dis. 2(2):145-146.
- Ashford D.A., David J.R., Freire M., David R., Sherlock I., Eulálio M.C., Sampaio D.P. & Badaró R. 1998. Studies on control of visceral leishmaniasis: impact of dog control on canine and human visceral leishmaniasis in Jacobina, Bahia, Brazil. Am. J. Trop. Med. Hyg. 59(1):53-57.
- Badaró R. 1988. Progressos nas pesquisas de leishmaniose visceral na área endêmica de Jacobina, Bahia, 1934-1989. Revta Soc. Bras. Med. Trop. 21(4): 159-164.
- Bevilacqua P.D., Paixão H.H., Modena C.M. & Castro M.C.P.S. 2001. Urbanização da leishmaniose visceral em Belo Horizonte. Arq. Bras. Med. Vet. Zootec. 53(1):1-8.
- Braga M.D.M., Coelho I.C.B., Pompeu M.M.L., Evans T.G., Macaullife, I.T., Teixeira M.J. & Lima J.W.O. 1998. Controle do calazar canino: comparação dos resultados de um programa de eliminação rápida de cães soro-reagentes por ensaio imuno-enzimático com outro de eliminação tardia de cães sororreagentes por teste de imunofluorescência indireta de eluato de papel filtro. Revta Soc. Bras. Med. Trop. 31(5):419-424.
- Brasil 2003. Manual de Vigilância e Controle da Leishmaniose Visceral. Departamento de Vigilância Epidemiológica, Secretaria de Vigilância em Saúde, Ministério da Saúde, Brasília.120p.
- Cabrera M.A.A., Paula A.A., Camacho L.A.B., Marzochi M.C.A., Xavier S.C., Silva A.V.M. & Jansen A.M. 2003. Canine visceral leishmaniasis in Barra de Guaratiba, Rio de Janeiro, Brazil: assenssment of risk factors. Revta Inst. Med. Trop. S. Paulo 45(2):79-83.
- Corredor A., Gallego J.F, Tesh R.B., Morales A., Carrasquilla C.F., Young D.G., Kreutzer R.D., Boshell J., Palau M.T., Caceres E. & Palaez D. 1989. Epidemiology of visceral leishmaniasis in Colombia. Am. J. Trop. Med. Hyg. 40(5):480-486.
- Courtenay O., Quinnell R.J., Garcés L.M., Shaw J.J. & Dye C. 2002. Infectiousness in a cohort of Brazilian dogs: why culling fails to control visceral leishmaniasis in areas of high transmission. J. Infect. Dis. 186:1314-1320.
- Cringoli G., Rinaldi L., Capuano F., Baldi L., Veneziano V. & Capelli G. 2002. Serological survey of Neospora caninum and Leishmania infantum co-infection in dogs. Vet. Parasitol. 106:307-313.
- Cunha S., Freire M., Eulalio C., Cristovao J., Netto E., Johnson Jr W.D., Reed S.G. & Badaró R. 1995. Visceral leishmaniasis in a new ecological niche near a major metropolitan área of Brazil. Trans. R. Soc. Trop. Med. Hyg. 89:155-158.
- Dereure J., El-Safi S.H., Bucheton B., Boni M., Kheir M.M., Davoust B., Pratlong F., Feugier E., Lambert M., Dessein A. & Dedet J.P. 2003. Visceral leishmaniasis in eastem Sudan: parasite identification in humans and dogs; host-parasite relationships. Microbes and Infection 5:1103-1108.
- Desjeux P. 1992. Human leishmaniases: epidemiology and public health aspects. Wld Hlth Statist. Quart. 45:267-275.
- Dias-Lima A.G. 2004. Distribuição e dispersão da Lutzomyia longipalpis (Lutz & Neiva, 1912) (Díptera: Psychodidae), vetora da leishmaniose visceral americana, no Estado da Bahia. Tese (doutorado) _ Instituto Oswaldo Cruz, Centro de Pesquisas Gonçalo Moniz. 145f
- Dietze R., Barros G.B., Teixeira L.T., Harris J., Michelson K., Falqueto A. & Corey R. 1997. Effect of eliminating seropositive canines on the trans-mission of visceral leishmaniasis in Brazil. Clin. Infect. Dis. 25(5):1240-1242.
- Dye C. 1992. Leishmaniasis epedemiology: the theory catches up. Parasitology 104:S7-S18.
- Dye C., Davies C.R. & Lainson R. 1991. Communication among phlebotomine sandflies: a field study of domesticated Lutzomyia longipalpis populations in Amazonian Brazil. Anim. Behaviour 42:183-192.
- Fisa R., Gállego M., Castillejo S., Aisa M.J., Serra T., Riera C., Carrió J., Gállego J. & Portús M. 1999. Epidemiology of canine leishmaniasis in Catalonia (Spain), the example of the Priorat focus. Vet. Parasitol. 83:87-97.
- França-Silva J.C., Costa R.T., Siqueira A.M., Machado-Coelho G.L.L., Costa C.A., Mayrink W., Vieira E.P., Costa J.S., Genaro O. & Nascimento E. 2003. Epidemiology of canine visceral leishmaniasis in the endemic área of Montes Claros municipality, Minas Gerais state, Brazil. Vet. Parasitol. 111:161-173.
- Franke C.R., Staubach C., Ziller M. & Schluter H. 2002. Trends in the temporal and spatial distribution of visceral and cutaneous leishmaniasis in the state of Bahia, Brazil, from 1985 to 1999. Trans. R. Soc. Trop. Med. Hyg. 96:1-6.
- Gavgani A.S.M., Mohite H., Edrissian G.H., Mohebali M. & Davies C.R. 2002. Domestic dog ownership in Iran is a risk factor for human infection with Leishmania infantum Am. Trop. Med. Hyg. 67(5):511-515.
- Griner P.F., Mayewski R.J., Mushlin A.I. & Greenland P. 1981. Selection and interpretation of diagnostic tests and procedures. Ann. Int. Med. 94:555-600.
- IBGE: <http://www.ibge.gov.br/cidadesat/default.php> Resultado da Amostra do Censo Demográfico 2000.
- Jeronimo S.M.B., Teixeira M.J., Sousa A.Q., Thielking .P, Pearson R.D. & Evans T.G. 2000. Natural history of Leishmania (Leishmania) chagasi infection in northeastern Brazil: long-term follow-up. Clin. Infect. Dis. 30(3):608-609.
- Leontides L.S., Saridomichelakis M.N., Billinis C., Kontos V., Koutinas A.F., Galatos A.D. & Mylonakis M.E. 2002. A cross-sectional study of Leishmania spp. infection in clinically healthy dogs with polymerase chain reaction and serology in Greece. Vet. Parasitol. 109:19-27.
- Lira R.A., Cavalcanti M.P., Nakazawa M., Ferreira A.G., Silva E.D., Abath F.G., Alves L.C., Souza W.V. & Gomes Y.M. 2006. Canine visceral leishmaniosis: a comparative analysis of the EIE-leishmaniose-visceral-canina-Bio-Manguinhos and the IFI-leishmaniose-visceral-canina-Bio-Manguinhos kits. Vet. Parasitol. 137(1-2):11-16.
- Mancianti F., Mignone W. & Galastri F. 1994. Serologic survey for leishmaniasis in free-living red fox (Vulpes vulpes) in Italy. J. Wild. Dis. 30(3):454-456.
- Moreira Jr E.D., Souza V.M.M., Sreenivasan M., Lopes N.L., Barreto R.B., Carvalho L.P. 2003. Peridomestic risk factors for canine leishmaniasis in urban dwellings: new findings from a prospective study in Brazil. Am. J. Trop. Med. Hyg. 69(4):393-397.
- Moreira Jr E.D., Souza V.M.M., Sreenivasan M., Nascimento E.G. & Carvalho L.C.P. 2004. Assessment of an optimized dog-culling program in the dynamics of canine Leishmania transmission. Vet. Parasitol. 122(4):245-252.
- Palatnik-de-Sousa C.B., Santos W.R., França-Silva J.C., Costa R.T., Reis A.B., Palatnik M., Mayrink W. & Genaro O. 2001. Impact of canine control on the epidemiology of canine and human visceral leishmaniasis in Brazil. Am. J. Trop. Med. Hyg. 65(5):510-517.
- Palatnik-de-Sousa C.B., Batista-de-Melo L.M., Borja-Cabrera G.P., Palatnik M. & Lavor C.C. 2004. Improving methods for epidemiological control of canine visceral leishmaniasis based on a mathematical model: impact on the incidence of the canine and human disease. Anais Acad. Bras. Ciênc. 76(3):583-593.
- Scalone A., De Luna R, Oliva G., Baldi L., Satta G., Vesco G., Mignone W., Turilli C., Mondesire R.R., Simpson D., Donoghue A.R., Frank G.R. & Gradoni L. 2002. Evaluation of the Leishmania recombinant K39 antigen as a diagnostic marker for canine leishmaniasis and validation of a standardized enzyme-linked immunosorbent assay. Vet. Parasitol. 104:275-285.
- Zaffaroni E., Rubaudo L., Lanfranchi P. & Mignone W. 1999. Epidemiological patterns of canine leishmaniosis in Western Ligúria (Italy). Vet. Parasitol. 81:11-19.
- Zulueta A.M., Villarroel E., Rodriguez N., Feliciangeli D., Mazzarri M., Reyes O., Rodriguez V., Centeno M., Barrios R.M. & Ulrich M. 1999. Epidemiologic aspects of American leishmaniasis in an endemic focus in eastern Venezuela. Am. J. Trop. Med. Hyg. 61(6):945-950.
Datas de Publicação
-
Publicação nesta coleção
21 Nov 2007 -
Data do Fascículo
Ago 2007
Histórico
-
Recebido
04 Abr 2007 -
Aceito
19 Jun 2007