Resumos
Através de um estudo retrospectivo dos casos de biópsias e necropsias de cães recebidos no Laboratório de Patologia Veterinária da Universidade Federal de Santa Maria, constatou-se a ocorrência de dois casos confirmados e de quatro casos suspeitos de pitiose gastrintestinal canina. Os dois casos diagnosticados e publicados tiveram a etiologia confirmada através da cultura e indução de zoosporogênese ou por nested-PCR. Neste estudo utilizou-se a técnica de imuno-histoquímica com anticorpo policlonal anti-Pythium insidiosum para confirmação da etiologia dos quatro casos suspeitos. A epidemiologia, sinais clínicos, lesões macroscópicas e microscópicas, características histoquímicas e imuno-histoquímicas e diagnósticos diferenciais são relatados e discutidos.
Pitiose; Pythium insidiosum; doenças de cães; doenças gastrintestinais; doenças granulomatosas; imuno-histoquímica; patologia
Four suspect and two confirmed cases of gastrointestinal pythiosis were found in a retrospective study of biopsy and necropsy cases of dogs received in the Laboratório de Patologia Veterinária at the Universidade Federal de Santa Maria. The two diagnosed and published cases have had the etiology confirmed by culture and zoosporogenesis induction or by nested-PCR. On this study, the etiologic diagnosis of four suspect cases was confirmed by immunohistochemistry using anti-Pythium insidiosum policlonal antibody. Epidemiology, clinical signs, gross and microscopic lesions, histochemistry, immunohistochemistry, and differential diagnoses are reported and discussed.
Pythiosis; Pythium insidiosum; diseases of dogs; gastrintestinal diseases; granulomatous diseases; immunohistochemistry; pathology
Aspectos clínicos, morfológicos e imuno-histoquímicos da pitiose gastrintestinal canina
Maria E. TrostI; Adriane L. GabrielI; Eduardo K. MasudaII; Rafael A. FigheraII; Luiz F. IrigoyenII; Glaucia D. KommersII,* * Autor para correspondência: glaukommers@yahoo.com
IPrograma de Pós-Graduação em Medicina Veterinária, área de concentração em Patologia Veterinária, Centro de Ciências Rurais, Universidade Federal de Santa Maria (UFSM), Santa Maria, RS 97105-900, Brasil
IIDepartamento de Patologia, Centro de Ciências da Saúde, UFSM, Santa Maria, RS
RESUMO
Através de um estudo retrospectivo dos casos de biópsias e necropsias de cães recebidos no Laboratório de Patologia Veterinária da Universidade Federal de Santa Maria, constatou-se a ocorrência de dois casos confirmados e de quatro casos suspeitos de pitiose gastrintestinal canina. Os dois casos diagnosticados e publicados tiveram a etiologia confirmada através da cultura e indução de zoosporogênese ou por nested-PCR. Neste estudo utilizou-se a técnica de imuno-histoquímica com anticorpo policlonal anti-Pythium insidiosum para confirmação da etiologia dos quatro casos suspeitos. A epidemiologia, sinais clínicos, lesões macroscópicas e microscópicas, características histoquímicas e imuno-histoquímicas e diagnósticos diferenciais são relatados e discutidos.
Termos de indexação: Pitiose, Pythium insidiosum, doenças de cães, doenças gastrintestinais, doenças granulomatosas, imuno-histoquímica, patologia.
ABSTRACT
Four suspect and two confirmed cases of gastrointestinal pythiosis were found in a retrospective study of biopsy and necropsy cases of dogs received in the Laboratório de Patologia Veterinária at the Universidade Federal de Santa Maria. The two diagnosed and published cases have had the etiology confirmed by culture and zoosporogenesis induction or by nested-PCR. On this study, the etiologic diagnosis of four suspect cases was confirmed by immunohistochemistry using anti-Pythium insidiosum policlonal antibody. Epidemiology, clinical signs, gross and microscopic lesions, histochemistry, immunohistochemistry, and differential diagnoses are reported and discussed.
Index terms: Pythiosis, Pythium insidiosum, diseases of dogs, gastrintestinal diseases, granulomatous diseases, immunohistochemistry, pathology.
INTRODUÇÃO
Pitiose canina é uma doença granulomatosa progressiva causada por Pythium insidiosum, um microrganismo aquático pertencente ao Reino Straminipila (Mendoza et al. 2005), Classe Oomycetes, Ordem Pythiales, Família Pythiaceae e Gênero Pythium (Grooters 2003). O Gênero Pythium compreende organismos que habitam a água e o solo úmido de regiões tropicais e subtropicais do mundo (Mendoza et al. 1996, Supabandhu et al. 2007). Há mais de 120 espécies de Pythium conhecidas, várias delas associadas a doenças em plantas de importância econômica (Alexopoulos et al. 1996). Entretanto, P. insidiosum é a única espécie responsável por doença em mamíferos (Alexopoulos et al. 1996, Rivierre et al. 2005, Krajaejun et al. 2006).
Para manter seu ciclo, P. insidiosum necessita de água com baixa concentração de íons, pH próximo à neutralidade, temperatura elevada (entre 30° e 40°C) e alguma espécie de planta hospedeira (Chaffin et al. 1995, Mendoza et al. 1996). Zoósporos móveis biflagelados são as estruturas responsáveis pela infecção. Produzidos e liberados no ambiente aquático, são capazes de colonizar plantas (Mendoza et al. 1996) e em condições especiais infectar tecidos de animais e humanos (Grooters & Foil 2006, Marques et al. 2006, Supabandhu et al. 2007). Além de eqüinos, outras espécies domésticas afetadas incluem: cães (Miller 1985), gatos (Rakich et al. 2005), bovinos (Gabriel et al. 2008) e ovinos (Tabosa et al. 2004). Recentemente foi descrito um caso de pitiose em uma ave migratória (Pesavento et al. 2008). Os cães são a segunda espécie mais afetada pela pitiose (Santurio et al. 2006) e a maioria dos relatos envolve o trato gastrintestinal (TGI) (Foil et al. 1984, Howerth et al. 1989). Entretanto, casos de pitiose cutânea (Dykstra et al. 1999), prostática (Jaeger et al. 2002) e disseminada também são descritos (Rivierre et al. 2005).
Cães acometidos pela forma gastrintestinal da pitiose apresentam emagrecimento progressivo, dor abdominal, inapetência, diarréia, vômito e massa abdominal palpável (Helmann & Oliver 1999, Mendoza et al. 2003). Esses sinais clínicos são comuns a outras doenças em cães, o que leva o diagnóstico da pitiose ser baseado nos achados de necropsia e histopatologia, associados à identificação do agente através de métodos auxiliares de diagnóstico como cultivo e posterior indução da zoosporogênese, técnicas de PCR e imuno-histoquímica (Grooters 2003).
O objetivo deste artigo é relatar e discutir a epidemiologia, os sinais clínicos, as lesões macroscópicas e microscópicas e as características histoquímicas e imuno-histoquímicas associadas ao diagnóstico da forma gastrintestinal da pitiose canina.
MATERIAL E MÉTODOS
Foi realizado um estudo retrospectivo dos casos suspeitos e confirmados de pitiose gastrintestinal canina recebidos na rotina de biópsias e necropsias do Laboratório de Patologia Veterinária da Universidade Federal de Santa Maria (LPV-UFSM). Os tecidos foram fixados em formol 10% e processados para histopatologia. Secções histológicas foram coradas com hematoxilina-eosina (HE). Foram também aplicadas as técnicas de metenamina nitrato de prata de Grocott (GMS) e ácido periódico de Schiff (PAS) para a visualização das hifas.
A técnica de imuno-histoquímica (IHQ) para a detecção de Pythium insidiosum foi realizada nos Casos 1, 3, 5 e 6, conforme protocolo descrito a seguir. Após a desparafinização e reidratação dos tecidos, foi realizada a recuperação antigênica com solução de TRIS-EDTA (pH 9,0) em forno microondas, em potência máxima, por dez minutos. Como anticorpo primário, foi utilizado anticorpo policlonal (não-comercial) anti-P. insidiosum produzido em coelho, diluído 1:1000 em PBST, e incubado por 60 minutos a 37°C. O anticorpo secundário biotinilado e o complexo estreptavidina-fosfatase alcalina (LSAB+System-AP, Dako Cytomation, K0689 [Dako Cytomation, 6392 Via Real, Carpinteria, CA, USA]) foram utilizados consecutivamente, incubados à temperatura ambiente por 30 minutos, e marcados através da adição do cromógeno Liquid Permanent Red (Dako Cytomation, K0640 [Dako Cytomation, 6392 Via Real, Carpinteria, CA, USA]). A contra-coloração foi com hematoxilina de Mayer. Como controle positivo, foram utilizadas secções histológicas de caso confirmado de pitiose canina (Caso 2) (RECH et al., 2004). Como controle negativo, as mesmas secções foram utilizadas, com substituição do anticorpo primário por PBST.
RESULTADOS E DISCUSSÃO
Através do estudo retrospectivo, foram encontrados dois casos confirmados e publicados (Rech et al. 2004, Rodrigues et al. 2006) e quatro casos suspeitos de pitiose gastrintestinal canina. Dados de anamnese, extraídos dos pro-tocolos de necropsia e biópsia, bem como, apresentação clínica, localização das lesões, aspectos macroscópicos e histopatológicos estão apresentados no Quadro 1.
Os cães tiveram morte espontânea (Casos 1, 3 e 6) ou foram submetidos à eutanásia (Casos 2, 4 e 5) devido à deterioração do quadro clínico, revelando a importância da pitiose gastrintestinal canina como causa de morte nesta espécie. Todos os cães deste estudo tinham entre um e três anos de idade. Três cães tinham raça definida e três eram sem raça, desses, quatro eram machos e duas eram fêmeas. Informações sobre o contato freqüente com ambiente aquático (pântano) favorável à infecção constavam nos históricos clínicos de apenas dois cães (Casos 2 e 4). Esses resultados são característicos da pitiose canina, que é frequentemente observada em indivíduos com menos de três anos, machos, de raças de grande porte (Miller 1985), criados fora de casa e com histórico recorrente de exposição a ambientes quentes e alagados, como pântanos e lagos (Helman & Oliver 1999, Grooters 2003). Apesar disso, em uma percentagem significativa de cães, não há informações sobre exposição a ambientes com essas características e ocorrem casos de pitiose em áreas suburbanas (Grooters 2003, Berryessa et al. 2008).
Os principais sinais clínicos relatados nos cães deste estudo foram: emagrecimento progressivo (6/6), dor abdominal (4/6), inapetência (3/6), diarréia (3/6), vômito (2/6) e massa abdominal palpável (1/6). Os mesmos sinais também são freqüentemente observados na forma gastrintestinal de pitiose em outros estudos (Helmann & Oliver 1999, Mendoza et al. 2003). Radiografia e ultrassonografia têm sido utilizadas no diagnóstico clínico, as quais revelam espessamento segmentar do trato gastrintestinal, massa abdominal ou linfadenopatia mesentérica, alterações que também podem ser detectadas através da palpação abdominal (Grooters 2003). Nos cães deste levantamento, radiografias da região abdominal revelaram peristaltismo acentuado (radiografia contrastada) (Caso 2), massa abdominal (Caso 3) ou não foram detectadas alterações (Caso 5). Pela ultrassonografia, em apenas um (Caso 5) de dois casos em que a mesma foi realizada, observou-se espessamento da parede gástrica. Neste estudo, diagnóstico por laparotomia exploratória revelou tumoração na região mesentérica (Caso 3) ou massa neoplásica envolvendo o intestino (Caso 4). Gastrotomia, realizada em um cão (Caso 5), revelou espessamento acentuado da mucosa gástrica.
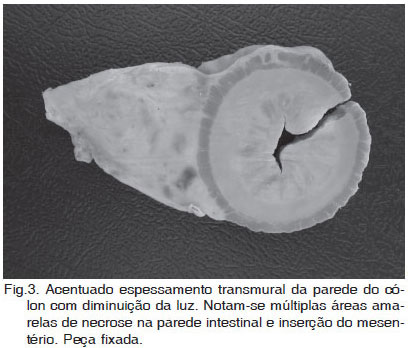
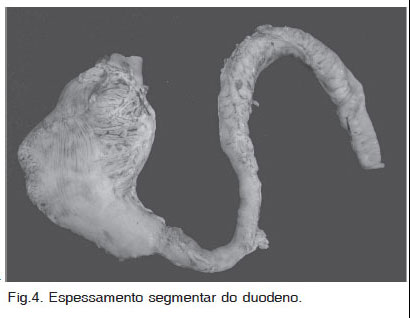
Em todos os cães deste estudo, as lesões macroscópicas consistiram de espessamento transmural e segmentar no estômago (2/6) (Fig.1), intestino delgado (2/6) (Fig.2), e cólon (1/6) (Fig.3). Em um cão (Caso 5), havia lesões no estômago e também no intestino (Fig.4). As lesões eram caracterizadas por massas firmes, fibrosas e com múltiplos pontos amarelados de necrose (Fig.1 e 3). Nos casos que envolveram o intestino (Casos 2, 4 e 5), a luz do órgão estava diminuída (Fig.3). Em dois cães (Casos 1 e 5) a mucosa apresentava úlceras multifocais e, em um deles (Caso 5), havia também edema acentuado. Envolvimento do mesentério e/ou de linfonodos mesentéricos (LNMs) foi observado em quatro casos (Fig.5 e 6 ). Apenas em um deles (Caso 3), as lesões estavam restritas aos LNMs.
Além dos locais listados, o envolvimento do esôfago ou faringe é raro (Patton et al. 1996, Mendoza et al. 2003, Grooters & Foil 2006) e não foi observado neste levantamento. Casos de envolvimento mesentérico sem lesões em outros locais são freqüentes. Nesses casos, os linfonodos geralmente estão envolvidos em uma massa única, grande e firme (Grooters & Foil 2006), como visto no Caso 3. Lesões segmentares em diferentes órgãos em um mesmo cão (como vistas no Caso 5) também foram relatadas por outros autores (Grooters & Foil 2006). Entretanto, lesões gastrintestinais e mucocutâneas simultâneas, como as descritas por alguns autores (Rech et al. 2004) (Caso 2 deste estudo), são raramente encontradas num mesmo cão (Grooters 2003).
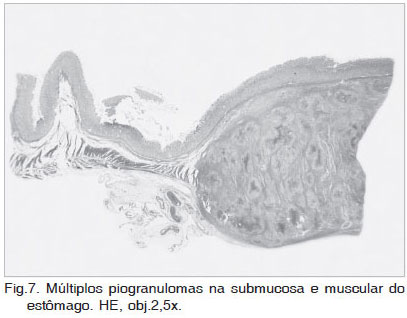
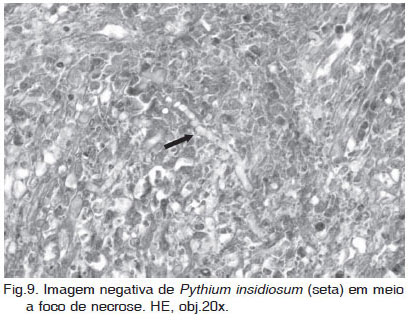
As lesões histológicas concentraram-se principalmente nas camadas submucosa e muscular dos órgãos afetados (Fig.7), e se caracterizaram por reação granulomatosa ou piogranulomatosa com áreas centrais de necrose (Fig.8). Os granulomas eram infiltrados e/ou circundados por eosinófilos, acompanhados de um menor número de neutrófilos, macrófagos epitelióides, plasmócitos e células gigantes multinucleadas. Áreas de tecido fibrovascular circundando os granulomas foram comumente observadas. Em dois cães (Casos 3 e 5), foram observadas vasculite e trombose. Imagens negativas de hifas (Fig.9) foram visualizadas em meio aos focos de necrose. Normalmente os organismos são difíceis de encontrar em secções de tecido coradas por HE, sendo mais freqüentes em áreas de necrose e menos freqüentes no centro de granulomas discretos (Miller 1985).
Nas secções impregnadas pela técnica de GMS, hifas com ramificações irregulares, raras septações e diâmetro de 4-10mm, puderam ser mais bem observadas (Fig.10), porém, elas não coraram pela técnica do PAS. Estes achados estão de acordo com os descritos na literatura (Grooters 2003). A técnica do PAS, amplamente utilizada na identificação de fungos, geralmente não cora as hifas de P. insidiosum (Grooters 2003). A ausência de coloração provavelmente ocorre porque, diferentemente dos fungos, a parede celular dos oomicetos não contém quitina (Alexopoulos et al. 1996), substância que é demonstrada pela técnica do PAS (Culling et al. 1985).
A técnica de IHQ, realizada em secções histológicas dos casos suspeitos de pitiose gastrintestinal (Casos 1, 3, 5 e 6), foi essencial para a confirmação do diagnóstico (Fig.11). O Caso 2, que havia tido o diagnóstico etiológico de pitiose confirmado através da cultura e indução de zoosporogênese (Rech et al. 2004), foi utilizado como controle positivo e resultou em forte imunomarcação para P. insidiosum em todas as secções.
Geralmente, o diagnóstico de pitiose é baseado nos aspectos macroscópicos e histopatológicos das lesões e na cultura do agente. A identificação definitiva do oomiceto envolve a análise dos zoósporos formados (Ginn et al. 2007). Entretanto, cabe ressaltar que, muitas vezes, as lesões de pitiose gastrintestinal são confundidas com neoplasmas e material fresco das lesões não é colhido, o que impede a cultura (Rakich et al. 2005). Opções diagnósticas como sorologia, imuno-histoquímica e PCR podem ser utilizadas em caso de impossibilidade de cultura ou resultado negativo (Rakich et al. 2005, Ginn et al. 2007). No Caso 4, as amostras foram positivas na cultura, porém não houve indução de zoosporogênese. A confirmação e identificação do agente nesse caso foi realizada por nested-PCR (Rodrigues et al. 2006).
A IHQ para P. insidiosum, primeiramente utilizada por Brown et al. (1988) na confirmação do diagnóstico de pitiose eqüina, tem sido amplamente utilizada na pitiose em diferentes espécies animais (Howerth et al. 1989, Fischer et al. 1994, Tabosa et al. 2004, Rakich et al. 2005, Santurio et al. 2006, Pavarini et al. 2007). Em todos os casos testados de um estudo, houve ausência de reação cruzada na IHQ com fungos dos gêneros Conidiobolus, Basidiobolus e Mucor (Brown et al. 1988).
Pitiose deve ser considerada no diagnóstico clínico diferencial em doenças debilitantes crônicas com emagrecimento, vômito e/ou diarréia e massas abdominais palpáveis, particularmente em cães jovens e de ambientes rurais (Miller, 1985, Fischer et al. 1994). Doenças com essas características clínicas incluem: gastrenterite eosinofílica, enterite granulomatosa regional, corpo estranho gastrintestinal, intussuscepção e neoplasia intrabdominal (Miller 1985). Alguns autores (Grooters et al. 2003) descreveram uma infecção cutânea e sistêmica em cães nos Estados Unidos, causada por oomicetos do gênero Lagenidium, a qual apresenta características morfológicas semelhantes à pitiose em cães. Dentre as doenças micóticas, somente os zigomicetos do gênero Basidiobolus são associados a lesões no trato gastrintestinal de cães (Rakich et al. 2005).
O mecanismo exato da infecção gastrentérica na pitiose canina é desconhecido, no entanto, suspeita-se que envolva a ingestão de água contaminada pelos zoósporos móveis de P. insidiosum (Mendoza et al. 1993, Patton et al. 1996, Liljebjelke et al. 2002, Grooters 2002, Grooters 2003). Vários autores sugerem que, para que ocorra a infecção do trato gastrintestinal, os zoósporos devem penetrar a camada submucosa através de lesões pré-existentes (Miller 1985, Helman & Oliver 1999, Liljebjelke et al. 2002, Grooters 2003), porém, não há evidências epidemiológicas sólidas que confirmem essa hipótese (Grooters 2003).
Em cães, a pitiose gastrintestinal geralmente é uma doença fatal (Mendoza et al. 2003). Na maioria dos casos é diagnosticada quando as lesões estão muito avançadas e a excisão cirúrgica torna-se impraticável (Hensel et al. 2003). Da mesma forma, o sucesso na terapia com o uso exclusivo de drogas antifúngicas tradicionais é difícil se for levado em conta que P. insidiosum não é um fungo e que o ergosterol, substância alvo da maioria dos fármacos, está ausente na parede celular deste oomiceto (Grooters 2003). A imunoterapia, amplamente utilizada no tratamento da pitiose equina, ainda não apresenta resultados satisfatórios na espécie canina (Santurio et al. 2006).
CONCLUSÕES
Nos casos estudados de pitiose gastrintestinal canina, a doença afetou principalmente cães jovens que apresentaram emagrecimento, inapetência, diarréia, vômito, dor abdominal e massas abdominais palpáveis.
As lesões ocorreram principalmente no estômago e intestino, ocasionalmente envolvendo o mesentério e os linfonodos mesentéricos, e foram caracterizadas por inflamação granulomatosa com numerosas hifas intralesionais.
A utilização da técnica imuno-histoquímica foi extremamente útil no diagnóstico da pitiose gastrintestinal canina, especialmente naqueles casos de rotina em que somente material fixado está disponível.
Agradecimentos.- À Dra. Daniela Brayer Pereira e ao Laboratório de Pesquisas Micológicas (LAPEMI-UFSM) pelo fornecimento do anticorpo utilizado na técnica de imuno-histoquímica.
Recebido em 28 de abril de 2009.
Aceito para a publicação em 6 de maio de 2009.
- Alexopoulos C.J., Mims C.W. & Blackwell M. 1996. Phylum Oomycota, p.683-737. In: Alexopoulos C.J., Mims C.W. & Blackwell M. (Eds), Introductory Mycology. 4th ed. John Wiley and Sons, New York.
- Berryessa N.A., Marks S.L., Pesavento P.A., Krasnansky T., Yoshimoto S.K., Johnson E.G. & Grooters A.M. 2008. Gastrointestinal pythiosis in 10 dogs from California. J. Vet. Intern. Med. 22:1065-1069.
- Brown C.C., McClure J.J., Triche P. & Crowder C. 1988. Use of immuno-histochemical methods for diagnosis of equine pythiosis. Am. J. Vet. Res. 49(11):1866-1868.
- Chaffin M.K., Schumacher J. & McMullan W.C. 1995. Cutaneous pythiosis in the horse. Vet. Clin. North Am., Equine Pract. 11(1):91-103.
- Culling C.F.A., Allison R.T. & Barr W.T. 1985. Cellular Pathology Technique. 4th ed. Butterworth, London, p.214-255.
- Dykstra M.J., Sharp N.J.H., Olivry T., Hillier A., Murphy K.M., Kaufman G.A., Kunkle G.A. & Pucheu-Haston C. 1999. A description of cutaneous-subcutaneous pythiosis in fifteen dogs. Med. Mycol. 37(6):427-433.
- Fischer J.R., Pace L.W., Turk J.R., Kreeger J.M., Miller M.A. & Gossner H.S. 1994. Gastrointestinal pythiosis in Missouri dogs: Eleven cases. J. Vet. Diagn. Invest. 6(3):380-382.
- Foil C.S.O., Short B.G., Fadok V.A. & Kunkle G.A. 1984. A report of subcutaneous pythiosis in 5 dogs and a review of the etiologic agent Pythium spp. J. Am. Anim. Hosp. Assoc. 20(6):959-966.
- Gabriel A.L., Kommers G.D., Trost M.E., Barros C.S.L., Pereira D.B., Schwendler S.E. & Santurio J.M. 2008. Surto de pitiose cutânea em bovinos. Pesq. Vet. Bras. 28(12):583-587.
- Ginn P.E., Mansell J.E.K.L. & Rakich P.M. 2007. Skin and appendages, p.553-781. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. Vol.1. 5th ed. Saunders Elsevier, Philadelphia.
- Grooters A.M. 2002. New diagnostic tests for pythiosis. Vet. Med. 97(7):503-504.
- Grooters A.M. 2003. Pythiosis, lagenidiosis, and zygomycosis in small animals. Vet. Clin. North Am., Small Anim. Pract. 33(4):695-720.
- Grooters A.M. & Foil C.S.O. 2006. Micellaneous fungal infections, p.637-650. In: Greene C.E. (Ed.), Infectious Diseases of the Dogs and Cats. 3rd ed. Saunders Elsevier, St Louis.
- Helman R.G. & Oliver J. 1999. Pythiosis of the digestive tract in dogs from Oklahoma. J. Am. Anim. Hosp. Assoc. 35(2):111-114.
- Hensel P., Greene C.E., Medlau L., Latimer K. & Mendoza L. 2003. Immunotherapy for treatment of multicentric cutaneous pythiosis in a dog. J. Am. Vet. Med. Assoc. 223(2):215-218.
- Howerth E.W., Brown C.C. & Crowder C. 1989. Subcutaneous pythiosis in a dog. J. Vet. Diag. Invest. 1(1):81-83.
- Jaeger G.H., Rotstein D.S. & Law J.M. 2002. Prostatic pythiosis in a dog. J. Vet. Intern. Med. 16(5):598-602.
- Krajaejun T., Kunakorn M., Niemhom S., Chongtrakool P. & Pracharktam R. 2006. Identification of a novel 74-kiloDalton immunodominant antigen of Pythium insidiosum recognized by sera from human patients with pythiosis. J. Clin. Microbiol. 44(5):1674-1680.
- Liljebjelke K.A., Abramson C., Brokus C. & Greene C.E. 2002. Duodenal obstruction caused by infection with Pythium insidiosum in a 12-week-old puppy. J. Am. Vet. Med. Assoc. 220(8):1188-1191.
- Marques S.A., Bagagli E., Bosco S.M.G., Camargo R.M.P. & Marques M.E.A. 2006. Pythium insidiosum: relato do primeiro caso de infecção humana no Brasil. Anais Bras. Dermatol. 5:483-485.
- Mendoza L., Ajello L. & McGinnis M.R. 1996. Infections caused by the oomycetous pathogen Pythium insidiosum J. Med. Mycol. 6:151-164.
- Mendoza L., Arias M., Colmenarez V. & Perazzo Y. 2005. Intestinal canine pythiosis in Venezuela confirmed by serological and sequencing analysis. Mycopathol. 159(2):219-222.
- Mendoza L., Hernandez F. & Ajello L. 1993. Life cycle of the human and animal oomycete pathogen Pythium insidiosum J. Clin. Microbiol. 31(11):2967-2973.
- Mendoza L., Mandy W. & Glass R. 2003. An improved Pythium insidiosum-vaccine formulation with enhanced immunotherapeutic properties in horses and dogs with pythiosis. Vaccine 21:2797-2804.
- Miller R.I. 1985. Gastrointestinal phycomycosis in 63 dogs. J. Am. Vet. Med. Assoc. 186(5):473-478.
- Patton C.S., Hake R., Newton J. & Toal R.L. 1996. Esophagitis due to Pythium insidiosum infection in two dogs. J. Vet. Intern. Med. 10(3):139-142.
- Pavarini S.P., Rigon G., Santos A.S., Pedroso P.M.O., Cavalheiro A.S., Santurio J.M. & Driemeier D. 2007. Diagnóstico imunoistoquímico de pitiose intestinal em um canino. Anais do 12ş Encontro Nacional de Patologia Veterinária, Campo Grande, MS, s/p. (Resumo)
- Pesavento P.A., Barr B., Riggs S.M., Eigenheer A.L., Pamma R. & Walker R.L. 2008. Cutaneous pythiosis in a Nestling white-faced ibis. Vet. Pathol. 45:538-541.
- Rakich P.M., Grooters A.M. & Tang K. 2005. Gastrointestinal pythiosis in two cats. J. Vet. Diag. Invest. 17(3):262-269.
- Rech R.R., Graça D.L. & Barros C.L.S. 2004. Pitiose em um cão: relato de caso e diagnósticos diferenciais. Clínica Vet. 9(50):68-72.
- Rivierre C., Laprie C., Guiard-Marigny O., Bergeaud P., Berthelemy M. & Guillot J. 2005. Pythiosis in Africa. Emerging Infect. Dis.11(3):479-481.
- Rodrigues A., Graça D.L., Fontoura C., Cavalheiro A.S., Henzel A., Schwendler S.E., Alves S.H. & Santurio J.M. 2006. Intestinal dog pythiosis in Brazil. J. Med. Vet. Mycol. 16(1):37-41.
- Santurio J.M., Alves S.H., Pereira D.B. & Argenta J.S. 2006. Pitiose: uma micose emergente. Acta Scientiae Veterinariae 34(1):1-14.
- Supabandhu J., Fisher M., Mendoza L. & Vanittanakom N. 2007. Isolation and identification of the human pathogen Pythium insidiosum from environ- mental samples collected in Thai agricultural areas. Med. Mycol. 18:1-12.
- Tabosa I.M., Medeiros V.T., Dantas A.F.M., Azevedo E.O. & Maia J.C. 2004. Outbreaks of pythiosis in two flocks of sheep in Northeastern Brazil. Vet. Pathol. 41(4):412-415.
Datas de Publicação
-
Publicação nesta coleção
24 Nov 2009 -
Data do Fascículo
Ago 2009
Histórico
-
Recebido
28 Abr 2009 -
Aceito
06 Maio 2009