Resumos
O estudo objetivou verificar a influência da temperatura corporal nos parâmetros fisiológicos e nos períodos de indução e recuperação anestésicos de cascavéis (Crotalus durissus) anestesiadas com cetamina. Os animais foram previamente submetidos à hipotermia (HIPO) (<22°C) e normotermia (30°C) (NORMO) e anestesiados com 80mg/kg IM de cetamina. Foram avaliados os períodos de latência e recuperação da anestesia por meio do tônus de cabeça, tônus muscular e reflexo de endireitamento. Mensurou-se a frequência cardíaca (FC), tempo de apnéia e temperatura corporal em 0 min e 5, 10, 15, 30, 60, 90, 120 min e análise dos gases sanguíneos em 0 min, 30 e 60 min. Não houve diferença em relação ao período de latência entre os grupos. A recuperação dos animais em HIPO foi mais prolongada (5,5 horas) que em NORMO (3,5 horas). Obteve-se FC no grupo NORMO superior que no grupo HIPO. O tempo de apnéia manteve o mesmo padrão em ambos os grupos. Em relação ao basal, tanto em HIPO quanto em NORMO o tempo de apnéia diminuiu acentuadamente entre 5 e 30 min. Observou-se acidose respiratória no grupo NORMO apenas em 0 min. O SvO2 elevou-se significativamente após 30 min, o mesmo ocorrendo com a PvO2. A PvCO2 diminuiu em ambos os grupos após 30 min. Evidenciou-se que a temperatura corporal influencia intrinsecamente o período de recuperação de cascavéis anestesiadas com cetamina.
Serpentes; metabolismo; Crotalus durissus; recuperação anestésica
The aim of the study was to verify the influence of the body temperature under physiological values and latency and recovery times on rattlesnakes anesthetized with ketamine. The animals were previously submitted to hypothermia (HYPO) (<22°C) and normothermia (30°C) (NORMO) and then, anesthetized with 80 mg/kg IM of ketamine. Latency and recovery times were evaluated by head tonus, muscular tonus and righting reflex. Heart rate (HR), time of apnea and body temperature were measured before and 5, 10, 15, 30, 60, 90 and 120 minutes after ketamine administration. Blood gases parameters were measured before, 30 and 60 minutes. It was not observed difference on latency time in both groups. The recovery time was higher on HYPO (5,5 hours) compared to NORMO (3,5 hours). HR was higher on NORMO compared to HYPO. Time of apnea was the same pattern on both groups. Compared to basal levels, time of apnea was shorter between 5 to 30 min on both groups. Respiratory acidosis was observed only at 0 min in NORMO. SvO2 was higher after 30 min, the same as with PvO2 in both groups. PvCO2 reduced after 30 min in both groups. It was evident that body temperature exerts intense influence on the recovery time on rattlesnakes anesthetized with ketamine.
Snake; metabolism; Crotalus durissus; anesthetic recovery
Influência da temperatura corporal de cascavéis (Crotalus durissus) submetidas à anestesia com cetamina
Influence of body temperature on rattlesnakes (Crotalus durissus) anesthetized with ketamine
Adriano B. CarregaroI,* * Autor para correspondência: carregaro@smail.ufsm.br ; Mariângela L. CruzII; André L. CherubiniII; Stélio P.L. LunaIII
IDepartamento de Clínica de Pequenos Animais, Centro de Ciências Rurais, Universidade Federal de Santa Maria, Camobi, Santa Maria, RS 97105-900, Brasil
IIFaculdade de Medicina Veterinária e Zootecnia, Unesp, Campus de Botucatu, Botucatu, SP
IIIDepartamento de Cirurgia e Anestesiologia Veterinária, Faculdade de Medicina Veterinária e Zootecnia, Universidade Estadual Paulista (Unesp), Campus de Botucatu, Rubião Júnior, Botucatu, SP 18618-000, Brasil
RESUMO
O estudo objetivou verificar a influência da temperatura corporal nos parâmetros fisiológicos e nos períodos de indução e recuperação anestésicos de cascavéis (Crotalus durissus) anestesiadas com cetamina. Os animais foram previamente submetidos à hipotermia (HIPO) (<22°C) e normotermia (30°C) (NORMO) e anestesiados com 80mg/kg IM de cetamina. Foram avaliados os períodos de latência e recuperação da anestesia por meio do tônus de cabeça, tônus muscular e reflexo de endireitamento. Mensurou-se a frequência cardíaca (FC), tempo de apnéia e temperatura corporal em 0 min e 5, 10, 15, 30, 60, 90, 120 min e análise dos gases sanguíneos em 0 min, 30 e 60 min. Não houve diferença em relação ao período de latência entre os grupos. A recuperação dos animais em HIPO foi mais prolongada (5,5 horas) que em NORMO (3,5 horas). Obteve-se FC no grupo NORMO superior que no grupo HIPO. O tempo de apnéia manteve o mesmo padrão em ambos os grupos. Em relação ao basal, tanto em HIPO quanto em NORMO o tempo de apnéia diminuiu acentuadamente entre 5 e 30 min. Observou-se acidose respiratória no grupo NORMO apenas em 0 min. O SvO2 elevou-se significativamente após 30 min, o mesmo ocorrendo com a PvO2. A PvCO2 diminuiu em ambos os grupos após 30 min. Evidenciou-se que a temperatura corporal influencia intrinsecamente o período de recuperação de cascavéis anestesiadas com cetamina.
Termos de indexação: Serpentes, metabolismo, Crotalus durissus, recuperação anestésica.
ABSTRACT
The aim of the study was to verify the influence of the body temperature under physiological values and latency and recovery times on rattlesnakes anesthetized with ketamine. The animals were previously submitted to hypothermia (HYPO) (<22°C) and normothermia (30°C) (NORMO) and then, anesthetized with 80 mg/kg IM of ketamine. Latency and recovery times were evaluated by head tonus, muscular tonus and righting reflex. Heart rate (HR), time of apnea and body temperature were measured before and 5, 10, 15, 30, 60, 90 and 120 minutes after ketamine administration. Blood gases parameters were measured before, 30 and 60 minutes. It was not observed difference on latency time in both groups. The recovery time was higher on HYPO (5,5 hours) compared to NORMO (3,5 hours). HR was higher on NORMO compared to HYPO. Time of apnea was the same pattern on both groups. Compared to basal levels, time of apnea was shorter between 5 to 30 min on both groups. Respiratory acidosis was observed only at 0 min in NORMO. SvO2 was higher after 30 min, the same as with PvO2 in both groups. PvCO2 reduced after 30 min in both groups. It was evident that body temperature exerts intense influence on the recovery time on rattlesnakes anesthetized with ketamine.
Index terms: Snake, metabolism, Crotalus durissus, anesthetic recovery.
INTRODUÇÃO
Ultimamente observa-se um crescente aumento no interesse em répteis, seja como instrumentos de pesquisa ou animais de estimação. Os procedimentos clínico-cirúrgicos nesta classe receberam relativa importância ao longo dos anos e consequentemente, a anestesia nestes animais deixou de ser puramente empírica. Apesar do manejo restrito em centros de pesquisa e zoológicos, as cascavéis (Crotalus durissus) podem ser utilizadas como parâmetro para a obtenção de maiores informações a respeito da anatomia e fisiologia das serpentes, já que algumas doenças envolvem o uso de medicamentos que, até então, não são padronizados para estes animais.
Por serem animais ectotérmicos, a temperatura corporal exerce efeito decisivo na cinética da maioria dos medicamentos administrados nesta classe. Situações de hipotermia promovem redução na biotransformação dos fármacos, afetando a cinética do mesmo no organismo, alterando o período de ação e recuperação (Mosley 2005). A relação hipóxia-hipotermia também tem relação intrínseca no metabolismo desses animais, uma vez que há relação direta entre a temperatura e o consumo de oxigênio pelos tecidos (Stinner & Hartzler 2000, Hicks & Wang 2004). Deste modo, recomenda-se que os animais sejam mantidos aquecidos tanto durante o processo anestésico como no período de recuperação (Malley 1997, Bennett 1998). Todavia, o aquecimento não deve ser excessivo uma vez que pode ser deletério por elevar demasiadamente o metabolismo e, com isso, aumentar a demanda de consumo de oxigênio (O2). Assim, para os répteis terrestres, o recomendável é manutenção da temperatura ambiente entre 25 e 30°C (Bennett 1991, Divers 1996).
Devido às particularidades anatômicas e comportamentais, a anestesia em serpentes deve priorizar o uso de medicamentos passíveis de administração intramuscular e elevada segurança anestésica. Neste sentido, os agentes dissociativos se destacam, pois além da segurança anestésica em serpentes, promovem poucas alterações fisiológicas em doses adequadas (Bennett 1991). O uso isolado da cetamina é realizado há vários anos em serpentes para facilitar a contenção, possibilitar a realização de exames clínicos e diminuir o estresse do procedimento (Glen et al. 1972, Cooper 1974, Hill & Mackessy 1997). Entretanto, poucos enfatizam as alterações fisiológicas dos animais no período trans-anestésico, atentando-se apenas na possibilidade de contenção e a segurança do procedimento, tanto para o animal quanto para o profissional (Green et al. 1981, Schumacher et al. 1997).
O presente estudo objetivou verificar a influência da temperatura corporal nos parâmetros fisiológicos e nos períodos de indução e recuperação de cascavéis submetidas à anestesia com cetamina.
MATERIAL E MÉTODOS
Foram utilizadas oito cascavéis (Crotalus durissus) provenientes do serpentário do Centro de Estudos de Venenos e Animais Peçonhentos (CEVAP), Unesp - Campus de Botucatu, fêmeas, adultas, pesando de 300-600g, as quais foram submetidas à anestesia com 80mg/kg de cetamina5, administrada na porção final do terço cranial da musculatura dorsal.
Os mesmos animais participaram dos dois grupos experimentais, com intervalo entre os tratamentos de 15 dias. Para isso, após jejum alimentar de 24 horas, os animais foram submetidos aleatoriamente à hipotermia (HIPO), objetivando temperatura corporal inferior a 25°C e normotermia (30 °C) (NORMO), por meio de controle da temperatura ambiente. Para isso, os animais foram mantidos em sala climatizada (20 ou 30ºC), contidos em uma caixa de transporte e em NORMO, sobre um colchão térmico (37ºC), durante 12 horas para a obtenção da temperatura corporal.
Para a constatação do período de latência e recuperação da anestesia foram avaliados tônus de cabeça, tônus muscular e reflexo de endireitamento (Malley 1997), aferidos em minutos até a perda total da variável, com auxílio de um gancho herpetológico. Para isso, os reflexos foram avaliados antes da administração da cetamina (0 min) até a perda total, e estendendo-se até o pronto restabelecimento de cada um (período de recuperação). Mensurou-se a frequência cardíaca (FC), em batimentos por minuto, através de doppler vascular6, posicionado ventralmente e no final do terço cranial do animal, tempo de apnéia, em segundos, através de observação visual e temperatura corporal, em graus Celsius, via cloacal em 0 min e 5, 10, 15, 30, 60, 90, 120min após administração de cetamina. Adicionalmente, foi colhido 1mL de sangue da veia coccígea ventral, posterior à cloaca, por meio de seringa heparinizada para a obtenção das pressões parciais de oxigênio (PvO2) e gás carbônico (PvCO2), potencial hidrogeniônico (pH), concentração de bicarbonato (HCO3-) e saturação de oxihemoglobina (SvO2)7, colhido em 0, 30 e 60 min pós-administração, ajustando-se os valores obtidos de acordo com a temperatura corporal do animal no momento da colheita.
A análise estatística foi realizada utilizando-se o programa Prism48. Para os valores fisiológicos utilizou-se análise de variância para amostras repetidas, seguindo de teste de Dunnett, comparando-os com o basal (0 min) e o teste t de Student entre os grupos para cada tempo. Para a comparação dos grupos em relação ao tônus de cabeça, tônus muscular e reflexo de endireitamento utilizou-se o teste de Wilcoxon e para a comparação dos mesmos dentro do mesmo grupo utilizou-se ANOVA seguido de teste de Friedman. Os valores fisiológicos foram expressos em média ± desvio padrão e os reflexos em mediana e intervalo interquartil. As diferenças foram consideradas significativas quando P<0,05.
RESULTADOS
Não houve diferença em relação ao período de latência da cetamina em HIPO, baseando-se nos três reflexos analisados. Todavia, em NORMO o reflexo de endireitamento foi abolido antes dos demais. Não houve diferença no período de latência entre os grupos (Fig.1a). Os períodos de recuperação observados nas três variáveis analisadas foram iguais entre si em ambos os grupos. Todavia, houve superioridade em HIPO que em NORMO, sendo de aproximadamente 5,5 horas e 3,5 horas, respectivamente (Fig.1b).
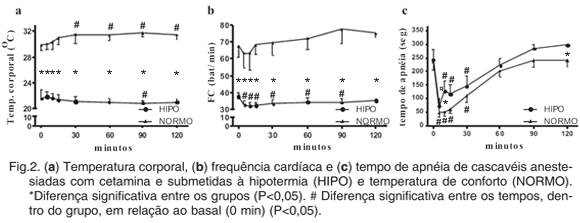
A temperatura corporal dos animais no início das avaliações foi significativamente diferente entre os grupos, com 21,5±1,2°C em HIPO e 29,8±0,8°C em NORMO, mantendo-se distintas entre si até o fim das mensurações. Comparando-se com o basal, o grupo HIPO diferiu somente aos 90min e no grupo NORMO a partir dos 30min (Fig.2a). A FC também seguiu o mesmo padrão na comparação entre grupos, com valores em NORMO 102% superiores que em HIPO. Houve diminuição da FC em HIPO a partir dos 5min até 90min (Fig.2b). O tempo de apnéia manteve o mesmo padrão em ambos os grupos, diferindo entre si apenas aos 10 e 120min. Em relação ao basal, tanto em HIPO quanto em NORMO o tempo de apnéia diminuiu acentuadamente entre 5 e 30min (Fig.2c).
Em ambos os grupos a SvO2 basal foi inferior a 80% porém, o grupo HIPO foi superior ao NORMO nesse tempo. Após 30min de anestesia os valores em ambos os grupos foram superiores aos valores basais, não havendo diferença entre si em cada tempo analisado (Quadro 1). A PvO2 foi crescente em ambos os grupos ao longo dos tempos, sendo estatisticamente diferentes em relação ao basal. Apesar de não diferirem entre si no basal, a PvO2 em NORMO foi superior a obtida em HIPO aos 30 e 60min. A PvCO2 diferiu entre os grupos no basal observando-se redução em HIPO aos 60min e em NORMO aos 30 min. Os animais em HIPO apresentaram pH superior comparando-se aos em NORMO em todos os tempos e inferior ao seu basal aos 30min. A concentração de HCO3- diferiu entre os grupos no basal e entre os tempos, apenas em HIPO.
DISCUSSÃO
Apesar de a literatura citar alguns estudos com o uso isolado de cetamina em serpentes, ainda há divergência sobre a dose ideal desse anestésico para uma contenção química apropriada. Glenn et al. (1972) determinaram a DL50 da cetamina para serpentes da espécie Crotalus atrox como 154mg/kg e que doses entre 55-88mg/kg promoveram uma contenção química adequada para a realização de pequenos procedimentos. Outros artigos também citam doses entre 50-80mg/kg como adequadas para contenção (Cooper 1974, Green et al. 1981, Hill & Mackessy 1997) com período de latência de até 30 min. Destaca-se que como os agentes dissociativos promovem discreta analgesia visceral (Bennett 1991), o uso de cetamina isolada deve ser realizado apenas para contenção física ou procedimentos cirúrgicos cutâneos. Para procedimentos intracelomáticos, o ideal é a associação desse anestésico com opióides, anti-inflamatórios não esteróides ou agonistas alfa-2 adrenérgicos, a fim de promover melhor analgesia (Malley 1997, Bennett 1998, Mosley 2005). Não foram utilizadas associações no protocolo anestésico do presente estudo uma vez que não houve procedimento cirúrgico e o maior interesse do estudo foi o de avaliar a resposta fisiológica dos animais, imobilizados com cetamina, frente às variações de temperatura. A adição de um analgésico ao procedimento poderia influenciar os resultados, pois certamente o miorrelaxamento promoveria alterações ventilatórias e metabólicas consideráveis (Malley 1997).
A dose utilizada no presente estudo proporcionou imobilização dos animais com um período de latência ao redor de 20 min, não diferindo entre os grupos, mesmo nos animais em hipotermia. Entretanto, observa-se que há uma tendência de elevação no período de latência no grupo HIPO em relação ao NORMO. Apesar dos resultados obtidos não diferirem entre si, acredita-se que pelos valores obtidos, uma variação na temperatura corpórea mais acentuada poderia evidenciar as diferenças de absorção nos animais nas diferentes situações, conforme demonstraram Stirl et al. (1996), no uso de tiletamina/zolazepam em Boa constrictor. Outros estudos (Glenn et al. 1971, Grenn et al. 1981) observaram um período de latência superior a 30 min em serpentes anestesiadas com cetamina e mantidas em temperatura ambiente de 22°C, o que reforça ainda mais essa hipótese. Já a recuperação dos animais submetidos à hipotermia foi obtida em 5,5 horas, período quase que o dobro dos animais em temperatura de conforto, certamente por todas as alterações fisiológicas já discutidas anteriormente. Os dados corroboram estudos os quais comprovaram a vantagem do aquecimento dos animais, desde que na zona de conforto (Divers 1996, Stirl et al. 1996, Bennett 1998, Mosley, 2005).
Durante a anestesia observou-se significativa diferença na FC entre os grupos, com os animais em temperatura de conforto com valores muito acima dos hipotérmicos, o que demonstra que a variação ambiental foi fundamental para as alterações nesse parâmetro. De acordo com Malley (1997), a FC ideal para os animais utilizados no estudo (tamanho e peso) é de 41 bpm, situando-se entre os dois grupos em questão. Em situações de hipotermia os répteis apresentam diminuição da FC, porém mantém o débito cardíaco devido uma compensação do volume sistólico e vasoconstrição periférica (Bennett 1991). A FC significativamente elevada em NORMO, mesmo quando comparada à FC ideal, não deve ser considerada um prejuízo, uma vez que os animais permaneceram em temperatura corporal de conforto.
Comparando-se com os valores basais de cada grupo, observa-se que em ambos houve diminuição da FC, a qual ocorreu em HIPO até 90min e em NORMO somente até 10min, apesar de neste não ser significativa em relação ao basal. Estudos anteriores relataram aumento na FC após a administração intramuscular de cetamina em serpentes (Stirl et al. 1996, Schumacher et al. 1997). Entretanto, doses acima de 110mg/kg produzem bradicardia e bradipnéia, instaurando-se o quadro em até 20min (Glenn et al. 1972, Bennett, 1991, Sedgwick & Borkowski, 1996). Apesar da dose utilizada no presente estudo ser inferior à citada, pode-se sugerir que houve um efeito acentuado do fármaco, uma vez que a diminuição da FC ocorreu nos dois grupos, corroborando com achados de Bennett (1991) e Sedgwick & Borkowski (1996). Ainda, verifica-se que a situação em HIPO agravou esse quadro.
Optou-se em mensurar o tempo de apnéia ao invés da frequência respiratória devido à apnéia ser facilmente verificada em répteis, os quais podem permanecer assim por até 24 horas (Bennett 1991), realizando respiração anaeróbica e percutânea. O método de mensuração foi eficiente, pois em vários tempos os animais apresentaram tempo de apnéia superior a 5min. Com os valores obtidos em ambos os grupos, verifica-se que não houve atuação significativa da temperatura corporal nesta variável, a qual apresentou perfil muito semelhante nos grupos. A diminuição do tempo de apnéia, ou seja, elevação da frequência respiratória nos primeiros 30 min pode ser imputada ao possível estresse de contenção para a administração da cetamina, já que o fato ocorreu imediatamente após isso. Destaca-se ainda a ação depressora da cetamina sobre a respiração nestes animais (Glenn et al. 1972, Bennett 1991, Sedgwick & Borkowski 1996), elevando-se o tempo de apnéia em ambos os grupos após 30 min, apesar de não diferirem em relação ao basal.
A análise de gases sanguíneos em répteis está sujeita a erros de interpretação, uma vez que vários fatores influenciam os resultados, como local da amostra, dificuldade em puncionar sangue arterial, com isso colhendo sangue misto ou venoso, concentração de O2 inspirado e termorregulação (Mosley 2005). Ademais, os répteis são muito mais tolerantes a alterações no pH e nas pressões parciais de gases que os mamíferos, o que pode caracterizar resultados que não expressam necessariamente um processo patológico (Bickler & Buck 2007).
Considerando-se os parâmetros de sangue venoso em répteis, a SvO2 indica que houve hipóxia em ambos os grupos apenas no tempo 0min, sugerindo uma correlação entre hipóxia e estresse de contenção, no qual pode ocorrer dificuldade nas trocas pulmonares (Malley 1997). Correlacionando-se a SvO2, PvCO2 e pH, no tempo 0min, nota-se que os animais em NORMO estavam em acidose respiratória no momento da contenção. Neste caso, como os animais foram mantidos em temperatura de conforto, a reação à contenção física foi mais intensa, sugerindo assim, uma exacerbação dos efeitos da contenção no equilíbrio ácido-base dos animais (Malley 1997). Como os animais em HIPO apresentavam-se mais letárgicos, a resposta à contenção não foi tão intensa. Os valores da PvO2 após 30min, em ambos os grupos, indica uma melhor oxigenação dos animais e menor gasto de oxigênio, contrapondo-se ao tempo 0min, o qual foi obtido com contenção física (Stirl et al. 1996). A concentração de HCO3- tem pouca influência da temperatura corporal em répteis, permanecendo geralmente constante durante o procedimento (Frappell 1998). Apesar de uma diferença significativa no HIPO ao 0min, as concentrações de HCO3- permaneceram dentro dos parâmetros fisiológicos para os répteis.
CONCLUSÃO
Apesar da maior resposta ao estresse de contenção nos animais mantidos em temperatura de conforto, culminando em alterações no equilíbrio ácido-base no início da anestesia, é evidente que a temperatura corporal promoveu alterações no metabolismo de Crotalus durissus. Deste modo, conclui-se que esses animais devem ser mantidos em temperatura de conforto durante a anestesia, no intuito de manter o metabolismo normal dos animais e reduzir o tempo de recuperação anestésica.
Recebido em 9 de abril de 2009.
Aceito para publicação em 6 de novembro de 2009.
- Bennett R.A. 1991. A review of anesthesia and chemical restraint in reptiles. J. Zoo Wildl. Med. 22:282-303.
- Bennett R.A. 1998. Reptile anesthesia. Seminars in Avian and Exotic Pet Medicine 7:30-40.
- Bickler P.E. & Buck L.T. 2007. Hypoxia Tolerance in reptiles, amphibians, and fishes: Life with variable oxygen availability. Annu. Rev. Physiol. 69:145-170.
- Chudzinski A.M., Seelaender M.C.L. & Kelen E.M.A. 1989. Standard-ization of anesthesia with pentobarbital in the snake Bothrops jararaca Mem. Inst. Butantan 51:147-152.
- Cooper J.E. 1974. Ketamine hydrochloride as an anaesthetic for East African reptiles. Vet. Rec. 95:37-41.
- Divers S. 1996. Basic reptile husbandry, history taking and clinical examination. In Practice. 18:51-65.
- Frappell P. 1998. Hypothermia and physiological control: The respiratory system. Clin. Exper. Pharmacol. Physiol. 25:159-164.
- Glenn J.L., Straight R. & Snyder C.C. 1972. Clinical use of ketamine hydrochloride as an anesthetic agent for snakes. Am. J. Vet. Res. 33:1901-1903.
- Green C.J., Knight J., Precious S. & Simpkin S. 1981. Ketamine alone and combined with diazepam or xylazine in laboratory animals: a 10 year experience. Laboratory Animals 15:163-170.
- Hicks J.W. & Wang T. 2004. Hypometabolism in reptiles: behavioural and physiological mechanisms that reduce aerobic demands. Resp. Physiol. Neurobiol. 141:261-271.
- Hill R.E. & Mackessy S.P. 1997. Venom yields from several species of colubrid snakes and differential effects of ketamine. Toxicon 35:671-678.
- Malley D. 1997. Reptile anaesthesia and the practicing veterinarian. In Practice 19:351-368.
- Mosley C.A.E. 2005. Anesthesia and Analgesia in Reptiles. Seminars in Avian and Exotic Pet Medicine 14:243-262.
- Sedgwick C.J. & Borkowski R. 1996. Allometric scaling: Extrapolating treatment regimens for reptiles, p.235-240. In: Mader D.R. (Ed.), Reptile Medicine and Surgery. Saunders Elsevier, Philadelphia. 512p.
- Shumacher J., Lillywhite H.B., Norman W.M. & Jacobson E.R. 1997. Effects of ketamine HCl in cardiopulmonary function in snakes. Copeia 2:395-400.
- Stinner J.N. & Hartzler L.K. 2000. Effect of temperature on pH and electrolyte concentration in air-breathing ectotherms. J. Exp. Biol. 203:2065-2074.
- Stirl R., Krug P. & Bonath K.H. 1996. Tiletamine/zolazepam sedation in Boa constrictor and its influence on respiration, circulation and metabolism. First Scientific Meeting European Association of Zoo and Wildlife Veterinarians European Association of Zoo- and Wildlife Veterinarians (EAZWV), Rostock, Germany, p.16-18.
Datas de Publicação
-
Publicação nesta coleção
20 Jan 2010 -
Data do Fascículo
Dez 2009
Histórico
-
Aceito
06 Nov 2009 -
Recebido
09 Abr 2009