Resumos
Esse estudo foi realizado com o objetivo de verificar a associação entre micoplasmas e ácaros (Raillietia auris e R. flechtmanni) no conduto auditivo de bovinos. Foram realizadas lavagens no conduto auditivo externo de 60 bovinos abatidos no Estado do Rio de Janeiro, Brasil. Para a lavagem dos condutos auditivos foi utilizada solução salina tamponada (PBS, pH 7.2) em seringas estéreis de 60mL. Para o isolamento de micoplasmas foram utilizados pools de ácaros por animal, lavados sucessivamente em 1mL de meio Hayflick modificado. Os lavados dos ácaros foram diluídos de 10-1 até 10-5 e repicados em meio Hayflick modificado, sólido e líquido e incubados a 37°C por 48-72 horas em microaerofilia. A identificação das espécies de micoplasmas foi realizada pelo teste da imunoperoxidase indireta (IPI). Verificou-se alta prevalência de ácaros do gênero Raillietia spp. 76,7% (46/60). O parasitismo por ácaros e micoplasmas foi verificado em 40 animais (74,1%), sendo esta associação significativa (p<0,001). Dos ácaros processados para isolamento de micoplasmas, 193 foram fêmeas e 25 machos. A frequência de Mycoplasma em Raillietia spp. foi de 81,2% (177/218) (p<0.001). Das fêmeas identificadas, 52,3% (101/193) foram R. auris e 47,7% (92/193) R. flechtmanni. A frequência de Mycoplasma nas fêmeas de R. auris foi de 75,2% (76/101) e na espécie R. flechtmanni foi de 88% (81/92) (P<0.05). As espécies de micoplasmas tipificadas pela IPI nos ácaros Raillietia auris foram: M. alkalescens 6,9%, M. arginini 3,4%, M. bovirhinis 9,2%, M. conjunctivae 18,4%, M. mycoides mycoides LC 8,0%, M. capricolum 5,7%. Em R. flechtmanni as espécies de micoplasmas identificadas foram: M. alkalescens 12,2%, M. arginini 1,0%, M. bovirhinis 18,9%, M. bovis 2,2%, M. conjunctivae 21,0%, M. mycoides mycoides LC 11,0% e M. capricolum 4,4%. As espécies de micoplasmas identificadas no conduto auditivo externo dos bovinos foram as mesmas presentes nos ácaros R. auris e R. flechtmanni. Os resultados confirmam que o conduto auditivo externo de bovinos é um habitat de Mycoplasma spp., incluindo espécies potencialmente patogênicas para os rebanhos, além dos ácaros R. auris e R. flechtmanni estarem associados com esses molicutes carreando-os em seu organismo.
Micoplasmas; ácaros; Gamasida; bovinos; conduto auditivo externo; transmissão; micoplasmoses
This study was carried out to assess the association between of mycoplasmas species with ear mites Raillietia auris and R. flechtmanni in the external ear canal of 60 bovines at slaughter time from the State of Rio de Janeiro, Brazil. Steril syringes (60ml) loaded with buffer solution (PBS, pH 7.2) were used for the ear canal flushing. Were processed 218 mites for mycoplasma isolation. A pool of mites from each sampled bovine was washed five times sucessively in 1mL of liquid modified Hayflick´s medium. The washed mites obtained were diluted up to 10-1 at 10-5, inoculated in liquid and solid Hayflick´s media and incubated at 37ºC for 2-3 days, being the plates put into jar for the obtention of microaerofilia condition. The Typical colonies were typified by the indirect imunoperoxidase test (IPI) with paper discs satured with hyperimmune rabbit sera. In the studied bovine high prevalence was verified Raillietia spp. 76.7% (46/60). The parasitism by mycoplasmas and mites was verified in 40 animals (74.1%), this association was significant (p<0.001). Among the mites processed for isolation mycoplasmas 193 were female and 25 males. The frequency of Mycoplasma in Raillietia spp. was of 81.2% (177/218) (p<0.001). Of the females identified 52.3% (101/193) were R. auris and 47.7% (92/193) were R. flechtmanni. The frequency of Mycoplasma in the females of R. auris was of 75.2% (76/101) and 88% (81/92) in R. flechtmanni (P<0.05). The mycoplasmas species typified by IPI in the Raillietia auris mites were M. alkalescens 6.9%, M. arginini 3.4%, M. bovirhinis 9.2%, M. conjunctivae 18.4%, M. mycoides mycoides LC 8.0%, M. capricolum 5.7%. In the R. flechtmanni mites mycoplasmas species typified were M. alkalescens 12.2%, M. arginini 1.0%, M. bovirhinis 18.9%, M. bovis 2.2%, M. conjunctivae 21.0%, M. mycoides mycoides LC 11.0% e M. capricolum 4.4%. The species of identified mycoplasmas in the external ear canal bovine and mites were exactly the same. The results confirm that the external ear canal cattle's ear canal is also a mycoplasmas source, including potentially pathogenic species for cattle, and these mollicutes are closely related with mites Raillietia spp. that is carrier and this agent in your organism.
Mycoplasmas; ear mites; Gamasida; bovine; external ear canal; mycoplasmosis; transmission
ANIMAIS DE PRODUÇÃO
Associação entre Mycoplasma spp. e ácaros do conduto auditivo de bovinos
Mycoplasmas species associated with the ear mites in cattle
Sandra B. dos SantosI, * * Autor para correspondência: sanbsantos@gmail.com ; Elmiro R. do NascimentoII; João Luiz H. FacciniIII; Maria Lúcia BarretoIV; Rinaldo A. MotaI
IDepartamento de Medicina Veterinária, Universidade Federal Rural de Pernambuco, Campus Dois Irmãos, Rua Dom Manoel de Medeiros s/n, Recife, PE 52171-900, Brasil
IIDepartamento de Saúde Coletiva Veterinária e Saúde Pública, Faculdade de Medicina Veterinária, Universidade Federal Fluminense (UFF), Rua Vital Brasil 64, Santa Rosa, Niterói, RJ 24020-150, Brasil
IIIDepartamento de Parasitologia Animal, Instituto de Veterinária, Universidade Federal Rural do Rio de Janeiro (UFRRJ), Seropédica, RJ 23890-000, Brasil. Bolsista do CNPq
IVNúcleo de Animais de Laboratório, Departamento de Imunobiologia, UFF, Outeiro São João Batista s/n, Centro, Niterói, RJ 24210-130
RESUMO
Esse estudo foi realizado com o objetivo de verificar a associação entre micoplasmas e ácaros (Raillietia auris e R. flechtmanni) no conduto auditivo de bovinos. Foram realizadas lavagens no conduto auditivo externo de 60 bovinos abatidos no Estado do Rio de Janeiro, Brasil. Para a lavagem dos condutos auditivos foi utilizada solução salina tamponada (PBS, pH 7.2) em seringas estéreis de 60mL. Para o isolamento de micoplasmas foram utilizados pools de ácaros por animal, lavados sucessivamente em 1mL de meio Hayflick modificado. Os lavados dos ácaros foram diluídos de 10-1 até 10-5 e repicados em meio Hayflick modificado, sólido e líquido e incubados a 37°C por 48-72 horas em microaerofilia. A identificação das espécies de micoplasmas foi realizada pelo teste da imunoperoxidase indireta (IPI). Verificou-se alta prevalência de ácaros do gênero Raillietia spp. 76,7% (46/60). O parasitismo por ácaros e micoplasmas foi verificado em 40 animais (74,1%), sendo esta associação significativa (p<0,001). Dos ácaros processados para isolamento de micoplasmas, 193 foram fêmeas e 25 machos. A frequência de Mycoplasma em Raillietia spp. foi de 81,2% (177/218) (p<0.001). Das fêmeas identificadas, 52,3% (101/193) foram R. auris e 47,7% (92/193) R. flechtmanni. A frequência de Mycoplasma nas fêmeas de R. auris foi de 75,2% (76/101) e na espécie R. flechtmanni foi de 88% (81/92) (P<0.05). As espécies de micoplasmas tipificadas pela IPI nos ácaros Raillietia auris foram: M. alkalescens 6,9%, M. arginini 3,4%, M. bovirhinis 9,2%, M. conjunctivae 18,4%, M. mycoides mycoides LC 8,0%, M. capricolum 5,7%. Em R. flechtmanni as espécies de micoplasmas identificadas foram: M. alkalescens 12,2%, M. arginini 1,0%, M. bovirhinis 18,9%, M. bovis 2,2%, M. conjunctivae 21,0%, M. mycoides mycoides LC 11,0% e M. capricolum 4,4%. As espécies de micoplasmas identificadas no conduto auditivo externo dos bovinos foram as mesmas presentes nos ácaros R. auris e R. flechtmanni. Os resultados confirmam que o conduto auditivo externo de bovinos é um habitat de Mycoplasma spp., incluindo espécies potencialmente patogênicas para os rebanhos, além dos ácaros R. auris e R. flechtmanni estarem associados com esses molicutes carreando-os em seu organismo.
Termos de indexação: Micoplasmas, ácaros, Gamasida, bovinos, conduto auditivo externo, transmissão, micoplasmoses.
ABSTRACT
This study was carried out to assess the association between of mycoplasmas species with ear mites Raillietia auris and R. flechtmanni in the external ear canal of 60 bovines at slaughter time from the State of Rio de Janeiro, Brazil. Steril syringes (60ml) loaded with buffer solution (PBS, pH 7.2) were used for the ear canal flushing. Were processed 218 mites for mycoplasma isolation. A pool of mites from each sampled bovine was washed five times sucessively in 1mL of liquid modified Hayflick´s medium. The washed mites obtained were diluted up to 10-1 at 10-5, inoculated in liquid and solid Hayflick´s media and incubated at 37ºC for 2-3 days, being the plates put into jar for the obtention of microaerofilia condition. The Typical colonies were typified by the indirect imunoperoxidase test (IPI) with paper discs satured with hyperimmune rabbit sera. In the studied bovine high prevalence was verified Raillietia spp. 76.7% (46/60). The parasitism by mycoplasmas and mites was verified in 40 animals (74.1%), this association was significant (p<0.001). Among the mites processed for isolation mycoplasmas 193 were female and 25 males. The frequency of Mycoplasma in Raillietia spp. was of 81.2% (177/218) (p<0.001). Of the females identified 52.3% (101/193) were R. auris and 47.7% (92/193) were R. flechtmanni. The frequency of Mycoplasma in the females of R. auris was of 75.2% (76/101) and 88% (81/92) in R. flechtmanni (P<0.05). The mycoplasmas species typified by IPI in the Raillietia auris mites were M. alkalescens 6.9%, M. arginini 3.4%, M. bovirhinis 9.2%, M. conjunctivae 18.4%, M. mycoides mycoides LC 8.0%, M. capricolum 5.7%. In the R. flechtmanni mites mycoplasmas species typified were M. alkalescens 12.2%, M. arginini 1.0%, M. bovirhinis 18.9%, M. bovis 2.2%, M. conjunctivae 21.0%, M. mycoides mycoides LC 11.0% e M. capricolum 4.4%. The species of identified mycoplasmas in the external ear canal bovine and mites were exactly the same. The results confirm that the external ear canal cattle's ear canal is also a mycoplasmas source, including potentially pathogenic species for cattle, and these mollicutes are closely related with mites Raillietia spp. that is carrier and this agent in your organism.
Index terms: Mycoplasmas, ear mites, Gamasida, bovine, external ear canal, mycoplasmosis, transmission.
INTRODUÇÃO
Micoplasmas são os menores procariotos conhecidos e estão agrupados na Classe Mollicutes. Caracterizam-se pela ausência de parede celular e pela sua estreita relação com bactérias Gram negativas (Whitford et al. 1994). São microrganismos que podem ser encontrados na natureza como endosimbiontes, comensais e saprófitas de humanos, animais, insetos e plantas (Nienhaus & Sikora 1979, Whitcomb & Davis 1970, Whitcomb & Bové 1983, Rosenbusch 1994). A estreita associação entre molicutes e insetos é remota, tendo sido relatada por Nocard & Roux (1898). Sabe-se que várias espécies de Mycoplasma spp. são encontradas como parasitas de vertebrados; onde colonizam diferentes tecidos dos seus hospedeiros, a exemplo do trato respiratório, urogenital, conduto auditivo, mucosa ocular, glândula mamária, articulações, placenta, além de cultivos celulares de diferentes linhagens (Thomas et al. 1987, Adegboye et al. 1995).
A microbiota do conduto auditivo de ruminantes é composta por uma ampla diversidade de microrganismos como bactérias e fungos. Alguns ocorrem como saprófitas ou comensais (Barber et al. 1986, Yates et al. 1983, Woldehiwet et al., 1990, Duarte & Hamdan 2004), enquanto outros são potencialmente patogênicos e determinam problemas de otites e outras doenças. Além de microrganismos é comum a presença de ácaros, nematóides e larvas de dípteros, considerados agentes primários de otites (Duarte & Hamdan 2004).
Micoplasmas estão entre as bactérias que fazem parte da microbiota do conduto auditivo dos ruminantes e a relação desses molicutes com ácaros das famílias Psoroptidae e Raillietidae tem sido relatada por alguns autores, no entanto, as interrelações parasito-hospedeiros ainda são pouco esclarecedoras, sabendo-se que os ácaros das espécies Psoroptes ovis e Raillietia caprae são potencialmente carreadores e disseminadores de micoplasmas presentes no conduto auditivo entre rebanhos caprinos (Cottew & Yeats 1981, 1982, Damassa 1990, Ribeiro et al. 1995, Mercier et al. 1997, Gil et al. 1999, Otero 2009).
Espécies patogênicas de micoplasmas têm sido relatadas em caprinos e bovinos (Cottew & Yeats 1981, 1982, Damassa 1990, Nascimento et al. 1998, Gil et al. 1999, Pretto et al. 2001, Francoz et al. 2004, Nascimento et al. 2005) e estão associadas a surtos de doenças nos animais, especialmente casos de otites, mastites e problemas reprodutivos. No Brasil, a associação entre micoplasmas e ácaros de conduto auditivo foi estudada durante um levantamento em caprinos (Ribeiro et al. 1995) e em surto de agalaxia contagiosa onde os animais apresentavam intenso parasitismo por ácaros P. ovis (Azevedo et al. 2006). Em rebanhos bovinos, estudos sobre essa problemática são escassos, mas sabe-se que micoplasmas são comumente isolados no conduto auditivo desses animais (Gil et al. 1999, Francoz et al. 2004, Santos et al. 2009).
O presente estudo teve como objetivo verificar a associação entre a presença de Mycoplasma spp. no conduto auditivo de bovinos com as duas espécies de Raillietia que parasitam bovinos no Brasil.
MATERAL E MÉTODOS
Colheita e processamento dos ácaros para isolamento de Mycoplasma
Foram realizadas lavagens no conduto auditivo externo de 60 bovinos de abate com idades e raças variadas e de ambos os sexos, procedentes de municípios da região sudeste do Estado do de Rio de Janeiro, Brasil. A lavagem do conduto auditivo foi realizada com uma solução salina tamponada (PBS, pH 7.2) em seringas estéreis de 60mL com uma sonda acoplada. As amostras coletadas foram transportadas em caixa isotérmica com gelo, sendo posteriormente armazenadas em glicerol (1:2) e congeladas a -20ºC até o uso.
Os ácaros obtidos nas lavagens foram contados e sexados para posterior identificação. Uma amostra de ácaro por animal foi lavado sucessivamente cinco vezes em 1mL de meio Hayflick modificado (Whitford et al. 1994), utilizando-se para isto um vórtex (Phoenix At 56) segundo técnica descrita por Cottew & Yeats (1982). As últimas lavagens (5ª ou 7ª) foram semeadas em meio líquido e sólido para quantificar as UFC/mL, antes e após a maceração dos ácaros. Em seguida a parte opistossomal de cada fêmea de Raillietia foi seccionada individualmente e processada para isolamento de micoplasma. Enquanto a porção podossomal de cada ácaro foi armazenada em álcool etílico a 70% e posteriormente processada individualmente em solução de Hoyer para identificação das espécies Raillietia auris e R. flechtmanni.
Os macerados dos ácaros foram diluídos de 10-1 até 10-5 e também repicados em meio Hayflick modificado. Todas as amostras foram semeadas em meio Hayflick modificado e incubadas a 37ºC por 72-96 horas e as placas foram mantidas em dessecador em microaerofilia, sendo examinadas diariamente para visualização de colônias típicas em forma de "ovo-frito" em microscópio estereoscópio (40-100x). A confirmação do isolamento de Mycoplasma spp. baseou-se nas provas de Dienes e digitonina (Whitford et al. 1994).
Tipificação das espécies de micoplasmas
A tipificação das amostras foi realizada pelo teste de Imunoperoxidase Indireta (IPI) de acordo com técnica padronizada na literatura (Imada et al. 1987). Foram utilizados antissoros específicos para cada espécie de micoplasma, a saber: M. arginini, M. agalactiae, M. bovis, M. conjunctivae, M. mycoides mycoides-Y goat, M. bovirhinis, M. alkalescens, M. capricolum, M. verecundum e M. gallisepticum. Amostras padrão ATCC (American type culture collection) de caprinos e bovinos foram submetidas às mesmas técnicas de cultivo e tipificação, sendo utilizadas como controle positivo nas reações de imunoperoxidase indireta.
Para análise das associações entre micoplasmas e ácaros foi utilizado o teste do qui-quadrado (Sampaio 2002).
RESULTADOS
Verificou-se uma alta frequência de ácaros do gênero Raillietia spp. 76,7% (46/60) nas amostras estudadas. O parasitismo por ácaros associados à micoplasmas foi verificado em 74,1% (40/54) dos animais, sendo significativamente (p<0,001) maior que as ocorrências isoladas de Raillietia spp. e Mycoplasma spp. de 11,1 e 14,8%, respectivamente (Quadro 1).
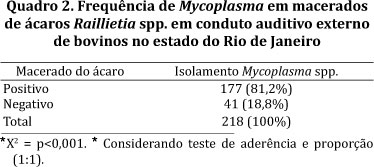
Dos ácaros processados para isolamento de micoplasmas, 193 foram fêmeas e 25 machos. A frequência de Mycoplasma em Raillietia spp. foi de 81,2% (177/218) (p<0.001) (Quadro 2). Das fêmeas identificadas, 52,3% (101/193) foram R. auris e 47,7% (92/193) R. flechtmanni. A frequência de Mycoplasma nas fêmeas de R. auris foi de 75,2% (76/101) e em R. flechtmanni foi de 88% (81/92) (P<0.05) (Quadro 3).
As espécies de micoplasmas tipificadas pela IPI nos ácaros Raillietia auris foram: Mycoplasma alkalescens (6,9%), M. arginini (3,4%), M. bovirhinis (9,2%), M. conjunctivae (18,4%), M. mycoides mycoides LC (8,0%), M. capricolum (5,7%). Em R. flechtmanni as espécies de micoplasmas identificadas foram: M. alkalescens (12,2%), M. arginini (1,0%), M. bovirhinis (18,9%), M. bovis (2,2%), M. conjunctivae (21,0%), M. mycoides mycoides LC (11,0%) e M. capricolum 4,4% (Quadro 4). As espécies de micoplasmas identificadas no conduto auditivo externo dos bovinos foram as mesmas presentes nas espécies R. auris e R. flechtmanni.
DISCUSSÃO
A frequência elevada de Raillietia spp. no conduto auditivo de bovinos está de acordo com os resultados obtidos por Faccini et al. (1992) que atribuem uma ampla distribuição geográfica das espécies desse gênero em várias regiões do País.
A presença das espécies de micoplasmas em R. auris e R. flechtmanni é semelhante aos achados em rebanhos caprinos (Cottew & Yeats 1981, 1982, Damassa 1990, Ribeiro et al. 1995, Barbosa et al. 2000). Indicam ainda que estes ácaros podem atuar como disseminadores de micoplasmas nos rebanhos bovinos no Brasil. Apesar de os bovinos estudados não apresentarem sinais clínicos de micoplasmoses, as espécies de micoplasmas identificadas nos ácaros (R. auris e R. flechtmanni) são consideradas patogênicas, tendo sido identificadas, cepas do Grupo Mycoides mycoides, além de espécies não incluídas neste grupo como M. conjunctivae, M. bovis, M. bovirhinis, M. arginini e M alkalenses, mas que em outras ocasiões já foram implicadas em surtos de micoplasmoses tanto em caprinos quanto em bovinos (Gil et al. 1999, Pretto et al. 2001, Francoz et al. 2004, Nascimento et al. 2005, Azevedo et al. 2006, Otero 2009, Santos et al. 2009).
A diversidade de espécies de micoplasmas identificadas nos ácaros R. auris e R. flechtmanni demonstra que o conduto auditivo de bovinos é um sítio preferencial desses molicutes, uma vez que oferece condições nutricionais (esteróis) e temperatura favoráveis (Yates et al. 1983, Barber et al. 1986, Woldehiwet et al. 1990) para manutenção e disseminação de Mycoplasma spp. A importância epidemiológica de micoplasmas no interior de ácaros R. auris e R. flechtmanni necessita de estudos adicionais sobre a possibilidade de transmissão transovariana desses molicutes, o que esclareceria aspectos da cadeia de transmissão das micoplasmoses no Brasil.
CONCLUSÃO
Os resultados obtidos neste estudo confirmam que o conduto auditivo externo de bovinos é uma fonte de micoplasmas para os animais, incluindo espécies potencialmente patogênicas para os rebanhos e que os ácaros Raillietia auris e R. flechtmanni estão estreitamente associados com esses molicutes carreando-os em seu organismo.
Agradecimentos.- Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e à Fundação de Amparo à Ciência e Tecnologia do Estado de Pernambuco (FACEPE) pelo suporte financeiro.
Recebido em 2 de setembro de 2011
Aceito para publicação em 22 de novembro de 2011
- Adegboye D.S., Halbur P.G., Cavanaugh D.L., Werdin R.E., Chase C.C.L., Miskimins D.W. & Rosenbusch R.F. 1995. Immunohistochemical and pathological study of Mycoplasma bovis-associated lung abscesses in calves. J. Vet. Diagn. Invest. 7:333-337.
- Azevedo E.O., Alcântara M.D.B., Nascimento E.R., Tabosa I.V., Barreto M.L., Almeida J.F., Araújo M.D'O., Rodrigues A.R.O., Riet-Correa F. & Castro R.S. 2006. Contagious agalactia by Mycoplasma agalactiae in small ruminants in Brazil: first report. Braz. J. Microbial.37:576-581.
- Barber D.M., Jones G.E. & Wood A. 1986. Microbial flora of the eye of cattle. Vet. Rec. 118(8):204-206.
- Barbosa V.P., Nascimento E.R., Danelli M.G.M., Nascimento M.G.F., Santos M.A.J., Lignon G.B. & Ribeiro V.R. 2000. Differentiation of Mycoplasma mycoides types on the etiopathogeny of goat mycoplasmosis. Revista Brasileira de Ciência Veterinária. 7(1): 33-36.
- Cottew G.S. & Yeats F.R. 1981. Occurrence of mycoplasmas in clinically normal goats. Aust. Vet. J. 57:52-53.
- Cottew G.S. & Yeats F.R. 1982. Mycoplasmas and mites in the ear of clinically normal goats. Aust. Vet. J. 59(3):77-81.
- Damassa A.J. 1990. The ear canal as a culture site for demonstration of mycoplasmas in clinically normal goats. Aust. Vet. J. 67:267-269.
- Duarte E.R. & Hamdan J.S. 2004. Otitis in cattle, an aetiological review. J. Vet. Med. B 51:1-7.
- Faccini J.L.H., Fonseca A.D., Costa A.L. & Leite R.C. 1992. Distribuição geográfica e prevalência das espécies do gênero Raillietia Trouessart em bovinos no Brasil. Revta Bras. Parasitol. Vet. 1(2):109-110.
- Francoz D., Fecteau G., Desrochers A. & Fortin M. 2004. Otite media in dairy calves: A retrospective study of 15 cases (1987 to 2002). Can. Vet. J. 45:661-666.
- Gil M.C., Mendoza H., Rey J., Alonso M., Poveda J.B. & Mendoza H. 1999. Isolation of Mycoplasmas from the external ear canal of goats affected with contagious agalactia, Vet. Journal 158:152-154.
- Imada Y., Uchida I. & Hashimoto K. 1987. Rapid identification of Mycoplasma by indirect imunoperoxidase test using small square filter paper. J. Clin. Microbiol. 25:17-21.
- Mercier P., Pellet M.P., Morignat E., Calavas D. & Poumarat F. 2007. Prevalence of mycoplasmas in the external ear canal of goats: Influence of the sanitary status of the herd. Small Rumin. Res. 73:296-299.
- Nascimento M.G.F., D'angelis F.H.F., Nascimento E.R, Resende O.A. & Lignon G.B. 1998. Mycoplasma bovirhinis em muco vaginal de novilhas. Revta Bras. Med. Vet. 20(5):210-214.
- Nascimento M.G.F., D'Angelis F.H.F., Nascimento E.R. & Resende O.A. 2005. Envolvimento de micoplasmas em vacas com distúrbios reprodutivos. Acta Scient. Vet. 33(2):195-199.
- Nienhaus F. & Sikora R.A. 1979. Mycoplasmas, spiroplasmas and rickettsia-like organisms as plant pathogens. Annual Rev. Phytophatol. 17:37-58.
- Nocard E.& Roux E. 1898. Le microbe de la péripneumoniae. Annual Institute Pasteur 12:240-262.
- Otero N.J., Jaramillo M.L., Miranda M.R.E., Navarro H.J.A & Quintero M.M.T. 2009. Association of Raillietia caprae with the presence of mycoplasmas in the external ear canal of goats. Prev. Vet. Med. 92:150-153.
- Pretto L.G., Muller E.E., Freitas J.C., Mettifogo E., Buzihani M. & Yamaguti M., Salvador R. 2001. Mastite bovina por Mycoplasma bovis em rebanhos leiteiros. Pesq. Vet. Bras. 21(4):143-145.
- Ribeiro V.R., Nascimento E.R., Faccini J.L.H., Nascimento M.G.F. & Lignon G.B. 1995. Presença de micoplama em exemplares de Raillietia caprae coletados do conduto auditivo externo de caprinos. Revta Bras. Med. Vet. 17:122-124.
- Rosenbusch R.F. 1994. Biology and taxonomy of the mycoplasmas, p.3-11. In: Whitford H.W., Rosenbusch R.F. & Lauerman L.H. (Eds), Mycoplasmosis in Animals: Laboratory diagnosis. Iowa State University, Ames. 150p.
- Sampaio I.B.M. 2002. Estatística Aplicada a Experimentação Animal. 2Ş ed. Fundação de Estudo e Pesquisa em Medicina Veterinária e Zootecnia, Belo Horizonte. 264p.
- Santos S.B., Nascimento E.R., Faccini J.L.H., Barreto M.L.& Pereira V.L.A. 2009. Potentially pathogenic mycoplasmas in the external ear canal of clinically normal cattle in Southeast Brazil: First report. Braz. J. Microbiol. 40:455-457.
- Thomas L.H., Howard C.J., Parsons K.R. & Anger H.S. 1987. Growth of Mycoplasma bovis in organ cultures of bovine foetal trachea and comparison with Mycoplasma dispar Vet. Microbiol. 13:189-200.
- Whitford H.W., Rosenbusch R.F. & Lauerman L.H. 1994. Mycoplasmosis in Animals: Laboratory diagnosis. Iowa State University, Ames. 150p.
- Whitcomb R.F. & Davis R.E. 1970. Mycoplasmas and phytarboviruses as plant phatogens persistently transmitted by insects. Annual Rev. Entomol. 15:405-464.
- Whitcomb R.F. & Bové J.M. 1983. Mycoplasma-plant-insect interrelationships, p.21-25. In: Razin S. & Tully J.G. (Eds), Methods in Mycoplasmology. Vol.1. Academic Press, New York, 589p.
- Woldehiwet Z., Mamache B. & Rowan T. G. 1990. Effects of age, environmental temperature and relative humidity on the colonization of the nose and trachea of calves by Mycoplasma spp. Brit. Vet. J. 146:419-424.
- Yates W.D.G., Kingscote B.F., Brandley J.A. & Mitchell D. 1983. The relationship of serology and nasal microbiology to pulmonary lesions in feedlot cattle. Can. J. Comp. Med. 47:375-378.
Datas de Publicação
-
Publicação nesta coleção
06 Jun 2012 -
Data do Fascículo
Abr 2012
Histórico
-
Recebido
02 Set 2011 -
Aceito
22 Nov 2011