Resumos
Algumas espécies de Solanum causam intoxicações em ruminantes caracterizadas clinicamente por desordens cerebelares e microscopicamente como doença do depósito lisossomal. Não há lesões de necropsia específicas e microscopicamente ocorrem vacuolização e perda de neurônios de Purkinje. Por ser Solanum paniculatum a espécie de ocorrência na região Nordeste, sendo responsável pelos surtos de intoxicação espontânea descrito no Estado de Pernambuco foi realizado um delineamento experimental para caracterizar o quadro clínico-patológico da intoxicação. Foram usados cinco bovinos, sendo quatro no grupo experimental (GE) e um animal no controle (GC), de seis meses de idade, sem raça definida, com peso de 120 Kg, mantidos em baias durante cinco meses na Clínica de Bovinos de Garanhuns/UFRPE. Os animais receberam a planta, colhida nas propriedades em que ocorreram os surtos naturais, na dosagem de 5g/kg/PV/dia da planta dessecada misturada na ração por ingestão natural. Semanalmente realizou-se o Head Raising Test para determinar os sinais cerebelares e quando positivo os animais foram submetidos à colheita de sangue e do líquido céfalo-raquidiano e em seguida foi feito à eutanásia. O SNC e a rete mirabile foram fixados em formol a 10% tamponado, processados rotineiramente e corados pela hematoxilina e eosina para avaliação histopatológica. Foi realizada análise morfométrica das lesões cerebelares. Para avaliação dos resultados laboratoriais utilizou-se análise descritiva e em relação à morfometria, empregou-se o teste T de Student (p<0.05) na contagem de células de Purkinje e para a espessura da camada molecular do cerebelo o teste de Mann Whitney, com nível de 5% de significância. Três animais apresentaram sinais de intoxicação com tempo em média de 90 dias e um com 155 dias. Os sinais clínicos observados foram ataques convulsivos transitórios, e distúrbios do equilíbrio. Na necropsia não foram encontradas lesões específicas da intoxicação. Não houve alterações no hemograma e no líquido céfalo-raquidiano causado pela planta. No histopatológico havia principalmente vacuolização fina do pericário e perda de células de Purkinje, com degeneração Walleriana e esferóides axonais na camada granular e na substância branca medular, com proliferação dos astrócitos de Bergman. Vacuolização e necrose neuronal também foram observadas no óbex, pedúnculos cerebelares e colículos rostral e caudal e raramente no tálamo, núcleos da base, hipocampo e medula oblonga. Na análise morfométrica não houve diferença significativa (p<0,05) entre o número de células de Purkinje e a espessura da camada molecular entre o GE e GC, demonstrando que apesar dos bovinos desenvolverem quadro clínico da intoxicação e alterações histopatológicas acentuadas, mas nestas condições experimentais não ocorreram alteração morfométricas significativas em relação ao GC. Sugerindo que há necessidade de um tempo de administração maior da planta para o aparecimento de lesões mais acentuadas como as que ocorrem em casos naturais. Os resultados laboratoriais de sangue e do líquido céfalo-raquidiano não refletem alterações relacionadas à intoxicação pela planta.
Plantas tóxicas; Solanum paniculatum; Jurubeba; sistema nervoso central; células de Purkinje; vacuolização; cerebelo; intoxicação por plantas; ruminantes
Some species of Solanum cause poisoning in ruminants clinically characterized by cerebellar disorders and microscopically lysosomal storage disease. There are no specific necropsy injuries and microscopically occurs vacuolation and Purkinje cells loss. Since Solanum paniculatum is the species of greater occurrence in the Northeast region of Brazil and is responsible for spontaneous intoxication outbreaks in Pernambuco State, an experimental delineation was carried out to characterize the clinical and pathological condition of the intoxication. Five cattle were randomly allotted in two groups, with four animals in the experimental group (EG) and one animal as control (CG), with six months of age, no defined breed and weighting 120 kg. All animals were kept in stalls along 5 months in the Clínica de Bovinos de Garanhuns/UFRPE. All animals from the experimental group were fed 5g/kg/body weight/day of the dried leaves of S. paniculatum which was mixed in the ration. The plant was collected in farms where outbreaks of intoxication were described. A Head Raising Test was weekly performed to determine the occurrence of any cerebellum clinical signs and when the result was positive the animal was submitted to a blood and cerebrospinal fluid sampling and subsequently euthanized. The CNS and rete mirabile were fixed in 10% buffered formalin and stained by hematoxylin-eosin for histological evaluation. Morphometric analysis of cerebellum injuries was accomplished. To evaluate the laboratory results, it was used descriptive analysis and in relation to morphometry the Student t test (p<0.05) was used in the counting of Purkinje cells and the thickness of the molecular layer of the cerebellum the Mann Whitney test, with 5% level of significance. Three animals showed clinical signs of intoxication a mean period of 90 days and one animal in155 days. Clinical signs involved transient seizure episodes and balance disturbance. At necropsy there were no specific injuries of intoxication observed as well as changes in red and white cell blood count and liquor analysis. Histological examination showed mainly thin vacuolation of the pericardium, loss of Purkinje cells with Wallerian degeneration, spheroid axons in the granular layer and in the marrows white matter with astrocytes Bergman proliferation. Vacuolation and neuron necrosis were also observed in other sites the obex, cerebellum peduncles, rostral and caudal colliculi and rarely in the thalamus, basal ganglia, hippocampus and medulla oblongata. Morphometric analysis did not differ significantly (p <0.05) in number of Purkinje cells and in molecular layer thickness between the EG and CG, showing that despite the cattle develop clinical symptoms of intoxication and marked histopathological changes, these experimental conditions had caused no significant morphometric changes in relation to the CG. It is suggested a greater time of administration of the plant for the development of most intense lesions as natural cases. Laboratory results of blood and cerebrospinal fluid do not reflect changes related to poisoning by the plant.
Poisonous plant; Solanum paniculatum; Jurubeba; central nervous system; Purkinje cells; vacuolation; cerebellum; plant poisoning; ruminants
ANIMAIS DE PRODUÇÃO
Alterações no SNC e morfometria cerebelar de bovinos intoxicados experimentalmente por Solanum paniculatum
Alterations in the CNS and cerebellar morphometry of cattle experimentally poisoned by Solanum paniculatum
Rafael O. RegoI, * * Autor para correspondência: faelvet@yahoo.com.br ; José A.B. AfonsoII; Carla L. de MendonçaII; Gliere S.L. SoaresIII; Márcia B.A.M. TorresIV
IPós-Graduando em Sanidade e Reprodução de Ruminantes, Unidade Acadêmica de Garanhuns (UAG), Universidade Federal Rural de Pernambuco (UFRPE), Campus Garanhuns, Av. Bom Pastor s/n, Cx. Postal 152, Mundaú, Garanhuns, PE 55296-901, Brasil
IIClínica de Bovinos, Campus Garanhuns, UFRPE, Garanhuns, PE 55292-901. E-mail: afonsojab@oi.com.br
IIIAluno de Graduação do Curso de Medicina Veterinária, UAG-UFRPE, Mundaú, Garanhuns, PE. E-mail: glieresilmara@hotmail.com
IVDocente do Curso de Medicina Veterinária, UAG-UFRPE, Cx. Postal 152 Mundaú, Garanhuns, PE. E-mail: bersane@hotmail.com
RESUMO
Algumas espécies de Solanum causam intoxicações em ruminantes caracterizadas clinicamente por desordens cerebelares e microscopicamente como doença do depósito lisossomal. Não há lesões de necropsia específicas e microscopicamente ocorrem vacuolização e perda de neurônios de Purkinje. Por ser Solanum paniculatum a espécie de ocorrência na região Nordeste, sendo responsável pelos surtos de intoxicação espontânea descrito no Estado de Pernambuco foi realizado um delineamento experimental para caracterizar o quadro clínico-patológico da intoxicação. Foram usados cinco bovinos, sendo quatro no grupo experimental (GE) e um animal no controle (GC), de seis meses de idade, sem raça definida, com peso de 120 Kg, mantidos em baias durante cinco meses na Clínica de Bovinos de Garanhuns/UFRPE. Os animais receberam a planta, colhida nas propriedades em que ocorreram os surtos naturais, na dosagem de 5g/kg/PV/dia da planta dessecada misturada na ração por ingestão natural. Semanalmente realizou-se o Head Raising Test para determinar os sinais cerebelares e quando positivo os animais foram submetidos à colheita de sangue e do líquido céfalo-raquidiano e em seguida foi feito à eutanásia. O SNC e a rete mirabile foram fixados em formol a 10% tamponado, processados rotineiramente e corados pela hematoxilina e eosina para avaliação histopatológica. Foi realizada análise morfométrica das lesões cerebelares. Para avaliação dos resultados laboratoriais utilizou-se análise descritiva e em relação à morfometria, empregou-se o teste T de Student (p<0.05) na contagem de células de Purkinje e para a espessura da camada molecular do cerebelo o teste de Mann Whitney, com nível de 5% de significância. Três animais apresentaram sinais de intoxicação com tempo em média de 90 dias e um com 155 dias. Os sinais clínicos observados foram ataques convulsivos transitórios, e distúrbios do equilíbrio. Na necropsia não foram encontradas lesões específicas da intoxicação. Não houve alterações no hemograma e no líquido céfalo-raquidiano causado pela planta. No histopatológico havia principalmente vacuolização fina do pericário e perda de células de Purkinje, com degeneração Walleriana e esferóides axonais na camada granular e na substância branca medular, com proliferação dos astrócitos de Bergman. Vacuolização e necrose neuronal também foram observadas no óbex, pedúnculos cerebelares e colículos rostral e caudal e raramente no tálamo, núcleos da base, hipocampo e medula oblonga. Na análise morfométrica não houve diferença significativa (p<0,05) entre o número de células de Purkinje e a espessura da camada molecular entre o GE e GC, demonstrando que apesar dos bovinos desenvolverem quadro clínico da intoxicação e alterações histopatológicas acentuadas, mas nestas condições experimentais não ocorreram alteração morfométricas significativas em relação ao GC. Sugerindo que há necessidade de um tempo de administração maior da planta para o aparecimento de lesões mais acentuadas como as que ocorrem em casos naturais. Os resultados laboratoriais de sangue e do líquido céfalo-raquidiano não refletem alterações relacionadas à intoxicação pela planta.
Termos de indexação: Plantas tóxicas, Solanum paniculatum, Jurubeba, sistema nervoso central, células de Purkinje, vacuolização, cerebelo, intoxicação por plantas, ruminantes.
ABSTRACT
Some species of Solanum cause poisoning in ruminants clinically characterized by cerebellar disorders and microscopically lysosomal storage disease. There are no specific necropsy injuries and microscopically occurs vacuolation and Purkinje cells loss. Since Solanum paniculatum is the species of greater occurrence in the Northeast region of Brazil and is responsible for spontaneous intoxication outbreaks in Pernambuco State, an experimental delineation was carried out to characterize the clinical and pathological condition of the intoxication. Five cattle were randomly allotted in two groups, with four animals in the experimental group (EG) and one animal as control (CG), with six months of age, no defined breed and weighting 120 kg. All animals were kept in stalls along 5 months in the Clínica de Bovinos de Garanhuns/UFRPE. All animals from the experimental group were fed 5g/kg/body weight/day of the dried leaves of S. paniculatum which was mixed in the ration. The plant was collected in farms where outbreaks of intoxication were described. A Head Raising Test was weekly performed to determine the occurrence of any cerebellum clinical signs and when the result was positive the animal was submitted to a blood and cerebrospinal fluid sampling and subsequently euthanized. The CNS and rete mirabile were fixed in 10% buffered formalin and stained by hematoxylin-eosin for histological evaluation. Morphometric analysis of cerebellum injuries was accomplished. To evaluate the laboratory results, it was used descriptive analysis and in relation to morphometry the Student t test (p<0.05) was used in the counting of Purkinje cells and the thickness of the molecular layer of the cerebellum the Mann Whitney test, with 5% level of significance. Three animals showed clinical signs of intoxication a mean period of 90 days and one animal in155 days. Clinical signs involved transient seizure episodes and balance disturbance. At necropsy there were no specific injuries of intoxication observed as well as changes in red and white cell blood count and liquor analysis. Histological examination showed mainly thin vacuolation of the pericardium, loss of Purkinje cells with Wallerian degeneration, spheroid axons in the granular layer and in the marrows white matter with astrocytes Bergman proliferation. Vacuolation and neuron necrosis were also observed in other sites the obex, cerebellum peduncles, rostral and caudal colliculi and rarely in the thalamus, basal ganglia, hippocampus and medulla oblongata. Morphometric analysis did not differ significantly (p <0.05) in number of Purkinje cells and in molecular layer thickness between the EG and CG, showing that despite the cattle develop clinical symptoms of intoxication and marked histopathological changes, these experimental conditions had caused no significant morphometric changes in relation to the CG. It is suggested a greater time of administration of the plant for the development of most intense lesions as natural cases. Laboratory results of blood and cerebrospinal fluid do not reflect changes related to poisoning by the plant.
Index terms: Poisonous plant, Solanum paniculatum, Jurubeba, central nervous system, Purkinje cells, vacuolation, cerebellum, plant poisoning, ruminants.
INTRODUÇÃO
Algumas espécies de Solanum, popularmente conhecidas como "jurubeba", causam intoxicações espontâneas em bovinos e caprinos caracterizadas clinicamente por desordens cerebelares e microscopicamente como doença do depósito lisossomal (Sant'Ana et al. 2011).
A jurubeba ocorre o ano inteiro invadindo pastagens e terrenos abandonados e para que ocorra a intoxicação é necessário o consumo de quantidades consideráveis da planta, o que ocorre sobretudo em épocas de carência alimentar (Tokarnia et al. 2000). No Brasil a ocorrência de intoxicação por jurubebas mais estudada é por Solanum fastigiatum na região Sul (Rech et al. 2006), enquanto que em relação a S. paniculatum, existem poucos relatos sobre intoxicações espontâneas e experimentais (Medeiros et al. 2004, Afonso et al. 2009, Barbosa Junior et al. 2010). Surtos de intoxicação por essa espécie em bovinos foram diagnosticados durante o período de três anos (2005-2008) em propriedades do Agreste do Estado de Pernambuco (Guaraná et al. 2011).
A intoxicação por S. paniculatum causa uma doença neurológica caracterizada clinicamente por ataques convulsivos transitórios e à necropsia não são encontradas lesões macroscópicas específicas. O diagnóstico é realizado através dos sinais clínicos observados e dos dados epidemiológicos, sendo confirmadas pela observação das lesões histológicas características, localizadas principalmente no cerebelo, mais especificamente nas células de Purkinje que apresentam vacuolização no citoplasma, com áreas multifocais de perda ou desaparecimento destas células, além da presença de esferóides axonais (Guaraná et al. 2011).
Por ser S. paniculatum a espécie predominante na região Nordeste e a responsável pelos surtos de intoxicação espontânea descritos no Estado de Pernambuco, é de fundamental importância o desenvolvimento de estudo para caracterização do quadro de toxidez causado por esta espécie de Solanum.
MATERIAL E MÉTODOS
Animais
No experimento foram utilizados cinco bovinos machos escolhidos ao acaso e divididos em dois grupos: grupo experimental (GE) com quatro animais identificados como B1, B2, B3 e B4, permanecendo em dupla por baias e o grupo controle (GC) com um bezerro chamado de controle (BC), com faixa etária de aproximadamente seis meses de idade sem raça definida (SRD), com peso médio de 120 kg. Os animais foram mantidos em baias de alvenaria, em sistema de criação intensiva, e submetidos ao mesmo manejo higiênico sanitário e nutricional, onde foram vacinados contra raiva, vermifugados e alimentados durante o experimento com capim elefante (Pennisetum purpureum) e tifton (Cynodon dactylon) à vontade e ração comercial, equivalente a 1% de peso, receberam água e sal mineral ad libitum. Foi estabelecido um período de 30 dias para a adaptação dos animais; foi realizado exame parasitológico de fezes e hemogramas para verificar a higidez clínica dos animais no início do experimento.
Colheita e ingestão da planta
A planta Solanum paniculatum foi colhida manualmente na propriedade em que foram relatados os casos naturais de intoxicação, no município de Brejão no Pernambuco. Três colheitas foram realizadas durante os meses de março, abril e setembro de 2010 e uma adicional em Janeiro de 2011. Após a colheita a planta foi dessecada a sombra durante uma semana, sendo revolvidas diariamente, e após a secagem as folhas foram trituradas em moinho industrial. Depois de triturada foi armazenada em local seco e ventilado e acondicionada em saco plástico em temperatura ambiente, sendo semanalmente pesada em balança digital (Filizola® CS-15).
A planta foi fornecida no cocho aos animais do GE por ingestão natural, misturada na ração comercial, na dose única de 5g/kg da planta dessecada diariamente pela manhã até o dia anterior ao da eutanásia. Um bezerro (BC) que não recebeu a planta, mas apenas a ração comercial, serviu como animal controle. Os animais foram pesados semanalmente para o ajuste da dose da planta. A duração do experimento foi de cinco meses. A dose e período de experimentação seguiram o que foi preconizado por Medeiros et al. (2004) e Afonso et al. (2009).
Exame clínico
Os animais foram avaliados clinicamente, diariamente pela manhã antes da ingestão da planta durante, todo período experimental segundo Dirksen et al. (1993); observaram-se as características de atitude, comportamento de postura e movimentação, apetite, frequência cardíaca e respiratória, motilidade retículo-ruminal (frequência e amplitude), temperatura retal, o aspecto das fezes e urina. O Head Raising Test (HR test) foi realizado semanalmente para determinar os sinais cerebelares. O teste consistia em levantar a cabeça do animal forçando-a para trás no sentido crânio caudal, mantendo essa posição durante um minuto e soltando-a subitamente logo após, se houvesse uma crise com perda de equilíbrio e crise epileptiforme; o teste então era considerado positivo (Pienaar et al. 1976). Esses testes eram realizados fora das baias para a observação da movimentação e postura e evitar traumas secundários.
Os animais foram eutanasiados após o resultado positivo do HR test, sendo mantidos por uma a três semanas para observação da ocorrência de crises espontâneas. Os animais foram submetidos a análises de amostras de sangue e de líquido céfalo-raquidiano (LCR) e em seguida foi feita a eutanásia com tiopental sódico (Cristália) (15mg/kg), xilazina (Sedazine®) a 10% (0,2mg/kg) e cloreto de potássio (Equiplex) a 19,1% (0,8mL/kg) (Luna & Teixeira 2007).
Análise laboratorial
Os exames laboratoriais foram realizados através da obtenção de amostras de sangue coletadas em dois momentos, no período de adaptação para verificar a normalidade dos parâmetros hematológicos e imediatamente antes da colheita do LCR. A realização do hemograma e as determinações das concentrações plasmáticas de proteína total e fibrinogênio foram realizadas conforme descrito por Jain (1986). Para determinação da glicose foram utilizadas as amostras de plasma e no soro foram analisadas as seguintes variáveis bioquímicas: aspartato aminotransferase (AST), lactato desidrogenase (LDH), creatina quinase (CK), proteínas totais e albumina. Estas determinações das atividades séricas foram realizadas em analisador semi-automático (Labquest) seguido o processamento recomendado pelos kits comerciais (Labtest). A proteína total sérica foi mensurada pelo método de biureto (Labtest).
A colheita do LCR foi feita assepticamente através do espaço atlantoccipital (Scott 1995), por meio de fluxo livre, sendo coletada uma amostra de dois a três mL, fracionada em três frascos a fim de minimizar os riscos de contaminação com sangue. Para a análise do LCR foi utilizada uma fração da amostra do terceiro tubo (Stöber 1993). A análise física foi realizada segundo as especificações preconizadas por Stöber (1993) avaliando-se coloração e aspecto (transparência), densidade por meio de refratometria, o pH utilizando fita reagente (Merck) e prova de Pandy segundo a metodologia de Meyer & Harvey (1998). Foram realizadas as determinações da proteína (Kit sensiprot- Labtest), glicose, e as atividades séricas da CK, LDH e AST com kits comerciais (Labtest) e a leitura foi realizada em um analisador (Labquest) bioquímico semi-automático.
As contagens globais de leucócitos contidas no LCR foram efetuadas na Câmara de Neubauer (Herka®) realizou-se a contagem com microscópio óptico usando a objetiva de 10X. De cada amostra foi realizada a análise diferencial, provenientes da centrifugação das amostras em citocentrífuga (Fanem-SP/Brasil) durante cinco minutos a 3000 rpm. Os esfregaços foram corados com Panótico rápido (Laborclin) e foram analisados ao microscópio óptico (Microscópio Leica modelo DM500 com câmera digital Leica modelo DFC290) com objetiva de 100X (Stöber 1993). A contagem global de células foi realizada prontamente após a obtenção das amostras, a fim de evitar degeneração celular.
Avaliação anátomo-patológica
Durante a necropsia foram colhidos encéfalo e a medula espinhal em formol tamponado a 10% o encéfalo e a medula foram fixados na íntegra por sete dias, e após 24 horas da colheita, o encéfalo foi seccionado transversalmente para melhor fixação. Os seguintes fragmentos do SNC foram selecionados para exame histopatológico seguindo o protocolo de colheita de Rech et al. (2006) em bovinos intoxicados por S. fastigiatum: fragmentos de bulbo na altura do óbex, cerebelo, ponte com pedúnculos cerebelares, mesencéfalo na altura dos colículos rostrais e caudais, córtex occipital, seção do diencéfalo através da massa intermédia, incluindo córtex parietal, hipocampo e tálamo, córtex frontal na altura do joelho do corpo caloso e dos núcleos de base, bem como a Rete mirabiles (gânglio trigeminal) e as medulas: oblonga (bulbo), cervical, torácica, lombo-sacro e cauda equina. Estes fragmentos foram processados rotineiramente e corados pela hematoxilina e eosina (HE) para avaliação descritiva da lesão (Barros & Marques 2003).
Análise morfométrica
Foi feito um estudo morfométrico de secção longitudinal do verme cerebelar utilizando um software (Leica LAS Interactive Measurements) de morfometria. Nestes cortes as células de Purkinje foram contadas em 20 campos microscópicos com objetiva de 10X. Em cada campo foram contadas todas as células de Purkinje de uma folha cerebelar. Foi avaliada também a espessura da camada molecular através da mensuração de três medidas por folha (faces laterais e ápice da folha) nas mesmas folhas cerebelares em que foram contadas as células de Purkinje (Rech et al. 2006). O material para a avaliação anátomo-patológica foi obtido dos animais de ambos os grupos experimentais.
Análise estatística
Para a análise estatística das variáveis relacionadas ao hemograma, enzimas séricas, proteínas totais, albumina no sangue e no LCR foi realizada análise descritiva. Com relação à morfometria, empregou-se o teste T de Student (p<0.05) para avaliar o comparativo de contagem de células de Purkinje entre GE e GC. Para a mensuração da espessura da camada molecular do cerebelo entre os grupos empregou-se o teste de Mann Whitney, com nível de 5% de significância, através do programa SigmaStat 3.0 (Curi 1997).
Aprovação do Comitê de Ética
A Comissão de Ética no Uso de Animais (CEUA), da UFRPE aprovou o delineamento experimental sob o processo 017559/2008.
RESULTADOS
Achados clínicos
Todos os bovinos de ambos os grupos experimentais apresentavam um bom escore corporal, em virtude do ganho de peso observado no final do experimento. O consumo médio da planta pelos animais foi de 96 Kg.
O delineamento experimental com os principais dados sobre a administração de Solanum paniculatum aos bovinos, bem como sobre o desfecho: períodos de alimentação, peso do animal inicial e final e da quantidade de planta consumida até a observação do HR test positivo e sacríficio subsequentes são apresentados no Quadro 1.
Em relação aos parâmetros clínicos avaliados como: aspecto da urina, micção, dinâmica e plenitude ruminal não foram observadas alterações. No exame das fezes do GE foram observadas, na maior parte do período, fezes ressecadas em forma de disco. Os parâmetros cardíacos, respiratórios e temperatura corpórea apresentaram-se dentro da normalidade para espécie.
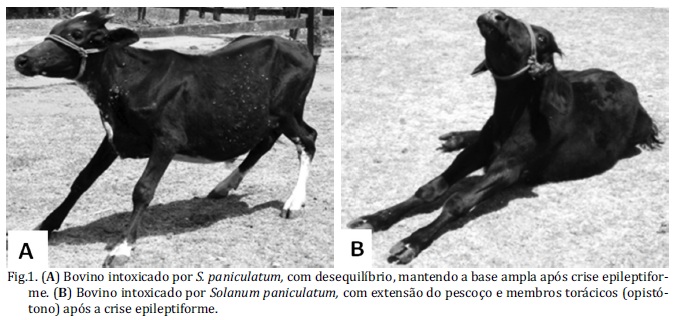
Quanto à avaliação do comportamento no decorrer do experimento, a partir de 70 dias, três animais (B1, B2 e B4) apresentaram um quadro neurológico leve de hiperestesia, excitação, olhar ansioso, tremores de intenção e dificuldade para se levantar do decúbito esternal, permanecendo em posição de base ampla (Fig.1A). Este quadro ocorria quando os animais eram manejados. Com a evolução do quadro clínico os animais não caíam, mas mostravam uma extensão de cabeça e membros torácicos e apresentaram de forma espontânea uma excitabilidade a ruídos, movimentos e estimulação tátil, e uma discreta incoordenação motora momentânea. O HR Test foi positivo após 90 dias do início da intoxicação em três animais (B1, B2 e B4), e no animal B3 aos 155 dias do início do experimento. Os animais positivos apresentaram crises epileptiformes periódicas, de duração de 20 a 30 segundos, sem perda da consciência acompanhada de tremores de intenção, torção lateral, extensão e rigidez dos músculos do pescoço, cabeça e dos membros torácicos; mantinham postura de repouso com os membros abduzidos para tentar manter o equilíbrio. Em seguida ocorreram quedas frequentes para o lado e para trás, permanecendo em decúbito esternal e/ou lateral, e mantinham esta posição por curtos períodos de tempo; tentaram-se levantar, porém sem êxito. Durante a crise, observaram-se opistótono (Fig.1B) e nistagmo. Quando em estação, os animais apresentaram ataxia e hipermetria, com o andar cambaleante e lateralização do mesmo. A realização de HR tests seguidos num mesmo animal resultava em sinais clínicos mais brandos ou até mesmo ausentes. O BC não apresentou HR test positivo.
Apenas o B4, apresentava as crises epileptiformes de forma espontânea e com periodicidade variável, principalmente quando era excitado. Todos os animais do GE permaneceram normais entre as crises epileptiformes quando não excitados.
Achados laboratoriais
Os resultados do eritrograma e concentração plasmática do fibrinogênio, de ambos os grupos não apresentaram alterações, com exceção da concentração da proteína plasmática total que apresentou valores médios pouco inferiores a 6,33g/dL e 6,40g/dL, no GE e GC, respectivamente. Com relação ao leucograma, ambos os grupos demonstraram discreta leucocitose por neutrofilia com desvio para esquerda regenerativo.
Foi observada discreta elevação da glicemia em ambos os grupos, com valores médios de 79 mg/dL e 86 mg/dL, respectivamente no GE e no GC. No entanto, os valores de proteína total sérica estavam no limiar inferior. Em relação às atividades séricas de CK, AST e LDH, apresentaram valores médios superiores no GE, quando comparado ao GC.
Não foram constatadas alterações nos parâmetros físico-químicos e citológicos avaliados no LCR de ambos os grupos experimentais. No diferencial celular, houve predominância de linfócitos seguido de poucos monócitos e neutrófilos. Em relação à análise bioquímica do LCR, as proteínas totais das amostras analisadas dos dois grupos experimentais apresentaram valores inferiores. No entanto, o valor médio encontrado para a glicose de ambos os grupos apresentou um leve aumento. Em relação à atividade da CK analisada manteve-se bem superior no GE (20,3 U/L), quando comparado ao GC (1,22 U/L), o mesmo sendo observado para as atividades de AST e LDH, mais de duas a três vezes superiores.
Achados patológicos
Não foram encontradas alterações macroscópica associadas a intoxicação pela planta. As lesões histológicas mais acentuadas foram encontradas no cerebelo nos animais do GE e consistiam de células de Purkinje tumefeitas e com vacuolização parcial ou difusa fina do pericário e perda dos grânulos da substância de Nissl, dando a célula um aspecto esponjoso, com seus núcleos deslocados para periferia da mesma (Fig.2A). Havia áreas multifocais necrose neuronal com desaparecimento das células de Purkinje e ao redor proliferação de astrócitos de Bergman, espessando a camada granular do cerebelo. Vacuolização neuronal moderada foi encontrada no óbex, pedúnculos cerebelares (Fig.2B,C) e colículos rostrais de todos os animais intoxicados. No colículo caudal, este achado só não foi encontrado no B1. No tálamo, núcleos da base, hipocampo e medula oblonga, este achado foi raramente encontrado.
Necrose neuronal em áreas multifocais associados a focos de gliose foi observada na região de óbex, pedúnculos cerebelares, tálamo, colículos caudal e rostral, nos núcleos da base e no hipocampo, na medula oblonga, torácica e cervical. Raramente foi observado gliose focal na medula espinhal de alguns animais do GE inclusive na cauda equina do controle.
Quantidades variáveis de esferóides axonais foram frequentemente encontrados na camada granular (Fig.2D) e molecular, na substância branca medular do cerebelo de todos os animais do GE. Estes achados foram moderadamente encontrados no colículo caudal, rostral e tálamo, sendo observados raramente nos cortes do hipocampo, núcleos da base e da medula espinhal. Próximo às áreas aonde foi encontrado os esferóides axonais, observaram-se degeneração Walleriana, microcavitações de tamanhos variados, tanto na substância branca como na cinzenta de B1 nos hemisférios cerebelares e colículo rostral. O mesmo achado foi observado no animal B3, no hemisfério cerebelar e colículo caudal e nos pedúnculos cerebelares de B2. Células Gitter foram observadas dentro de algumas dessas cavidades.
Áreas com manguitos perivasculares foram encontrado em ambos os grupos experimentais nas regiões de óbex, colículo rostral, tálamo, núcleos da base, córtex frontal córtex parietal e temporal. A distribuição das principais lesões nas diferentes secções do SNC dos animais encontram-se detalhadas no Quadro 2.
Análise morfométrica
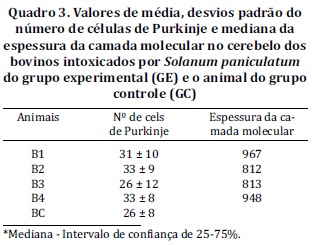
Na avaliação da morfometria quanto à contagem de células de Purkinje não existiram diferenças significativas (p>0,05) entre os animais do GE (x=3±3,5) em relação ao GC (26±8) células. Com relação à espessura da camada molecular foi constatado haver diferença significativa (p<0,05) entre os animais do GE e do GC (Quadro 3).
DISCUSSÃO
O delineamento experimental proposto pelo estudo resultou em manifestações clínicas semelhantes às descritas em intoxicações naturais e experimentais, por outras espécies do gênero Solanum como: S. fastigiatum, S. kwebense, S. dimidiatum, S. bonariensis, S. cinereum e S. viarum (Pienaar et al. 1976, Menzies et al. 1979, Bourke et al. 1997, Porter et al. 2003, Rech et al. 2006, Verdes et al. 2006, Van der Lugt et al. 2010).
A duração de poucos segundos dos ataques convulsivos e a recuperação rápida da crise dos animais, foi também descrita por Medeiros et al. (2004) e Guaraná et al. (2011), nas intoxicações espontâneas e experimentais, e nos casos de intoxicação natural pela S. fastigiatum citados por Riet-Correa et al. (1983) e Rech et al. (2006). A diminuição da intensidade dos sinais com a repetição do teste foi bem observada segundo relatado por Tokarnia et al. (2000). Em relação às variações de intensidade dos sinais observadas entre os animais, isso pode ser justificado pelo fato de ocorrer variabilidade na resistência de cada animal e no desconhecimento do conteúdo das substâncias químicas indicadas como responsáveis pela doença (Sousa & Irigoyen 1999, Tokarnia et al. 2000, Guaraná et al. 2009).
Os sinais neurológicos encontrados nesta intoxicação associadas às lesões cerebelares foram relatados por outros autores do Brasil e do mundo em bovinos, caprinos e ovinos, com variação de intensidade dependendo da espécie de Solanum e da espécie animal envolvida (Pienaar et al. 1976, Menzies et al. 1979, Riet-Correa et al. 1983, Zambrano et al. 1985, Bourke 1997, Verdes et al. 2002, Verdes et al. 2006, Van der Lugt et al. 2010). Zambrano et al. (1985), em experimentos com ovinos justificaram que essas variações no quadro clínico patológico ocorrem em função da dosagem e o maior tempo de administração da planta, já que nas condições do experimento não foi observado quadro clínico semelhante encontrado nos bovinos, porém apresentaram as mesmas lesões histológicas no SNC.
Os resultados do eritrograma e da concentração plasmática do fibrinogênio de ambos os grupos estavam dentro dos parâmetros de normalidade para a espécie bovina (Kramer 2000). Achados semelhantes foram relatados em bovinos intoxicados com a S. paniculatum e outras espécies de Solanum (Pienaar et al. 1976, Guaraná et al. 2011). A discreta hipoproteinemia que não se refletiu no hematócrito, pode estar relacionada à atividade espoliativa de alguns nematódeos gastrintestinais comuns na região (Costa et al. 2009), e a leve alteração leucocitária observada nos animais deste estudo pode estar associada a um leve quadro infeccioso respiratório, não atribuindo essa oscilação a uma reação orgânica dos bovinos à ação da planta ingerida.
A elevação da glicemia poderia estar relacionada ao aumento da glicogenólise hepática, em resposta a liberação de epinefrina e pela estimulação da gliconeogênese exercida pelo cortisol, ocasionado nas situações de estresse (Bennet et al. 1989). Por outro lado, Menzies et al. (1979) e Chaves (2009) estudando a intoxicação espontânea por S. dimidiatum em bovinos e ovinos intoxicados por Ipomoea asarifolia não observaram alterações nos valores de glicemia.
Todos os parâmetros físicos e químicos avaliados no LCR de ambos os grupos situaram-se nos limites fisiológicos para a espécie bovina (Stöber 1993, Scott 1995, Meyer & Harvey 1998). Os resultados das análises da proteína total e da glicemia, de ambos os grupos não se distanciaram dos valores fisiológicos de bovinos adultos (Welles et al. 1992). O aumento da atividade sérica de CK, AST e LDH encontrado pode ter ocorrido como consequência do esforço muscular realizado durante as tentativas dos animais em permanecerem em estação e/ou pelo decúbito prolongado (Kaneko et al. 2008, Chaves 2009). De acordo com Bennet et al. (1989), os aumentos dos níveis de AST e CK, durante situações de estresse prolongado, são atribuídos aos efeitos do catabolismo. A liberação de fosfato de creatina das fibras musculares catabolizadas promove um aumento da atividade destas enzimas. Portanto Chaves (2009) descreve achados semelhantes, em que ovinos intoxicados por Ipomoea asarifolia apresentaram marcadas elevações na atividade da CK, porém com valores médios ainda bem inferiores aos encontrados neste estudo. Já em relação à atividade enzimática da AST, o mesmo autor relata um discreto aumento de sua atividade.
Vacuolização neuronal não é um achado específico da intoxicação por S. paniculatum e S. fastigiatum, pois ocorre em outras doenças de ruminantes causadas pela ingestão de plantas do gênero Solanum (Pienaar et al. 1976, Menzies et al. 1979, Bourke 1997, Porter et al. 2003), Swainsona, Oxytropis, Astragalus (Summers et al. 1995), Ipomoea (Van der lugt 2002) e Sida (Driemeier et al. 2000, Loretti et al. 2003, Seitz et al. 2005, Furlan et al. 2008) e nas doenças de depósitos lisossomais (DDL) hereditárias (Jolly & Walkley 1997). Diferente de S. fastigiatum em que a vacuolização é confinada apenas as células de Purkinje (Rech 2007), esse achado predominou nestas células, mas ocorreu também em neurônios dos pedúnculos cerebelares, óbex, colículos e tálamo. A presença de raros vacúolos neuronais em outras áreas do SNC, particularmente no núcleo vermelho, pode ocorrer como um achado incidental em animais clinicamente sadios (Jardim et al. 1999, Gavier-Widen et al. 2001). No entanto esse achado só foi observado em animais com sintomatologia clínica. A vacuolização neuronal ocorre devido alterações subcelulares nas organelas neuronais, nos bovinos a forma mais comum esta associado ao acúmulo de substratos não metabolizados nos lisossomos (Jolly & Wakley 1997, Rech 2007).
Com relação à morfometria das células de Purkinje, os resultados foram semelhantes aos encontrados por Verdes et al. (2002), em estudo experimental com S. bonariensis. Entretanto diferem da casuística de intoxicação natural de S. fastigiatum, onde ocorreu uma redução de células de Purkinje e da espessura da camada molecular nos campos analisado (Rech et al. 2006). Tais diferenças observadas podem ser decorrentes das espécies da planta, a quantidade, ao tempo de ingestão pelos animais. Esses resultados confirmam a hipótese levantada por Riet-Correa et al. (1983) e Zambrano et al. (1985) de que nos casos naturais, a ingestão de quantidades menores da planta durante períodos prolongados, ocasionaria o desaparecimento mais acentuado de células de Purkinje do que nos casos experimentais, onde ocorre a ingestão de doses maiores num menor espaço de tempo (Tokarnia et al. 2000, Verdes et al. 2006). Provavelmente em nosso estudo no momento da avaliação havia proliferação das células da glia em resposta da lesão neuronal, que ainda não tinha sido suficiente para que ocorresse e redução da camada molecular. Segundo Guaraná et al. (2011), depleção das camadas granular e molecular que se encontravam marcadamente diminuídas de espessura e com rarefação do neurópilo e menor número de células quando comparadas com cerebelos de animais normais são em consequência da remoção de axônios e dendritos das células de Purkinje.
Nas DDLs com a progressão da lesão os neurônios acumulam vacúolos até a sua necrose ou morte do animal e parece provável que haja alguma capacidade limitada para descarregar parte da carga armazenada por exocitose, isso quando não há atividade enzimática deficiente. Os locais de armazenamento se limitam mais para o corpo neuronal e algumas hastes dendríticas maiores, tornando a celúla muita distendida, arredondada, tumefeita e não angular. No entanto, mesmo dentro do corpo celular do neurônio, o armazenamento pode ser um tanto polarizado, muitas vezes ao lado de vários axônios, diferentes planos da seção podem sugerir que alguns neurônios não são afetados, principalmente se analisado no início do curso da doença (Jubb & Huxtable 2010). Portanto no estágio inicial da DDL ocorre pouca morte neuronal que será progressiva e que provavelmente contribui muito significativamente para a perturbação funcional na fase final da doença. Independendente do quadro clínico observado pelos animais no GE havia o mesmo padrão de lesão em todos os animais, o que pode ser justificado pois quando os neurônios estão envolvidos na DDL os sinais clínicos de comprometimento neurológico, eventualmente, tornam-se evidentes, mas, em geral, estes não se correlacionam com a morte neuronal significativa, pois os mecanismos da disfunção estão em desenvolvimento (Jubb & Huxtable 2010).
Esferóides axonais e degeneração Walleriana são os dois principais tipos de reações à injuria observados nos axônios em doença com lesão neuronal. Em casos de intoxicação por S. fastigiatum, esferóides axonais ocorrem devido à degeneração do pericário que prejudica o transporte de substâncias entre o pericário e o axônio (Rech 2007), porém não deve ser descartada a possibilidade da ação direta da planta sobre esses axônios (Medeiros et al. 2004). Essas lesões também foram descritas em casos de intoxicação espontânea e experimental por S. paniculatum (Guaraná et al. 2011) e por S. fastigiatum (Riet-Correa et al. 1983, Rech et al. 2006). A presença de esferóides axonais no tronco encefálico de equinos e degerenação Walleriana na substância branca da medula espinhal de ovinos e caprinos são considerados achados incidentais (Hooper 1999, Jahns et al. 2006).
Os focos de gliose observados nos animais do GE também foram observados em intoxicações por S. paniculatum em bovinos (Guaraná et al. 2011) e em outras espécies de Solanum (Riet-Correa et al. 1983, Porter et al. 2003, Rech et al. 2006, Verdes et al. 2006) porém alguns animais não apresentaram tais focos o que pode ser justificado pelos diferentes tempos de ingestão e quantidade da planta, sendo relacionado principalmente essa resposta à função de reparação realizada por essas células (Zambrano et al. 1985). Portanto segundo Rech (2007), gliose é uma resposta inespecífica das células gliais a diversas formas de injúria e geralmente envolve astrócitos e microglia.
O delineamento proposto neste trabalho representa um bom modelo experimental de intoxicação por S. paniculatum uma vez que desenvolveu o quadro de sintomatologia clínica da intoxicação, sendo as lesões degenerativas cerebelares, as mais acentuadas, mas estendendo-se estas lesões a outras áreas do SNC, que devem ser colhidas e examinadas para avaliação do grau e extensão da lesão. Os resultados laboratoriais de sangue e do LCR não refletem alterações relacionadas à intoxicação pela S. paniculatum e o desenvolvimento do quadro clínico não causou uma depleção neuronal em relação ao GC. Portanto, nas condições experimentais propostas não houve uma correlação positiva entre sinais clínicos e gravidade das lesões histopatológicas examinadas, sugerindo que necessitam de um tempo de administração da planta maior para o agravamento das lesões.
Agradecimentos.- À Fundação de Amparo à Pesquisa do Estado de Pernambuco (FACEPE) pela concessão da bolsa de mestrado (Edital PBPG 0772-5.05/09). Ao Conselho Nacional de Desenvolvimento Científico Tecnológico (MCT/CNPq), pelo apoio financeiro e bolsa de PIBIC. Ao Edital Universal Rural. À Clínica de Bovinos de Garanhuns pelas instalações para desenvolvimento da pesquisa. À Professora Dra. Rosemeri Vasconcelos do Departamento de Patologia da Unesp-Jaboticabal, pelo treinamento na análise morfométrica.
Recebido em 19 de junho de 2012.
Aceito para publicação em 18 de julho de 2012.
Parte da Dissertação do primeiro autor, Programa de Pós-Graduação em Sanidade e Reprodução de Ruminantes, Unidade Acadêmica de Garanhuns, Universidade Federal Rural de Pernambuco.
- Afonso J.A.B., Guaraná E.L.S., Riet-Correa F., Mendonça C.L. & Costa N.A. 2009. Ocorrência de Intoxicação por Solanum paniculatum (jurubeba) em bovinos no estado de Pernambuco. Vet. Zootec. 1:7.
- Barbosa Junior S.A., Monteiro B.C.M., Albuquerque R.F., Cunha A.L.B. & Mendonça F.S. 2010. Ocorrência de doença lisossomal associada à ingestão de Solanum paniculatum em caprinos em Pernambuco. Anais 10ª Jornada de Ensino, Pesquisa e Extensão, Recife. UFRPE, Recife.
- Barros C.S.L. & Marques G.H.F. 2003. Procedimentos para o Diagnóstico das Doenças do Sistema Nervoso Central de Bovinos. Departamento de Defesa Animal, Ministério da Agricultura, Pecuária e Abastecimento (MAPA), Brasília. 50p.
- Bennet B.W., Kerschenm R.P. & Nockfls C.F. 1989. Stress-induced hematological changes in feedlot cattle. Agric. Practice 10:16-28.
- Bourke C.A. 1997. Cerebellar degeneration in goats grazing Solanum cinereum (Narrawa burr). Aust. Vet. J. 75(5):363-365.
- Chaves D.P. 2009. Intoxicação experimental por Ipomoea asarifolia em ovinos: achados clínicos, laboratoriais e anatomopatológicos. Tese de Doutorado em Clínica Médica Veterinária, Faculdade de Ciências Agrárias e Veterinárias, Universidade Estadual Federal Paulista, Jaboticabal, SP. 82p.
- Costa V.M.M., Simões S.V.D. & Riet-Correa F. 2009. Doenças parasitárias em ruminantes no semi-árido brasileiro. Pesq. Vet. Bras. 29(7):563-568.
- Curi P.R. 1997. Metodologia e Análise da Pesquisa em Ciências Biológicas. Tipomic, Botucatu, p.220-228.
- Dirksen G., Gründer H.D. & Stöber M. 1993. Rosemberger Exame Clínico dos Bovinos. 3a ed. Guanabara Koogan, Rio de Janeiro. 419p.
- Furlan F.H., Lucioli J., Veronezi L.O., Traverso S.D. & Gava A. 2008. Intoxicação experimental por Sida carpinifolia (Malvaceae) em bovinos. Pesq. Vet. Bras. 29(1):57-62.
- Gavier-Widen D., Wells G.A.H., Simmons M.M., Wilesmith J.W. & Ryan J. 2001. Histological observations on the brains of symptomless 7-year-old cattle. J. Comp. Pathol. 124:52-59.
- Guaraná E.L.S., Riet-Correa F., Mendonça C.L., Medeiros M.T., Costa N.A. & Afonso J.A.B. 2009. Poisoning by Solanum paniculatum in cattle in Pernambuco, Northeasten Brazil. Proc. 8th International Symposium on Poisonous Plants, João Pessoa, Brazil, p.62.
- Guaraná E.L.S., Riet-Correa F., Mendonça C.L., Medeiros R.M.T., Costa N.A. & Afonso J.A.B. 2011. Intoxicação por Solanum paniculatum (Solanaceae) em bovinos. Pesq. Vet. Bras. 31(1):59-64.
- Hooper P.T. 1999. Incidental lesions in the brains of sheep and goats. Aust. Vet. J. 77:398-399.
- Jahns H., Callanan M.C., McElroy M.C., Sammin D.J. & Basset H.F. 2006. Age-related and non age-related changes in 100 surveyed horses brains. Vet. Pathol. 43.740-750.
- Jain N.C. 1986. Schalm's Veterinary Hematology. 4th ed. Lea and Febiger, Philadelphia. 1221p.
- Jardim L.S., Andrade-Neto J.P. & Alessi A.C. 1999. Neuronal vacuolation and spongiform lesions in young Rottweiler dogs. Arq. Bras. Med. Vet. Zootec. 51(5):449-452.
- Jolly R.D. & Walkley S.U. 1997. Lysosomal storage diseases of animals: An essay in comparative pathology. Vet. Pathol. 34:159-163.
- Jubb K.V.F. & Huxtable C.R. 2010. The nervous system, p.267-437. In: Jubb K.V.F., Kennedy P.C. & Palmer N. (Eds), Pathology of Domestic Animals. Vol.1. 4th ed. Academic Press, San Diego.
- Kaneko J.J., Harvey J.W. & Bruss M.L. 2008. Clinical Biochemistry of Domestic Animal. 6th ed. Elsevier, New York. 916p.
- Kramer J.W. 2000. Normal hematology of cattle, sheep and goats, p.1075-1084. In: Feldman B.F., Zinkl J.G. & Jain N.C. (Eds), Schalm's Veterinary Hematology. 5th ed. Williams and Wilkins, Philadelphia.
- Loretti A.P., Colodel E.M., Gimeno E.J. & Driemeier D. 2003. Lysossomal storage disease in Sida carpinifolia toxicosis: An induced mannosidosis in horses. Equine Vet. J. 35:434-438.
- Luna S.P.L. & Teixeira M.W. 2007. Eutanásia: considerações éticas e indicações técnicas. Revta CFMV 41:60-69.
- Medeiros R.M.T., Guilherme R.E., Riet-Correa F., Barbosa R.C. & Lima E.F. 2004. Intoxicação Experimental por Solanum paniculatum (jurubeba) em bovinos. Pesq. Vet. Bras. 24(Supl.):41.
- Menzies J.S., Bridges C.H. & Bayley Jr E.M. 1979. A neurological disease of cattle associated with Solanum dimidiatum Southwestern Vet. 32:45-49.
- Meyer D.J. & Harvey D.J. 1998. Veterinary Laboratory Medicine: Interpretation and diagnosis. W.B. Saunders, Philadelphia. 373p.
- Pienaar J.G., Kellerman T.S., Basson P.A., Jenkins W.L. & Vahrmeijer J. 1976. Maldronksiekte in cattle: A neuronopathy caused by Solanum kwebense N.E. Br. Ondertespoort J. Vet. Res. 43:67-74.
- Porter M.B., Mackay R.J., Uhl E., Platt S.R. & De Lahunta A. 2003. Neurologic disease putatively associated with Solanum viarum in goats. J. Am. Vet. Med. Assoc. 223(4):501-504.
- Rech R.R. 2007. Alterações no encéfalo de bovinos submetidos à vigilância das encefalopatias espongiformes transmissíveis. Tese de Doutorado em Medicina Veterinária, Centro de Ciências Rurais, Universidade Federal de Santa Maria, RS. 228p.
- Rech R.R., Rissi D.R., Rodrigues A., Pierezan F., Piazer J.V.M., Komers G.D. & Barros C.S.L. 2006. Intoxicação por Solanum fastigiatum (Solanaceae) em bovinos: epidemiologia, sinais clínicos e morfometria das lesões cerebelares. Pesq. Vet. Bras. 26(3):183-189.
- Riet-Correa F., Méndez M.D., Schild A.L., Summers B.A. & Oliveira J.A. 1983. Intoxication by Solanum fastigiatum var. fastigiatum as a cause of cerebellar degeneration in cattle. Cornell Vet. 73(3):240-256.
- Sant'Ana F.J.F., Barbeito C.G., Nishida F., Gimeno E.J., Verdes J.M., Battes D., Moraña A. & Barros C.S.L. 2011. Clinical and pathological aspects and cerebellar lectin binding in cattle poisoned with Solanum fastigiatum var. fastigiatum and Solanum bonariense Int. J. Poison. Plant Res. 1(1):28-34.
- Scott P.R. 1995. The collection and analysis of cerebrospinal fluid as an aid to diagnosis in ruminant neurological disease. Brit. Vet. J. 151:603-614.
- Seitz A.L., Colodel E.M., Barros S.S. & Driemeier D. 2005. Intoxicação experimental por Sida carpinifolia (Malvaceae) em ovinos. Pesq. Vet. Bras. 25(1):15-20.
- Sousa R.S. & Irigoyen L.F. 1999. Intoxicação experimental por Phalaris angusta (Gramineae) em bovinos. Pesq. Vet. Bras. 19(3/4):116-122.
- Stöber M. 1993. Sistema Nervoso Central, p.341-62. In: Dirksen G., Gründer H.D. & Stöber M. (Eds), Rosenberger Exame Clínico dos Bovinos. 3a ed. Guanabara Koogan, Rio de Janeiro.
- Summers B.A., Cummings J.F. & De Lahunta A. 1995. Veterinary Neuro-pathology. Mosby, St Louis. 527p.
- Tokarnia C.H., Döbereiner J. & Peixoto P.V. 2000. Plantas Tóxicas do Brasil. Editora Helianthus, Rio de Janeiro. 310p.
- Van der Lugt J.J. 2002. Lysosomal storage diseases, p.15-16. In: Van Der Lugt J.J. (Ed.), The Clinicopathology and Pathology of Selective Toxicoses and Storage Disease of the Nervous System of Ruminants in Southern Africa. Dissertation, University of Utrecht, The Netherlands. 174p.
- Van Der Lugt J.J., Bastianello S.S., Van Ederen A.M. & Van Wilpe E. 2010. Cerebellar cortical degeneration in cattle caused by Solanum kwebense Vet. J. 185(2):225-227.
- Verdes J.M., Moraña A., Battes D., Guerrero F., Riet-Correa F. & Santos C.G. 2002. Enfermedad cerebelosa em bovinos ocasionada por lá ingestion de Solanum bonariense 10º Congresso Latinoamericano de Buiatria, Paysandú, Uruguay, p.252-255.
- Verdes J.M., Moraña A., Gutiérrez F., Battes D., Fidalgo L.E. & Guerreiro F. 2006. Cerebellar degeneration in cattle grazing Solanum bonariense ("Naranjillo") in Western Uruguay. J. Vet. Diag. Invest. 18(3):299-303.
- Welles E.G., Tyler J.W., Sorjonen D.C. & Whatley E.M. 1992. Composition and analysis of cerebrospinal fluid in clinically normal adult cattle. Am. J. Vet. Res. 5:2050-2057.
- Zambrano M.S., Riet-Correa F., Schild A.L. & Méndez M.C. 1985. Intoxicação por Solanum fastigiatum var. fastigiatum: evolução e reversibilidade das lesões em bovinos, e susceptibilidade de ovinos, coelhos, cobaias e ratos. Pesq. Vet. Bras. 5(4):133-141.
Datas de Publicação
-
Publicação nesta coleção
03 Dez 2012 -
Data do Fascículo
Nov 2012
Histórico
-
Recebido
19 Jun 2012 -
Aceito
18 Jul 2012