Resumos
Mycobacterium sp. induz inflamação granuloma-tosa em diferentes espécies animais. Mycobacterium bovis e o complexo Mycobacterium avium são importantes patógenos de bovinos e suínos e podem causar infecção em humanos, principalmente imunossuprimidos. Perdas na produção, barreiras comerciais e prejuízos por condenação de carcaças em abatedouro/frigorífico estão atrelados à ocorrência dessas infecções, com prejuízos econômicos significativos. Foi realizado um estudo de casos diagnosticados como tuberculose em bovinos e linfadenite granulomatosa em suínos no Setor de Patologia Veterinária da Universidade Federal do Rio Grande do Sul (SPV-UFRGS) no período de janeiro de 2007 a dezembro de 2011. Dados referentes à raça, ao sexo, à idade e ao histórico clínico foram compilados dos livros de registro e analisados. As características histológicas das lesões em linfonodos e pulmões foram avaliadas em Hematoxilina-Eosina, com predomínio de células gigantes nas lesões de tuberculose bovina e de macrófagos epitelioides em suínos. As técnicas histoquímicas de Ziehl-Neelsen e Tricrômico de Masson foram utilizadas para evidenciar, respectivamente, bacilos álcool-ácido resistentes e tecido conjuntivo fibroso nas lesões. A técnica de imuno-histoquímica foi utilizada em aproximadamente 30% dos casos estudados de cada espécie, selecionados aleatoriamente, para a caracterização do infiltrado linfocítico. Foram utilizados os anticorpos anti-CD3 para a marcação de linfócitos T e anti-CD79αcy para a marcação de linfócitos B. Linfócitos T predominaram nas lesões em ambas as espécies, com diferença estatisticamente significativa entre as médias dos linfócitos T e linfócitos B. Foi usado o teste t pareado, com t=5,501 (p<0,001) nas lesões dos bovinos e t=5,826 (p<0,001) para as lesões de linfadenite dos suínos. Adicionalmente foram marcados macrófagos com o uso do anticorpo anti-CD68 para bovinos e anti-Lisozima para suínos. Além desses, o anticorpo policlonal anti-Mycobacterium tuberculosis foi utilizado para a detecção de bactérias do gênero Mycobacterium, com imunomarcação positiva em todos os casos e, nos casos dos suínos, houve marcação anti-Mycobacterium avium.
Mycobacterium spp.; doenças infecciosas; bovinos; suínos; imuno-histoquímica.
Mycobacterium sp. induces granulomatous inflammation in different animal species. Mycobacterium bovis and the Mycobacterium avium complex are important cattle and swine pathogens that can also infect humans, especially those immunosuppressed. Losses in production, commercial barriers and carcasses condemnations in slaughtering are related to this infection, which implies in large economic losses. It was carried out a study on bovine tuberculosis lesions and granulomatous lymphadenitis in pigs, diagnosed by the Setor de Patologia Veterinária from the Universidade Federal do Rio Grande do Sul (SPV-UFRGS), Brazil, between January 2007 and December 2011. Data concerning breed, sex, age and clinical history were retrieved from the files and analyzed. Histological features of the lesions in lymph nodes and lungs were evaluated in Hematoxylin-Eosin staining. Multinucleated giant cells were predominant in bovine tuberculosis lesions and epithelioid macrophages were abundant in swine. Ziehl-Neelsen and Masson's trichrome techniques were used respectively to demonstrate the alcohol-acid resistant bacillus and fibrous connective tissue in the lesions. The immunohistochemistry technique was performed to characterize the lymphocytic infiltrate. Anti-CD3 antibodies were utilized to immunolabeling lymphocytes T; and anti-CD79αcy to lymphocytes B. Lymphocytes T were predominant in both species lesions; confirmed statistically by paired t test, which showed significantly differ means of T and B lymphocytes, with t=5,501 (p<0.001) for the bovines tuberculosis lesions, and t=5.826 (p<0.001), for the cases of pigs lymphadenitis. In addition, macrophages were immunolabeled by antibody anti-CD68 to bovine, and lysozyme to swine; and polyclonal anti-Mycobacterium tuberculosis antibody were used successfully to detect Mycobacterium sp. in bovine and swine lesions, apart from in the swine samples there was also anti-Mycobacterium avium immunolabelling.
Mycobacterium spp.; infectious diseases; cattle; swine; immunohistochemistry.
Introdução
A tuberculose é uma doença infectocontagiosa, crônica, causada por bactérias álcool-ácido-resistentes (BAAR) do gênero Mycobacterium (Cousins et al. 2004Cousins D.V., Huchzermeyer H.F.K.A., Griffin J.F.T., Brückner G.K., Van Rensburg I.B.J. & Kriek N.P.J. 2004. Tuberculosis, p.1973-1993. In: Coetzer J.A.W. & Tustin R.C. (Eds), Infectious Diseases of Livestock. Vol.3. 2nd ed. Oxford University Press, Cape Town.). Ocorre mundialmente e provoca grande impacto na produção animal, principalmente em bovinos leiteiros (Radostits et al. 2007Palmer M.V., Waters W.R. & Thacker T.C. 2007. Lesion development and immunohistochemical changes in granulomas from cattle experimentally infected with Mycobacterium bovis. Vet. Pathol. 44:863-874.). Em suínos podem não ocorrer perdas econômicas relacionadas a doença clínica, porém vísceras com lesões tuberculoides são descartadas e carcaças inteiras podem ser condenadas ou requerer tratamento térmico antes de liberadas para o consumo humano (Morés et al. 2007Morés N., Ventura L., Dutra V., Silva V.S., Junior W.B., Oliveira S.O., Kramer B. & Neto J.S.F. 2007. Linfadenite granulomatosa em suínos: linfonodos afetados e diagnóstico patológico da infecção causada por agentes do Complexo Mycobacterium avium. Pesq. Vet. Bras. 27:13-17., Hibiya et al. 2008Hibiya K., Kasumi Y., Sugawara I. & Fujita J. 2008. Histopathological classification of systemic Mycobacterium avium complex infections in slaughtered domestic pigs. Comp. Immunol. Microbiol. Infect. Dis. 31:347-366.).
Mycobacterium bovis é o agente da tuberculose em bovinos, mas pode afetar também outras espécies de animais vertebrados, domésticos e silvestres, bem como humanos (Cousins et al. 2004Cousins D.V., Huchzermeyer H.F.K.A., Griffin J.F.T., Brückner G.K., Van Rensburg I.B.J. & Kriek N.P.J. 2004. Tuberculosis, p.1973-1993. In: Coetzer J.A.W. & Tustin R.C. (Eds), Infectious Diseases of Livestock. Vol.3. 2nd ed. Oxford University Press, Cape Town., McAdam & Sharpe 2010McAdam A.J. & Sharpe A.H. 2010. Doenças infecciosas, p.331-405. In: Kumar V., Abbas A.K., Fausto N., Aster J.C. (Eds), Robbins and Cotran, Bases Patológicas das Doenças (Tradução da 8ª ed., com adaptações referentes às doenças tropicais e sua epidemiologia). 8th ed. Elsevier, Rio de Janeiro.). A tuberculose é uma zoonose importante, principalmente para pessoas imunologicamente debilitadas e, especialmente, em países em desenvolvimento (McAdam & Sharpe 2010McAdam A.J. & Sharpe A.H. 2010. Doenças infecciosas, p.331-405. In: Kumar V., Abbas A.K., Fausto N., Aster J.C. (Eds), Robbins and Cotran, Bases Patológicas das Doenças (Tradução da 8ª ed., com adaptações referentes às doenças tropicais e sua epidemiologia). 8th ed. Elsevier, Rio de Janeiro., Thakur et al. 2011Stepanova H., Pavlova B., Stromerova N., Matiasovic J., Kaevska M., Pavlik I.& Faldyna M. 2011. Cell-mediated immune response in swine infected with Mycobacterium avium subsp. avium. Vet. Immunol Immunopathol. 142:107-112.). Mycobacterium bovis é apontado como responsável por 5 a 10% dos casos de tuberculose humana (Radostits et al. 2007Palmer M.V., Waters W.R. & Thacker T.C. 2007. Lesion development and immunohistochemical changes in granulomas from cattle experimentally infected with Mycobacterium bovis. Vet. Pathol. 44:863-874., Schiller et al. 2011Radostits O.M., Gay C.C., Hinchcliff K.W. & Constable P.D. 2007. Diseases associated with bacteria - IV, p.1007-1017. In: Radostits O.M., Gay C.C., Hinchcliff K.W. & Constable P.D. (Eds), Veterinary Medicine. 10th ed. Saunders Elsevier, Edinburgh.).
A infecção dos bovinos ocorre principalmente por via aerógena (Nugent 2011Morés N., Ventura L., Dutra V., Silva V.S., Junior W.B., Oliveira S.O., Kramer B. & Neto J.S.F. 2007. Linfadenite granulomatosa em suínos: linfonodos afetados e diagnóstico patológico da infecção causada por agentes do Complexo Mycobacterium avium. Pesq. Vet. Bras. 27:13-17.) com instalação do agente em vias aéreas, em macrófagos alveolares e de linfonodos relacionados (Caswell & Williams 2007Caswell J.L. & Williams K.J. 2007. Respiratory system, p.523-653. In: Maxie M.G. (Ed.), Jubb, Kennedy and Palmer's Pathology of Domestic Animals. Vol.2. 5th ed. Elsevier, Edinburgh., Beytut 2011Beytut E. 2011. Immunohistochemical evaluation of surfactant proteins and lymphocyte phenotypes in the lungs of cattle with natural tuberculosis. Res. Vet. Sci. 91:119-124., Velázquez, Cortés & Pabello 2011Velázquez U.C., Cortés E.A. & Pabello J.A.G. 2011. Alternative activation modifies macrophage resistance to Mycobacterium bovis. Vet. Microbiol. 151:51-59.). A tuberculose bovina é caracterizada pela formação de granulomas, conhecidos como tubérculos (Cousins et al. 2004Cousins D.V., Huchzermeyer H.F.K.A., Griffin J.F.T., Brückner G.K., Van Rensburg I.B.J. & Kriek N.P.J. 2004. Tuberculosis, p.1973-1993. In: Coetzer J.A.W. & Tustin R.C. (Eds), Infectious Diseases of Livestock. Vol.3. 2nd ed. Oxford University Press, Cape Town.), caracterizados por lesões circunscritas, muitas vezes encapsuladas, de 0,1 a 4,0 cm de diâmetro, amarelo-pálidas ou brancacentas e frequente aspecto caseoso e/ou mineralizado, embora lesões extensas possam conter exsudato pastoso ou liquefeito. As lesões podem ocorrer nos pulmões e são frequentes nos linfonodos relacionados ao sistema respiratório, principalmente retrofaríngeos, bron-quiais e mediastínicos. Em algumas circunstâncias, ocorrem inúmeros focos disseminados a partir da liberação de BAAR na circulação sanguínea, caracterizando tuberculose miliar (Caswell & Williams 2007Caswell J.L. & Williams K.J. 2007. Respiratory system, p.523-653. In: Maxie M.G. (Ed.), Jubb, Kennedy and Palmer's Pathology of Domestic Animals. Vol.2. 5th ed. Elsevier, Edinburgh.). A infecção também pode ocorrer por ingestão do agente em pastagens e uso de bebedouros e cochos coletivos contaminados por animais infectados. Nesses casos as lesões ocorrem mais comumente em intestino e linfonodos relacionados, principalmente mesentéricos. Os sinais clínicos da doença e a distribuição das lesões dependem do modo de transmissão (Caswell & Williams 2007Caswell J.L. & Williams K.J. 2007. Respiratory system, p.523-653. In: Maxie M.G. (Ed.), Jubb, Kennedy and Palmer's Pathology of Domestic Animals. Vol.2. 5th ed. Elsevier, Edinburgh., Radostits et al. 2007Palmer M.V., Waters W.R. & Thacker T.C. 2007. Lesion development and immunohistochemical changes in granulomas from cattle experimentally infected with Mycobacterium bovis. Vet. Pathol. 44:863-874.). As micobacterioses, diferentes da tuberculose, são associadas a micobactérias não tuberculosas ou atípicas, pertencentes ao Complexo Mycobacterium avium (MAC) (Cousins et al. 2004Cousins D.V., Huchzermeyer H.F.K.A., Griffin J.F.T., Brückner G.K., Van Rensburg I.B.J. & Kriek N.P.J. 2004. Tuberculosis, p.1973-1993. In: Coetzer J.A.W. & Tustin R.C. (Eds), Infectious Diseases of Livestock. Vol.3. 2nd ed. Oxford University Press, Cape Town.). O MAC é composto por patógenos oportunistas (Hibiya et al. 2010Hibiya K., Kazumi Y., Nishiuchi Y., Sugawara I., Miyagi K., Oda Y., Oda E. & Fujita J. 2010. Descriptive analysis of the prevalence and the molecular epidemiology of Mycobacterium avium complex-infected pigs that were slaughtered on the main island of Okinawa. Comp. Immunol. Microbiol. Infect. Dis. 33:401-421.), presentes em elevado número de espécies animais e em humanos (Ingen et al. 2010Ingen J.V., Wisselink H.J., Solt-Smits C.B.V., Boeree M.J. & Soolingen D.V. 2010. Isolation of mycobacteria other than Mycobacterium avium from porcine limph nodes. Vet. Microbiol. 144:250-253.). Nestes, a infecção por essas bactérias atípicas ocorre principalmente em indivíduos imunodeprimidos; M. avium subsp. avium é causa de infecção especialmente em pacientes infectados pelo vírus da imunodeficiência humana (HIV) (McAdam & Sharpe 2010McAdam A.J. & Sharpe A.H. 2010. Doenças infecciosas, p.331-405. In: Kumar V., Abbas A.K., Fausto N., Aster J.C. (Eds), Robbins and Cotran, Bases Patológicas das Doenças (Tradução da 8ª ed., com adaptações referentes às doenças tropicais e sua epidemiologia). 8th ed. Elsevier, Rio de Janeiro.). Devido à característica zoonótica, as micobacterioses têm sido consideradas como problema veterinário e sócio-econômico (Stepanova et al. 2011Sobestiansky J. & Barcellos D. 2007. Doenças dos Suínos. Cânone Editorial, Goiânia, p.148-153.).
Nos animais domésticos, as micobacterioses têm maior importância em suínos, nos quais são mundialmente relacionadas ao MAC. Trabalhos mostram frequência elevada de isolamento de M. avium em tecidos de suínos abatidos (Hibiya et al. 2010Hibiya K., Kazumi Y., Nishiuchi Y., Sugawara I., Miyagi K., Oda Y., Oda E. & Fujita J. 2010. Descriptive analysis of the prevalence and the molecular epidemiology of Mycobacterium avium complex-infected pigs that were slaughtered on the main island of Okinawa. Comp. Immunol. Microbiol. Infect. Dis. 33:401-421., Ingen et al. 2010Ingen J.V., Wisselink H.J., Solt-Smits C.B.V., Boeree M.J. & Soolingen D.V. 2010. Isolation of mycobacteria other than Mycobacterium avium from porcine limph nodes. Vet. Microbiol. 144:250-253.). No Brasil o MAC é considerado o mais importante grupo de bactérias envolvido em infecções desse tipo em suínos. Num estudo para verificação dos agentes encontrados em linfonodos suínos, M. avium foi o mais frequente (Lara et al. 2011Lara G.H.B., Ribeiro M.G., Leite C.Q.F., Paes A.C., Guazzelli A., Silva A.V., Santos A.C.B. & Listoni F.J.P. 2011. Occurrence of Mycobacterium spp. and other pathogens in lymphnodes of slaughtered swine and wild boars (Sus scrofa). Res. Vet. Sci. 90:185-188.). Em outro estudo foram isoladas micobactérias do MAC em 28,42% das amostras colhidas de 394 suínos abatidos com lesões granulomatosas (Morés et al. 2007Morés N., Ventura L., Dutra V., Silva V.S., Junior W.B., Oliveira S.O., Kramer B. & Neto J.S.F. 2007. Linfadenite granulomatosa em suínos: linfonodos afetados e diagnóstico patológico da infecção causada por agentes do Complexo Mycobacterium avium. Pesq. Vet. Bras. 27:13-17.).
O trato gastrintestinal é a rota preferencial para a infecção por MAC em suínos (Hibiya et al. 2008Hibiya K., Kasumi Y., Sugawara I. & Fujita J. 2008. Histopathological classification of systemic Mycobacterium avium complex infections in slaughtered domestic pigs. Comp. Immunol. Microbiol. Infect. Dis. 31:347-366.). Após a ingestão, o microrganismo invade a mucosa do sistema digestório e atinge linfonodos regionais, principalmente cefálicos e mesentéricos. Nos linfonodos os bacilos são fagocitados por macrófagos e induzem lesões (Sobestiansky & Barcellos 2007Schiller I., Raywaters W., Vordermeier H.M., Jemmi T., Welsh M., Keck N., Whelan A., Gormley E., Boschiroli M.L., Moyen J.L., Vela C., Cagiola M., Buddle B.M., Palmer M., Thacker T. & Oesch B. 2011. Bovine tuberculosis in Europe from the perspective of an officially tuberculosis free country: trade, surveillance and diagnostics. Vet. Microbiol. 151:153-159.). Morés et al. (2007)Morés N., Ventura L., Dutra V., Silva V.S., Junior W.B., Oliveira S.O., Kramer B. & Neto J.S.F. 2007. Linfadenite granulomatosa em suínos: linfonodos afetados e diagnóstico patológico da infecção causada por agentes do Complexo Mycobacterium avium. Pesq. Vet. Bras. 27:13-17. encontraram lesões em linfonodos da cadeia alimentar em 95,2% das carcaças analisadas. Essas lesões se caracterizam como granulomas em linfonodos aumentados de volume, com nódulos pequenos até lesões de dimensões variáveis, branco-amareladas, caseosas, às vezes mineralizadas (Matlova et al. 2005Matlova L., Dvorska L., Ayele W.Y., Bartos M., Amemori T. & Pavlik I. 2005. Distribution of Mycobacterium avium Complexes isolates in tissue samples of pigs fed peat naturally contaminated with Mycobacteria as a supplement. J. Clin. Microbiol. 43:1261-1268., Thoen 2006Thakur A., Sharma M., Katoch V.C., Dhar P. & Katoch R.C. 2011. Detection of Mycobacterium bovis and Mycobacterium tuberculosis from cattle: Possible public health relevance. Indian J. Microbiol. 5:289-291.). No entanto, pode ocorrer infecção sistêmica, com lesões em órgãos como fígado, pulmões e baço (Iwakiri et al. 2001Iwakiri A., Toshimasu M., Xu D.L., Shinjo T. & Goto Y. 2001. Lymphoproliferative responses in pigs infected with Mycobacterium avium. J. Vet. Med. Sci. 63:827-829., Matlova et al. 2005Matlova L., Dvorska L., Ayele W.Y., Bartos M., Amemori T. & Pavlik I. 2005. Distribution of Mycobacterium avium Complexes isolates in tissue samples of pigs fed peat naturally contaminated with Mycobacteria as a supplement. J. Clin. Microbiol. 43:1261-1268., Hibiya et al. 2008Hibiya K., Kasumi Y., Sugawara I. & Fujita J. 2008. Histopathological classification of systemic Mycobacterium avium complex infections in slaughtered domestic pigs. Comp. Immunol. Microbiol. Infect. Dis. 31:347-366., Ingen et al. 2010Ingen J.V., Wisselink H.J., Solt-Smits C.B.V., Boeree M.J. & Soolingen D.V. 2010. Isolation of mycobacteria other than Mycobacterium avium from porcine limph nodes. Vet. Microbiol. 144:250-253.).
A resposta à infecção por micobactérias varia muito entre espécies animais, com variação menor entre indivíduos de uma mesma espécie (Cousins et al. 2004Cousins D.V., Huchzermeyer H.F.K.A., Griffin J.F.T., Brückner G.K., Van Rensburg I.B.J. & Kriek N.P.J. 2004. Tuberculosis, p.1973-1993. In: Coetzer J.A.W. & Tustin R.C. (Eds), Infectious Diseases of Livestock. Vol.3. 2nd ed. Oxford University Press, Cape Town.). O objetivo deste trabalho é diferenciar histologicamente as lesões causadas por micobactérias em bovinos e suínos e caracterizar seu infiltrado inflamatório, com auxílio de técnicas histoquímicas e da imuno-histoquímica (IHQ).
Material e Métodos
Foram avaliados casos diagnosticados como tuberculose em bovinos e como linfadenite granulomatosa em suínos da rotina de diagnóstico (necropsias e histopatologia) do Setor de Patologia Veterinária da Universidade Federal do Rio Grande do Sul (SPV-UFRGS), no período de janeiro de 2007 a dezembro de 2011. Dados referentes a raça, sexo, idade, histórico clínico e achados macroscópicos foram compilados dos livros de registro. Os cortes de linfonodo e pulmão corados com Hematoxilina-Eosina (HE) foram avaliados e realizadas as técnicas histoquímicas de Ziehl-Neelsen (ZN) para a identificação de BAAR nas lesões em linfonodos e/ou pulmões e de Tricrômico de Masson (TM) para evidenciação de tecido conjuntivo fibroso (TCF).
A técnica de IHQ foi utilizada em 15/60 (25%) casos dos bovinos e em 15/57 (26,31%) dos casos de suínos, selecionados aleatoriamente, para a caracterização do infiltrado inflamatório linfocítico nas lesões. Para a marcação de linfócitos T foi utilizado o anticorpo anti-CD3 e, para a marcação de linfócitos B, o anticorpo anti-CD79αcy. Para a marcação de macrófagos foi usado o anticorpo anti-CD68 nos casos de bovinos e anti-Lisozima para os suínos. Para a marcação de bactérias do gênero Mycobacterium foram empregados os anticorpos anti-Mycobacterium tuberculosis e anti-Mycobacterium avium. As especificações dos anticorpos primários usados, a recuperação antigênica, a diluição e a origem dos anticorpos são detalhadas no Quadro 1. Utilizaram-se o método estreptavidina ligada à peroxidase e o cromógeno DAB (Dako, code K3468) para os anticorpos anti-CD68, anti-lisozima e anti-Mycobacterium tuberculosis; o mesmo método foi utilizado para o anticorpo anti-Mycobacterium avium, empregando-se, no entanto, o cromógeno AEC (Dako, code K3464); e foi usado o método da estreptavidina ligada à fosfatase alcalina e o cromógeno Permanent Red (Dako, code K0695) para os anticorpos anti-CD3 e anti-CD79αcy.
O infiltrado linfocítico foi classificado de acordo com a marcação para linfócitos T ou B. Foram avaliados subjetivamente cinco campos microscópicos em cada técnica e em cada caso, em objetiva de 40x e atribuídos valores de 1 a 4 conforme a quantidade de células com marcação positiva, sendo considerados os valores 1 (até 25% da população linfocítica com imunomarcação positiva); 2 (25 a 50%); 3 (50 a 75%) e 4 (75 a 100%) e calculada a média dos cinco campos para cada caso. Esses valores foram submetidos à análise estatística pelo Teste t pareado.
Resultados
Sessenta casos de tuberculose em bovinos e 57 casos de linfadenite granulomatosa em suínos diagnosticados no período janeiro de 2007 a dezembro de 2011 foram avaliados. Quanto ao sexo dos bovinos, 45/60 eram fêmeas, 12 machos e, em três casos, o sexo não foi informado. A raça, informada em 41/60 casos, variou entre Holandesa (35), zebuína (2), Jersey (1) e mista (3). Com relação à origem das amostras, 32/60 casos provinham de propriedades rurais particulares e 27 casos de abatedouro/frigorífico e, em um caso, a origem não foi identificada. A idade dos bovinos variou de três a 20 anos. Dos órgãos acometidos, 40/60 animais apresentaram lesão apenas em linfonodo, oito apenas em pulmão e 12 em ambos.
Os achados histológicos nas amostras de bovinos se caracterizaram por lesões multifocais a coalescentes até extensas áreas de necrose caseosa, compostas por material eosinofílico homogêneo, núcleos e restos nucleares (cariorrexia) escassos, com graus variados de mineralização multifocal, ausente em alguns casos. Adjacente à necrose havia inflamação granulomatosa com macrófagos epitelioides abundantes, células gigantes multinucleadas do tipo Langhans e linfócitos escassos a abundantes (Fig.1A). Havia proliferação discreta a acentuada de tecido conjuntivo fibroso, evidenciado pela coloração de TM, circundando o infiltrado inflamatório ou, em alguns casos, entremeado nele (Fig.2A). Bacilos álcool-ácido resistentes foram demonstrados pela coloração de ZN em todos os casos. Eram escassos, localizados no interior de células gigantes ou estavam livres na área de necrose (Fig.3A).
Caracterização de lesões causadas por Mycobacterium spp. em bovinos e suínos. (A) Inflamação granulomatosa acentuada com macrófagos epitelioides, abundantes células gigantes multinucleadas e focos de necrose caseosa em linfonodo bovino (B) Extensa área de necrose caseosa contendo mineralização multifocal cercada por inflamação granulomatosa, circundadas por abundante tecido conjuntivo fibroso em linfonodo suíno. HE, obj.10x.
Caracterização de lesões por Mycobacterium spp. em bovinos e suínos. Lesão em linfonodo bovino (A) e suíno (B) evidenciando, em azul, extensa proliferação de tecido conjuntivo fibroso. Tricrômico de Masson, obj.10x.
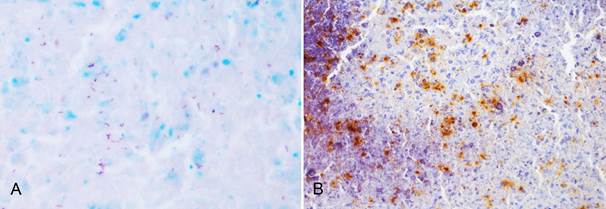
Caracterização de lesões por Mycobacterium spp. em bovinos e suínos. Bacilos álcool-ácido resistentes (setas) no citoplasma de célula gigante em lesão de linfonodo bovino com tuberculose. (A) Ziehl-Neelsen, obj.40x. (B) Imunomarcação anti-Mycobacterium tuberculosis. Método estreptavidina ligada à peroxidase, cromógeno DAB, obj.40x.
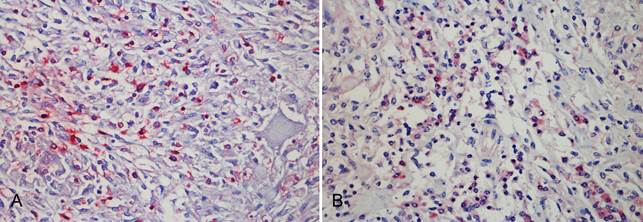
No uso da IHQ para evidenciação de linfócitos T e linfócitos B em amostras de bovinos predominou a imunomarcação de linfócitos T (Fig.6), com diferença significativa entre as médias de linfócitos T e B. Na análise estatística, para a qual foi usado o Teste t pareado, os resultados foram t=5,501 (p<0.001) para as lesões dos bovinos e t=5,826 (p <0,001) para as lesões dos suínos. Houve imunomarcação anti-CD68 em todos os casos. No emprego do anticorpo anti-Mycobacterium tuberculosis houve marcação citoplasmática multifocal em macrófagos epitelioides e em células gigantes tipo Langhans, confirmando a infecção por Mycobacterium sp. em todos os casos analisados (Fig.3B). Em dois casos houve marcação intensa também em áreas de necrose.
As amostras de suíno remetidas para exame anatomopatológico eram provenientes de abatedouro/frigorífico e constituídas por linfonodos mesentéricos e mandibulares de suínos machos e fêmeas com idade de 170-175 dias (exceto um animal, com aproximadamente 150 dias).
As alterações histológicas dos suínos eram constituídas por áreas de necrose caseosa, multifocais a coalescentes, ou extensas, com mineralização multifocal acentuada, circundadas por inflamação granulomatosa de intensidade variada contendo macrófagos epitelioides e escassa a moderada quantidade de células gigantes do tipo Langhans, eosinófilos e linfócitos (Fig.1B). Circundando e/ou entremeada à inflamação havia proliferação de tecido conjuntivo fibroso, formando, em alguns casos, extensas áreas de fibrose (Fig.2B). A extensão das lesões variava entre os casos, com pequenos focos até extensas áreas, em alguns casos afetando todo o linfonodo. Na coloração histoquímica de ZN foi evidenciada grande quantidade de BAAR, livres, na periferia ou amplamente distribuídos nas áreas de necrose (Fig.4A).
Caracterização de lesões por Mycobacterium spp. em bovinos e suínos. Área de necrose caseosa em linfonodo suíno; (A) Bacilos álcool-ácido resistentes corados em magenta, Ziehl-Neelsen, obj.40x. (B) Imunomarcação anti-Mycobacterium tuberculosis, método estreptavidina ligada à peroxidase, cromógeno DAB, obj.40x.
Na comparação das proporções entre linfócitos T e B nas lesões de linfadenite granulomatosa em suínos pela IHQ houve também predominância de linfócitos T, estatisticamente significativa pelo Teste t pareado (t = 5,826; p <0,001). Os linfócitos T predominaram nas lesões em todas as amostras avaliadas (Fig. 5A e 5B), exceto em dois casos; um apresentou marcação equivalente entre linfócitos T e B; e outro menor marcação de linfócitos T em relação a linfócitos B (Fig.7).
Caracterização de lesões por Mycobacterium spp. em bovinos e suínos. Imunomarcação de linfócitos T e B em lesão de tuberculose em linfonodo bovino. (A) Marcação positiva para linfócitos T (anti-CD3). (B) Marcação positiva para linfócitos B (anti-CD79αcy), evidenciando maior proporção de linfócitos T nas lesões. Método da estreptavidina ligada à fosfatase alcalina, cromógeno Permanent Red, obj.40x.
Demonstração gráfica do infiltrado linfocítico nas lesões de tuberculose em bovinos, de acordo com a marcação positiva para linfócitos T e B. Foram considerados os valores 1 (até 25% da população linfocítica com imunomarcação positiva); 2 (25-50%); 3 (50-75%) e 4 (75-100%) e calculada a média dos cinco campos para cada caso, submetidos à avaliação estatística (teste t pareado)
Demonstração gráfica do infiltrado linfocítico nas lesões de linfadenite granulomatosa em suínos, de acordo com a marcação positiva para linfócitos T e B. Foram considerados os valores 1 (até 25% da população linfocítica com imunomarcação positiva); 2 (25-50%); 3 (50-75%) e 4 (75-100%) e calculada a média dos 5 campos para cada caso, submetidos à avaliação estatística (teste t pareado).
A imunomarcação com o anticorpo policlonal anti-Mycobacterium tuberculosis foi positiva em todas as amostras (Fig. 3B e 4B). Houve marcação evidente em áreas de necrose e adjacentes, áreas nas quais foram também demonstrados bacilos com a coloração de ZN. O uso do anticorpo anti-Lisozima marcou abundantes quantidades de macrófagos epitelioides, células gigantes multinucleadas e macrófagos nos tecidos suínos, mas outras células inflamatórias, como neutrófilos, também mostraram marcação positiva. Os materiais dos suínos foram submetidos à IHQ anti-Mycobacterium avium, com marcação em focos de necrose e, principalmente, em sua periferia.
Discussão e Conclusões
As alterações histológicas induzidas por bactérias do gênero Mycobacterium apresentaram semelhanças entre as lesões de bovinos e suínos, no entanto, algumas diferenças foram significativas. Células gigantes multinucleadas do tipo Langhans foram abundantes nas lesões de bovinos enquanto que, em suínos, predominaram macrófagos epitelioides. Em várias amostras dos suínos com linfadenite havia infiltrado de eosinófilos, não observado nos bovinos. Hibiya et al. (2008)Hibiya K., Kasumi Y., Sugawara I. & Fujita J. 2008. Histopathological classification of systemic Mycobacterium avium complex infections in slaughtered domestic pigs. Comp. Immunol. Microbiol. Infect. Dis. 31:347-366. observaram também maior frequência de eosinófilos em infecções por MAC em suínos que em outras espécies.
Foram encontradas quantidades variadas de TCF nas lesões; escasso, entremeado à inflamação, até abundante, circundando os granulomas. Segundo Caswell & Williams (2007)Caswell J.L. & Williams K.J. 2007. Respiratory system, p.523-653. In: Maxie M.G. (Ed.), Jubb, Kennedy and Palmer's Pathology of Domestic Animals. Vol.2. 5th ed. Elsevier, Edinburgh., as características histológicas e a variação nas proporções dos componentes celulares das lesões permitem uma noção acerca do tempo de evolução da doença. Cassidy et al. (1999)Cassidy J.P., Bryson D.G., Pollock J.M., Evans R.T., Forster F. & Neill S.D. 1999. Lesions in cattle exposed to Mycobacteriumbovis-inoculated calves. J. Comp. Pathol. 121:321-337. observaram, em infecção experimental de bovinos com M. bovis, lesões pulmonares compostas por aglomerados de macrófagos intra-alveolares, neutrófilos necróticos, células gigantes multinucleadas, poucos linfócitos e BAAR uma semana após inoculação e, após duas semanas da infecção, havia tubérculos contendo agregados de neutrófilos circundados por macrófagos epitelioides. É descrito que necrose central aparece cerca de três semanas após infecção; mineralização inicia por volta de cinco semanas; e o TCF aumenta com o tempo, tendendo a ser mais proeminente em indivíduos e espécies mais resistentes (Caswell & Williams 2007Caswell J.L. & Williams K.J. 2007. Respiratory system, p.523-653. In: Maxie M.G. (Ed.), Jubb, Kennedy and Palmer's Pathology of Domestic Animals. Vol.2. 5th ed. Elsevier, Edinburgh.). Conforme Beytut (2011)Beytut E. 2011. Immunohistochemical evaluation of surfactant proteins and lymphocyte phenotypes in the lungs of cattle with natural tuberculosis. Res. Vet. Sci. 91:119-124., à medida que aumentam as áreas de necrose caseosa em granulomas avançados, o infiltrado linfocítico diminui e fica restrito às margens internas da cápsula fibrosa. Hibiya et al. (2008)Hibiya K., Kasumi Y., Sugawara I. & Fujita J. 2008. Histopathological classification of systemic Mycobacterium avium complex infections in slaughtered domestic pigs. Comp. Immunol. Microbiol. Infect. Dis. 31:347-366., na avaliação de lesões granulomatosas sistêmicas em órgãos de suínos abatidos, sugeriram três estágios, conforme os componentes das lesões. Lesões iniciais, caracterizadas por reação exsudativa com macrófagos epitelioides, linfócitos, eosinófilos e células gigantes do tipo Langhans, dão espaço a reações proliferativas com encapsulamento, até o aparecimento de granulomas mistos, com mineralização e fibrose abundantes. No presente estudo, alterações referentes aos três estágios descritos foram observadas nas amostras dos suínos.
Houve diferença significativa na quantidade de BAAR nas lesões. Em bovinos, bacilos foram escassos nas lesões, em alguns casos localizados principalmente no citoplasma de células gigantes e, em outros, livres nas áreas de necrose, ou ambos. Outros estudos indicam que lesões em estágios iniciais apresentam moderado a elevado número de BAAR, localizados em macrófagos e em células gigantes multinucleadas. Em estágios mais avançados, a localização passa a ser mais extracelular, em meio à necrose e, raramente, no interior de macrófagos ou células gigantes multinucleadas (Palmer et al. 2007Nugent G. 2011. Maintenance, spillover and spillback transmission of bovine tuberculosis in multi-host complexes: a New Zealand case study. Vet. Microbiol. 151:34-42., Beytut 2011Beytut E. 2011. Immunohistochemical evaluation of surfactant proteins and lymphocyte phenotypes in the lungs of cattle with natural tuberculosis. Res. Vet. Sci. 91:119-124.). Escassez de bacilos nas lesões é mais indicativa de tuberculose por M. bovis do que micobacteriose por M. avium (Caswell & Williams 2007Caswell J.L. & Williams K.J. 2007. Respiratory system, p.523-653. In: Maxie M.G. (Ed.), Jubb, Kennedy and Palmer's Pathology of Domestic Animals. Vol.2. 5th ed. Elsevier, Edinburgh.). Em dois casos de bovinos do estudo foi verificada abundante quantidade de BAAR livre e no citoplasma de macrófagos e de células gigantes multinucleadas. Houve, também nestes casos, forte marcação por IHQ anti-Mycobacterium tuberculosis; em áreas de necrose, células gigantes e em macrófagos.
Nas amostras dos suínos havia abundantes BAAR livres, em áreas de necrose ou circundando-as. Isto pode ser explicado pelo fato de infecções por MAC serem mais comuns em suínos e lesões por micobactérias atípicas apresentarem número mais elevado de microrganismos do que infecções por bacilos tuberculosos. A marcação IHQ com anticorpo anti-Mycobacterium tuberculosis foi mais evidente nas áreas de necrose, principalmente no citoplasma de macrófagos necróticos. Morés et al. (2007)Morés N., Ventura L., Dutra V., Silva V.S., Junior W.B., Oliveira S.O., Kramer B. & Neto J.S.F. 2007. Linfadenite granulomatosa em suínos: linfonodos afetados e diagnóstico patológico da infecção causada por agentes do Complexo Mycobacterium avium. Pesq. Vet. Bras. 27:13-17. tiveram achados semelhantes em testes de IHQ em lesões de suínos, utilizando anticorpo primário anti-Mycobacterium avium.
A detecção de bacilos álcool-ácido resistentes, tanto pela coloração de Ziehl-Neelsen quanto pela IHQ, mostrou-se muito útil para o diagnóstico das infecções induzidas por Mycobacterium sp., principalmente em suínos, nos quais pode ocorrer também linfadenite por bactérias Gram positivas, como na infecção por Rhodococcus equi em linfonodos cervicais, com lesões macro e microscópicas semelhantes. Komijn et al. (2007)Komijn R.E., Wisselink H.J., Rijsman V.M.C., Stockhofe-Zurwieden N., Bakker D., Zijderveld F.G., Eger T., Wagenaar J.A., Putirulan F.F. & Urlings B.A.P. 2007. Granulomatous lesions in lymph nodes of slaughter pigs bacteriologically negative for Mycobacterium avium subsp. avium and positive for Rhodococcus equi. Vet. Microbiol. 120:352-357., verificaram alta prevalência de infecções por R. equi em linfonodos mandibulares de suínos abatidos com lesões granulomatosas, sugerindo ser R. equi a maior causa de diagnóstico falso-positivo de infecções por micobactérias na inspeção de suínos abatidos. Em recente estudo realizado no Brasil, Mycobacterium sp. (24,1%) e R. equi (13,2%) foram os microrganismos mais frequentemente detectados em suínos com linfadenite (Lara et al. 2011Lara G.H.B., Ribeiro M.G., Leite C.Q.F., Paes A.C., Guazzelli A., Silva A.V., Santos A.C.B. & Listoni F.J.P. 2011. Occurrence of Mycobacterium spp. and other pathogens in lymphnodes of slaughtered swine and wild boars (Sus scrofa). Res. Vet. Sci. 90:185-188.).
A marcação IHQ anti-Mycobacterium tuberculosis se mostrou mais intensa, quantitativa e qualitativamente, em comparação com a coloração de ZN, tanto nas amostras de bovinos quanto nas de suínos, sendo indicada para a detecção de Mycobacterium sp. em lesões granulomatosas, em ambas as espécies. No entanto, a técnica de ZN mostrou ser eficiente na detecção de micobactérias em todos os casos e tem como vantagem o baixo custo.
Quanto ao infiltrado linfocítico nas lesões de tuberculose de bovinos, linfócitos T foram predominantes. Outros estudos de caracterização do perfil de linfócitos T e sua distribuição nas lesões de tuberculose bovina mostraram achados semelhantes (Liebana et al. 2007Liebana E., Marsh S., Gough J., Nunez A., Vordermeier H.M., Whelan A., Spencer Y., Hardley R.C., Hewinson G. & Johnson L. 2007. Distribution and activation of T-lymphocyte subsets in tuberculous bovine lymph-node granulomas. Vet. Pathol. 44:366-372., Palmer et al. 2007Nugent G. 2011. Maintenance, spillover and spillback transmission of bovine tuberculosis in multi-host complexes: a New Zealand case study. Vet. Microbiol. 151:34-42.). Conforme Beytut (2011)Beytut E. 2011. Immunohistochemical evaluation of surfactant proteins and lymphocyte phenotypes in the lungs of cattle with natural tuberculosis. Res. Vet. Sci. 91:119-124., linfócitos T CD3+ são abundantes na fase inicial de granulomas, quando não há, ainda, necrose central. À medida que o granuloma aumenta, os linfócitos são deslocados para a periferia e permanecem nas margens internas da cápsula fibrosa; em granulomas avançados, células T são comumente detectadas na zona marginal. Em lesões avançadas com mineralização central, o número de linfócitos T CD3+ diminui acentuadamente, com acúmulo na zona subcapsular, na periferia do granuloma. Linfócitos B são também detectados em áreas subcapsulares de granulomas avançados.
A composição do infiltrado linfocítico em lesões causadas por Mycobacterium sp. em suínos foi semelhante à dos bovinos, com predomínio de linfócitos T. A imunidade em infecções por micobactérias é essencialmente mediada por células e dependente de uma complexa interação entre linfócitos T e macrófagos. As características estruturais de Mycobacterium sp. são responsáveis pela indução desse tipo de resposta imune (Caswell & Williams 2007Caswell J.L. & Williams K.J. 2007. Respiratory system, p.523-653. In: Maxie M.G. (Ed.), Jubb, Kennedy and Palmer's Pathology of Domestic Animals. Vol.2. 5th ed. Elsevier, Edinburgh., Liebana et al. 2007Liebana E., Marsh S., Gough J., Nunez A., Vordermeier H.M., Whelan A., Spencer Y., Hardley R.C., Hewinson G. & Johnson L. 2007. Distribution and activation of T-lymphocyte subsets in tuberculous bovine lymph-node granulomas. Vet. Pathol. 44:366-372., Velázquez et al. 2011Velázquez U.C., Cortés E.A. & Pabello J.A.G. 2011. Alternative activation modifies macrophage resistance to Mycobacterium bovis. Vet. Microbiol. 151:51-59.).
O perfil do infiltrado linfocítico, com predomínio de células T, ainda não havia sido caracterizado em infecções por Mycobacterium sp. em suínos, para o qual a IHQ foi uma ferramenta importante.
Agradecimentos
À equipe do Núcleo de Assessoria Estatística NAE/UFTRGS pela análise estatística, ao CNPq e à CAPES, pela concessão de Bolsas e aos colegas do Setor de Patologia Veterinária da UFRGS pela ajuda neste trabalho.
- Beytut E. 2011. Immunohistochemical evaluation of surfactant proteins and lymphocyte phenotypes in the lungs of cattle with natural tuberculosis. Res. Vet. Sci. 91:119-124.
- Cassidy J.P., Bryson D.G., Pollock J.M., Evans R.T., Forster F. & Neill S.D. 1999. Lesions in cattle exposed to Mycobacteriumbovis-inoculated calves. J. Comp. Pathol. 121:321-337.
- Caswell J.L. & Williams K.J. 2007. Respiratory system, p.523-653. In: Maxie M.G. (Ed.), Jubb, Kennedy and Palmer's Pathology of Domestic Animals. Vol.2. 5th ed. Elsevier, Edinburgh.
- Cousins D.V., Huchzermeyer H.F.K.A., Griffin J.F.T., Brückner G.K., Van Rensburg I.B.J. & Kriek N.P.J. 2004. Tuberculosis, p.1973-1993. In: Coetzer J.A.W. & Tustin R.C. (Eds), Infectious Diseases of Livestock. Vol.3. 2nd ed. Oxford University Press, Cape Town.
- Hibiya K., Kasumi Y., Sugawara I. & Fujita J. 2008. Histopathological classification of systemic Mycobacterium avium complex infections in slaughtered domestic pigs. Comp. Immunol. Microbiol. Infect. Dis. 31:347-366.
- Hibiya K., Kazumi Y., Nishiuchi Y., Sugawara I., Miyagi K., Oda Y., Oda E. & Fujita J. 2010. Descriptive analysis of the prevalence and the molecular epidemiology of Mycobacterium avium complex-infected pigs that were slaughtered on the main island of Okinawa. Comp. Immunol. Microbiol. Infect. Dis. 33:401-421.
- Ingen J.V., Wisselink H.J., Solt-Smits C.B.V., Boeree M.J. & Soolingen D.V. 2010. Isolation of mycobacteria other than Mycobacterium avium from porcine limph nodes. Vet. Microbiol. 144:250-253.
- Iwakiri A., Toshimasu M., Xu D.L., Shinjo T. & Goto Y. 2001. Lymphoproliferative responses in pigs infected with Mycobacterium avium. J. Vet. Med. Sci. 63:827-829.
- Komijn R.E., Wisselink H.J., Rijsman V.M.C., Stockhofe-Zurwieden N., Bakker D., Zijderveld F.G., Eger T., Wagenaar J.A., Putirulan F.F. & Urlings B.A.P. 2007. Granulomatous lesions in lymph nodes of slaughter pigs bacteriologically negative for Mycobacterium avium subsp. avium and positive for Rhodococcus equi. Vet. Microbiol. 120:352-357.
- Lara G.H.B., Ribeiro M.G., Leite C.Q.F., Paes A.C., Guazzelli A., Silva A.V., Santos A.C.B. & Listoni F.J.P. 2011. Occurrence of Mycobacterium spp. and other pathogens in lymphnodes of slaughtered swine and wild boars (Sus scrofa). Res. Vet. Sci. 90:185-188.
- Liebana E., Marsh S., Gough J., Nunez A., Vordermeier H.M., Whelan A., Spencer Y., Hardley R.C., Hewinson G. & Johnson L. 2007. Distribution and activation of T-lymphocyte subsets in tuberculous bovine lymph-node granulomas. Vet. Pathol. 44:366-372.
- Matlova L., Dvorska L., Ayele W.Y., Bartos M., Amemori T. & Pavlik I. 2005. Distribution of Mycobacterium avium Complexes isolates in tissue samples of pigs fed peat naturally contaminated with Mycobacteria as a supplement. J. Clin. Microbiol. 43:1261-1268.
- McAdam A.J. & Sharpe A.H. 2010. Doenças infecciosas, p.331-405. In: Kumar V., Abbas A.K., Fausto N., Aster J.C. (Eds), Robbins and Cotran, Bases Patológicas das Doenças (Tradução da 8ª ed., com adaptações referentes às doenças tropicais e sua epidemiologia). 8th ed. Elsevier, Rio de Janeiro.
- Morés N., Ventura L., Dutra V., Silva V.S., Junior W.B., Oliveira S.O., Kramer B. & Neto J.S.F. 2007. Linfadenite granulomatosa em suínos: linfonodos afetados e diagnóstico patológico da infecção causada por agentes do Complexo Mycobacterium avium. Pesq. Vet. Bras. 27:13-17.
- Nugent G. 2011. Maintenance, spillover and spillback transmission of bovine tuberculosis in multi-host complexes: a New Zealand case study. Vet. Microbiol. 151:34-42.
- Palmer M.V., Waters W.R. & Thacker T.C. 2007. Lesion development and immunohistochemical changes in granulomas from cattle experimentally infected with Mycobacterium bovis. Vet. Pathol. 44:863-874.
- Radostits O.M., Gay C.C., Hinchcliff K.W. & Constable P.D. 2007. Diseases associated with bacteria - IV, p.1007-1017. In: Radostits O.M., Gay C.C., Hinchcliff K.W. & Constable P.D. (Eds), Veterinary Medicine. 10th ed. Saunders Elsevier, Edinburgh.
- Schiller I., Raywaters W., Vordermeier H.M., Jemmi T., Welsh M., Keck N., Whelan A., Gormley E., Boschiroli M.L., Moyen J.L., Vela C., Cagiola M., Buddle B.M., Palmer M., Thacker T. & Oesch B. 2011. Bovine tuberculosis in Europe from the perspective of an officially tuberculosis free country: trade, surveillance and diagnostics. Vet. Microbiol. 151:153-159.
- Sobestiansky J. & Barcellos D. 2007. Doenças dos Suínos. Cânone Editorial, Goiânia, p.148-153.
- Stepanova H., Pavlova B., Stromerova N., Matiasovic J., Kaevska M., Pavlik I.& Faldyna M. 2011. Cell-mediated immune response in swine infected with Mycobacterium avium subsp. avium. Vet. Immunol Immunopathol. 142:107-112.
- Thakur A., Sharma M., Katoch V.C., Dhar P. & Katoch R.C. 2011. Detection of Mycobacterium bovis and Mycobacterium tuberculosis from cattle: Possible public health relevance. Indian J. Microbiol. 5:289-291.
- Thoen C.O. 2006. Tuberculosis, p.807-816. In: Straw B.E., Zimmerman J.J., D'Allaire S. & Taylor D.J. (Eds), Diseases of Swine. 9th ed. Blackwell Publishing, Victoria.
- Velázquez U.C., Cortés E.A. & Pabello J.A.G. 2011. Alternative activation modifies macrophage resistance to Mycobacterium bovis. Vet. Microbiol. 151:51-59.
Datas de Publicação
-
Publicação nesta coleção
Fev 2015
Histórico
-
Recebido
24 Jul 2014 -
Aceito
13 Fev 2015