Resumos
O objetivo deste estudo foi monitorar o ciclo estral em cutias (Dasyprocta leporina) criadas em cativeiro no semiárido brasileiro. Durante 70 dias, cinco cutias foram diariamente submetidas a citologia esfoliativa vaginal, e o monitoramento ultrassonográfico ovariano foi realizado a cada três dias. Um total de 8 ciclos estrais foi completamente monitorado, com duração de 28,2±0,7 dias, variando de 24 a 31 dias. Pela citologia esfoliativa vaginal, houve uma predominância de células superficiais nas fases de proestro e estro (P<0,05), seguida da predominância de células intermediárias no metaestro (P<0,05) e de células parabasais no diestro (P<0,05). Por ultrassonografia, não houve diferenças na morfologia ovariana durante as diferentes fases do ciclo estral (P>0,05). Os folículos foram identificados durante as fases estrogênicas (proestro e estro), com diâmetro médio de 1±0,5mm. Em apenas 12,5% das fases luteais, corpos lúteos medindo 1,4±0,9mm foram identificados. Conclui-se que a associação da citologia vaginal e da ultrassonografia ovariana constitui uma alternativa viável para o monitoramento de ciclos estrais e identificação das fases estrogênicas em cutias da espécie Dasyprocta leporina
Dasyprocta leporina; roedores; colpocitologia; ecografia ovariana
The objective of the study was to monitor the estrous cycle in agoutis (Dasyprocta leporina) bred in captivity in Brazilian semiarid. During 70 days, five agoutis were daily subjected to vaginal exfoliative cytology, and the ovarian ultrasound monitoring was conducted every three days. A total of 8 estrous cycles were completely monitored, lasting 28.2±0.7 days, ranging from 24 to 31 days. By vaginal exfoliative cytology, there was predominance of superficial cells at proestrus and estrus phases (P<0.05), followed by the predominance of intermediate cells in the metestrus (P<0.05) and parabasal cells in diestrus (P<0.05). By ultrasound, there were no differences in ovarian morphology during the different phases of the estrous cycle (P>0.05). Follicles during the estrogenic phases (proestrus and estrus) were identified, with an average diameter of 1±0.5mm. In only 12.5% of luteal phases, corpora lutea measuring 1.4±0.9mm were identified. We conclude that the association of vaginal cytology and ovarian ultrasonography is a useful alternative for monitoring the estrous cycle and identifying the estrogenic phases in Dasyprocta leporina
Dasyprocta leporine; rodents; colpocytology; ovarian echography
Introdução
As cutias (Dasyprocta sp.) são roedores utilizadas frequentemente como fonte de alimento e extração de sua pele, couro e pelos por populações humanas (Lopes et al. 2004Lopes J.B., Cavalcante R.R., Almeida M.M., Carvalho M.A.M., Moura S.G., Dantas Filho L.A. & Conceição W.L.F. 2004. Desempenho de cutias (Dasyprocta prymnolopha) criadas em cativeiro do nascimento até o desmame em Teresina, Piauí. Revta Bras. Zootec. 33(6):2318-2322.). No semiárido nordestino, esses animais são bem adaptados às características climáticas (Ribeiro et al. 2008Ribeiro E.E.A., Batista M.C.S., Carvalho M.A.M.& Silva J.A.L. 2008. Níveis iônicos e enzimáticos de cutias (Dasyprocta sp.) hígidas, criadas em cativeiro, influência do sexo e da idade. Arq. Bras. Med. Vet. Zootec. 60(3):651-655.), assim, apresentam um grande potencial zootécnico, devendo-se, para tanto, direcionar um maior fluxo de pesquisas, no intuito de garantir sua conservação (Souza et al. 2003Souza P.C., Ramos R.S.L., Guimarães D.A. A., Ferreira A.C.S., Bastos L.V., Batista C.R. & Ohashi O.M.2003. Determinação da população folicular em cutias (Dasyprocta sp.) criadas em cativeiro. Revta Bras. Reprod. Anim. 27(2):286-287.) e a formação de criatórios com fins comerciais (Bonaudo et al. 2005Bonaudo T., Le Pendu Y., Faure J.F. & Quantz D. 2005. The effects of deforestation on wildlife along the transamazon highway. Eur. J. Wildl. Res. 51(3):199-206.). Nos últimos anos, diversos conhecimentos têm sido gerados no tocante à biologia reprodutiva das cutias, como a caracterização morfológica dos ovários (Almeida et al. 2003Almeida M.M., Carvalho M.A.M., Cavalcante Filho M.F., Miglino M.A. & Menezes D.J.A. 2003. Estudo morfológico e morfométrico do ovário de cutias (Dasyprocta aguti Linnaeus, 1766). Braz. J. Vet. Res. Anim. Sci. 40(1):55-62.), tubas uterinas (Fortes et al. 2005Fortes E.A.M., Carvalho M.A.M., Almeida M.M., Conde Júnior A.M., Cruz N.E.A. & Assis Neto A.C. 2005. Aspectos morfológicos da tuba uterina de cutias (Dasyprocta aguti, Mammalia: Rodentia). Braz. J. Vet. Res. Anim. Sci.42(2):135-142.), placentação (Rodrigues et al. 2003Rodrigues R.F., Miglino M.A., Ferraz R.H.S. & Morais-Pinto L. 2003. Placentação em cutias (Dasyprocta aguti, Carleton M.D.): aspectos morfológicos. Braz. J. Vet. Res. Anim. Sci.2(40):133-137.) e criopreservação de folículos pré-antrais (Wanderley et al. 2012Wanderley L.S., Machado Luz H.K., Faustino L.R., Lima I.M.T., Lopes C.A.P., Silva A.R., Báo S.N., Campello C.C., Rodrigues A.P.R. & De Figueiredo J.R. 2012. Ultrastructural features of agouti (Dasyprocta aguti) preantral follicles cryopreserved using dimethyl sulfoxide, ethylene glycol and propanediol. Theriogenology77(2):260-267.) em D. leporina, bem como o diagnóstico de gestação por ultrassonografia em D. prymnolopha (Sousa et al. 2012Sousa F.C.A., Alves F.R., Fortes E.A.M., Ferraz M.S., Machado Júnior A.A.N., Menezes D.J.A.& Carvalho M.A.M.2012. Pregnancy in Hystricomorpha: gestational age and embryonic fetal development of agouti (Dasyprocta prymnolopha Wagler, 1831) estimated by ultrasonography. Theriogenology78(6):1278-1285.). Das 11 diferentes espécies de cutias catalogadas, genericamente conhecidas como D. aguti, apenas sete habitam o território brasileiro (Woods & Kilpatrick 2005Woods C.A. & Kilpatrick C.W. 2005. Infraorder Hystricognathi, p.1538-1600. In: Wilson D.E. & Reeder D.M. (Eds), Mammal Species of the World: a taxonomic and geographic reference. Vol.2. 3rd ed. John Hopkins University Press, Baltimore.), no entanto, diferentes aspectos reprodutivos entre as diferentes espécies permanecem não elucidados.
O ciclo estral de cutias (Dasyprocta aguti) foi primeiramente estudado por Weir et al. (1971)Weir B. 1971. Some observations on reproduction in the female agouti, Dasyprocta aguti. J. Reprod. Fertil.24(2):203-211., através de observações da genitália externa, verificando-se que apresenta ciclo do tipo poliéstrico contínuo, com duração média de 34,2 dias. Posteriormente, Guimarães et al. (1997)Guimarães D.A., Moreira D. & Vale W.G.1997. Determinação do ciclo reprodutivo da cutia (Dasyprocta prymnolopha) através do diagnóstico colpocitológico. Acta Amazonica 27(1):55-64. realizaram análises colpocitológicas para descrever as características do ciclo estral em Dasyprocta prymnolopha. De fato, sabe-se que as mudanças citológicas vaginais refletem os eventos endócrinos associados aos ciclos reprodutivos em algumas espécies mamíferas, podendo esta técnica ser utilizada com eficiência para predizer o seu período fértil (Moxon et al. 2010Moxon R., Copler D. & England G.C.W. 2010. Quality assurance of canine vaginal cytology: a preliminary study. Theriogenology74(3):479-485.).
Nos últimos anos, o uso da ultrassonografia em tempo real tem despontado como uma importante ferramenta para o estudo da dinâmica ovariana durante o ciclo estral em inúmeros mamíferos (Maia et al. 2014Maia K.M., Peixoto G.C.X., Campos L.B., Bezerra J.A.B., Ricarte A.R.F., Moreira N., Oliveira M.F. & Silva A.R. 2014. Estrus cycle monitoring of captive collared peccaries (Pecari tajacu) in semiarid conditions. Pesq. Vet. Bras. 34(11):1115-1120.), possibilitando inclusive, a identificação do estro (Griffin & Ginther 1992Griffin P.G. & Ginther O. J. 1992. Research applications of ultrasonic imaging in reproductive biology. J. Anim. Sci. 70(3):953-972.). Em roedores silvestres, estudos relacionados à aplicação da técnica de ultrassonografia à reprodução são escassos. Existem apenas relatos da sua utilização para estimar a previsão do parto em pacas (Agouti paca) (Oliveira et al.2003Oliveira F.S., Machado M.R.F. & Canola J.C. 2003. Handling of female pacas (Agouti paca L., 1766) for ultrasound pregnancy detection. Braz. J. Vet. Res. Anim. Sci.40(1):69-72.) e para o acompanhamento gestacional em cutias D. prymnolopha (Sousa et al. 2012Sousa F.C.A., Alves F.R., Fortes E.A.M., Ferraz M.S., Machado Júnior A.A.N., Menezes D.J.A.& Carvalho M.A.M.2012. Pregnancy in Hystricomorpha: gestational age and embryonic fetal development of agouti (Dasyprocta prymnolopha Wagler, 1831) estimated by ultrasonography. Theriogenology78(6):1278-1285.).
Com o intuito de contribuir para o conhecimento dos fenômenos relacionados ao ciclo estral da espécie D. leporina, objetivou-se verificar a eficiência da associação entre citologia esfoliativa vaginal e a ultrassonografia ovariana para o monitoramento do ciclo estral em cutias criadas em cativeiro no semiárido brasileiro.
Material e Métodos
Foram utilizadas cinco fêmeas de cutias da espécie Dasyprocta leporina, adultas (~2 anos), provenientes do Centro de Multiplicação de Animais Silvestres (Cemas), Universidade Federal Rural do Semi-árido (Ufersa), Mossoró/RN, Brasil. Os protocolos experimentais e procedimentos adotados para os animais foram aprovados pela comissão de ética da mesma instituição (Processo Ufersa nº 23091.002752/2011-08). Os animais apresentaram, em média, 3 kg, e foram alimentados com ração para roedores, vegetais frescos, milho, frutas e água à vontade. Previamente ao experimento, todos os animais foram submetidos ao exame clínico geral e ginecológico. Durante o experimento, as fêmeas foram mantidas isoladas, sem contato físico com os machos.
No decorrer de 70 dias, realizou-se diariamente, procedimentos de citologia esfoliativa vaginal em todos os animais. Estes foram contidos mecanicamente utilizando-se um puçá. Em seguida, foi introduzido, cranioventralmente, um swab descartável, estéril e umedecido em solução fisiológica. O swab foi friccionado contra a parede vaginal, e as células foram transferidas para uma lâmina de vidro. Estes esfregaços foram secos à temperatura ambiente e corados com panótico rápido (New Prov - Produtos para laboratório, Pinhais-PR, Brasil). Os esfregaços foram analisados ao microscópio de luz (x400), sendo contadas 200 células em cinco diferentes campos. As células foram classificadas como: basais, parabasais, intermediárias e superficiais (Guimarães et al. 1997Guimarães D.A., Moreira D. & Vale W.G.1997. Determinação do ciclo reprodutivo da cutia (Dasyprocta prymnolopha) através do diagnóstico colpocitológico. Acta Amazonica 27(1):55-64.). Para a delimitação do ciclo estral, foi considerado o intervalo compreendido entre dois metaestros, segundo os achados descritos por Guimarães et al. (1997)Guimarães D.A., Moreira D. & Vale W.G.1997. Determinação do ciclo reprodutivo da cutia (Dasyprocta prymnolopha) através do diagnóstico colpocitológico. Acta Amazonica 27(1):55-64..
Paralelamente, a cada três dias, foi realizado monitoramento ovariano por ultrassonografia transabdominal em tempo real. Para tanto, além da contenção física foi realizada uma contenção química utilizando-se associação de cetamina (Quetamina®, Vetecia, Louveira/SP, Brasil) (7mg/kg/IM) e xilazina (Sedomin®, Konig S.A., Santana de Parnaíba/SP, Brasil) (1mg/kg/IM). Inicialmente, realizou-se tricotomia do abdômen dos animais, depois, os mesmos foram dispostos em decúbito lateral direito e esquerdo. Foi utilizado um transdutor microconvexo com frequência de 8 MHz, e este, colocado na região abdominal. Procedeu-se a identificação dos rins para facilitar o acesso à topografia ovariana. Os ovários e suas estruturas foram identificados, mensurados e avaliados quanto à ecogenicidade e ecotextura, utilizando-se um aparelho de ultrassom portátil modelo Aquila (Esaote-Pie Medical, Campinas/SP, Brasil). As imagens foram armazenadas para posterior avaliação. Durante os exames ultrassonográficos, também foram avaliadas quaisquer alterações relativas a manifestação de sinais de estro presentes na genitália externa dos animais.
Os dados foram expressos em média e desvio padrão e analisados pelo programa Statview 5.0 para Windows. Para avaliar o efeito das fases do ciclo estral sobre a proporção de células epiteliais vaginais, bem como, para a comparação dos tipos celulares dentro da mesma fase, foi utilizada análise de variância seguida do teste t Student não pareado. Este mesmo teste foi utilizado para a comparação da biometria ovariana entre as diferentes fases do ciclo estral. Os resultados foram considerados significativos quando P<0,05.
Resultados
Foi possível acompanhar, por completo, oito ciclos estrais, os quais apresentaram em média 28,2±0,7 dias, com variação de 24 a 31 dias. Salienta-se que três animais apresentaram dois ciclos cada; já nas outras duas cutias, apenas um ciclo completo foi monitorado. Um dos animais apresentou um ciclo adicional que durou apenas 11 dias, e que, devido a fugir da variação normal, não foi incluso no cálculo da média de duração dos ciclos. Durante os ciclos estrais de todos os animais, foi possível identificar todos os tipos celulares nos esfregaços vaginais, exceto as células basais. Como demonstrado no Quadro 1, observou-se predominância significativa de células superficiais durante as fases de proestro e estro (P<0,05), seguida de predominância de células intermediárias no metaestro (P<0,05) e células parabasais no diestro (P<0,05). Salienta-se que pela citologia vaginal isoladamente, não foi possível distinguir o proestro do estro.
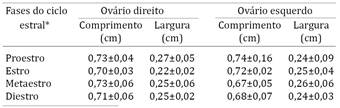
Em relação aos achados ultrassonográficos, os ovários se mostraram como estruturas bem definidas, levemente hipoecóicos em relação ao tecido circundante. Não se verificou diferença significativa nas dimensões dos ovários detectadas por ultrassonografia nas diferentes fases do ciclo estral (P>0,05), como demonstra o Quadro 2. Os folículos ovarianos apresentaram-se como estruturas circulares regulares contendo líquido anecóico, com diâmetro médio de 1±0,5 mm, com variação de 0,4 a 1,6mm (Fig.1A). Já os corpos lúteos determinados pela ultrassonografia se apresentaram como estruturas hiperecóicas em relação ao parênquima ovariano, contudo não tão ecogênicos quanto a gordura adjacente. Tais estruturas mediram em média 1,4±0,9mm, com variação de 0,2 a 2,3mm (Fig.1B). Pelas pequenas dimensões dos ovários, é necessário ressaltar a dificuldade de captação de imagens, as quais perdem qualidade e resolução quando armazenadas.
Avaliação ultrassonografia ovariana em cutias (Dasyprocta leporina). (A) Imagem ultrassonográfica do ovário (setas brancas) com a presença de um folículo pré-ovulatório (círculo) no estro. (B) Imagem ultrassonográfica do ovário (setas brancas), com presença de corpos lúteos (círculos) identificados no decorrer do diestro.
No tocante à avaliação da genitália externa, verificou-se a presença de sinais típicos da fase de estro, como afastamento dos lábios vulvares com presença de secreção mucosa, coincidindo com 75% das vezes em que se observou a presença de um folículo ovariano desenvolvido por meio da ultrassonografia, também coincidindo com a predominância de células superficiais ao exame da citologia vaginal.
Discussão
Os resultados deste estudo demonstram ciclos estrais, com média de 28,2±0,7 dias, com variação de 24 a 31 dias, para as fêmeas de cutias (Dasyprocta leporina) criadas em cativeiro em clima semiárido. Estes resultados aproximam-se àqueles previamente descritos em geral para cutias (Dasyprocta aguti) por Weir et al. (1971)Weir B. 1971. Some observations on reproduction in the female agouti, Dasyprocta aguti. J. Reprod. Fertil.24(2):203-211., os quais tomaram por base as alterações na genitália externa relativas aos sinais de estro, como abertura e fechamento vaginal, determinando uma média de 34,2±2,1 dias para a duração do ciclo estral nesta espécie. Também foram próximos aos reportados para a cutia D. prymnolopha, por Guimarães et al. (1997)Guimarães D.A., Moreira D. & Vale W.G.1997. Determinação do ciclo reprodutivo da cutia (Dasyprocta prymnolopha) através do diagnóstico colpocitológico. Acta Amazonica 27(1):55-64., os quais realizaram citologia vaginal esfoliativa duas vezes por semana, verificando-se ciclos estrais com duração média de 30,69±4,65 dias, com variações entre 19 e 40 dias. Posteriormente, os mesmos autores (Guimarães et al. 2011Guimarães D.A., Ramos R.L., Ohashi O.M., Garcia G.W. & Vale W.G. 2011. Plasma concentration of progesterone and 17β-estradiol of black-rumped agouti (Dasyprocta prymnolopha) during the estrous cycle. Revta Bras. Tróp. 59(1):29-35.) comprovaram seus resultados através de dosagens hormonais realizadas duas vezes por semana, determinando a duração média do ciclo estral como 32,05±4,17 dias. Assim, sugere-se que esta técnica seja também empregada para estudos posteriores em D. leporina, haja vista que a mesma proporciona a geração de inúmeros dados espécie-específicos relativos aos aspectos reprodutivos, como a ocorrência de sazonalidade, duração de ciclo estral, estro, e fase luteal não gestante (Brown & Wildt, 1997Brown J.L. & Wildt D.E. 1997. Assessing reproductive status in wild felids by non-invasive faecal steroid monitoring. Int. Zoo Yearbook 35(1):173-191.).
Salienta-se que um dos animais no presente estudo apresentou um ciclo adicional que durou apenas 11 dias, e que, devido a fugir da variação normal, não foi incluso no cálculo da média de duração dos ciclos. De modo similar, Weir et al. (1971)Weir B. 1971. Some observations on reproduction in the female agouti, Dasyprocta aguti. J. Reprod. Fertil.24(2):203-211. reportaram a existência de ciclos curtos com apenas 12 dias de duração em D. aguti. De fato, uma variação na duração do ciclo estral foi também evidenciada em outros roedores, como em Chinchilla lanígera com ciclos entre 16 a 69 dias, e em Lagostomus maximus com ciclos entre 16 a 94 dias (Weir 1974Weir B.1974. Reproductive characteristics of hystricomorph rodents. Symp. Zool. Soc. London. 34:265-301.). Essas observações demonstram que a variação observada no ciclo estral seria normal para os roedores histricomorfos, haja vista que estão presentes nestas diferentes espécies citadas, mesmo quando submetidas a diferentes condições de criação.
Através de citologia esfoliativa vaginal, os achados encontrados em D. leporina foram semelhantes aos descritos por Guimarães et al. (1997)Guimarães D.A., Moreira D. & Vale W.G.1997. Determinação do ciclo reprodutivo da cutia (Dasyprocta prymnolopha) através do diagnóstico colpocitológico. Acta Amazonica 27(1):55-64. para a cutia D. prymnolopha. Em estudos posteriores, os mesmos autores descrevem a existência de uma longa fase folicular, caracterizada pela predominância do hormônio 17β-estradiol, que seria então responsável pelo predomínio de células superficiais durante proestro e estro (Guimarães et al. 2011Guimarães D.A., Ramos R.L., Ohashi O.M., Garcia G.W. & Vale W.G. 2011. Plasma concentration of progesterone and 17β-estradiol of black-rumped agouti (Dasyprocta prymnolopha) during the estrous cycle. Revta Bras. Tróp. 59(1):29-35.), como também observado nas mesmas fases no presente estudo. De modo geral, não foi possível distinguir com exatidão a duração de cada fase estrogênica (proestro e estro) do ciclo estral através dos achados colpocitológicos em D. leporina. Segundo Weir et al. (1971)Weir B. 1971. Some observations on reproduction in the female agouti, Dasyprocta aguti. J. Reprod. Fertil.24(2):203-211., as cutias apresentam uma membrana de oclusão vaginal, cuja presença possibilitaria a identificação de estro, conforme também observado em D. prymnolopha (Weir et al. 1974Weir B.1974. Reproductive characteristics of hystricomorph rodents. Symp. Zool. Soc. London. 34:265-301.), Cavia porcellus (Hunter et al. 1969Hunter R.H.F., Hunt D.M. & Chang M.C. 1969. Temporal and cytological aspects of fertilization and early development in the guinea pig, Cavia porcellus. Anat. Rec. 165(3):411-430.) e Myoprocta pratti (Kleiman 1970Kleiman D.G. 1970. Reproduction in the female green acouchi, Myoprocta pratti Pocock. J. Reprod. Fertil. 23(1):55-65.). Entretanto, Felipe et al. (2001)Felipe A.E., Carbodevila J. & Callejas S. 2001. Characterization of estrous cycle of the Myocastor coypus (coypu) by means of exfoliative colpocytology. J. Neotrop. Mammal. 8(4):129-137. atribuem certa dificuldade em se precisar as fases do ciclo estral em Myocastor coypus justamente devido à existência desta membrana que tende a obstruir o óstio vaginal externo, permanecendo até o período de estro ou parto. A constituição desta membrana é muito variável podendo ser desde uma secreção mucosa até a formação de um tecido que fecha todo o orifício vaginal. Em Cavia porcellus, (Kelly & Papanicolaou, 1927Kelly G.L. & Papanicolaou G.N. 1927. The mechanism of the periodical opening and closing of the vaginal orifice in the guinea-pig. Am. J. Anat. 40(2):387-411.) e Galea spixii (Santos et al. 2014Santos A.C., Bertassoli B.M., Viana D.C., Vasconcelos B.G., Oliveira M.F., Miglino M.A.& Assis-Neto A.C. 2014. The morphology of female genitalia in Galea spixii (Caviidae, Caviinae). Biosci. J. 30(6):1793-1802.), esta membrana de oclusão vaginal é descrita como sendo de origem epitelial. De modo geral, entende-se ser difícil a extrapolação de técnicas e conceitos aplicáveis às diferentes espécies, haja vista existirem roedores que apresentam comportamento de estro e ruptura da membrana de oclusão vaginal somente com indução da presença do macho, enquanto outras espécies apresentam estro espontâneo (Touma et al., 2001Touma C., Palme R. & Sachser N. 2001. Different types of oestrous cycle in two closely related South American rodents (Cavia aperea and Galea musteloides) with different social and mating systems. Reproduction 121(5):791-801.).
Quanto aos achados ultrassonográficos, foi possível identificar os ovários em todas as avaliações, configurando uma eficiência de 100% em D. leporina. Os resultados encontrados da morfometria ovariana detectada por ultrassonografia nas diferentes fases do ciclo estral foram semelhantes às afirmações feitas por Mayor et al. (2011)Mayor P., Bodmer R.E. & Lopez-Bejar M. 2011. Functional anatomy of the female genital organs of the wild black agouti (Dasyprocta fuliginosa) female in the Peruvian Amazon. Anim. Reprod. Sci. 123(3-4):249-257., os quais analisaram peças anatômicas de cutias negras (D. fuliginosa) comparando as diferentes fases reprodutivas. Ao que parece, as pequenas dimensões alcançadas pelas estruturas ovarianas não interferem nas dimensões totais do ovário, ao longo do ciclo estral. Por outro lado, o detalhamento das estruturas ovarianas nem sempre foi possível de ser visualizado, fato que dificultou o acompanhamento preciso da dinâmica ovariana ao longo do ciclo estral. Provavelmente, esta dificuldade de visualização decorre do fato das cutias desta espécie apresentarem a margem mesovárica e a face lateral do ovário cobertas pelo mesossalpinge, conforme descrito por Almeida et al. 2003Almeida M.M., Carvalho M.A.M., Cavalcante Filho M.F., Miglino M.A. & Menezes D.J.A. 2003. Estudo morfológico e morfométrico do ovário de cutias (Dasyprocta aguti Linnaeus, 1766). Braz. J. Vet. Res. Anim. Sci. 40(1):55-62.. De modo similar, em D. prymnolopha, na maioria das vezes, os ovários encontram-se imersos em tecido adiposo (Guimarães et al. 1994Guimarães D.A., Matos E. & Vale W.G.1994. Estudo morfológico do sistema genital feminino de cutia (Dasyprocta prymnolopha, Rodentia:Cavidae). Revta Bras. Ciênc. Morfol. 11(2):167-171.), como também visto em camundongos (Cook 1965Cook M.J. 1965. The Anatomy of the Laboratory Mouse. 2nd ed. Academic, London. 143p., Dumas 1953Dumas J. 1953. Les Animaux de Laboratoire. Éditions Médicales Flammarion, Paris. 716p.) e ratos albinos (Chiasson 1969Chiasson R.B. 1969. Laboratory anatomy of the white rat. 2nd ed. Wm. C. Brown, Arizona, USA. 81p.).
Adicionalmente, o diâmetro dos folículos ovarianos (1±0,5mm) encontrado no presente estudo, foi aproximado dos valores descritos para cutias (D. aguti) por Weir et al. (1971)Weir B. 1971. Some observations on reproduction in the female agouti, Dasyprocta aguti. J. Reprod. Fertil.24(2):203-211., os quais utilizando técnicas histológicas, relataram que os maiores folículos antrais apresentam valores em torno de 0,8mm. Desse modo, pode-se inferir que a maior dimensão determinada pela ultrassonografia pode ser indicativa da presença do folículo pré-ovulatório. Constata-se, entretanto, que existem diferenças marcantes entre as diferentes espécies de cutias, uma vez que na cutia negra (D. fuliginosa), Mayor et al. (2011)Mayor P., Bodmer R.E. & Lopez-Bejar M. 2011. Functional anatomy of the female genital organs of the wild black agouti (Dasyprocta fuliginosa) female in the Peruvian Amazon. Anim. Reprod. Sci. 123(3-4):249-257. descrevem, por meio de análises histológicas, a presença de folículos antrais atingindo valores próximos a 2,4mm. Ainda, foi possível observar por ultrassonografia que um folículo se projetava na superfície do ovário das cutias do presente estudo, coincidindo com elevações de células superficiais na citologia esfoliativa vaginal, caracterizando as fases foliculares e, mais provavelmente, o estro. Esse fato já foi descrito por Almeida et al. (2003)Almeida M.M., Carvalho M.A.M., Cavalcante Filho M.F., Miglino M.A. & Menezes D.J.A. 2003. Estudo morfológico e morfométrico do ovário de cutias (Dasyprocta aguti Linnaeus, 1766). Braz. J. Vet. Res. Anim. Sci. 40(1):55-62. nesta mesma espécie, por meio de achados de necropsia, onde se verificou a migração de folículos da margem mesovárica para a extremidade tubárica à medida que aumentavam de tamanho, indicando ser esta a região onde ocorre a ovulação. Já, os corpos lúteos determinados pela ultrassonografia no presente estudo mediram em média 1,4±0,9mm. Estes valores coincidem com os valores médios demonstrados previamente por Weir et al. (1971)Weir B. 1971. Some observations on reproduction in the female agouti, Dasyprocta aguti. J. Reprod. Fertil.24(2):203-211. para D. aguti, através do estudo de peças anatômicas. Porém, salienta-se que os referidos autores descreveram também grandes corpos lúteos atingindo até 3 mm em alguns animais, fato não identificado no presente estudo.
Ao se relacionar os achados colpocitológicos com os ultrassonográficos em D. leporina, identificou-se que a detecção de folículos em desenvolvimento na superfície ovariana coincidiu com 75% das fases foliculares (proestro e estro) nos ciclos estrais monitorados, conforme comprovado pela inspeção da genitália externa. Já a identificação e diferenciação das fases luteais, metaestro e diestro, não foi tão precisa. Tomando-se por base o início da fase luteal com a elevação de células intermediárias na citologia vaginal, identificou-se com precisão a presença de estruturas classificadas como corpos lúteos em apenas 12,5% dos ciclos estrais monitorados, no decorrer da fase de diestro das cutias D. leporina.
Conclusões
Diante disso, conclui-se que a ultrassonografia sozinha não proporcionou um acompanhamento preciso da dinâmica das estruturas ovarianas, desse modo, não permitindo o acompanhamento da ovulação.
Entretanto, salienta-se que a associação entre a ultrassonografia e a citologia vaginal constitui uma alternativa viável para a identificação da presença de folículos pré-ovulatórios em cutias da espécie Dasyprocta leporina, proporcionando indícios suficientes para a comprovação da ocorrência de estro.
- Almeida M.M., Carvalho M.A.M., Cavalcante Filho M.F., Miglino M.A. & Menezes D.J.A. 2003. Estudo morfológico e morfométrico do ovário de cutias (Dasyprocta aguti Linnaeus, 1766). Braz. J. Vet. Res. Anim. Sci. 40(1):55-62.
- Bonaudo T., Le Pendu Y., Faure J.F. & Quantz D. 2005. The effects of deforestation on wildlife along the transamazon highway. Eur. J. Wildl. Res. 51(3):199-206.
- Brown J.L. & Wildt D.E. 1997. Assessing reproductive status in wild felids by non-invasive faecal steroid monitoring. Int. Zoo Yearbook 35(1):173-191.
- Chiasson R.B. 1969. Laboratory anatomy of the white rat. 2nd ed. Wm. C. Brown, Arizona, USA. 81p.
- Cook M.J. 1965. The Anatomy of the Laboratory Mouse. 2nd ed. Academic, London. 143p.
- Dumas J. 1953. Les Animaux de Laboratoire. Éditions Médicales Flammarion, Paris. 716p.
- Felipe A.E., Carbodevila J. & Callejas S. 2001. Characterization of estrous cycle of the Myocastor coypus (coypu) by means of exfoliative colpocytology. J. Neotrop. Mammal. 8(4):129-137.
- Fortes E.A.M., Carvalho M.A.M., Almeida M.M., Conde Júnior A.M., Cruz N.E.A. & Assis Neto A.C. 2005. Aspectos morfológicos da tuba uterina de cutias (Dasyprocta aguti, Mammalia: Rodentia). Braz. J. Vet. Res. Anim. Sci.42(2):135-142.
- Griffin P.G. & Ginther O. J. 1992. Research applications of ultrasonic imaging in reproductive biology. J. Anim. Sci. 70(3):953-972.
- Guimarães D.A., Ramos R.L., Ohashi O.M., Garcia G.W. & Vale W.G. 2011. Plasma concentration of progesterone and 17β-estradiol of black-rumped agouti (Dasyprocta prymnolopha) during the estrous cycle. Revta Bras. Tróp. 59(1):29-35.
- Guimarães D.A., Moreira D. & Vale W.G.1997. Determinação do ciclo reprodutivo da cutia (Dasyprocta prymnolopha) através do diagnóstico colpocitológico. Acta Amazonica 27(1):55-64.
- Guimarães D.A., Matos E. & Vale W.G.1994. Estudo morfológico do sistema genital feminino de cutia (Dasyprocta prymnolopha, Rodentia:Cavidae). Revta Bras. Ciênc. Morfol. 11(2):167-171.
- Hunter R.H.F., Hunt D.M. & Chang M.C. 1969. Temporal and cytological aspects of fertilization and early development in the guinea pig, Cavia porcellus. Anat. Rec. 165(3):411-430.
- Lopes J.B., Cavalcante R.R., Almeida M.M., Carvalho M.A.M., Moura S.G., Dantas Filho L.A. & Conceição W.L.F. 2004. Desempenho de cutias (Dasyprocta prymnolopha) criadas em cativeiro do nascimento até o desmame em Teresina, Piauí. Revta Bras. Zootec. 33(6):2318-2322.
- Kelly G.L. & Papanicolaou G.N. 1927. The mechanism of the periodical opening and closing of the vaginal orifice in the guinea-pig. Am. J. Anat. 40(2):387-411.
- Kleiman D.G. 1970. Reproduction in the female green acouchi, Myoprocta pratti Pocock. J. Reprod. Fertil. 23(1):55-65.
- Maia K.M., Peixoto G.C.X., Campos L.B., Bezerra J.A.B., Ricarte A.R.F., Moreira N., Oliveira M.F. & Silva A.R. 2014. Estrus cycle monitoring of captive collared peccaries (Pecari tajacu) in semiarid conditions. Pesq. Vet. Bras. 34(11):1115-1120.
- Mayor P., Bodmer R.E. & Lopez-Bejar M. 2011. Functional anatomy of the female genital organs of the wild black agouti (Dasyprocta fuliginosa) female in the Peruvian Amazon. Anim. Reprod. Sci. 123(3-4):249-257.
- Moxon R., Copler D. & England G.C.W. 2010. Quality assurance of canine vaginal cytology: a preliminary study. Theriogenology74(3):479-485.
- Oliveira F.S., Machado M.R.F. & Canola J.C. 2003. Handling of female pacas (Agouti paca L., 1766) for ultrasound pregnancy detection. Braz. J. Vet. Res. Anim. Sci.40(1):69-72.
- Ribeiro E.E.A., Batista M.C.S., Carvalho M.A.M.& Silva J.A.L. 2008. Níveis iônicos e enzimáticos de cutias (Dasyprocta sp.) hígidas, criadas em cativeiro, influência do sexo e da idade. Arq. Bras. Med. Vet. Zootec. 60(3):651-655.
- Rodrigues R.F., Miglino M.A., Ferraz R.H.S. & Morais-Pinto L. 2003. Placentação em cutias (Dasyprocta aguti, Carleton M.D.): aspectos morfológicos. Braz. J. Vet. Res. Anim. Sci.2(40):133-137.
- Santos A.C., Bertassoli B.M., Viana D.C., Vasconcelos B.G., Oliveira M.F., Miglino M.A.& Assis-Neto A.C. 2014. The morphology of female genitalia in Galea spixii (Caviidae, Caviinae). Biosci. J. 30(6):1793-1802.
- Sousa F.C.A., Alves F.R., Fortes E.A.M., Ferraz M.S., Machado Júnior A.A.N., Menezes D.J.A.& Carvalho M.A.M.2012. Pregnancy in Hystricomorpha: gestational age and embryonic fetal development of agouti (Dasyprocta prymnolopha Wagler, 1831) estimated by ultrasonography. Theriogenology78(6):1278-1285.
- Souza P.C., Ramos R.S.L., Guimarães D.A. A., Ferreira A.C.S., Bastos L.V., Batista C.R. & Ohashi O.M.2003. Determinação da população folicular em cutias (Dasyprocta sp.) criadas em cativeiro. Revta Bras. Reprod. Anim. 27(2):286-287.
- Touma C., Palme R. & Sachser N. 2001. Different types of oestrous cycle in two closely related South American rodents (Cavia aperea and Galea musteloides) with different social and mating systems. Reproduction 121(5):791-801.
- Wanderley L.S., Machado Luz H.K., Faustino L.R., Lima I.M.T., Lopes C.A.P., Silva A.R., Báo S.N., Campello C.C., Rodrigues A.P.R. & De Figueiredo J.R. 2012. Ultrastructural features of agouti (Dasyprocta aguti) preantral follicles cryopreserved using dimethyl sulfoxide, ethylene glycol and propanediol. Theriogenology77(2):260-267.
- Weir B. 1971. Some observations on reproduction in the female agouti, Dasyprocta aguti. J. Reprod. Fertil.24(2):203-211.
- Weir B.1974. Reproductive characteristics of hystricomorph rodents. Symp. Zool. Soc. London. 34:265-301.
- Woods C.A. & Kilpatrick C.W. 2005. Infraorder Hystricognathi, p.1538-1600. In: Wilson D.E. & Reeder D.M. (Eds), Mammal Species of the World: a taxonomic and geographic reference. Vol.2. 3rd ed. John Hopkins University Press, Baltimore.
Datas de Publicação
-
Publicação nesta coleção
Fev 2015
Histórico
-
Recebido
07 Nov 2014 -
Aceito
30 Jan 2015