RESUMO:
O objetivo deste trabalho foi verificar a presença de Brucella abortus e as lesões causadas por esse agente nos anexos fetais e nos fetos de búfalas. Para isso, 20 búfalas em diversos meses de gestação, sorologicamente positivas para brucelose, foram submetidas ao abate sanitário. A idade fetal foi determinada através de exames ultrassonográficos associados à mensuração dos fetos durante a necropsia. Do útero fechado desses animais foram coletadas amostras para histopatologia e qPCR. A partir do segundo mês de gestação foi possível detectar a presença de DNA de B. abortus em líquido amniótico, líquido alantoide e em útero e, a partir do quinto mês, na placenta, coração, baço, rim, pulmão, intestino, fígado e linfonodos dos fetos. Os principais achados anatomopatológicos foram placentite fibrinopurulenta necrótica e endometrite supurativa crônica.
TERMOS DE INDEXAÇÃO:
Brucelose; búfalos; Bubalus bubalis; Brucella abortus; infecção transplacentária
ABSTRACT:
The objective of this study was to detect Brucella abortus and injuries caused by the bacteria in fetal membranes and fetuses. Twenty buffaloes serologically positive for brucellosis were used and subjected to stamping for collection of material from the closed uterus of several months gestation. Fetal age was determined by ultrasound examination and the size of fetuses was measured at necropsy. The samples were subjected to histopathology and qPCR. From the second month of pregnancy on it was possible to detect the presence of B. abortus DNA in amniotic fluid, allantoic liquid and uterus, and from the fifth month on in placenta, heart, spleen, kidney, lung, intestine, liver and lymph nodes of the fetuses. The main pathological findings were fibrinous suppurative necrotic placentitis, and chronic endometritis.
INDEX TERMS:
Brucellosis; buffaloes; Bubalus bubalis; Brucella abortus; transplacental infection
INTRODUÇÃO
A bubalinocultura tem importância no mundo inteiro, como fonte de proteína; é utilizada na tração, além de ser capaz de sobreviver em terras pobres e subsistir com baixa qualidade de forragens. No entanto, pesquisas específicas com bubalinos são limitadas, por não se tratar de um animal importante em muitos países que possuem os recursos necessários para realizar grandes projetos e assegurar a publicação dos resultados na literatura internacional (Fosgate et al. 2011 Fosgate G.T., Diptee M.D., Ramnanan A. & Adesiyun A.A.2011. Brucellosis in domestic water buffalo (Bubalus bubalis) of Trinidad and Tobago with comparative epidemiology to cattle. Trop. Anim. Health Prod.43:14791486.).
O Brasil possui 1.277.199 bubalinos; a região Norte, com 820 mil animais, é a maior produtora do País, com destaque para o estado do Pará, que responde por 37,9% do rebanho nacional (IBGE 2011IBGE 2011. Produção da Pecuária Municipal. Instituto Brasileiro de Geografia e Estatística. 39. Disponível em <Disponível em http://www.ibge.gov.br/home/ estatistica/economia/ppm/2011/default_pdf.shtm
> Acesso em 29 out. 2015.
http://www.ibge.gov.br/home/ estatistica...
).
A brucelose, doença infecto-contagiosa de evolução geralmente crônica e de caráter granulomatoso, infecta as células do sistema mononuclear fagocitário. O principal agente para bubalinos, assim como para bovinos, é uma bactéria intracelular facultativaa Brucella abortus biotipo1 (Cheville et al. 1993Cheville N.F., Stevens M.G., Jensen E., Tatum F.M. & Halling S.M. 1993. Immune responses and protection against infection and abortion in cattle experimentally vaccinated with mutant strains of Brucella abortus. Am. J. Vet. Res. 54:1591-1597., Fosgate et al. 2002 Fosgate G.T., Adesiyun A.A., Hird D.W., Hietala S.K. & Ryan J. 2002. Isolation of Brucella abortus biovar 1 from cattle and water buffaloes on Trinidad. Vet. Rec. 151:272-273., Megid et al. 2005Megid J., Albert D., Fagliari J.J., Paes A.C., Listoni F.P., Pinto A.C., Ribeiro M.G., Thiébaud M., Ueno T. & Garin-Bastiji B. 2005. Isolation of Brucella abortus from cattle and water buffalo in Brazil. Vet. Rec.156(5):147148., Xavier et al. 2009Xavier M.N., Paixão T.A., Poester F.P., Lage A.P. & Santos R.L. 2009. Pathology, immunohistochemistry and bacteriology of tissues and milk of cows and fetuses experimentally infected with Brucella abortus. J. Comp. Pathol. 140(2/3):149-157.), que tem como principal fonte de contaminação a via digestiva (Payne 1959Payne J.M. 1959. The pathogenesis of experimental brucellosis in the pregnant cow. J. Pathol. Bacteriol. 78:447-463.). A brucelose provoca grandes prejuízos econômicos devido a problemas reprodutivos (Corbel 1997Corbel M.J. 1997. Brucellosis: an overview. Emerg. Infect. Dis. 3:213-221.) e é uma das zoonoses que também afeta o búfalo doméstico. Apesar de semelhanças com a brucelose bovina, as diferenças na epidemiologia da doença entre essas espécies são importantes no estabelecimento de medidas de controle (Fosgate et al. 2011 Fosgate G.T., Diptee M.D., Ramnanan A. & Adesiyun A.A.2011. Brucellosis in domestic water buffalo (Bubalus bubalis) of Trinidad and Tobago with comparative epidemiology to cattle. Trop. Anim. Health Prod.43:14791486.).
No Brasil, o primeiro relato de brucelose em búfalos foi efetuado por Santa Rosa et al. (1969Santa Rosa C.A., Castro A.F.P. & Troise C. 1969. Títulos aglutinantes para "Brucella" em búfalos do Estado de São Paulo., Arqs Inst. Biológico São Paulo, 28:35-39.), que encontraram 40,9% (27/66) dos búfalos reativos ao teste de soroaglutinação rápida em placa. No entanto, o primeiro isolamento em búfalas adultas no Brasil foi estabelecido por Ogassawara et al. (1969Ogassawara S., Cury R., D'apice V.B., Mendes M.F.M. & Rocha U.F. 1969. Higroma articular brucélico em búfalo, Bubalus bubalis (Linneu, 1758). Arqs Inst. Biológico, São Paulo, 36:117-121.) a partir do conteúdo de um higroma articular, do qual isolou B. abortus. Posteriormente, outros trabalhos evidenciaram a presença de brucelose nessa espécie, por meio de testes sorológicos (Bastianetto et al. 2005Bastianetto E., Amaral F.R., Carvalho L.B., Oliveira D.A.A. & Leite R.C. 2005. Brucelose em rebanhos de búfalos criados na região do Alto São Francisco, Minas Gerais. Revta Bras. Reprod. Anim. 29(1):55-56.). No estado do Pará, a prevalência encontrada foi de 3,67% (176/4796) bubalinos positivos ao teste 2-mercaptoetanol (2-ME) (Silva et al. 2014Silva J.B., Fonseca A.H. & Barbosa J.D. 2014. Serological survey of Mycobacterium bovis, Brucella abortus and Borrelia burgdorferi in water buffaloes in the northern region of Brazil. Revta Salud Anim. 36(1): 35-39.).
Esta enfermidade foi diagnosticada em ruminantes domésticos no Egito, onde se demonstrou a presença de estirpes de B. suis e B. abortus, identificadas por meio de PCR, em ruminantes domésticos incluindo-se os bubalinos (Menshawy et al. 2014Menshawy A.M.S., Perez-Sancho M., Garcia-Seco T., Hosein H.I., García N., Martinez I., Sayour A.E., Goyache J., Azzam R.A.A., Dominguez L. & Alvarez J. 2014. Assessment of genetic diversity of zoonotic Brucella spp. recovered from livestock in Egypt using multiple locus VNTR analysis. BioMed. Res. Int. 2014:1-7.), e em Trinidad e Tobago, por meio de testes sorológicos e bacteriológicos (Fosgate et al. 2002 Fosgate G.T., Adesiyun A.A., Hird D.W., Hietala S.K. & Ryan J. 2002. Isolation of Brucella abortus biovar 1 from cattle and water buffaloes on Trinidad. Vet. Rec. 151:272-273.), bem como no Paquistão onde também foi identificada B. abortus em explorações pecuárias privadas (Nasir et al. 2004Nasir A.A., Parveen Z., Shah M.A. & Rashid M. 2004. Seroprevalence of brucellosis in animals at government and private livestock farms in Punjab. Pak. Vet. J. 24(3):144-146.).
Além de provocar aborto a brucelose causa placentite necrosante fibrinosa (Payne 1959Payne J.M. 1959. The pathogenesis of experimental brucellosis in the pregnant cow. J. Pathol. Bacteriol. 78:447-463., Palmer et al. 1996Palmer M.V., Cheville N.F. & Jensen A.E. 1996. Experimental infection of pregnant cattle with the vaccine candidate Brucella abortus strain RB51: pathologic, bacteriologic, and serologic findings. Vet. Pathol.33: 682-691., Pérez et al. 1998Pérez J., Quezada M., Lopez J., Casquet O., Sierra M.A. & Martín de las Mulas J. 1998. Immunohistochemical detection of Brucella abortus antigens in tissues from aborted bovine fetuses using a commercially available polyclonal antibody. J. Vet. Diagn. Invest. 10:17-21., Xavier et al. 2009Xavier M.N., Paixão T.A., Poester F.P., Lage A.P. & Santos R.L. 2009. Pathology, immunohistochemistry and bacteriology of tissues and milk of cows and fetuses experimentally infected with Brucella abortus. J. Comp. Pathol. 140(2/3):149-157.), com produção de exsudato amarelo acastanhado e odor fétido, contendo fibrina, restos necróticos e infiltrados perivasculares no útero (Xavier et al. 2009Xavier M.N., Paixão T.A., Poester F.P., Lage A.P. & Santos R.L. 2009. Pathology, immunohistochemistry and bacteriology of tissues and milk of cows and fetuses experimentally infected with Brucella abortus. J. Comp. Pathol. 140(2/3):149-157.).
O diagnóstico desta enfermidade em bubalinos vem sendo realizado da mesma forma que para os bovinos, através de diferentes testes sorológicos e do isolamento do agente. As provas sorológicas empregadas no diagnóstico são teste de triagem do Antígeno Acidificado Tamponado (AAT), Fixação do Complemento (FC) e teste de Polarização Fluorescente (PF) (Nielsen 2001Nielsen K., Gall D., Smith P., Kelly W., Yeo J., Kenny K., Heneghan T., McNamara S., Maher P., O'Connor J., Walsh B., Carroll J., Rojas X., Rojas F., Perez B., Wulff O., Buffoni L., Salustio E., Gregoret R., Samartino L.E., Dager A. & Luna-Martinez E. 2001. Fluorescence polarization assay for the diagnosis of bovine brucellosis: adaptation to field use. Vet. Microbiol. 21(80):163-170.). Porém, podem ser empregados outros testes como o imunoenzimático competitivo (ELISA-C) (Paulin et al. 2012Paulin L.M.S., Samartino L.E., Conde S.B., Federsoni I.S.P., Ferreira F., Amaku M. & Ferreira Neto J.S.2012. Fluorescence polarization assay, competitive enzyme-linked immunosorbent assay (ELISA-C) and indirect ELISA for the diagnosis of brucellosis in buffaloes (Bubalus bubalis). Ciência Rural 42(9):1621-1626.) e ensaio imunoenzimático com proteínas-G (ELISA-G) (Kumar & Chand 2011Kumar M. & Chand P. 2011. Improvement in the diagnosis of Brucella abortus infections in naturally infected water buffaloes (Bubalus bubalis) using an ELISA with a Protein-G-based indicator system. Trop. Anim. Health Prod.43(8):1493-1499.).
Um teste que vem se destacando no diagnóstico da brucelose é o teste de Reação em Cadeia da Polimerase em tempo real (qPCR) por apresentar altos níveis de sensibilidade e especificidade (Hinić et al. 2009Hinić V., Brodard I.,Thomann A., Holub M., Miserez R. & Abri C. 2009. IS711-based real-time PCR assay as a tool for detection of Brucella spp. in wild boars and comparison with bacterial isolation and serology. BMC Vet. Res. 5:1-8., Caitano et al. 2014).
Não foram encontrados dados que demonstrassem a presença de B. abortus na espécie bubalina, assim como as lesões causadas por esse agente nos anexos fetais e no feto de bubalinos. Portanto, o objetivo do presente trabalho foi verificar a presença de B. abortus em búfalas sorologicamente positivas para brucelose assim como caracterizar as lesões histológicas causadas por esse agente, nos anexos fetais e nos fetos de búfalas.
MATERIAL E MÉTODOS
Animais. Foram utilizadas 20 búfalas mestiças da raça Murrah, primíparas, provenientes da Ilha de Marajó, estado do Pará, com 24 a 30 meses de idade, sorologicamente positivas para brucelose. As búfalas passaram por um período de adaptação de seis meses em uma propriedade no município de Castanhal, PA, e foram submetidas à inseminação artificial; nas que não emprenharam foram realizados repasse com o touro através de monta natural.
Coleta das amostras. Para confirmação da enfermidade foram coletadas amostras de sangue por venopunção da jugular, em tubos de 10mL à vácuo; o soro foi separado por meio de centrifugação a 3000rpm por cinco minutos e foram armazenados a -20°C até a realização do teste sorológico. Os soros foram analisados por meio do teste de triagem do Antígeno Acidificado Tamponado (AAT) e os testes confirmatórios de Fixação do Complemento (FC) e Polarização Fluorescente (PF) conforme recomenda o Manual Técnico do Programa Nacional de Controle e Erradicação da Brucelose e Tuberculose Animal (Brasil 2006Brasil 2006. Manual Técnico do Programa Nacional de Controle e Erradicação da Brucelose e Tuberculose (PNCEBT): legislação. Departamento de Defesa Animal, Secretaria de Defesa Agropecuária, Ministério da Agricultura, Pecuária e Abastecimento, Brasília, p.36-42.). Todos os testes foram realizados no Instituto Biológico em São Paulo.
Os animais do presente estudo, sorologicamente positivos para brucelose, foram submetidos ao abate sanitário em matadouros frigoríficos localizados nos municípios de Castanhal e Belém, estado do Pará, sob inspeção estadual e federal, respectivamente, conforme a legislação vigente. Foi realizada a coleta do útero fechado das 20 búfalas. Nas gestações até o quarto mês foram coletados líquido alantoide, líquido amniótico e útero. Nas gestações a partir do quinto mês, foram colhidas amostras de líquido amniótico, líquido alantoide, cotilédone, placenta, e dos fetos, fragmentos de fígado, rim, baço, pulmão, coração, intestino, linfonodo pré-escapular e líquido abomasal. A idade fetal foi determinada através de exames ultrassonográficos, realizados mensalmente, associados à mensuração do feto durante a necropsia, conforme recomendado por Barr et al. (1990Barr B.C., Anderson M.L., Blanchard P.C., Daft B.M., Kinde H. & Conrad P.A. 1990. Bovine fetal encephalitis and myocarditis associated with protozoal infections. Vet. Pathol.27:354-361.).
As amostras foram coletadas em duplicata, com a utilização de equipamentos de proteção individual (EPI), tubos e frascos esterilizados para coleta individuais. Uma das amostras foi congelada e enviada ao Laboratório de Biologia Molecular do Laboratório Nacional Agropecuário em Minas Gerais (LBM Lanagro/MG) para realização da reação em cadeia da polimerase em tempo real (qPCR). A outra amostra foi fixada em formol a 10% e enviada ao Setor de Anatomia Patológica, do Instituto de Veterinária da Universidade Federal Rural do Rio de Janeiro (UFRRJ). As amostras foram submetidas ao processamento de rotina para histopatologia, cortadas a 5μm e coradas pela hematoxilina e eosina (HE).
Extração de DNA. Todas as amostras de tecidos foram homogeneizadas e submetidas à extração de DNA genômico com o kit comercial QIAamp Cador Pathogen mini kit (Qiagen®), utilizando-se o protocolo recomendado pelo fabricante. O DNA extraído foi analisado e quantificado em gel de agarose a 0,8%, com marcador de peso molecular 1Kb, corado com Blue green (LGCbio), visualizado em luz ultravioleta e fotodocumentado para verificação de sua qualidade.
PCR em Tempo Real (qPCR). O ensaio foi realizado utilizando-se os oligonucleotídeos Bru.is711.128.F (TGGTGCTGTCAATGAGGAC), Bru.is711.128.F (GACCTTCGGCAAATGGACAG), Bru. is711.128.S (5´.FAM-CGGCGTATCAGCCAGGGCAT-IowaBlack.3') para amplificação da sequência de inserção 711 do gênero Brucella. Após as extrações dos DNAs, as reações de amplificação foram realizadas em um volume final de 25μL contendo: 2,5μL de DNA genômico; 2,0μL de cada primer à 10μM; 4,4μL de Água Mili-Q ultrapura, 0,6μL de MgCl2, 1,0μL de sonda e 12,5μL de Mix Quantitect (Qiagen, Alemanha) de acordo com o protocolo do fornecedor. As condições de termociclagem foram as seguintes: 50°C por 2 minutos, desnaturação a 95°C por 15 minutos, seguidos de 45 ciclos a 95°C por 15 segundos e 60°C por um minuto. Todas as amostras foram avaliadas em duplicata em termociclador LigthCycler® 480 II (Roche), com Software Release 1.5.0 SP4.
RESULTADOS
No Quadro 1 mostram-se os anexos fetais (líquido amniótico, líquido alantoide e útero) dos quais foi detectada a presença de Brucella abortus do primeiro ao quarto mês de gestação. Verificou-se que a partir do segundo mês foi possível detectar DNA de B. abortus no líquido amniótico, líquido alantoide e útero.
No Quadro 2 observa-se a detecção de DNA de B. abortus em búfalas a partir do quinto mês de gestação, nas quais verificou-se a presença da bactéria nos líquidos amniótico e alantoide, placenta e cotilédone. Portanto, B. abortus foi detectada em 60% (12/20) dos animais no líquido amniótico, 65% (13/20) no líquido alantoide, 66,66% (8/12) na placenta, 33,33% (4/12) nos cotilédones e 25% (2/8) no útero.
O Quadro 3 mostra os tecidos fetais nos quais foram detectados DNA de B. abortus através da qPCR e o período gestacional das búfalas em meses no qual foi realizada a coleta.
Verificou-se que no quinto mês de gestação foi possível detectar DNA de B. abortus nos tecidos fetais, sendo que os órgãos nos quais foram detectados com maior frequência foram coração 58,33% (7/12), baço 58,33% (7/12), rim 58,33% (7/12), pulmão 50% (6/12), intestino 50% (6/12), fígado 41,66% (5/12) e linfonodo pré-escapular 33,33% (4/12).
Achados anatomopatológicos
As lesões macroscópicas observadas nos bubalinos foram placentite com exsudato de coloração acastanhada e odor fétido, com áreas de necrose e fibrina, além de congestão e hemorragias multifocais (Búfalas 18 e 20) ( Fig.1), e exsudato purulento nos placentomas (Búfalas 18 e 20) (Fig.2-3), útero com focos de necrose nos placentomas, exsudato fibrinopurulento com odor fétido e restos placentários (Búfala 20) ( Fig.4), edema e hemorragia do corioalantoide intercotiledonário (Búfala 20) (Fig.5), carúnculas com exsudato fibrinoso multifocal na superfície de corte e outras carúnculas com congestão e áreas hemorrágicas (Búfalas 18 e 20) (Fig.6). Não foram encontradas outras alterações macroscópicas.
Placentitecom exsudato de coloração amarelo acastanhado com fibrina e áreas de necrose (Búfala 18).
Útero com necrose nos placentomas, exsudato fibrinopurulento e restos placentários (Búfala 20).
Exsudato fibrinoso multifocal na superfície de corte da carúncula, acima, e áreas de hemorragia na carúncula, abaixo (Búfala 18).
Achados histopatológicos
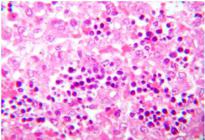
Observou-se placentite caracterizada pela presença de focos de necrose e denso infiltrado inflamatório por células polimorfonucleares, congestão, hemorragia e áreas com exsudação por fibrina. Em outras áreas também foi
possível observar infiltrado inflamatório por linfócitos, plasmócitos e microgranulomas com alguns neutrófilos, e invasão e multiplicação de numerosas colônias bacterianas cocoides basofílicas nas células trofoblásticas da placenta, muitas das quais necróticas (Búfala 20) (Fig.7-11), ou ainda endometrite supurativa crônica com áreas de fibrose e presença de numerosas colônias bacterianas cocoides basofílicas na superfície endometrial ulcerada (Búfala 20).
Colônias bacterianas basofílicas, congestão e hemorragia em placentoma (Búfala 20). HE, obj.16x.
Placenta com colônias bacterianas basofílicas nas células trofoblásticas, muitas das quais necróticas (Búfala 20). HE, obj.40x.
Necrose e infiltrado inflamatório fibrinopurulento com colônias bacterianas basofílicas em placentoma (Búfala 20). HE, obj.25x.
Infiltrado inflamatório por linfócitos, plasmócitos, microgranuloma e alguns neutrófilos em placentoma (Búfala 20). HE, obj.25x.
Dentre os achados histopatológicos nos fetos bubalinos verificou-se fígado com infiltrados linfocitários em focos pequenos, distribuídos por todo parênquima, com lesão leve (Feto da Búfala 14) a moderada (Fetos das Búfalas 9, 10 e 12) (Fig.12), moderada vacuolização difusa dos hepatócitos (Feto da Búfala 14) e leve congestão no rim e baço (Feto da Búfala 16). Nos linfonodos foram observadas congestão, edema e fibrina moderados (Feto da Búfala 13).
DISCUSSÃO
Considerando-se que os bubalinos, diferentemente dos bovinos, apresentam um período médio de 10,5 meses de gestação (Cockrill 1967Cockrill W.R. 1967. The Water Buffalo. Scientific American 217:118.), as coletas foram feitas em dois animais em cada mês gestacional. Por meio da utilização da técnica de PCR em tempo real, foi possível detectar a presença de DNA de Brucella abortus a partir do segundo mês de gestação nos líquidos amniótico, alantoide e no útero. Contudo, até o quarto mês de prenhez essa detecção foi feita somente nos líquidos fetais e no útero, pois somente a partir do quinto mês foram coletados tecidos fetais devido ao pequeno tamanho do feto; além disso, não foi possível observar placentomas ou qualquer tipo de conexão entre o endométrio e o córion em fetos bubalinos no terço inicial de gestação, à semelhança dos achados de Morini et al. (2008Morini A.C., Barbosa P.L.G., Melnic R.V., Morini-Junior J.C., Franciolli A.L.R., Martins D.S., Pereira F.T.V., Favaron P.O., Ambrósio C.E. & Miglino M.A. 2008. Caracterização das membranas fetais em búfalas no terço inicial da gestação. Pesq. Vet. Bras. 28(9):437-445.).
A partir do quinto mês de prenhez foi possível detectar a presença de B. abortus nos cotilédones e nos tecidos fetais, como coração, baço, pulmão, rim e fígado. Segundo Ko & Splitter (2003Ko J. & Splitter G.A. 2003. Molecular host-pathogen interaction in brucellosis: current understanding and future approaches to vaccine development for mice and humans. Clin. Microbiol. Rev. 6:65-78.), após a bacteremia, as brucelas alojam-se em tecidos do sistema mononuclear fagocitário, depois invadem o lúmen uterino e as vilosidades coriônicas, pois há maior disponibilidade de elementos para sua multiplicação (produtos da degradação do eritritol, prostaglandina-F2-α e o estradiol-17β), para finalmente se disseminarem para as vísceras fetais por via hematógena. Silva et al. (2009Silva T.M.A., Oliveira R.G., Mol J.P.S., Xavier M.N., Paixão T.A., Cortez A., Heinemann M.B., Richtzenhain L.J., Lage A.P. & Santos R.L. 2009. Etiologic diagnosis of bovine infectious abortion by PCR. Ciência Rural39(9):2563-2570.), em um estudo realizado em bovinos, utilizaram a PCR para detectar a presença de 12 diferentes agentes infecciosos associados a abortos em bovinos, o que resultou no diagnóstico etiológico em 19% dos casos, os quais avaliaram tecidos incluídos em parafina, e homogeneizados de vários tecidos fetais agrupados juntos e congelados. No estudo verificaram que B. abortus foi o agente etiológico detectado com maior frequência. Matrone et al. (2009Matrone M., Keid L.B., Rocha V.C.M., Vejarano M.P., Ikuta C.Y., Rodriguez C.A.R., Ferreira F., Dias R.A. & Ferreira Neto J.S. 2009. Evaluation of DNA extraction protocols for Brucella abortus PCR detection in aborted fetuses or calves born from cows experimentally infected with strain 2308. Braz. J. Microb. 40:480-489.), ao avaliarem a detecção de B. abortus por meio da PCR em amostras de órgãos homogeneizadas de fetos abortados e de bezerros nascidos de vacas infectadas experimentalmente com a cepa de B. abortus 2308, concluíram que o pulmão e o baço apresentaram maior probabilidade de sucesso na detecção da bactéria do que o fígado e linfonodo; no nosso estudo o coração, baço, rim, pulmão e intestino foram os órgãos que apresentaram uma maior detecção de B. abortus. Cortez et al. (2006Cortez A., Castro A.M.G., Heinemann M.B., Soares R.M., Leite R.C., Scarcelli E., Genovez M.E., Alfieri A.A & Richtzenhain. 2006. Detecção de ácidos nucléicos de Brucella spp., Leptospira spp., herpesvirus bovino e vírus da diarreia viral bovina, em fetos bovinos abortados e em animais mortos no perinatal. Arq. Bras. Med. Vet. Zootec. 58(6):1226-1228.) utilizaram macerados de pulmão e cérebro para detecção de DNA de Brucella spp. por meio da PCR de 114 fetos bovinos abortados e 10 bezerros com mortalidade perinatal dos quais 13% foram positivos. Nesse estudo de 12 pulmões analisados pela PCR em seis foram detectados DNA de B. abortus.
Das Búfalas 13 e 19 não foram detectados DNA de B. abortus nas vísceras fetais; a detecção foi feita somente nos líquidos amniótico, alantoide e placenta; provavelmente as concentrações de DNA genômico nas amostras estavam abaixo do limite de detecção.
As lesões macroscópicas observadas no presente estudo em búfalas foram placentite necrótica fibrinopurulenta; essas lesões também descritas por Payne (1959Payne J.M. 1959. The pathogenesis of experimental brucellosis in the pregnant cow. J. Pathol. Bacteriol. 78:447-463.), Palmer et al. (1996Palmer M.V., Cheville N.F. & Jensen A.E. 1996. Experimental infection of pregnant cattle with the vaccine candidate Brucella abortus strain RB51: pathologic, bacteriologic, and serologic findings. Vet. Pathol.33: 682-691.), Pérez et al. (1998Pérez J., Quezada M., Lopez J., Casquet O., Sierra M.A. & Martín de las Mulas J. 1998. Immunohistochemical detection of Brucella abortus antigens in tissues from aborted bovine fetuses using a commercially available polyclonal antibody. J. Vet. Diagn. Invest. 10:17-21.) e Xavier et al. (2009Xavier M.N., Paixão T.A., Poester F.P., Lage A.P. & Santos R.L. 2009. Pathology, immunohistochemistry and bacteriology of tissues and milk of cows and fetuses experimentally infected with Brucella abortus. J. Comp. Pathol. 140(2/3):149-157.) em bovinos, além de hemorragias multifocais na placenta também descrita por Xavier et al. (2009Xavier M.N., Paixão T.A., Poester F.P., Lage A.P. & Santos R.L. 2009. Pathology, immunohistochemistry and bacteriology of tissues and milk of cows and fetuses experimentally infected with Brucella abortus. J. Comp. Pathol. 140(2/3):149-157.) em bovinos. Os estudos na espécie bubalina em relação aos achados anatomopatológicos são escassos, contudo os achados do presente estudo foram semelhantes aos encontrados em bovinos. Estudos realizados por Fosgate et al. (2002 Fosgate G.T., Adesiyun A.A., Hird D.W., Hietala S.K. & Ryan J. 2002. Isolation of Brucella abortus biovar 1 from cattle and water buffaloes on Trinidad. Vet. Rec. 151:272-273.), Fosgate et al. (2003 Fosgate G.T., Adesiyun A.A., Hird D.W., Johnson W.O., Hietala S.K., Schurig G.G., Ryan J. & Diptee M.D. 2003. Evaluation of brucellosis RB51 vaccine in domestic water buffalo (Bubalus bubalis) in Trinidad. Prev. Vet. Med. 58:211-215.), Diptee et al. (2007Diptee M.D., Asgarali Z., Campbell M., Fosgate G. & Adesiyun A.A.2007. Post-exposure serological and bacteriological responses of water buffalo (Bubalus bubalis) to Brucella abortus biovar 1 following vaccination with Brucella abortus strain RB51. Rev. Sci. Tech. Off. Int. Epiz. 26(3):669-678.), Adesiyun et al. (2010Adesiyun A.A., Fosgate G.T., Persad A., Campbell M., Seebaransingh R. & Stewart-Johnson A. 2010. Comparative study on responses of cattle and water buffalo (Bubalus bubalis) to experimental inoculation of Brucella abortus biovar 1 by the intraconjunctival route: a preliminary report. Trop. Anim. Health Prod. 42(8):1685-94.) em bubalinos, com relação às respostas sorológicas a vacinas e infecções experimentais, têm demonstrado que os bubalinos são mais resistentes à infecção por B. abortus que os bovinos, e segundo Adesiyun et al. (2011Adesiyun A.A., Fosgate G.T., Seebaransingh R., Brown G., Stoute S. & Stewart- Johnson A. 2011. Virulence of Brucella abortus isolated from cattle and water buffalo. Trop. Anim. Health Prod.43:13-16.) os búfalos tendem a ser infectados com estirpes de menor virulência. Isso provavelmente também influencia na capacidade de B. abortus causar lesões em bubalinos, como observadas nos animais do presente estudo, pois poucos animais apresentaram lesões macroscópicas significativas.
Os achados histopatológicos encontrados nos fetos bubalinos, tais como infiltrados linfoplasmocitários no fígado, com leve congestão em rins e baço, foram semelhantes aos descritos por Hong et al. (1991Hong C.B., Donahue J.M., Giles R.C.J.R., Poonacha K.B., Tuttle P.A. & Cheville N.F. 1991. Brucella abortus-associated meningitis in aborted bovine fetuses. Vet. Pathol.28:492-496.), em fetos bovinos, os quais descreveram lesões microscópicas que incluem processos inflamatórios vistos no fígado, baço e rim. A placentite fibrinossupurativa observada nos bubalinos do presente estudo caracterizada pela presença de necrose, congestão, hemorragia, infiltrado inflamatório purulento com fibrina e numerosas colônias bacterianas cocoides, são semelhantes aos achados de Xavier et al. (2009Xavier M.N., Paixão T.A., Poester F.P., Lage A.P. & Santos R.L. 2009. Pathology, immunohistochemistry and bacteriology of tissues and milk of cows and fetuses experimentally infected with Brucella abortus. J. Comp. Pathol. 140(2/3):149-157.), em bovinos infectados experimentalmente, que observaram placentite necrótica neutrofílica com infiltrado perivascular, associada com um grande número de B. abortus intracelularmente em macrófagos e trofoblastos e também extracelularmente em tecidos necróticos. De acordo com Anderson et al. (1986Anderson T.D., Meador V.P. & Cheville N.F. 1986. Pathogenesis of placentitis in the goat inoculated with Brucella abortus. I. Gross and histologic lesions. Vet. Pathol. 23:219-226.), os trofoblastos são as células alvo principal para a invasão e multiplicação de B. abortus na placenta. Samartino & Enright (1996Samartino L.E. & Enright F.M. 1996. Brucella abortus differs in the multiplication with in bovine chorioallantoic membrane explants from early and late gestation. Comp. Immunol. Microbiol. Infect. Dis. 19:55-63.) afirmam que o forte tropismo de B. abortus pelo útero se dá principalmente durante o último trimestre de gestação, devido às altas concentrações de eritritol e hormônios esteroides. Contudo, no presente trabalho foi possível verificar que no primeiro trimestre já existe a presença de B. abortus no útero dos bubalinos.
CONCLUSÕES
Os resultados demonstram que é possível detectar DNA de Brucella abortus desde o segundo até o último mês de prenhez em bubalinos, tanto nos líquidos fetais quanto nos tecidos e mostra a transmissão intrauterina como rota de infecção na cadeia epidemiológica da brucelose em bubalinos.
Os achados anatomopatológicos significativos foram placentite fibrinopurulenta a necrótica e endometrite supurativa crônica.
Agradecimentos.
Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pela concessão de ajuda de custo referente ao processo 456376/2014-3.
REFERÊNCIAS
- Adesiyun A.A., Fosgate G.T., Persad A., Campbell M., Seebaransingh R. & Stewart-Johnson A. 2010. Comparative study on responses of cattle and water buffalo (Bubalus bubalis) to experimental inoculation of Brucella abortus biovar 1 by the intraconjunctival route: a preliminary report. Trop. Anim. Health Prod. 42(8):1685-94.
- Adesiyun A.A., Fosgate G.T., Seebaransingh R., Brown G., Stoute S. & Stewart- Johnson A. 2011. Virulence of Brucella abortus isolated from cattle and water buffalo. Trop. Anim. Health Prod.43:13-16.
- Anderson T.D., Meador V.P. & Cheville N.F. 1986. Pathogenesis of placentitis in the goat inoculated with Brucella abortus I. Gross and histologic lesions. Vet. Pathol. 23:219-226.
- Barr B.C., Anderson M.L., Blanchard P.C., Daft B.M., Kinde H. & Conrad P.A. 1990. Bovine fetal encephalitis and myocarditis associated with protozoal infections. Vet. Pathol.27:354-361.
- Bastianetto E., Amaral F.R., Carvalho L.B., Oliveira D.A.A. & Leite R.C. 2005. Brucelose em rebanhos de búfalos criados na região do Alto São Francisco, Minas Gerais. Revta Bras. Reprod. Anim. 29(1):55-56.
- Brasil 2006. Manual Técnico do Programa Nacional de Controle e Erradicação da Brucelose e Tuberculose (PNCEBT): legislação. Departamento de Defesa Animal, Secretaria de Defesa Agropecuária, Ministério da Agricultura, Pecuária e Abastecimento, Brasília, p.36-42.
- Cheville N.F., Stevens M.G., Jensen E., Tatum F.M. & Halling S.M. 1993. Immune responses and protection against infection and abortion in cattle experimentally vaccinated with mutant strains of Brucella abortus Am. J. Vet. Res. 54:1591-1597.
- Cockrill W.R. 1967. The Water Buffalo. Scientific American 217:118.
- Corbel M.J. 1997. Brucellosis: an overview. Emerg. Infect. Dis. 3:213-221.
- Cortez A., Castro A.M.G., Heinemann M.B., Soares R.M., Leite R.C., Scarcelli E., Genovez M.E., Alfieri A.A & Richtzenhain. 2006. Detecção de ácidos nucléicos de Brucella spp., Leptospira spp., herpesvirus bovino e vírus da diarreia viral bovina, em fetos bovinos abortados e em animais mortos no perinatal. Arq. Bras. Med. Vet. Zootec. 58(6):1226-1228.
- Diptee M.D., Asgarali Z., Campbell M., Fosgate G. & Adesiyun A.A.2007. Post-exposure serological and bacteriological responses of water buffalo (Bubalus bubalis) to Brucella abortus biovar 1 following vaccination with Brucella abortus strain RB51. Rev. Sci. Tech. Off. Int. Epiz. 26(3):669-678.
- Fosgate G.T., Adesiyun A.A., Hird D.W., Johnson W.O., Hietala S.K., Schurig G.G., Ryan J. & Diptee M.D. 2003. Evaluation of brucellosis RB51 vaccine in domestic water buffalo (Bubalus bubalis) in Trinidad. Prev. Vet. Med. 58:211-215.
- Fosgate G.T., Adesiyun A.A., Hird D.W., Hietala S.K. & Ryan J. 2002. Isolation of Brucella abortus biovar 1 from cattle and water buffaloes on Trinidad. Vet. Rec. 151:272-273.
- Fosgate G.T., Diptee M.D., Ramnanan A. & Adesiyun A.A.2011. Brucellosis in domestic water buffalo (Bubalus bubalis) of Trinidad and Tobago with comparative epidemiology to cattle. Trop. Anim. Health Prod.43:14791486.
- Hinić V., Brodard I.,Thomann A., Holub M., Miserez R. & Abri C. 2009. IS711-based real-time PCR assay as a tool for detection of Brucella spp. in wild boars and comparison with bacterial isolation and serology. BMC Vet. Res. 5:1-8.
- Hong C.B., Donahue J.M., Giles R.C.J.R., Poonacha K.B., Tuttle P.A. & Cheville N.F. 1991. Brucella abortus-associated meningitis in aborted bovine fetuses. Vet. Pathol.28:492-496.
- IBGE 2011. Produção da Pecuária Municipal. Instituto Brasileiro de Geografia e Estatística. 39. Disponível em <Disponível em http://www.ibge.gov.br/home/ estatistica/economia/ppm/2011/default_pdf.shtm > Acesso em 29 out. 2015.
» http://www.ibge.gov.br/home/ estatistica/economia/ppm/2011/default_pdf.shtm - Ko J. & Splitter G.A. 2003. Molecular host-pathogen interaction in brucellosis: current understanding and future approaches to vaccine development for mice and humans. Clin. Microbiol. Rev. 6:65-78.
- Kumar M. & Chand P. 2011. Improvement in the diagnosis of Brucella abortus infections in naturally infected water buffaloes (Bubalus bubalis) using an ELISA with a Protein-G-based indicator system. Trop. Anim. Health Prod.43(8):1493-1499.
- Matrone M., Keid L.B., Rocha V.C.M., Vejarano M.P., Ikuta C.Y., Rodriguez C.A.R., Ferreira F., Dias R.A. & Ferreira Neto J.S. 2009. Evaluation of DNA extraction protocols for Brucella abortus PCR detection in aborted fetuses or calves born from cows experimentally infected with strain 2308. Braz. J. Microb. 40:480-489.
- Megid J., Albert D., Fagliari J.J., Paes A.C., Listoni F.P., Pinto A.C., Ribeiro M.G., Thiébaud M., Ueno T. & Garin-Bastiji B. 2005. Isolation of Brucella abortus from cattle and water buffalo in Brazil. Vet. Rec.156(5):147148.
- Menshawy A.M.S., Perez-Sancho M., Garcia-Seco T., Hosein H.I., García N., Martinez I., Sayour A.E., Goyache J., Azzam R.A.A., Dominguez L. & Alvarez J. 2014. Assessment of genetic diversity of zoonotic Brucella spp. recovered from livestock in Egypt using multiple locus VNTR analysis. BioMed. Res. Int. 2014:1-7.
- Morini A.C., Barbosa P.L.G., Melnic R.V., Morini-Junior J.C., Franciolli A.L.R., Martins D.S., Pereira F.T.V., Favaron P.O., Ambrósio C.E. & Miglino M.A. 2008. Caracterização das membranas fetais em búfalas no terço inicial da gestação. Pesq. Vet. Bras. 28(9):437-445.
- Nasir A.A., Parveen Z., Shah M.A. & Rashid M. 2004. Seroprevalence of brucellosis in animals at government and private livestock farms in Punjab. Pak. Vet. J. 24(3):144-146.
- Nielsen K., Gall D., Smith P., Kelly W., Yeo J., Kenny K., Heneghan T., McNamara S., Maher P., O'Connor J., Walsh B., Carroll J., Rojas X., Rojas F., Perez B., Wulff O., Buffoni L., Salustio E., Gregoret R., Samartino L.E., Dager A. & Luna-Martinez E. 2001. Fluorescence polarization assay for the diagnosis of bovine brucellosis: adaptation to field use. Vet. Microbiol. 21(80):163-170.
- Ogassawara S., Cury R., D'apice V.B., Mendes M.F.M. & Rocha U.F. 1969. Higroma articular brucélico em búfalo, Bubalus bubalis (Linneu, 1758). Arqs Inst. Biológico, São Paulo, 36:117-121.
- Palmer M.V., Cheville N.F. & Jensen A.E. 1996. Experimental infection of pregnant cattle with the vaccine candidate Brucella abortus strain RB51: pathologic, bacteriologic, and serologic findings. Vet. Pathol.33: 682-691.
- Paulin L.M.S., Samartino L.E., Conde S.B., Federsoni I.S.P., Ferreira F., Amaku M. & Ferreira Neto J.S.2012. Fluorescence polarization assay, competitive enzyme-linked immunosorbent assay (ELISA-C) and indirect ELISA for the diagnosis of brucellosis in buffaloes (Bubalus bubalis). Ciência Rural 42(9):1621-1626.
- Payne J.M. 1959. The pathogenesis of experimental brucellosis in the pregnant cow. J. Pathol. Bacteriol. 78:447-463.
- Pérez J., Quezada M., Lopez J., Casquet O., Sierra M.A. & Martín de las Mulas J. 1998. Immunohistochemical detection of Brucella abortus antigens in tissues from aborted bovine fetuses using a commercially available polyclonal antibody. J. Vet. Diagn. Invest. 10:17-21.
- Ramnanan A., Diptee M., Asgarali Z., Campbell M. & Adesiyun A.A.2012. Serological and bacteriological responses of water buffalo (Bubalus bubalis) vaccinated with two doses of Brucella abortus strain RB51 vaccine. Trop. Anim. Health Prod.44:1451-1458.
- Samartino L.E. & Enright F.M. 1996. Brucella abortus differs in the multiplication with in bovine chorioallantoic membrane explants from early and late gestation. Comp. Immunol. Microbiol. Infect. Dis. 19:55-63.
- Santa Rosa C.A., Castro A.F.P. & Troise C. 1969. Títulos aglutinantes para "Brucella" em búfalos do Estado de São Paulo., Arqs Inst. Biológico São Paulo, 28:35-39.
- Silva T.M.A., Oliveira R.G., Mol J.P.S., Xavier M.N., Paixão T.A., Cortez A., Heinemann M.B., Richtzenhain L.J., Lage A.P. & Santos R.L. 2009. Etiologic diagnosis of bovine infectious abortion by PCR. Ciência Rural39(9):2563-2570.
- Silva J.B., Fonseca A.H. & Barbosa J.D. 2014. Serological survey of Mycobacterium bovis, Brucella abortus and Borrelia burgdorferi in water buffaloes in the northern region of Brazil. Revta Salud Anim. 36(1): 35-39.
- Xavier M.N., Paixão T.A., Poester F.P., Lage A.P. & Santos R.L. 2009. Pathology, immunohistochemistry and bacteriology of tissues and milk of cows and fetuses experimentally infected with Brucella abortus J. Comp. Pathol. 140(2/3):149-157.
Datas de Publicação
-
Publicação nesta coleção
Nov 2015
Histórico
-
Recebido
25 Maio 2015 -
Aceito
18 Nov 2015