Resumo:
O objetivo do presente estudo foi avaliar a concentração e viabilidade da fração de células mononucleares (FCM) a partir de diferentes técnicas de colheita e processamento de medula óssea (MO) em equinos. Foram avaliados cinco equinos adultos, hígidos e sem raça definida. Obtiveram-se frações de medula óssea (MO) do osso esterno, de acordo com dois protocolos: na colheita A, utilizou-se 10mL de solução de heparina dentro da seringa e em seguida, aspirou-se a MO; na colheita B, 10mL de solução de heparina foi injetada na MO e a aspiração foi realizada após 20 segundos. Todos os animais foram submetidos aos dois protocolos de colheitas, realizadas em sequência, sem intervalo entre os dois procedimentos. Após isolamento da fração de células mononucleares (FCM), das amostras de MO obtidas nas colheitas A e B, cada amostra foi dividida em dois tubos, um contendo solução de DMEM e outro contendo PBS. Assim, alternando-se o tipo de colheita e a solução diluidora, obteve-se quatro tubos de amostras por animal. Os tubos foram centrifugados e os sedimentos foram homogeneizados nos respectivos meios obtendo-se o volume final de 100μL. Realizou-se determinação da concentração e viabilidade celular, obtendo-se as concentrações médias de FCM. Para ambos os meios de diluição, a colheita B apresentou valor numérico maior em comparação à colheita A, porém não foi significativo (p>0,05). Atribui-se tal tendência à menor ocorrência de coagulação da MO no momento da colheita B, sugerindo-se melhor aproveitamento da FCM. Não houve diferença (p>0,05) entre os meios DMEM ou PBS, indicando que os mesmos não alteraram a viabilidade celular. Os protocolos utilizados para colheita de MO e separação da FCM se mostraram eficientes, para o uso em terapia celular em equinos.
Termos de Indexação:
Medula óssea; células mononucleares; DMEM; fração medular; PBS; terapia celular; viabilidade celular; equinos
Abstract:
The aim of this study was to evaluate mononuclear cells fraction (MCF) concentration and viability from different techniques of bone marrow (BM) aspiration and processing in horses. Five adult horses, healthy and of unknown breed were evaluated. BM was obtained from sternum bone, according two protocols: in aspiration A, 10mL of heparin solution was used inside the syringe and BM was aspirated; in aspiration B, 10mL of heparin solution was injected into the BM, and aspiration was done after 20 seconds. All the animals were submitted by both protocols realized in sequence, without a gap between the procedures. After MCF isolation, of BM samples obtained from A and B aspiration, each sample was divided into two tubes; one contained DMEM solution and the other with PBS solution. Therefore, interchanging the aspiration protocol and the dilution solution, four sample tubes were obtained for each horse. The tubes were centrifuged and the pellet was homogenized with the respectively solution to obtain the final volume of 100μL. Cellular concentration and viability were determined to obtain the FCM medium concentration. For both solutions, the aspiration B had higher numeric values comparing with aspiration A; however, it was not significant (p>0.05). This tendency is attribute for the less BM coagulation observed in the aspiration B, suggesting greater improvement of MCF. No difference (p>0.05) was found between DMEM and PBS solution, indicating that both do not alter the cell viability. The protocols used for BM aspiration and MCF isolation were efficient for application in equine cellular therapy.
Index Terms:
Bone marrow; mononuclear cell isolation; cell therapy; cellular viability; DMEM; medullar fraction; PBS; horses
Introdução
A descoberta da aplicabilidade das células-tronco adultas (CTA) aumentou o interesse pelo uso terapêutico desse tipo celular (Parekkadan 2010Parekkadan B. & Milwid J.M. 2010. Mesenchymal stem cells as therapeutics. Annu. Rev. Biomed. Engineering 12:87-117.), a qual tem sido utilizada rotineiramente em algumas áreas da Medicina Veterinária, principalmente em tratamento de injúrias do sistema músculo esquelético de equinos (Koch et al. 2009Koch T.G., Berg L.C. & Betts D.H. 2009. Current and future regenerative medicine: principles, concepts and therapeutic use of stem cell therapy and tissue engineering in equine medicine. Can. Vet. J. 50:155-165., Varanda et al. 2015Varanda L.F.O., Moraes J.M., Sales J.V.F., Mota A.L.A.A., Barreto-Vianna A.R.C., Godoy R.F. & Lima E.M.M. 2015. Collection and isolation of mesenchymal stem cells from equine bone marrow. Online J. Vet. Res. 19(3):216-223.). A terapia celular com uso de CTA apresenta custo elevado se comparada aos tratamentos convencionais. Porém, quando se avalia o seu elevado potencial terapêutico em injúrias do sistema locomotor e, o retorno precoce dos animais ao esporte, seu uso passa a ser considerado de custo viável (Rebelo 2010Rebelo S., Barreira A.P.B., Magalhães F., Fonseca F., Lobato G., Bacelar D.T., Silva Junior H. & Rorojevic R. 2010. Terapia celular com células-tronco em periostite de terceiro osso metacarpiano em cavalos de corrida: avaliação clínica e performance. Revta Eletrôn. Novo Enfoque 9(9):31-32., Burk et al. 2013Burk J., Ribitsch I., Gittel C., Juelke H., Kasper C., Staszyk C. & Brehm W. 2013. Growth and differentiation characteristics of equine mesenchymal stromal cells derived from different sources. Vet. Journal 195(1):98-106.).
Considerando-se o sucesso e o crescente uso da terapia celular em equinos, destaca-se a importância na determinação de todas as variáveis que podem influenciar na quantidade e qualidade do material biológico a ser utilizado, incluindo o método de diluição para isolamento das frações celulares dos tecidos colhidos (Koch et al., 2008Koch T.G., Berg L.C. & Betts D.H. 2008. Concepts for the clinical use of stem cells in equine medicine. Can. Vet. J. 49:1009-1017., Maia et al. 2013Maia L., Landim-Alvarenga F.C., Da Mota L.S., De Assis Golim M., Laufer-Amorim R., De Vita B., Barberini D.J., Listoni A.J., De Moraes C.N., Heckler M.C. & Amorim R.M. 2013. Immunophenotypic, immunocytochemistry, ultrastructural, and cytogenetic characterization of mesenchymal stem cells from equine bone marrow. Microsc. Res Tech. 76(6):618-624., Barberini et al. 2014Barberini D.J., Freitas N.P.P., Magnoni M.S., Maia L., Listoni A.J., Heckler M. C., Sudano M.J., Golim M.A., Landim-Alvarenga F.C. & Amorim R.M. 2014. Equine mesenchymal stem cells from bone marrow, adipose tissue and umbilical cord: immunophenotypic characterization and differentiation potential. Stem Cell Res. Ther. 5(25):1-11., Varanda et al. 2015Varanda L.F.O., Moraes J.M., Sales J.V.F., Mota A.L.A.A., Barreto-Vianna A.R.C., Godoy R.F. & Lima E.M.M. 2015. Collection and isolation of mesenchymal stem cells from equine bone marrow. Online J. Vet. Res. 19(3):216-223.). Sabe-se que há uma relação direta com o número de células obtidas nas colheitas e sua capacidade de diferenciação e viabilidade nos meios utilizados. Para que o concentrado celular promova efeitos terapêuticos benéficos, sem necessidade de cultivo celular, uma quantidade alta de CTA deve estar presente nos aspirados de medula óssea (MO) (Oliveira 2009Oliveira B.J.N.A. 2009. Isolamento e cultivo de células tronco mesenquimais: revisão de literatura. Tese de Doutorado em Cirurgia Experimental, Escola de Veterinária e Zootecnia, Universidade Federal de Goiás, Goiânia. 44p., Maia et al. 2013Maia L., Landim-Alvarenga F.C., Da Mota L.S., De Assis Golim M., Laufer-Amorim R., De Vita B., Barberini D.J., Listoni A.J., De Moraes C.N., Heckler M.C. & Amorim R.M. 2013. Immunophenotypic, immunocytochemistry, ultrastructural, and cytogenetic characterization of mesenchymal stem cells from equine bone marrow. Microsc. Res Tech. 76(6):618-624., Barberini et al. 2014Barberini D.J., Freitas N.P.P., Magnoni M.S., Maia L., Listoni A.J., Heckler M. C., Sudano M.J., Golim M.A., Landim-Alvarenga F.C. & Amorim R.M. 2014. Equine mesenchymal stem cells from bone marrow, adipose tissue and umbilical cord: immunophenotypic characterization and differentiation potential. Stem Cell Res. Ther. 5(25):1-11., Varanda et al. 2015Varanda L.F.O., Moraes J.M., Sales J.V.F., Mota A.L.A.A., Barreto-Vianna A.R.C., Godoy R.F. & Lima E.M.M. 2015. Collection and isolation of mesenchymal stem cells from equine bone marrow. Online J. Vet. Res. 19(3):216-223.).
Em equinos os aspirados de MO podem ser feitos tanto no osso esterno, como na tuberosidade coxal (Kasashima et al. 2011Kasashima Y., Ueno T., Tomita A., Goodship A.E. & Smith R.K.W. 2011. Optimisation of bone marrow aspiration from the equine sternum for the safe recovery of mesenchymal stem cells. Equine Vet. J. 43(3):288-294., Delling et al. 2012Delling U., Lindner K., Ribitsch I., Jülke H. & Brehm W. 2012. Comparison of bone marrow aspiration at the sternum and the tuber coxae in middleaged horses. Can. J. Vet. Res. 76:52-56., Adams et al. 2013Adams M.K., Goodrich L.R., Rao S., Olea-Popelka F., Phillips N., Kisiday J.D. & McIlwraith C.W. 2013. Equine bone marrow-derived mesenchymal stromal cells (BMDMSCs) from the ilium and sternum: are there differences? Equine Vet. J. 45(3):372-375., Kisiday et al. 2013Kisiday J.D., Goodrich L.R., McIlwraith C.W. & Frisbie D.D. 2013. Effects of equine bone marrow aspirate volume on isolation, proliferation, and differentiation potential of mesenchymal stem cells. Am. J. Vet. Res. 74(5):801-807., Maia et al. 2013Maia L., Landim-Alvarenga F.C., Da Mota L.S., De Assis Golim M., Laufer-Amorim R., De Vita B., Barberini D.J., Listoni A.J., De Moraes C.N., Heckler M.C. & Amorim R.M. 2013. Immunophenotypic, immunocytochemistry, ultrastructural, and cytogenetic characterization of mesenchymal stem cells from equine bone marrow. Microsc. Res Tech. 76(6):618-624., Barberini et al. 2014Barberini D.J., Freitas N.P.P., Magnoni M.S., Maia L., Listoni A.J., Heckler M. C., Sudano M.J., Golim M.A., Landim-Alvarenga F.C. & Amorim R.M. 2014. Equine mesenchymal stem cells from bone marrow, adipose tissue and umbilical cord: immunophenotypic characterization and differentiation potential. Stem Cell Res. Ther. 5(25):1-11., Schnabel et al. 2014Schnabel L.V., Pezzanite L.M., Antczak D.F., Felippe M.J.B. & Fortier L.A. 2014. Equine bone marrow-derived mesenchymal stromal cells are heterogeneous in MHC class II expression and capable of inciting an immune response in vitro. Stem Cell Res Ther. 5(13):1-13., Varanda et al. 2015Varanda L.F.O., Moraes J.M., Sales J.V.F., Mota A.L.A.A., Barreto-Vianna A.R.C., Godoy R.F. & Lima E.M.M. 2015. Collection and isolation of mesenchymal stem cells from equine bone marrow. Online J. Vet. Res. 19(3):216-223.). Com a colheita da MO faz-se a separação da fração de células mononucleares (FCM), na qual se obtém uma população de células-tronco mesenquimais e hematopoiéticas, o que pode ser utilizada prontamente eu expandida em cultivo. No procedimento de isolamento da FCM, normalmente utiliza-se a solução de Dulbecco's Modified Eagle Medium (DMEM) como meio diluidor de células (Tognoli et al. 2009Tognoli G.K., Olsson D.C., Martins D.B., Santos Júnior E.B., Salbego F.Z., Oliveira G.K., Braga F.V.A., Raiser A.G., Dezengrini R., Da Cruz F.S.F., Castro M.B., Rosa M.C., Carregaro A.B. & Pippi N.L. 2009. Transplante autólogo de células mononucleares da medula óssea em úlcera de córnea experimental em cães. Ciência Rural 39(1):148-155., Delling et al. 2012Delling U., Lindner K., Ribitsch I., Jülke H. & Brehm W. 2012. Comparison of bone marrow aspiration at the sternum and the tuber coxae in middleaged horses. Can. J. Vet. Res. 76:52-56., Burk et al. 2013Burk J., Ribitsch I., Gittel C., Juelke H., Kasper C., Staszyk C. & Brehm W. 2013. Growth and differentiation characteristics of equine mesenchymal stromal cells derived from different sources. Vet. Journal 195(1):98-106., Schnabel et al. 2014Schnabel L.V., Pezzanite L.M., Antczak D.F., Felippe M.J.B. & Fortier L.A. 2014. Equine bone marrow-derived mesenchymal stromal cells are heterogeneous in MHC class II expression and capable of inciting an immune response in vitro. Stem Cell Res Ther. 5(13):1-13., Varanda et al. 2015Varanda L.F.O., Moraes J.M., Sales J.V.F., Mota A.L.A.A., Barreto-Vianna A.R.C., Godoy R.F. & Lima E.M.M. 2015. Collection and isolation of mesenchymal stem cells from equine bone marrow. Online J. Vet. Res. 19(3):216-223.), necessitando de mais opções de soluções para utilização em rotina.
Tendo em vista a relevância do tema e a necessidade de estabelecer protocolos consistentes quanto ao isolamento de MO, o presente trabalho foi realizado com o objetivo de avaliar a tanto a facilidade de colheita como a concentração e viabilidade da fração de células mononucleares (FCM) a partir de diferentes técnicas de colheita e processamento de medula óssea (MO) em equinos.
Material e Métodos
As colheitas de medula óssea (MO) foram realizadas no Hospital-Escola de Grandes Animais da Faculdade de Agronomia e Medicina Veterinária (FAV/UnB), e o isolamento e as contagens das FCM foram realizados no Laboratório de Reprodução e Biotecnologia FAV/UnB, Brasília, DF, de acordo com os protocolos preconizados por Tognoli et al. (2009)Tognoli G.K., Olsson D.C., Martins D.B., Santos Júnior E.B., Salbego F.Z., Oliveira G.K., Braga F.V.A., Raiser A.G., Dezengrini R., Da Cruz F.S.F., Castro M.B., Rosa M.C., Carregaro A.B. & Pippi N.L. 2009. Transplante autólogo de células mononucleares da medula óssea em úlcera de córnea experimental em cães. Ciência Rural 39(1):148-155. e Barreira et al. (2008)Barreira A.P.B., Bacellar D.T.L., Kiffer R.G. & Alves A.L.G. 2008. Punção aspirativa de medula óssea em equinos adultos para obtenção de célulastronco. Revta Bras. Ciênc. Vet. 15(1):56-59.. O experimento foi aprovado pelo Comitê de Ética no Uso Animal (CEUA) do Instituto de Ciências Biológicas da Universidade de Brasília (UnBDOC nº 75944/2008).
Foram utilizados cinco equinos hígidos, previamente avaliados por exame clínico, hematológico e bioquímico, sem raça definida, de aproximadamente quatro anos de idade (4,4±0,55) e peso médio de 250 kg (±15,81). Para realização da colheita de MO, os animais foram mantidos em posição quadrupedal, contidos em bretes e sedados com cloridrato de detomidina, sob a dose de 0,02mg/kg, administrados por via intravenosa. Realizou-se tricotomia de uma área de aproximadamente 5cm x 20cm na região do osso esterno e posterior limpeza da área com iodopolividona degermante (Riodeine/Rioquima). Após identificação do local de colheita por meio de diagnóstico ultrassonográfico, compreendido entre a 4ª e a 5ª esternébra, procedeu-se anestesia local com 10mL de cloridrato de lidocaína a 2% infiltrados por injeção percutânea no local de inserção da agulha de punção de MO. Após antissepsia da área com álcool 70%, a punção de MO foi realizada com o uso de agulhas de punção medular do modelo Jamshid (Ecomed) de12 cm de comprimento e calibre 8. A agulha foi inserida em ângulo de 90º em relação ao osso, com introdução de aproximadamente cinco centímetros da agulha. Para a introdução da agulha na esternebra, se exerceu força moderada e uniforme para no sentido ventro-dorsal e em giro simultaneamente, encontrando-se resistência moderada em todo o procedimento de penetração da agulha. Uma vez fixada a agulha dentro do esterno, a MO foi aspirada com seringa de 60mL (BD Plastipak).
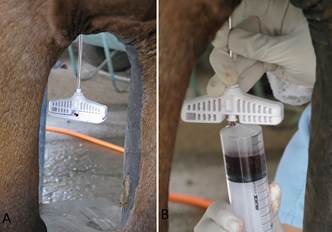
Previamente à realização das colheitas de cada animal, preparou-se uma solução de 10.000 UI de heparina sódica diluídos em 20mL de cloreto de sódio (0,9%). A colheita de MO foi realizada sob dois protocolos, A e B no mesmo animal, sem intervalo entre as colheitas, utilizando a mesma agulha de punção fixada no osso esterno. Para a colheita A, reservou-se 10mL da solução de heparina dentro da seringa de 60mL e aspirou-se 10mL de MO, obtendo-se um total de 20mL. Em seguida, retirou-se da agulha a seringa da colheita A e colocou-se a seringa da colheita B. Para a colheita B, injetou-se 10mL da solução de heparina na esternébra, com a agulha Jamshid já inserida no osso e, após 20 segundos realizou-se a aspiração de 20mL MO ( Fig.1 ). As alíquotas obtidas foram depositadas em tubos de plástico tipo falcon de fundo cônico e volume de 50mL (Tubo Falcon/TPP).
Procedimento de colheita de medula óssea (MO). (A) Mandril e agulha encaixados no interior do esterno. (B) Inicio das colheitas, observa-se a agulha acoplada à seringa e o conteúdo medular no interior da seringa.
As amostras foram refrigeradas em caixa de isopor com gelo a aproximadamente 8ºC e encaminhadas imediatamente para o processamento, que foi realizado exclusivamente em capela estéril de fluxo laminar. Cada amostra obtida (colheitas A e B) foi dividida em dois tubos contendo solução de separação por gradiente de densidade (Ficoll-Hypaque, Histopaque/ Sigma-Aldrich), sobre o qual a MO foi delicadamente depositada na proporção de 1:1 ( Fig.2A ). Os tubos foram centrifugados a 500 G por 30 minutos, para a separação da FCM por gradiente de concentração, sendo a fração visível na forma de um halo na suspensão em cada um dos tubos ( Fig.2B ).
Separação por gradiente de Ficoll. (A) Amostra de medula óssea (MO) (seta grossa) depositada sobre o Ficoll (seta fina). (B) Frações celulares separadas após a primeira centrifugação, com formação de um halo visível, no qual se encontra a FCM (chave). (C) Halo da FCM em destaque (chave).
O halo de células mononucleares foi removido com auxílio de pipeta graduada e diluído na proporção 1:1 em duas soluções diferentes para a lavagem das células, sendo estes, solução de Dulbecco's Modified Eagle Medium (DMEM, Gibco, Invitrogen) e Tampão fosfato salino (PBS, Laborclin). Desta forma, para cada animal, obteve-se quatro tubos de amostras: colheita A diluída em DMEM, colheita A diluída em PBS colheita B diluída em DMEM e colheita B diluída em PBS. Todos os tubos foram centrifugados novamente, agora a 500 G por 10 minutos. Os sedimentos obtidos foram novamente ressuspensos no meio de escolha, DMEM ou PBS, e as amostras então centrifugadas, pela ultima vez, a 500 G por 10 minutos. Assim, os sedimentos finais foram diluídos nos respectivos meios, DMEM ou PBS, para que completassem o volume final de 100 μL de cada amostra, não sendo ressuspensos os sedimentos que já tinham 100μL. Em seguida, todas as amostras foram submetidas à quantificação e ao teste de viabilidade celular.
A quantificação celular e a determinação da viabilidade da FCM obtida foi realizada por meio da mistura de 20μL de Azul de Tripan a 1% (Sigma-Aldrich) em 20μL de cada FCM em tubo Eppendorf. Após homogeneização, 20μL da mistura foram transferidos para a câmara de Neubauer para a contagem e determinação da viabilidade celular em microscopia de luz.
Após a colheita de MO foi realizado curativo local com iodopolividona tópico (Riodeine/Rioquima) em todos os animais, estes foram mantidos em baias individuais e receberam antibioticoterapia sistêmica com penicilina benzatina (30.000 UI/kg/IM) em três aplicações, a cada 48 horas, e fenilbutazona (4,4mg/kg/IV), uma vez ao dia, por três dias consecutivos.
Após visualização da existência de normalidade entre as variáveis com o teste de aderência Kolmogorov-Smirnov, evidenciaram-se amostras paramétricas e foi utilizada a análise de variância (ANOVA) seguida pelo Teste de Tukey para comparação entre os grupos. O nível de significância de 5% (p<0,05) foi considerado significativo com o software GraphPad InStat.
Resultados e Discussão
Não ocorreram manifestações de dor ou desconforto durante os procedimentos de colheita de MO, demonstrando que a contenção, a sedação e anestesia local foram efetivas, não havendo problemas durante o procedimento de coleta. A realização da colheita de medula óssea (MO) em posição quadrupedal foi descrita como de baixo risco em relação ao mesmo procedimento sob anestesia geral inalatória, mostrando-se um método de pouco custo e mais seguro para o animal (Alves et al. 2009Alves A.L.G., Vieira M.E.M., Barreira A.P.B., Mota L.S.L.S., Saito M.E., Kohayagawa A., Hussni C.A., Watanabe M.J. & Oliveira G.G. 2009. Protocolo de isolamento de células mononucleares de medula óssea de eqüinos. Vet. Zootec. 16:650-655., Kasashima et al. 2011Kasashima Y., Ueno T., Tomita A., Goodship A.E. & Smith R.K.W. 2011. Optimisation of bone marrow aspiration from the equine sternum for the safe recovery of mesenchymal stem cells. Equine Vet. J. 43(3):288-294.). Apesar de alguns autores descreverem que a posição quadrupedal pode oferecer risco ao manipulador (Durando et al. 2006Durando M.M., Zarucco L., Schaer T.P., Ross M. & Reef V.B. 2006. Pneumopericardium in a horse secondary to sternal bone marrow aspiration. Equine Vet. Educ. 18:75-79., Delling et al. 2012Delling U., Lindner K., Ribitsch I., Jülke H. & Brehm W. 2012. Comparison of bone marrow aspiration at the sternum and the tuber coxae in middleaged horses. Can. J. Vet. Res. 76:52-56.), o mesmo não foi evidenciado nesse experimento, o que corrobora com Kasashima et al. (2011)Kasashima Y., Ueno T., Tomita A., Goodship A.E. & Smith R.K.W. 2011. Optimisation of bone marrow aspiration from the equine sternum for the safe recovery of mesenchymal stem cells. Equine Vet. J. 43(3):288-294., que afirmaram ser um método seguro quando acompanhado de exame ultrassonográfico no momento da coleta.
Alguns autores como Delling et al. (2012)Delling U., Lindner K., Ribitsch I., Jülke H. & Brehm W. 2012. Comparison of bone marrow aspiration at the sternum and the tuber coxae in middleaged horses. Can. J. Vet. Res. 76:52-56., Adams et al. (2013)Adams M.K., Goodrich L.R., Rao S., Olea-Popelka F., Phillips N., Kisiday J.D. & McIlwraith C.W. 2013. Equine bone marrow-derived mesenchymal stromal cells (BMDMSCs) from the ilium and sternum: are there differences? Equine Vet. J. 45(3):372-375. e Kisiday et al. (2013)Kisiday J.D., Goodrich L.R., McIlwraith C.W. & Frisbie D.D. 2013. Effects of equine bone marrow aspirate volume on isolation, proliferation, and differentiation potential of mesenchymal stem cells. Am. J. Vet. Res. 74(5):801-807. relataram a possibilidade de colheita de MO na tuberosidade coxal, porém, pode apresentar mais dificuldade em relação ao osso esterno quanto à penetração da agulha e aspiração do conteúdo medular. Ainda, Adams et al. (2013)Adams M.K., Goodrich L.R., Rao S., Olea-Popelka F., Phillips N., Kisiday J.D. & McIlwraith C.W. 2013. Equine bone marrow-derived mesenchymal stromal cells (BMDMSCs) from the ilium and sternum: are there differences? Equine Vet. J. 45(3):372-375. e Kisiday et al. (2013)Kisiday J.D., Goodrich L.R., McIlwraith C.W. & Frisbie D.D. 2013. Effects of equine bone marrow aspirate volume on isolation, proliferation, and differentiation potential of mesenchymal stem cells. Am. J. Vet. Res. 74(5):801-807. não observaram diferença quanto à quantidade celular obtida nos diferentes locais de colheita de MO em equinos adultos. Já Delling et al. (2012)Delling U., Lindner K., Ribitsch I., Jülke H. & Brehm W. 2012. Comparison of bone marrow aspiration at the sternum and the tuber coxae in middleaged horses. Can. J. Vet. Res. 76:52-56., encontraram uma população celular significativamente menor na tuberosidade coxal, em relação ao esterno, em equinos de idade média de 13 anos, não recomendando esse local de colheita para aplicações clínicas em cavalos mais velhos.
Apesar de não ter sido evidenciado sinal de desconforto nos animais durante as colheitas, seria necessária a monitoração tanto da frequência cardíaca quanto dos níveis de cortisol dos animais para a avaliação adequada da intensidade de dor conforme sugerido por Barreira et al. (2008)Barreira A.P.B., Bacellar D.T.L., Kiffer R.G. & Alves A.L.G. 2008. Punção aspirativa de medula óssea em equinos adultos para obtenção de célulastronco. Revta Bras. Ciênc. Vet. 15(1):56-59.. Tal avaliação não foi realizada, pois o protocolo de colheita de MO em posição quadrupedal já foi padronizado e considerado adequado (Alves et al. 2009Alves A.L.G., Vieira M.E.M., Barreira A.P.B., Mota L.S.L.S., Saito M.E., Kohayagawa A., Hussni C.A., Watanabe M.J. & Oliveira G.G. 2009. Protocolo de isolamento de células mononucleares de medula óssea de eqüinos. Vet. Zootec. 16:650-655., Ribeiro 2009Ribeiro G 2009. Células-tronco mesenquimais de equinos: isolamento, cultivo e caracterizacão. Tese de Doutorado em Cirurgia Veterinária, Faculdade de Ciências Agrárias e Veterinárias, Universidade Estadual Paulista, Jaboticabal, SP. 84p., Kasashima et al. 2011Kasashima Y., Ueno T., Tomita A., Goodship A.E. & Smith R.K.W. 2011. Optimisation of bone marrow aspiration from the equine sternum for the safe recovery of mesenchymal stem cells. Equine Vet. J. 43(3):288-294., Delling et al. 2012Delling U., Lindner K., Ribitsch I., Jülke H. & Brehm W. 2012. Comparison of bone marrow aspiration at the sternum and the tuber coxae in middleaged horses. Can. J. Vet. Res. 76:52-56., Adams et al. 2013Adams M.K., Goodrich L.R., Rao S., Olea-Popelka F., Phillips N., Kisiday J.D. & McIlwraith C.W. 2013. Equine bone marrow-derived mesenchymal stromal cells (BMDMSCs) from the ilium and sternum: are there differences? Equine Vet. J. 45(3):372-375., Maia et al. 2013Maia L., Landim-Alvarenga F.C., Da Mota L.S., De Assis Golim M., Laufer-Amorim R., De Vita B., Barberini D.J., Listoni A.J., De Moraes C.N., Heckler M.C. & Amorim R.M. 2013. Immunophenotypic, immunocytochemistry, ultrastructural, and cytogenetic characterization of mesenchymal stem cells from equine bone marrow. Microsc. Res Tech. 76(6):618-624., Barberini et al. 2014Barberini D.J., Freitas N.P.P., Magnoni M.S., Maia L., Listoni A.J., Heckler M. C., Sudano M.J., Golim M.A., Landim-Alvarenga F.C. & Amorim R.M. 2014. Equine mesenchymal stem cells from bone marrow, adipose tissue and umbilical cord: immunophenotypic characterization and differentiation potential. Stem Cell Res. Ther. 5(25):1-11., Schnabel et al. 2014Schnabel L.V., Pezzanite L.M., Antczak D.F., Felippe M.J.B. & Fortier L.A. 2014. Equine bone marrow-derived mesenchymal stromal cells are heterogeneous in MHC class II expression and capable of inciting an immune response in vitro. Stem Cell Res Ther. 5(13):1-13., Varanda et al. 2015Varanda L.F.O., Moraes J.M., Sales J.V.F., Mota A.L.A.A., Barreto-Vianna A.R.C., Godoy R.F. & Lima E.M.M. 2015. Collection and isolation of mesenchymal stem cells from equine bone marrow. Online J. Vet. Res. 19(3):216-223.) e, devido à técnica em questão não ser o foco do estudo.
Neste experimento não foi evidenciado nenhum sinal de complicação na colheita de MO, o que está de acordo com Kasashima et al. (2011)Kasashima Y., Ueno T., Tomita A., Goodship A.E. & Smith R.K.W. 2011. Optimisation of bone marrow aspiration from the equine sternum for the safe recovery of mesenchymal stem cells. Equine Vet. J. 43(3):288-294. e Varanda et al. (2015)Varanda L.F.O., Moraes J.M., Sales J.V.F., Mota A.L.A.A., Barreto-Vianna A.R.C., Godoy R.F. & Lima E.M.M. 2015. Collection and isolation of mesenchymal stem cells from equine bone marrow. Online J. Vet. Res. 19(3):216-223., que relataram que colheita de MO do osso esterno é um procedimento simples, que dificilmente apresenta complicações como hematoma, hemorragia ou infecção no local da punção, quando há tanto o treinamento adequado como a identificação do local de colheita, por meio de diagnóstico ultrassonográfico. Entretanto, Durando et al. (2006)Durando M.M., Zarucco L., Schaer T.P., Ross M. & Reef V.B. 2006. Pneumopericardium in a horse secondary to sternal bone marrow aspiration. Equine Vet. Educ. 18:75-79. destacou a possibilidade de complicações graves como pneumotórax e pneumopericárdio, o que não foi aqui evidenciado nem por outros autores com protocolos mais recentes de colheita como Alves et al. (2009)Alves A.L.G., Vieira M.E.M., Barreira A.P.B., Mota L.S.L.S., Saito M.E., Kohayagawa A., Hussni C.A., Watanabe M.J. & Oliveira G.G. 2009. Protocolo de isolamento de células mononucleares de medula óssea de eqüinos. Vet. Zootec. 16:650-655., Ribeiro (2009)Ribeiro G 2009. Células-tronco mesenquimais de equinos: isolamento, cultivo e caracterizacão. Tese de Doutorado em Cirurgia Veterinária, Faculdade de Ciências Agrárias e Veterinárias, Universidade Estadual Paulista, Jaboticabal, SP. 84p., Kasashima et al. (2011)Kasashima Y., Ueno T., Tomita A., Goodship A.E. & Smith R.K.W. 2011. Optimisation of bone marrow aspiration from the equine sternum for the safe recovery of mesenchymal stem cells. Equine Vet. J. 43(3):288-294., Delling et al. (2012)Delling U., Lindner K., Ribitsch I., Jülke H. & Brehm W. 2012. Comparison of bone marrow aspiration at the sternum and the tuber coxae in middleaged horses. Can. J. Vet. Res. 76:52-56., Moraes (2012)Moraes J.M. 2012. Células-tronco da medula óssea e do tecido adiposo na regeneração do nervo ulnar em equinos. Tese de Doutorado em Ciência Animal, Escola de Veterinária e Zootecnia, Universidade Federal de Goiás, Goiânia. 108p., Adams et al. (2013Adams M.K., Goodrich L.R., Rao S., Olea-Popelka F., Phillips N., Kisiday J.D. & McIlwraith C.W. 2013. Equine bone marrow-derived mesenchymal stromal cells (BMDMSCs) from the ilium and sternum: are there differences? Equine Vet. J. 45(3):372-375.), Kisiday et al. (2013)Kisiday J.D., Goodrich L.R., McIlwraith C.W. & Frisbie D.D. 2013. Effects of equine bone marrow aspirate volume on isolation, proliferation, and differentiation potential of mesenchymal stem cells. Am. J. Vet. Res. 74(5):801-807., Maia et al. (2013Maia L., Landim-Alvarenga F.C., Da Mota L.S., De Assis Golim M., Laufer-Amorim R., De Vita B., Barberini D.J., Listoni A.J., De Moraes C.N., Heckler M.C. & Amorim R.M. 2013. Immunophenotypic, immunocytochemistry, ultrastructural, and cytogenetic characterization of mesenchymal stem cells from equine bone marrow. Microsc. Res Tech. 76(6):618-624.), Barberini et al. (2014)Barberini D.J., Freitas N.P.P., Magnoni M.S., Maia L., Listoni A.J., Heckler M. C., Sudano M.J., Golim M.A., Landim-Alvarenga F.C. & Amorim R.M. 2014. Equine mesenchymal stem cells from bone marrow, adipose tissue and umbilical cord: immunophenotypic characterization and differentiation potential. Stem Cell Res. Ther. 5(25):1-11., Schnabel et al. (2014)Schnabel L.V., Pezzanite L.M., Antczak D.F., Felippe M.J.B. & Fortier L.A. 2014. Equine bone marrow-derived mesenchymal stromal cells are heterogeneous in MHC class II expression and capable of inciting an immune response in vitro. Stem Cell Res Ther. 5(13):1-13. e Varanda et al. (2015)Varanda L.F.O., Moraes J.M., Sales J.V.F., Mota A.L.A.A., Barreto-Vianna A.R.C., Godoy R.F. & Lima E.M.M. 2015. Collection and isolation of mesenchymal stem cells from equine bone marrow. Online J. Vet. Res. 19(3):216-223..
A força manual necessária para a penetração da agulha modelo Jamshid no esterno mostrou-se moderada e bastante uniforme em todos os animais, sem grandes dificuldades de penetração da agulha. No experimento realizado por Barreira et al. (2008)Barreira A.P.B., Bacellar D.T.L., Kiffer R.G. & Alves A.L.G. 2008. Punção aspirativa de medula óssea em equinos adultos para obtenção de célulastronco. Revta Bras. Ciênc. Vet. 15(1):56-59., a punção realizada no animal mais jovem do grupo, de três anos de idade, apresentou maior facilidade de penetração da agulha, enquanto no animal mais idoso, com nove anos, a penetração revelou maior dificuldade. Tal diferença foi justificada pela autora com base nos diferentes estágios de mineralização do esqueleto, que alterariam a intensidade da força necessária na execução da técnica. O mesmo foi evidenciado por Delling et al. (2012)Delling U., Lindner K., Ribitsch I., Jülke H. & Brehm W. 2012. Comparison of bone marrow aspiration at the sternum and the tuber coxae in middleaged horses. Can. J. Vet. Res. 76:52-56., que relataram dificuldade na colheita de MO tanto no esterno mas principalmente na tuberosidade coxal em equinos com idade média de 13 anos.
Com relação aos protocolos utilizados para a colheita da MO, a colheita realizada com a injeção da solução de heparina do interior da MO (protocolo B) foi mais fácil de ser executada, necessitando-se de uma menor força de tração, para a aspiração da MO, que na colheita sem injeção de solução de heparina (protocolo A). Assim, na colheita B, a quantidade de MO estipulada no experimento foi obtida em alguns segundos, com apenas uma sucção da seringa, enquanto na colheita A era necessário mais de uma sucção na seringa para a aspiração da MO, o que demandou alguns minutos. Além disso, na colheita A, houve grande formação de coágulo no interior da agulha e seringa, o que dificultou as aspirações e alterou a qualidade das amostras colhidas, o que possivelmente ocasionou o menor número de células na contagem final da FCM.
Os volumes finais dos sedimentos da FCM variaram entre 45μL e 100μL, porém mais associado ao individuo colhido, que pelo método de colheita ou meio de diluição utilizados. Os sedimentos cujo volume foi de 100μL, não precisaram ser ressuspensos para obtenção do volume final para contagem (Quadro 1). No experimento de Alves et al. (2009)Alves A.L.G., Vieira M.E.M., Barreira A.P.B., Mota L.S.L.S., Saito M.E., Kohayagawa A., Hussni C.A., Watanabe M.J. & Oliveira G.G. 2009. Protocolo de isolamento de células mononucleares de medula óssea de eqüinos. Vet. Zootec. 16:650-655., o volume final dos sedimentos da FCM variou de 0,5 a 7mL, enquanto no presente estudo a variação foi de 45μL (0,045mL) a 100μL (0,1 mL). A diferença observada entre os trabalhos foi considerável, visto que os valores observados no nosso experimento chegam a ser seis vezes menores que os relatados pelos autores. Isso pode ser atribuído pelo fato de Alves et al. (2009)Alves A.L.G., Vieira M.E.M., Barreira A.P.B., Mota L.S.L.S., Saito M.E., Kohayagawa A., Hussni C.A., Watanabe M.J. & Oliveira G.G. 2009. Protocolo de isolamento de células mononucleares de medula óssea de eqüinos. Vet. Zootec. 16:650-655. terem realizado apenas uma aspiração em cada animal, e o total colhido foi processado integralmente para a obtenção da FCM, enquanto no presente experimento, foram realizadas duas aspirações seguidamente em cada animal, e o total de cada aspiração foi dividido em duas partes, e processadas separadamente. Similarmente, Delling et al. (2012)Delling U., Lindner K., Ribitsch I., Jülke H. & Brehm W. 2012. Comparison of bone marrow aspiration at the sternum and the tuber coxae in middleaged horses. Can. J. Vet. Res. 76:52-56. e Kisiday et al. (2013)Kisiday J.D., Goodrich L.R., McIlwraith C.W. & Frisbie D.D. 2013. Effects of equine bone marrow aspirate volume on isolation, proliferation, and differentiation potential of mesenchymal stem cells. Am. J. Vet. Res. 74(5):801-807. verificaram que a segunda aspiração de MO, feita em sequência à primeira, como o realizado no presente estudo, diminui a obtenção de FCM na segunda colheita, o que pode justificar os menores sedimentos encontrados em comparação aos de Alves et al. (2009)Alves A.L.G., Vieira M.E.M., Barreira A.P.B., Mota L.S.L.S., Saito M.E., Kohayagawa A., Hussni C.A., Watanabe M.J. & Oliveira G.G. 2009. Protocolo de isolamento de células mononucleares de medula óssea de eqüinos. Vet. Zootec. 16:650-655..
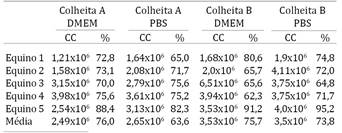
Após a separação da FCM e contagem em câmara de Neubauer, obteve-se uma média dos cinco animais com relação à concentração celular em cada diluição, sendo: 2,49 x 106 para a colheita A em meio DMEM; 2,65 x 106 na colheita A em meio PBS; 3,53 x 106 na colheita B em meio DMEM; e 3,5 x 106 na colheita B em meio PBS. No entanto, a concentração celular final da colheita B foi superior à da colheita A (Quadro 2) mesmo sendo a segunda aspiração de MO em sequência à primeira, discordando dos achados de Delling et al. (2012)Delling U., Lindner K., Ribitsch I., Jülke H. & Brehm W. 2012. Comparison of bone marrow aspiration at the sternum and the tuber coxae in middleaged horses. Can. J. Vet. Res. 76:52-56. e Kisiday et al. (2013)Kisiday J.D., Goodrich L.R., McIlwraith C.W. & Frisbie D.D. 2013. Effects of equine bone marrow aspirate volume on isolation, proliferation, and differentiation potential of mesenchymal stem cells. Am. J. Vet. Res. 74(5):801-807.. Isso se deve, provavelmente, à maior eficácia de colheita B em relação à colheita A, como já descrito anteriormente. Em adição, neste estudo foram testados dois protocolos diferentes de colheita de MO, o que não foi realizado por Delling et al. (2012)Delling U., Lindner K., Ribitsch I., Jülke H. & Brehm W. 2012. Comparison of bone marrow aspiration at the sternum and the tuber coxae in middleaged horses. Can. J. Vet. Res. 76:52-56. e Kisiday et al. (2013)Kisiday J.D., Goodrich L.R., McIlwraith C.W. & Frisbie D.D. 2013. Effects of equine bone marrow aspirate volume on isolation, proliferation, and differentiation potential of mesenchymal stem cells. Am. J. Vet. Res. 74(5):801-807..
Segundo Gengozian (2000)Gengozian N. 2000. Identification and isolation of hematopoietic progenitors, p.91-96. In: Feldman B.F., Zinkl J.G. & Jain N.C. (Eds), Schalm's Veterinary Hematology. Williams and Wilkins, Philadelphia., geralmente é necessário aproximadamente 2 x 106 células a serem inoculadas para o sucesso de uma terapia celular. No entanto, a quantidade ideal de células necessárias para implantação ainda é contraditório entre os autores tanto com relação à quantidade de células necessárias, como o tecido implantado e a espécie, uma vez que alguns afirmam que a quantidade celular de 2 x 106 é eficiente para terapia, como relatado por Tognoli et al. (2009)Tognoli G.K., Olsson D.C., Martins D.B., Santos Júnior E.B., Salbego F.Z., Oliveira G.K., Braga F.V.A., Raiser A.G., Dezengrini R., Da Cruz F.S.F., Castro M.B., Rosa M.C., Carregaro A.B. & Pippi N.L. 2009. Transplante autólogo de células mononucleares da medula óssea em úlcera de córnea experimental em cães. Ciência Rural 39(1):148-155. em experimento feito em cães em tecido ocular, ou 2 x 107 (Hu et al. 2007Hu J., Zhu Q.T., Liu X.L., Xu Y.B. & Zhu J.K. 2007. Repair of extended peripheral nerve lesions in rhesus monkeys using acellular allogenic nerve grafts implanted with autologous mesenchymal stem cells. Exp. Neurol. 204:658-666.) em macacos em nervo periférico e ainda 3 x 106 células utilizadas também em nervo periférico de equinos (Moraes, 2012Moraes J.M. 2012. Células-tronco da medula óssea e do tecido adiposo na regeneração do nervo ulnar em equinos. Tese de Doutorado em Ciência Animal, Escola de Veterinária e Zootecnia, Universidade Federal de Goiás, Goiânia. 108p.). Já outros estrapolam para valores como 10 x 106 células como evidenciado por Frisbie et al. (2009)Frisbie D.D., Kisiday J.D., Kawcak C.E., Werpy N.M. & McIlwraith C.W. 2009. Evaluation of adipose-derived stromal vascular fraction or bone marrow-derived mesenchymal stem cells for treatment of osteoarthritis. J. Orthop. Res. 27(12):1675-1680. em experimento realizado com equinos no tratamento de osteoartite. Com base nas informações, conclui-se que a quantidade de CTA obtida nas colheitas A e B está dentro de uma margem aceitável e viável para o sucesso de um tratamento baseado na terapia celular, com exceção das colheitas no animal 1, que não atingiram o quantitativo celular preconizado pelo autor em questão.
A porcentagem de viabilidade nas contagens da FCM, comparando as colheitas A e B, com o uso de DMEM ou PBS estão apresentadas no Quadro 2. A média geral de viabilidade celular foi de 72,2%, semelhante ao encontrado por Barreira (2005)Barreira A.P.B. 2005. Implante Botucatu: tese autólogo de células mesenquimais no tratamento de tendinites induzidas em equinos: avaliação clínica, ultra-sonográfica, histopatológica e imunoistoquímica. Tese de Doutorado em Medicina Veterinária, Faculdade de Medicina Veterinária e Zootecnia, Universidade Estadual Paulista, Botucatu, SP. 97p. com 76%, e Moraes (2012)Moraes J.M. 2012. Células-tronco da medula óssea e do tecido adiposo na regeneração do nervo ulnar em equinos. Tese de Doutorado em Ciência Animal, Escola de Veterinária e Zootecnia, Universidade Federal de Goiás, Goiânia. 108p. com 77,3% de viabilidade celular, mas consideravelmente menor que a observada por Alves et al. (2009)Alves A.L.G., Vieira M.E.M., Barreira A.P.B., Mota L.S.L.S., Saito M.E., Kohayagawa A., Hussni C.A., Watanabe M.J. & Oliveira G.G. 2009. Protocolo de isolamento de células mononucleares de medula óssea de eqüinos. Vet. Zootec. 16:650-655., que obteve uma média de 86,9%. De acordo com Alves et al. (2009)Alves A.L.G., Vieira M.E.M., Barreira A.P.B., Mota L.S.L.S., Saito M.E., Kohayagawa A., Hussni C.A., Watanabe M.J. & Oliveira G.G. 2009. Protocolo de isolamento de células mononucleares de medula óssea de eqüinos. Vet. Zootec. 16:650-655., essa menor viabilidade normalmente encontrada em equinos, pode estar relacionada com a alta coagulabilidade medular nessa espécie, o que também foi evidenciado por Moraes (2012)Moraes J.M. 2012. Células-tronco da medula óssea e do tecido adiposo na regeneração do nervo ulnar em equinos. Tese de Doutorado em Ciência Animal, Escola de Veterinária e Zootecnia, Universidade Federal de Goiás, Goiânia. 108p., mas difere de outras espécies, já que em cães a viabilidade de FCM pode atingir 97% como relatado por Tognoli et al. (2009)Tognoli G.K., Olsson D.C., Martins D.B., Santos Júnior E.B., Salbego F.Z., Oliveira G.K., Braga F.V.A., Raiser A.G., Dezengrini R., Da Cruz F.S.F., Castro M.B., Rosa M.C., Carregaro A.B. & Pippi N.L. 2009. Transplante autólogo de células mononucleares da medula óssea em úlcera de córnea experimental em cães. Ciência Rural 39(1):148-155..
Nesse sentido, as colheitas realizadas com injeção de solução de heparina apresentaram maior concentração celular, provavelmente devido à menor ocorrência de coagulação da MO no momento da colheita, porém não foi significativo (p>0,05) quando se comparou com a colheita A. No entanto, esse resultado pode ser biologicamente relevante para a terapia celular, visto que uma das estratégias utilizadas para a terapia é baseada no princípio de se obter a maior quantidade celular possível de CTA nos aspirados de MO para que a terapia seja efetiva, como descrito acima. Assim, quanto maior o número celular obtido na FCM, maior será a indução de efeitos terapêuticos benéficos, sem que haja a necessidade de cultivo celular (Kraus & Kirker-Head 2006Kraus K.H. & Kirker-Head C. 2006. Mesenchymal stem cells and bone regeneration. Vet. Surg. 35(3):232-242.). Oliveira (2009)Oliveira B.J.N.A. 2009. Isolamento e cultivo de células tronco mesenquimais: revisão de literatura. Tese de Doutorado em Cirurgia Experimental, Escola de Veterinária e Zootecnia, Universidade Federal de Goiás, Goiânia. 44p. cita que a utilização de solução de heparina não é recomendada como anticoagulante, pois poderia ser um fator causador de dano celular. Porém, os estudos realizados por Barreira (2005)Barreira A.P.B. 2005. Implante Botucatu: tese autólogo de células mesenquimais no tratamento de tendinites induzidas em equinos: avaliação clínica, ultra-sonográfica, histopatológica e imunoistoquímica. Tese de Doutorado em Medicina Veterinária, Faculdade de Medicina Veterinária e Zootecnia, Universidade Estadual Paulista, Botucatu, SP. 97p., Ribeiro (2009)Ribeiro G 2009. Células-tronco mesenquimais de equinos: isolamento, cultivo e caracterizacão. Tese de Doutorado em Cirurgia Veterinária, Faculdade de Ciências Agrárias e Veterinárias, Universidade Estadual Paulista, Jaboticabal, SP. 84p., Tognoli et al. (2009)Tognoli G.K., Olsson D.C., Martins D.B., Santos Júnior E.B., Salbego F.Z., Oliveira G.K., Braga F.V.A., Raiser A.G., Dezengrini R., Da Cruz F.S.F., Castro M.B., Rosa M.C., Carregaro A.B. & Pippi N.L. 2009. Transplante autólogo de células mononucleares da medula óssea em úlcera de córnea experimental em cães. Ciência Rural 39(1):148-155. e Moraes (2012)Moraes J.M. 2012. Células-tronco da medula óssea e do tecido adiposo na regeneração do nervo ulnar em equinos. Tese de Doutorado em Ciência Animal, Escola de Veterinária e Zootecnia, Universidade Federal de Goiás, Goiânia. 108p. não demonstraram haver alteração na viabilidade das células isoladas de MO com a utilização de heparina no momento das colheitas e diluições.
Com relação aos dois meios de diluição utilizados, DMEM e PBS, não houve diferença (p>0,05) entre os dois, indicando que os meios não alteraram a viabilidade celular durante esse processo. Muitos autores como Tognoli et al. (2009)Tognoli G.K., Olsson D.C., Martins D.B., Santos Júnior E.B., Salbego F.Z., Oliveira G.K., Braga F.V.A., Raiser A.G., Dezengrini R., Da Cruz F.S.F., Castro M.B., Rosa M.C., Carregaro A.B. & Pippi N.L. 2009. Transplante autólogo de células mononucleares da medula óssea em úlcera de córnea experimental em cães. Ciência Rural 39(1):148-155., Delling et al. (2012)Delling U., Lindner K., Ribitsch I., Jülke H. & Brehm W. 2012. Comparison of bone marrow aspiration at the sternum and the tuber coxae in middleaged horses. Can. J. Vet. Res. 76:52-56., Burk et al. (2013)Burk J., Ribitsch I., Gittel C., Juelke H., Kasper C., Staszyk C. & Brehm W. 2013. Growth and differentiation characteristics of equine mesenchymal stromal cells derived from different sources. Vet. Journal 195(1):98-106., Maia et al. (2013)Maia L., Landim-Alvarenga F.C., Da Mota L.S., De Assis Golim M., Laufer-Amorim R., De Vita B., Barberini D.J., Listoni A.J., De Moraes C.N., Heckler M.C. & Amorim R.M. 2013. Immunophenotypic, immunocytochemistry, ultrastructural, and cytogenetic characterization of mesenchymal stem cells from equine bone marrow. Microsc. Res Tech. 76(6):618-624., Barberini et al. (2014)Barberini D.J., Freitas N.P.P., Magnoni M.S., Maia L., Listoni A.J., Heckler M. C., Sudano M.J., Golim M.A., Landim-Alvarenga F.C. & Amorim R.M. 2014. Equine mesenchymal stem cells from bone marrow, adipose tissue and umbilical cord: immunophenotypic characterization and differentiation potential. Stem Cell Res. Ther. 5(25):1-11., Schnabel et al. (2014)Schnabel L.V., Pezzanite L.M., Antczak D.F., Felippe M.J.B. & Fortier L.A. 2014. Equine bone marrow-derived mesenchymal stromal cells are heterogeneous in MHC class II expression and capable of inciting an immune response in vitro. Stem Cell Res Ther. 5(13):1-13. e Varanda et al. (2015)Varanda L.F.O., Moraes J.M., Sales J.V.F., Mota A.L.A.A., Barreto-Vianna A.R.C., Godoy R.F. & Lima E.M.M. 2015. Collection and isolation of mesenchymal stem cells from equine bone marrow. Online J. Vet. Res. 19(3):216-223.. utilizaram o DMEM como solução de diluição, sendo o meio de eleição para tal finalidade. No entanto, Bravo et al. (2012)Bravo M.O., Moraes J.M., Dummont C.B.S., Filgueiras R.R., Hashimoto H.H. & Godoy R.F. 2012. Isolamento, expansão e caracterização de célulastronco do tecido adiposo de equinos. Ars Vet. 28(2):66-74. e Moraes (2012)Moraes J.M. 2012. Células-tronco da medula óssea e do tecido adiposo na regeneração do nervo ulnar em equinos. Tese de Doutorado em Ciência Animal, Escola de Veterinária e Zootecnia, Universidade Federal de Goiás, Goiânia. 108p. utilizaram o PBS como meio diluidor e obtiveram resultados satisfatórios com relação à viabilidade celular. Isso corrobora com os achados neste experimento, e reafirma a possibilidade de utilização do PBS para o isolamento de FCM, o que torna uma opção mais econômica em relação ao DMEM.
Conclusões
Os protocolos utilizados para colheita de medula óssea (MO) e separação da FCM se mostraram eficientes, com valores de concentração e viabilidade celular satisfatórios em todos os tipos de colheitas e diluições.
O protocolo com injeção de solução de heparina no interior do osso esterno se mostrou mais eficiente quanto à facilidade de obtenção de MO.
Agradecimentos
Ao CNPq e à FAPDF pelo auxílio pesquisa concedido para o desenvolvimento do projeto. Ao DPP/UnB pela bolsa de iniciação científica cedida. À professora Carolina Lucci, do Departamento de Ciências Fisiológicas, pelas instalações cedidas ao processamento das amostras. À SEAPA/DF por conceder os animais utilizados no projeto. Ao Hospital Veterinário de Grandes Animais da Universidade de Brasília ceder as instalações para realização das colheitas de MO e internação dos animais.
Referências
- Adams M.K., Goodrich L.R., Rao S., Olea-Popelka F., Phillips N., Kisiday J.D. & McIlwraith C.W. 2013. Equine bone marrow-derived mesenchymal stromal cells (BMDMSCs) from the ilium and sternum: are there differences? Equine Vet. J. 45(3):372-375.
- Alves A.L.G., Vieira M.E.M., Barreira A.P.B., Mota L.S.L.S., Saito M.E., Kohayagawa A., Hussni C.A., Watanabe M.J. & Oliveira G.G. 2009. Protocolo de isolamento de células mononucleares de medula óssea de eqüinos. Vet. Zootec. 16:650-655.
- Barberini D.J., Freitas N.P.P., Magnoni M.S., Maia L., Listoni A.J., Heckler M. C., Sudano M.J., Golim M.A., Landim-Alvarenga F.C. & Amorim R.M. 2014. Equine mesenchymal stem cells from bone marrow, adipose tissue and umbilical cord: immunophenotypic characterization and differentiation potential. Stem Cell Res. Ther. 5(25):1-11.
- Barreira A.P.B. 2005. Implante Botucatu: tese autólogo de células mesenquimais no tratamento de tendinites induzidas em equinos: avaliação clínica, ultra-sonográfica, histopatológica e imunoistoquímica. Tese de Doutorado em Medicina Veterinária, Faculdade de Medicina Veterinária e Zootecnia, Universidade Estadual Paulista, Botucatu, SP. 97p.
- Barreira A.P.B., Bacellar D.T.L., Kiffer R.G. & Alves A.L.G. 2008. Punção aspirativa de medula óssea em equinos adultos para obtenção de célulastronco. Revta Bras. Ciênc. Vet. 15(1):56-59.
- Bravo M.O., Moraes J.M., Dummont C.B.S., Filgueiras R.R., Hashimoto H.H. & Godoy R.F. 2012. Isolamento, expansão e caracterização de célulastronco do tecido adiposo de equinos. Ars Vet. 28(2):66-74.
- Burk J., Ribitsch I., Gittel C., Juelke H., Kasper C., Staszyk C. & Brehm W. 2013. Growth and differentiation characteristics of equine mesenchymal stromal cells derived from different sources. Vet. Journal 195(1):98-106.
- Delling U., Lindner K., Ribitsch I., Jülke H. & Brehm W. 2012. Comparison of bone marrow aspiration at the sternum and the tuber coxae in middleaged horses. Can. J. Vet. Res. 76:52-56.
- Durando M.M., Zarucco L., Schaer T.P., Ross M. & Reef V.B. 2006. Pneumopericardium in a horse secondary to sternal bone marrow aspiration. Equine Vet. Educ. 18:75-79.
- Frisbie D.D., Kisiday J.D., Kawcak C.E., Werpy N.M. & McIlwraith C.W. 2009. Evaluation of adipose-derived stromal vascular fraction or bone marrow-derived mesenchymal stem cells for treatment of osteoarthritis. J. Orthop. Res. 27(12):1675-1680.
- Gengozian N. 2000. Identification and isolation of hematopoietic progenitors, p.91-96. In: Feldman B.F., Zinkl J.G. & Jain N.C. (Eds), Schalm's Veterinary Hematology. Williams and Wilkins, Philadelphia.
- Hu J., Zhu Q.T., Liu X.L., Xu Y.B. & Zhu J.K. 2007. Repair of extended peripheral nerve lesions in rhesus monkeys using acellular allogenic nerve grafts implanted with autologous mesenchymal stem cells. Exp. Neurol. 204:658-666.
- Kasashima Y., Ueno T., Tomita A., Goodship A.E. & Smith R.K.W. 2011. Optimisation of bone marrow aspiration from the equine sternum for the safe recovery of mesenchymal stem cells. Equine Vet. J. 43(3):288-294.
- Kisiday J.D., Goodrich L.R., McIlwraith C.W. & Frisbie D.D. 2013. Effects of equine bone marrow aspirate volume on isolation, proliferation, and differentiation potential of mesenchymal stem cells. Am. J. Vet. Res. 74(5):801-807.
- Koch T.G., Berg L.C. & Betts D.H. 2008. Concepts for the clinical use of stem cells in equine medicine. Can. Vet. J. 49:1009-1017.
- Koch T.G., Berg L.C. & Betts D.H. 2009. Current and future regenerative medicine: principles, concepts and therapeutic use of stem cell therapy and tissue engineering in equine medicine. Can. Vet. J. 50:155-165.
- Kraus K.H. & Kirker-Head C. 2006. Mesenchymal stem cells and bone regeneration. Vet. Surg. 35(3):232-242.
- Maia L., Landim-Alvarenga F.C., Da Mota L.S., De Assis Golim M., Laufer-Amorim R., De Vita B., Barberini D.J., Listoni A.J., De Moraes C.N., Heckler M.C. & Amorim R.M. 2013. Immunophenotypic, immunocytochemistry, ultrastructural, and cytogenetic characterization of mesenchymal stem cells from equine bone marrow. Microsc. Res Tech. 76(6):618-624.
- Moraes J.M. 2012. Células-tronco da medula óssea e do tecido adiposo na regeneração do nervo ulnar em equinos. Tese de Doutorado em Ciência Animal, Escola de Veterinária e Zootecnia, Universidade Federal de Goiás, Goiânia. 108p.
- Oliveira B.J.N.A. 2009. Isolamento e cultivo de células tronco mesenquimais: revisão de literatura. Tese de Doutorado em Cirurgia Experimental, Escola de Veterinária e Zootecnia, Universidade Federal de Goiás, Goiânia. 44p.
- Parekkadan B. & Milwid J.M. 2010. Mesenchymal stem cells as therapeutics. Annu. Rev. Biomed. Engineering 12:87-117.
- Rebelo S., Barreira A.P.B., Magalhães F., Fonseca F., Lobato G., Bacelar D.T., Silva Junior H. & Rorojevic R. 2010. Terapia celular com células-tronco em periostite de terceiro osso metacarpiano em cavalos de corrida: avaliação clínica e performance. Revta Eletrôn. Novo Enfoque 9(9):31-32.
- Ribeiro G 2009. Células-tronco mesenquimais de equinos: isolamento, cultivo e caracterizacão. Tese de Doutorado em Cirurgia Veterinária, Faculdade de Ciências Agrárias e Veterinárias, Universidade Estadual Paulista, Jaboticabal, SP. 84p.
- Schnabel L.V., Pezzanite L.M., Antczak D.F., Felippe M.J.B. & Fortier L.A. 2014. Equine bone marrow-derived mesenchymal stromal cells are heterogeneous in MHC class II expression and capable of inciting an immune response in vitro. Stem Cell Res Ther. 5(13):1-13.
- Tognoli G.K., Olsson D.C., Martins D.B., Santos Júnior E.B., Salbego F.Z., Oliveira G.K., Braga F.V.A., Raiser A.G., Dezengrini R., Da Cruz F.S.F., Castro M.B., Rosa M.C., Carregaro A.B. & Pippi N.L. 2009. Transplante autólogo de células mononucleares da medula óssea em úlcera de córnea experimental em cães. Ciência Rural 39(1):148-155.
- Varanda L.F.O., Moraes J.M., Sales J.V.F., Mota A.L.A.A., Barreto-Vianna A.R.C., Godoy R.F. & Lima E.M.M. 2015. Collection and isolation of mesenchymal stem cells from equine bone marrow. Online J. Vet. Res. 19(3):216-223.
Datas de Publicação
-
Publicação nesta coleção
Mar 2016
Histórico
-
Recebido
06 Jun 2015 -
Aceito
15 Jan 2016