Resumo:
O objetivo deste estudo foi descrever o desenvolvimento do esqueleto do punaré (Thrichomys laurentinus). Para tanto, foram utilizados 11 embriões e 12 fetos em diferentes estágios de desenvolvimento, sendo divididos em 4 grupos de acordo com o período gestacional. As amostras foram obtidas no Centro de Multiplicação de Animais Silvestres da Universidade Federal Rural do Semi-Árido, Mossoró-RN, Brasil. Após fixados em formol (10%) ou glutaraldeído (2,5%), foi realizada a analise morfológica com auxílio de lupa, sendo as características macroscópicas fotodocumentadas. Análises de raios-x e coloração por alizarina red foram realizadas para melhor compreensão do desenvolvimento ósseo. Nas análises de raio-x os embriões não apresentaram nenhuma radiopacidade, ao contrário dos fetos que apresentavam radiopacidade gradual ao longo dos grupos. No grupo II houve aumento de radiopacidade na região da coluna vertebral e das regiões mandibular e maxilar. No grupo III a radiopacidade estava aumentada nos membros pélvicos, nas costelas e na região frontal e no grupo IV nos membros torácicos e nas regiões occipital, temporal e frontal do crânio. Tais características foram confirmadas pelas analises histológicas e pela técnica de Alizarina Red. Com isso podemos concluir que o conhecimento acerca da embriologia do sistema ósseo normal é fundamental para o entendimento dos efeitos adversos causados pela nutrição e uso de drogas durante o desenvolvimento.
Termos de Indexação:
Esqueletogênese; punaré; membros torácicos; membros pélvicos
Abstract:
The aim of this study was to describe the skeletogenesis in punaré (Thrichomys laurentinus). We used 11 embryos and 12 fetuses in different stages of development, allocated into 4 groups. Samples were obtained from the Multiplication Center of Wild Animals, at Federal Rural University of the Semi-Arid, Mossoro/RN, Brazil. After fixed in formalin (10%) or glutaraldehyde (2.5%) the morphological analysis was performed with a magnifying glass, and the macroscopic characteristics were photographed. Analysis of X-rays and alizarin red staining was made to better understand the development of bone structures. In x-ray analysis, it was possible to verify that the embryos showed no radiopacity, unlike fetuses that had gradual radiopacity along of the groups. In group II, there was an increase in radiopacity in the spine, mandibular and maxillary regions. In group III, the radiopacity was increased in the hind limbs, ribs and in the frontal region, and group IV showed higher radiopacity in the thoracic limbs and occipital, temporal and frontal skull. These characteristics were confirmed by histological and alizarin red analysis. We concluded that the knowledge of normal skeletal embryology is critical for understanding of adverse effects caused by nutrition and use of drugs during the development.
Index Terms:
Skeletogenesis; punare; forelimbs; hind limb
Introdução
O punaré (Thrichomys laurentinus), conhecido como rato espinhoso é um roedor caviomorfo da família Echimydae (Wilson & Reeder 2005Wilson D.E & Reeder D.A. 2005. Mammal species of the world: a taxonomic and geographic reference. Johns Hopkins University Press, Baltimore.142p.). No Brasil, está distribuído nas regiões nordeste, central e sudeste principalmente na Caatinga e regiões da floresta Amazônica e Atlântica. A maturidade sexual da espécie ocorre entre o sétimo e o nono mês de vida, com período gestacional de 95 dias (Streilen 1982Streilen K.E. 1982. Ecology of small mammals in the semiarid Brazilian Caatinga. I. Climate and faunal composition. Ann. Carnegie Mus. 51:79-106.).
A embriologia pode levar ao entendimento sobre a origem e as causas de diversas doenças, e possíveis alterações da formação do embrião, as quais podem inclusive levar há perdas gestacionais. Frequentemente, espécies de roedores são utilizadas como modelos experimentais (Elson 1995Elson C.O., Sartor R.B., Tennyson G.S. & Riddell R.H. 1995. Experimental models of inflammatory bowel disease. Gastroenterology 109(4):1344-1367., Islam & Loots 2009Islam M.S. & Loots D.T. 2009. Experimental rodent models of type 2 diabetes: a review. Methods Find Exp Clin Pharmacol. 31(4):249-261.) por diversas razões que vão desde o baixo custo de manutenção, fácil manuseio e curto período de gestação, os quais representam fatores importantes para a obtenção e interpretação dos resultados, assim como para o acompanhamento das proles (Garzoni et al. 2004). Os roedores são particularmente interessantes para estudos celulares e moleculares. Assim muitas ferramentas moleculares são desenvolvidas com base em estudos realizados em roedores, como o desenvolvimento de anticorpos específicos e viabilidade e validação de dados de sequência do genoma. Além disso, o rápido desenvolvimento de genes alvos em roedores transgênicos e a manipulação genética constituem poderosos instrumentos para estudos básicos e biomédicos (Salvat et al. 2005).
Em relação ao sistema esquelético, sabe-se que embriologia clássica demonstra 3 linhagens embrionárias distintas que contribuem para a formação inicial do esqueleto, do qual a crista neural originam os derivados do arco braquial do esqueleto craniofacial, o esclerótomo gera a maior parte do esqueleto axial e a mesoderme lateral forma o esqueleto apendicular (Erlebacher et al. 1995Erlebacher A., Filvaroff E.H., Gitelman S.E. & Derynck R. 1995. Toward a molecular understanding of skeletal development. Cell80:371-381.). A osteogênese inicia-se a partir da diferenciação de célula tronco mesenquimal por uma linhagem osteogênica precurssora, estas células osteoprogenitoras demonstram capacidade de se diferenciarem em osteoblastos, condroblastos e fibroblastos (Grandy et al. 2011Grandy R., Sepulveda H., Aguilar R., Pihan P., Henriquez B., Olate J. & Montecino M. 2011. The Ric-8B Gene is highly expressed in proliferating preosteoblastic cells and downregulated during osteoblast differentiation in a SWI/SNF-and C/EBPβ-mediated manner. Mol. Cell Biol. 31(14):2997-3008.). Os osteoblastos vão dar origem aos osteócitos que são células que não possuem potencial proliferativo e migratório, correspondendo ao tipo celular mais abundante no tecido ósseo (Kogianni & Noble 2007Kogianni G. & Noble B.S. 2007. The biology of osteocytes. Curr. Osteoporos Rep. 5(2):81-86.). Os osteoclastos são células multinucleadas derivadas das células tronco hematopoiética responsáveis pela reabsorção óssea (Andia et al. 2006Andia D.C., Cerri P.S. & Spolidorio L.C. 2006. Tecido ósseo: aspectos morfológicos e histofisiológicos. Revta Odontol. Unesp 35(2):191-198.). Dessa forma a formação óssea ocorre por dois tipos de ossificação: a intramembranosa e endocondral. Na ossificação intramembranosa, os osteoblastos diferenciam diretamente do mesenquima ricamente vascularizado. Em contraste, na formação do osso endocondral, as células mesenquimais se condensam para formar um modelo de cartilagem hialina. A maioria dos ossos longos dos membros, as vértebras, as costelas e pelve são gerados pela ossificação endocondral com base em um molde pré-existente de cartilagem hialina, primórdios do futuro osso adulto (Cheng et al. 2014Cheng X., Chen J.L. & Laima Z. 2014. Biphasic influence of dexamethasone exposure on embryonic vertebrate skeleton development. Toxicol. Appl. Pharmacol. 281:19-29.).
O desenvolvimento do sistema esquelético tem sido alvo de estudos que buscam compreender não apenas o desenvolvimento normal (Abzhanov et al. 2007Abzhanov A., Rodda S.J., McMahon & Tabin C.J. 2007. Regulation of skeletogenic differentiation in cranial dermal bone. Development 134:3133-3144., Kaufman 2011), mas também as influências de drogas e medicamentos que possam interferir na formação, crescimento e fisiologia do esqueleto (Teixeira et al. 2010Teixeira L.V., Lopes S.T., Martins D.B., França R.T. & Fighera R.A. 2010. Punção aspirativa por agulha fina como método de coleta de material para a histopatologia no osteossarcoma canino. Pesq. Vet. Bras. 30(2):132-138., Cheng et al. 2014Cheng X., Chen J.L. & Laima Z. 2014. Biphasic influence of dexamethasone exposure on embryonic vertebrate skeleton development. Toxicol. Appl. Pharmacol. 281:19-29.), bem como descrições no individuo adulto podem contribuir para o conhecimento sobre a funcionalidade dos diferentes sistemas corpóreos (Borghesi et al. 2015Borghesi J., Mario L.C., Carvalho R.C., Rodrigues M.N., Favaron P.O. & Miglino M.A. 2015. Morphology of the digestive apparatus in Oligoryzomys nigripes (Rodentia, Sigmodontinae). J. Anim. Sci. 5:132-141.).
Assim, o objetivo deste estudo foi fornecer uma descrição detalhada do desenvolvimento do esqueleto do punaré, dados estes que poderão servir de base para estudos relacionados à analises filogenéticas e ecomorfológicas.
Material e Métodos
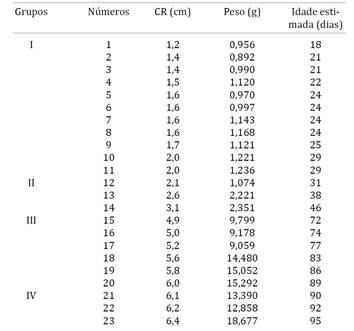
Foram utilizados 11 embriões e 12 fetos de punaré (Thrichomys laurentinus) com diferentes idades, as quais foram estimadas considerando o crown-rump (CR) dos embriões e fetos de acordo com Evans e Sack (1973)Evans H.E. & Sack W.O. 1973. Prenatal development of domestic and laboratory mammals: growth curves, external features and selected references. Anat. Histol. Embryol. 2:11-45., e peso (usando uma balança digital - modelo MARTE). Os indivíduos foram divididos em 4 grupos (I, II, III, e IV, ver Quadro 1). As amostras foram oriundos do CEMAS - Centro de Multiplicação de Animais Silvestres da Universidade Federal Rural do Semi-Árido (IBAMA 12.492-0.004), Mossoró-RN, Brasil e aprovada pelo Comitê de Ética da Universidade Federal Rural do Semi-Árido (Número 23091.001975/10-24).
Valores do comprimento dos embriões e fetos de punaré (Thrichomys laurentinus - Rodentia, Echimyidae), CR (cm), peso (g) e idade estimada (de acordo com Evans & Sack 1973)
Após fixação em formol (10%) ou glutaraldeído (2,5%), analisou-se a morfologia com auxílio de uma lente de aumento (Zeiss Stemi SV6, Alemanha) e câmera (Sony MVC - CD500). Irradiação de raios-x foram realizadas em fetos para melhor compreensão do desenvolvimento das estruturas ósseas. A nomenclatura baseou-se no International Committee on Veterinary Gross Anatomical Nomenclature (2012) e International Committee on Veterinary Embryological Nomenclature (2006).
Para histologia, as amostras foram desidratadas em soluções de etanol em concentrações crescentes (70 a 100%), diafanizadas em xilol e embebidas em paraplast (Paraplast Embedding Media, Oxford Lab., USA). Cortes de 5 μm de espessura obtidos em micrótomo automático (Leika RM2165, Alemanha) foram corados com hematoxilina e eosina (Tolosa et al. 2003Tolosa E.M.C., Rodrigues C.J., Behemer O.A. & Freitas-Neto A.G. 2003. Manual de Técnicas para Histologia Normal e Patológica. Manole, São Paulo. 341p.).
Para a técnica de alizarina red um indivíduo de cada grupo foi dissecado removendo-se a pele, músculos e órgãos internos. Os esqueletos foram mantidos em água destilada durante 72 h para então serem colocados em solução de 10 mg de azul Alcian, 80 ml de etanol 95% e 20 ml de ácido acético durante 48 h. Em seguida, foram transferidos para etanol 95% durante 3 dias, para então serem reidratadas em etanol e água destilada. Logo após, as amostras foram colocadas em 30 ml de borato de sódio durante 72 h e os esqueletos transferidos para solução de hidróxido de potássio 5g, 100 ml de água destilada, e 5 mg de vermelho de alizarina, durante 5 h. Finalmente, os esqueletos foram mantidas em glicerol.
Resultados
No Grupo I os embriões apresentaram curvatura cervical evidente com formato de "C", pele translucida, narinas fechadas sem fissura nasal, presença de folículos pilosos, vesícula óptica recoberta por película translucida, orelha externa arredondada, membros torácicos e pélvicos desenvolvidos com separação dos dígitos (Fig.1A). No Grupo II, possuíam corpo alongado, pele com pigmentação marrom, olhos perderam a película e ocorreu a formação da fissura palpebral. Os membros torácicos e pélvicos aumentaram de tamanho e identificou-se o órgão genital indiferenciado (Fig.1B). Os indivíduos do Grupo III apresentaram corpo ainda mais alongado, pele de aspecto enrugado, narinas com fissuras nasais havendo o aparecimento de garras (Fig.1C). Indivíduos do Grupo IV, eram semelhantes à neonatos, com presença de pêlos por todo o corpo, inclusive sensoriais na região das narinas. A orelha adquiriu um formato pontiagudo e as garras estavam completamente desenvolvidas (Fig.1D).
Analise macroscópica de embriões e fetos de Punaré (Thrichomys laurentinus). Em [A] grupo I, [B] grupo II, [C] grupo III e [D] grupo IV. Observar: vesicula optica (1), fissura nasal (2), região temporal (3), orelha externa (4), digitos (5), região cervical (6), região escapular (7), região abdominal (8), região femural (9), membro pélvico (10), cauda (11), tuberculo genital (12), garras (13) e foliculo piloso (14).
Inicialmente todo o sistema esquelético dos embriões era formado por tecido mesenquimal indiferenciado. No terço inicial da gestação, ocorreu o desenvolvimento dos somitos, da placa mesodérmica e da crista neural. As células mesenquimais primeiro se diferenciaram em tecido cartilaginoso, sendo possível notar essa diferenciação em embriões a partir do Grupo II (Fig.2A-2D). Com o avançar do desenvolvimento as cartilagens do corpo dos embriões e fetos se desenvolveram de maneira a assumir o formato do futuro osso.
Ossificação endocondral em fetos de Punaré (Thrichomys laurentinus) do grupo II. Em [A] somitos (S) dispostos ao longo da região lombar e tecido mesenquimal indiferenciado (M) subjacente. Em [B], [C] e [D] características dos condrócitos (C) em diferentes aumentos e zona demonstrando início do processo de calcificação (setas). Coloração hematoxilina-eosina.
À medida que a calcificação ocorreu, foram observadas pequenas espículas ósseas se irradiando para fora da região onde se iniciava a ossificação e substituição de tecido cartilagíneo por ósseo, como visto nas análises de raio-x, que demonstraram que fetos do Grupo I não apresentavam radiopacidade diferindo dos embriões dos demais Grupos que apresentavam radiopacidade gradual (Fig.3A-3B). O início do processo de ossificação endocondral foi visualizado primeiramente na coluna vertebral, estendendo-se posteriormente para as costelas, pelve e membros, respectivamente como observado nos exames de raio-x (Fig.3). No Grupo II ocorreu aumento da radiopacidade na região da coluna e regiões mandibular e maxilar, com evidência dos incisivos. No Grupo III, a radiopacidade estava aumentada nos membros pélvicos principalmente no fêmur, nas costelas, nas regiões mandibular e frontal. No Grupo IV, ocorreu radiopacidade nos membros torácicos (ossos do carpo, rádio e ulna e úmero), no membro pélvico (nos ossos társicos e tíbia), assim como no crânio (regiões occipital, temporal e frontal).
Imagem radiográfica de embrião e fetos de Punaré (Thrichomys laurentinus) dos quatro grupos estudados (I, II, III e IV). Em [A] vista latero-lateral direita e [B] vista latero-lateral esquerda. Notar: dentes incisivos (In), dentes (pontilhado), mandíbula (Ma), osso frontal (Fr), osso occipital (Oc), osso temporal (Te), vertebras (Ve), costelas (Co), úmero (Um), radio-ulna (Ru), ossos cárpicos (Ca), fêmur (Fe), tíbia (Ti) e ossos társicos (Ta).
Com relação ao desenvolvimento do crânio, os primórdios básicos cartilaginosos do condrocrânio foram visualizados no Grupo I (Fig.4 A,B), o qual era formado por pares de cartilagens que formavam o assoalho e as paredes rostral e inferior da calota craniana. No grupo II notou-se o início da substituição do tecido cartilaginoso por tecido ósseo, sendo este denominado de osteocrânio. Foram identificados ainda nessa fase os ossos nasal, frontal, parietal e occipital (Fig.4 C). Neste grupo ainda foram observados na região do crânio uma tabua cartilagínea nasal e uma cápsula óptica.
Desenvolvimento do crânio de Punaré (Thrichomys laurentinus). Em [A] analise histológica do crânio dos embriões pertencentes ao grupo I evidenciando o crânio (C), tecido cartilaginoso subjacente (Ca) e mesênquima (M). Em [B], [C], [D] e [E] desenvolvimento macroscópico do crânio corado pela técnica de Alizarina red, nos animais dos grupos I, II, III e IV, respectivamente. Notar as regiões: osso occipital (Oc), osso parietal (Pa), osso frontal (Fr), osso nasal (Na), osso zigomático (Zi), fissura craniana (pontilhado). A coloração (azul) em [B] especialmente evidencia o crânio completamente cartilaginoso em individuo do grupo I. Enquanto que nos grupos II, III e IV gradualmente há uma diminuição dos espaços entre os diferentes ossos que constituem o crânio, assim como aumento da ossificação (coloração vermelha). Em [F], [G], [H] e [I] analise histológica da cavidade oral dos animais do grupo I. Notar: na cavidade oral (Cor) os dentes incisivo superior (Is) e incisivo inferior (Ii) encontram-se dentro dos respectivos alvéolos. Detalhe dos ameloblasto (Am), dentina (De) e esmalte (Esm). Em [A] e [F-I] coloração hematoxilina-eosina.
Nos animais do Grupo III, os elementos individuais do crondrocrânio passaram por vários padrões de crescimento e de fusão para então formar os ossos do basicrânio, o occipital, esfenóide, ossos temporais, bem como grande parte dos ossos de apoio da cavidade nasal. Alguns destes ossos, como os ossos occipital e temporal incorporam componentes membranosos durante o seu desenvolvimento, tornando-se estruturas compostas (Fig.4 D). Nos animais do grupo IV, a parte caudal da trabécula nasal e as cartilagens trabeculares aumentaram de tamanho e se ossificaram para formar a lâmina crivosa do osso etmoide (Fig.4 E). Ao longo do desenvolvimento, as regiões mais periféricas de cada molde dos ossos cranianos, ainda formadas por tecido cartilaginoso, fecharam-se continuamente durante o desenvolvimento mediante a substituição do tecido cartilaginoso por tecido ósseo, diminuindo os espaços existentes entre ossos, restando ao final (Grupo IV) apenas as suturas que comunicam um osso com o outro.
No grupo II notou-se que o processo mandibular expandia-se em direção à linha média ventral e faringe. O processo maxilar crescia e se expande medialmente sob as elevações nasais e posteriormente fundiam-se com o processo nasal, juntos esses componentes formam o osso maxilar e o incisivo. Neste grupo, notou-se que a partir dos primórdios do osso incisivo as cavidades nasal e oral iniciavam seu processo de separação, notando-se uma pequena membrana oronasal a qual posteriormente se fundia dando origem a formação do processo palatino. Nos animais do grupo I foi possível observar o inicio do desenvolvimento dos dentes. Estes se desenvolvem a partir de componentes ectodérmicos e mesenquimais. Os dentes em formação, porém ainda não eruptados, encontravam-se recobertos pela gengiva (Fig.4F-4H), estando presentes os três principais componentes do órgão dental: o esmalte, dentina e o cemento (Fig.4H-4I). Nos animais do Grupo III foi verificada uma arcada dentária bem desenvolvida. No grupo IV todos os ossos do crânio encontravam-se formados (Fig.3).
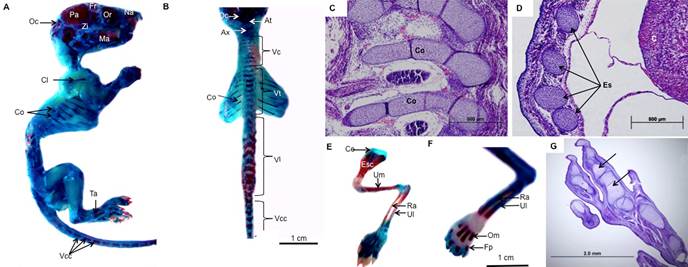
A coluna foi dividida em cinco regiões: cervical, torácica, lombar, sacral e caudal (Fig.5A e 5B). A região cervical inclui o eixo que liga a coluna vertebral ao crânio. Duas vértebras modificadas foram identificadas: o atlas e axis (Fig.5B). Nessa região em indivíduos do grupo II foram verificados característicos pontos de ossificação. Na região torácica, observou-se o ponto de início de formação das costelas verdadeiras (Fig.5C). O processo de ossificação das costelas foi bem evidenciado nos indivíduos dos grupos III e IV.
Desenvolvimento do aparelho locomotor de Punaré (Thrichomys laurentinus). Em [A] e [B] desenvolvimento ósseo corado pela técnica de Alizarina red dos animais pertencentes ao grupo IV. Notar as seguintes regiões: osso nasal (Na), osso frontal (Fr), orbita (Or), osso parietal (Pa), osso zigomático (Zi), osso occipital (Oc), osso mandibular (Ma), atlas (At), axis (Ax), vertebra cervical (Vc), vertebra torácica (Vt), vertebra lombar (Vl), vertebra coccígea (Vcc), costelas (Co), clavícula (Cl), ossos társicos (Ta). Regiões em vermelho indicam pontos de calcificação enquanto que aquelas coradas em azul são regiões formadas por tecidos cartilaginosos. Em [C] e [D] analise histológica dos membros nos animais do grupo II, III, respectivamente. Notar: costelas (Co) e esterno (Es) fazendo sintonia com o coração (C). Em [E] e [F] desenvolvimento do membro torácico corado pela técnica de Alizarina red dos animais pertencentes ao grupo IV. Notar: cartilagem escapular (Ce), escapula (Esc), úmero (Um), radio (Ra), Ulna (Ul), osso metatársico (Om) e falange proximal (Fp). Em [G] histologia do membro pélvico demostrando as falanges (setas) ossificadas. Coloração de hematoxilina-eosina em [C, D, G].
A região lombar, por sua vez compreende a área onde encontravam as vértebras lombares. Na região sacral as vértebras fundiam-se para a estruturação de um único osso sacral. Na região caudal foi notado que o processo de ossificação ocorre mais vagarosamente que nas regiões mencionadas anteriormente, sendo possível verificar uma completa formação vertebral desta região nos animais do Grupo III.
As extremidades distais das costelas cresciam em direção a linha média fazendo contato em cada face para formar uma agregação longitudinal de mesoderma somático. Esta agregação estruturava pares de bandas cartilagíneas que convergiam para a linha média ventral, as quais puderam ser observadas nos animais do Grupo II. Não foram observados pontos de ossificação desse mesmo osso nessa fase. O processo de calcificação do agregado cartilagíneo ocorria a partir dos 72 dias de gestação (Grupo III). Nesses indivíduos foi observada inicialmente a fusão entre as cartilagens para então posteriormente sofrer ossificação e formar um único osso, o esterno (Fig.5 D).
Com relação a ossificação dos ossos longos, notou-se que essa inicia na porção central (diáfise) da cartilagem estendendo-se para as porções mais periféricas (epífise proximal e distal). Nos animais do grupo I não foram verificados pontos de ossificação, sugerindo que a calcificação ainda não havia iniciado (Fig.3). Nessa fase, ainda estava ocorrendo à substituição das células mesenquimais por condroblastos
Os primeiros pontos de ossificação dos membros torácicos e pélvicos foram observados em animais do grupo II, com idades gestacionais de 31-46 dias. O crescimento ósseo dos membros torácicos e pélvicos ocorreu de maneira distinta, uma vez que pelas imagens de raio-x a ossificação dos ossos que compõem o membro pélvico precede à ossificação do membro torácico (Fig.3).
Observou-se ainda um tecido cartilagíneo que integra as cartilagens articular e epifisária. Estes dois tecidos cartilaginosos persistem ao longo da vida adulta, e foram encontrados nos fetos do grupo IV (Fig.5E-5G).
Discussão
Nos animais estudados, observamos que as células mesenquimais se diferenciam em tecido cartilaginoso entre os dias 31-46 de gestação semelhante as descrições de Abzhanov et al. (2007)Abzhanov A., Rodda S.J., McMahon & Tabin C.J. 2007. Regulation of skeletogenic differentiation in cranial dermal bone. Development 134:3133-3144. e Cheng et al. (2014)Cheng X., Chen J.L. & Laima Z. 2014. Biphasic influence of dexamethasone exposure on embryonic vertebrate skeleton development. Toxicol. Appl. Pharmacol. 281:19-29. em outros vertebrados, os quais afirmaram que os ossos intermembranosos surgem mediante a diferenciação do mesênquima. Tal descrição também assemelha-se aos achados de Hall & Miyake (2000)Hall B.K. & Miyake T. 2000. All for one and one for all: condensations and the initiation of skeletal development. BioEssays 22:138-147., que relatam que a condensação do tecido mesenquimal é a fase crucial do desenvolvimento do esqueleto. Ela ocorre quando uma população anteriormente dispersa de células se reúne para se diferenciar em um tipo de célula ou tecido. Karsenty (2008)Karsenty G. 2008. Transcriptional control of skeletogenesis. Annu. Rev. Genomics Hum. Genet. 9:183-196. e Grandy et al. (2011)Grandy R., Sepulveda H., Aguilar R., Pihan P., Henriquez B., Olate J. & Montecino M. 2011. The Ric-8B Gene is highly expressed in proliferating preosteoblastic cells and downregulated during osteoblast differentiation in a SWI/SNF-and C/EBPβ-mediated manner. Mol. Cell Biol. 31(14):2997-3008. relataram que os condrócitos são o primeiro grupo celular a organizar um molde do esqueleto, durante o desenvolvimento embrionário. Para os autores tanto os condrócitos quanto os osteoblastos possuem origem mesenquimal. Nos animais analisados nesta pesquisa, os primórdios básicos cartilaginosos do condrocrânio, e o início do desenvolvimento dos dentes foram visualizados nos embriões do Grupo I. Aos 31-46 dias de gestação (Grupo II) notou-se o inicio da substituição do tecido cartilaginoso, o qual formava o molde craniano por tecido ósseo. O processo mandibular expandia-se em direção à linha média ventral, ocasião na qual a faringe e os dentes ainda encontravam-se em formação, porém ainda não eruptados para a cavidade oral. Segundo Abzhanov et al. (2007)Abzhanov A., Rodda S.J., McMahon & Tabin C.J. 2007. Regulation of skeletogenic differentiation in cranial dermal bone. Development 134:3133-3144. a mineralização do esqueleto fornece elementos estruturais para formação morfológica da cabeça e do tronco na maioria dos vertebrados. A maior parte do esqueleto é produzido a partir de moldes cartilaginosos, os quais são substituídos por osso no processo de ossificação endocondral (Erlebacher et al. 1995Erlebacher A., Filvaroff E.H., Gitelman S.E. & Derynck R. 1995. Toward a molecular understanding of skeletal development. Cell80:371-381., Olsen et al. 2000Olsen B.R., Reginato A.M. & Wang W. 2000. Bone development. Annu. Rev. Cell Dev. Biol. 16:191-220., Kronenberg 2003Kronenberg H.M. 2003. Developmental regulation of the growth plate. Nature 423:332-336.). De forma semelhante, observou-se que nos animais do Grupo III os elementos individuais do crondrocrânio sofreram vários padrões de crescimento e de fusão, para então formar os ossos do crânio. Nesta mesma idade foi verificada uma arcada dentária já bem desenvolvida. Muitos dos ossos do esqueleto craniofacial surgem diretamente a partir da derme craniana (Noden 1983Noden D.M. 1983. The role of the neural crest in patterning of avian cranial skeletal, connective and muscle tissues. Dev. Biol. 96:144-165., Dunlop & Hall 1995Dunlop L.T. & Hall B.K. 1995. Relationships between cellular condensation, preosteoblast formation and epithelial-mesenchymal interactions in initiation of osteogenesis. Int. J. Dev. Biol. 39:357-371., Jiang et al. 2002Jiang X., Iseki S & Maxson R.E. 2002. Tissue origins and interactions in the mammalian skull vault. Dev. Biol. 241:106-116.). No grupo IV todos os ossos do crânio encontravam-se formados, inclusive os dentes.
Martin & Sims (2005)Martin T.J. & Sims N.A. 2005. Osteoclast-derived activity in the coupling of bone formation to resorption. Trends Mol. Med. 11(2):77-81. relatam que na remodelação óssea os osteoblastos são induzidos a se diferenciar em células ósseas. A diferenciação dos osteoblastos em osteoclastos, ocorre relativamente cedo, e é modelado por enzimas ativadas as quais posteriormente sinalizam para os osteoclastos a transmitirem informações para o osteo-linhagem para a formação do osso. Nos animais pertencentes ao grupo II foram verificados pontos de ossificação nas vértebras e formação cartilagínea que dará origem a caixa torácica. No grupo III notou-se completa formação vertebral, bem como a fusão entre as cartilagens, para formar o esterno. No grupo IV o processo de ossificação das costelas estava bem evidenciado. Abzhanov et al. (2007)Abzhanov A., Rodda S.J., McMahon & Tabin C.J. 2007. Regulation of skeletogenic differentiation in cranial dermal bone. Development 134:3133-3144. afirmam que os ossos intermembranosos surgem diretamente através da diferenciação do mesênquima, semelhante ao observado no punaré.
Nossos resultados em relação ao início dos pontos de ossificação se diferem dos descritos por Theiler (1989)Theiler K.1989. The house mouse: atlas of embryonic development. Springer-Verlag, New York. 178p. e Kaufman (2011) em camundongo onde é possível verificar essa característica a partir do 13º e 14º dias gestacionais, respectivamente. Ao contraio do nosso que ocorre a partir do 31ºdia gestacional. Segundo Theiler (1989)Theiler K.1989. The house mouse: atlas of embryonic development. Springer-Verlag, New York. 178p. as extremidades do corpo se desenvolvem rapidamente nesta fase no camundongo. O esqueleto do membro pélvico aos 13 dias de gestação já contém moldes cartilaginosos, enquanto que no membro torácico continua formado por tecido mesenquimal, resultados esses que se assemelham aos nossos, uma vez que as análises de raio-x evidenciaram formação tardia do membro torácico em relação ao pélvico.
Conclusões
Assim como em outras espécies de roedores, no punaré (Thrichomys laurentinus) o desenvolvimento do esqueleto mostrou-se como um conjunto gradual de processos celulares que envolvem migração, adesão, proliferação e crescimento celular.
Com este estudo foi possível conhecer a esqueletogênese desta espécie, uma vez que os roedores são frequentemente utilizados como modelos experimentais, inclusive para testar os efeitos de drogas sobre a formação óssea.
O conhecimento acerca da embriologia do sistema ósseo normal é fundamental para o entendimento dos efeitos adversos causados pelo uso de drogas no desenvolvimento ósseo ao longo do desenvolvimento embrionário.
Os resultados aqui apresentados acerca das características da osteogênese do punaré podem servir como parâmetros para traçar relações filogenéticas durante a especiação entre diferentes espécies.
Referências
- Abzhanov A., Rodda S.J., McMahon & Tabin C.J. 2007. Regulation of skeletogenic differentiation in cranial dermal bone. Development 134:3133-3144.
- Andia D.C., Cerri P.S. & Spolidorio L.C. 2006. Tecido ósseo: aspectos morfológicos e histofisiológicos. Revta Odontol. Unesp 35(2):191-198.
- Borghesi J., Mario L.C., Carvalho R.C., Rodrigues M.N., Favaron P.O. & Miglino M.A. 2015. Morphology of the digestive apparatus in Oligoryzomys nigripes (Rodentia, Sigmodontinae). J. Anim. Sci. 5:132-141.
- Cheng X., Chen J.L. & Laima Z. 2014. Biphasic influence of dexamethasone exposure on embryonic vertebrate skeleton development. Toxicol. Appl. Pharmacol. 281:19-29.
- Dunlop L.T. & Hall B.K. 1995. Relationships between cellular condensation, preosteoblast formation and epithelial-mesenchymal interactions in initiation of osteogenesis. Int. J. Dev. Biol. 39:357-371.
- Elson C.O., Sartor R.B., Tennyson G.S. & Riddell R.H. 1995. Experimental models of inflammatory bowel disease. Gastroenterology 109(4):1344-1367.
- Erlebacher A., Filvaroff E.H., Gitelman S.E. & Derynck R. 1995. Toward a molecular understanding of skeletal development. Cell80:371-381.
- Evans H.E. & Sack W.O. 1973. Prenatal development of domestic and laboratory mammals: growth curves, external features and selected references. Anat. Histol. Embryol. 2:11-45.
- Grandy R., Sepulveda H., Aguilar R., Pihan P., Henriquez B., Olate J. & Montecino M. 2011. The Ric-8B Gene is highly expressed in proliferating preosteoblastic cells and downregulated during osteoblast differentiation in a SWI/SNF-and C/EBPβ-mediated manner. Mol. Cell Biol. 31(14):2997-3008.
- Hall B.K. & Miyake T. 2000. All for one and one for all: condensations and the initiation of skeletal development. BioEssays 22:138-147.
- Islam M.S. & Loots D.T. 2009. Experimental rodent models of type 2 diabetes: a review. Methods Find Exp Clin Pharmacol. 31(4):249-261.
- Jiang X., Iseki S & Maxson R.E. 2002. Tissue origins and interactions in the mammalian skull vault. Dev. Biol. 241:106-116.
- Karsenty G. 2008. Transcriptional control of skeletogenesis. Annu. Rev. Genomics Hum. Genet. 9:183-196.
- Kogianni G. & Noble B.S. 2007. The biology of osteocytes. Curr. Osteoporos Rep. 5(2):81-86.
- Kronenberg H.M. 2003. Developmental regulation of the growth plate. Nature 423:332-336.
- Martin T.J. & Sims N.A. 2005. Osteoclast-derived activity in the coupling of bone formation to resorption. Trends Mol. Med. 11(2):77-81.
- Noden D.M. 1983. The role of the neural crest in patterning of avian cranial skeletal, connective and muscle tissues. Dev. Biol. 96:144-165.
- Olsen B.R., Reginato A.M. & Wang W. 2000. Bone development. Annu. Rev. Cell Dev. Biol. 16:191-220.
- Streilen K.E. 1982. Ecology of small mammals in the semiarid Brazilian Caatinga. I. Climate and faunal composition. Ann. Carnegie Mus. 51:79-106.
- Teixeira L.V., Lopes S.T., Martins D.B., França R.T. & Fighera R.A. 2010. Punção aspirativa por agulha fina como método de coleta de material para a histopatologia no osteossarcoma canino. Pesq. Vet. Bras. 30(2):132-138.
- Theiler K.1989. The house mouse: atlas of embryonic development. Springer-Verlag, New York. 178p.
- Tolosa E.M.C., Rodrigues C.J., Behemer O.A. & Freitas-Neto A.G. 2003. Manual de Técnicas para Histologia Normal e Patológica. Manole, São Paulo. 341p.
- Wilson D.E & Reeder D.A. 2005. Mammal species of the world: a taxonomic and geographic reference. Johns Hopkins University Press, Baltimore.142p.
Datas de Publicação
-
Publicação nesta coleção
Jun 2016
Histórico
-
Recebido
14 Dez 2015 -
Aceito
24 Mar 2016