RESUMO:
Objetivou-se com este estudo determinar a ocorrência e os fatores de risco associados à infecção por Campylobacter spp. em criações de ovinos no estado de Pernambuco, Brasil. Foram coletadas 421 amostras fecais de ovinos procedentes de 20 rebanhos para o isolamento de Campylobacter spp. As espécies Campylobacter fetus subsp. fetus e Campylobacter jejuni foram identificadas por Reação em Cadeia da Polimerase (PCR). Para análise dos fatores de risco foi realizada uma análise univariada e posteriormente regressão logística a partir de questionário com perguntas objetivas sobre o manejo higiênico-sanitário e reprodutivo. A ocorrência para Campylobacter spp. foi de 4,5% (19/421; I.C. 2,8% - 7,1%). Das 19 amostras positivas no cultivo, oito (1,9%; I.C. 0,9% - 3,9%) foram classificadas como C. fetus subsp. fetus e sete (1,7%; I.C. 0,7% - 3,6%) como C. jejuni, com co-infecção em quatro amostras (0,95%). O número de focos identificados foi de 35,0% (7/20) das criações de ovinos que apresentavam pelo menos um animal positivo. Na análise de regressão logística não foi identificada nenhuma das variáveis como fator de risco. Este é o primeiro registro da infecção por Campylobacter spp. em rebanhos ovinos no Nordeste do Brasil, concluindo-se que a infecção ocorre nesses rebanhos. Dessa forma, se faz necessário à implementação de medidas de controle e prevenção, para impedir a propagação do agente entre as criações, evitando prejuízos para ovinocultura e riscos para saúde pública, uma vez que a campilobacteriose é considerada uma zoonose emergente.
TERMOS DE INDEXAÇÃO:
Campylobacter spp.; campilobacteriose; ovinos; bacterioses
ABSTRACT:
The objective of this study was to determine the occurrence and risk factors associated with Campylobacter spp. infection in sheep in the State of Pernambuco, Brazil. A total of 421 fecal samples were collected from 20 herds for the isolation of Campylobacter spp. The species Campylobacter fetus and Campylobacter jejuni were identified by Polymerase Chain Reaction (PCR). To analyze the risk factors, logistic regression was conducted through a questionnaire about the hygienic-sanitary and reproductive management. The occurrence of Campylobacter spp. was 4.5% (19/421; C.I. 2.8 to 7.1%). Of the 19 positive samples isolated, eight (1.9% CI 0.9 to 3.9%) were classified as C. fetus subsp. fetus and seven (1.7% CI 0.7 to 3.5%) as C. jejuni, with co-infection in four samples (0.95%). The number of identified focuses was 35.0% (7/20) of the sheep herds that had at least one positive animal. The logistic regression analysis did not identify any of the variables as a risk factor. This appears to be the first report of infection with Campylobacter spp. in sheep herds in northeastern Brazil. Thus it is necessary to implement measures for control and prevention avoid damage to sheep production and risk to public health, since campylobacteriosis is considered an emerging zoonosis.
INDEX TERMS:
Campylobacter spp.; campylobacteriosis; sheep; bacterioses
Introdução
Os problemas reprodutivos em ovinos podem ser causados por inúmeros fatores de origem infecciosa ou não (Pinto et al. 2012Pinto A.P., Bacha F.B., Santos B.S., Driemeier D., Antoniassi N.A., Ribas N.L. & Lemos R.A. 2012. Sheep abortion associated with Neospora caninum in Mato Grosso do Sul, Brazil. Pesq. Vet. Bras. 32(8):739-742. http://dx.doi.org/10.1590/S0100-736X2012000800010.
https://doi.org/10.1590/S0100-736X201200...
, Rizzo et al. 2014Rizzo H., Gregory L., Beraldi F., Carvalho A.F., Pinheiro E.S. & Paulin L.M. 2014. Ocorrência de anticorpos anti-Brucella ovis em ovinos com histórico de distúrbios reprodutivos no estado de São Paulo, Brasil. Arqs Inst. Biológico, São Paulo 81(2):99-106.). Entre os principais agentes infecciosos, em vários países destaca-se Campylobacter spp., com taxas de aborto causadas pela infecção variando de 5% a 50% (Skirrow 1994Skirrow M.B. 1994. Diseases due to Campylobacter, Helicobacter and related bacteria. J. Comp. Pathol. 111(2):113-149. PMid:7806700. http://dx.doi.org/10.1016/S0021-9975(05)80046-5.
https://doi.org/10.1016/S0021-9975(05)80...
, Agerholm et al. 2006Agerholm J.S., Aalbaek B., Fog-Larsen A.M., Boye M., Holm E., Jensen T.K., Lindhardt T., Larsen L.E. & Buxton D. 2006. Veterinary and medical aspects of abortion in Danish sheep. Apmis 114(2):146-152. PMid:16519752. http://dx.doi.org/10.1111/j.1600-0463.2006.apm_362.x.
https://doi.org/10.1111/j.1600-0463.2006...
, Wu et al. 2014Wu Z., Sippy R., Sahin O., Plummer P., Vidal A., Newell D. & Zhang Q. 2014. Genetic diversity and antimicrobial susceptibility of Campylobacter jejuni isolates associated with sheep abortion in the United States and Great Britain. J. Clin. Microbiol. 52(6):1853-1861. PMid:24648552. http://dx.doi.org/10.1128/JCM.00355-14.
https://doi.org/10.1128/JCM.00355-14....
).
C. fetus subsp. fetus e C. jejuni são as principais espécies de Campylobacter envolvidas no aborto de ovelhas, que geralmente ocorre no último trimestre da gestação. Outros problemas reprodutivos que já foram relatados são: placentite, infecção uterina, natimortalidade, nascimento de cordeiros prematuros e morte de ovelhas devido à metrite e septicemia (Delong et al. 1996Delong W.J., Jaworski M.D. & Ward A.C. 1996. Antigenic and restriction enzyme analysis of Campylobacter spp. associated with abortion in sheep. Am. J. Vet. Res. 57(2):163-167. PMid:8633801., Sahin et al. 2008Sahin O., Plummer P.J., Jordan D.M., Sulaj K., Pereira S., Robbe-Austerman S., Wang L., Yaeger M.J., Hoffman L.J. & Zhang Q. 2008. Emergence of a tetracycline-resistant Campylobacter jejuni clone associated with outbreaks of ovine abortion in the United States. J. Clin. Microbiol. 46(5):1663-1671. PMid:18322054. http://dx.doi.org/10.1128/JCM.00031-08.
https://doi.org/10.1128/JCM.00031-08...
, Hamali et al. 2014Hamali H., Fallah S., Joozani R.J., Zare P. & Noorsaadat G. 2014. Detection of Campylobacter spp. in sheep aborted fetuses by PCR. TLS 3(2):49-56.). Os mecanismos pelos quais esse agente, que pode estar presente no intestino de ovinos sem causar doença clínica, leva a quadros de bacteremia ainda não estão totalmente elucidados (Hedstrom et al. 1987Hedstrom O.R., Sonn R.J., Lassen E.D., Hultgren B.D., Crisman R.O., Smith B.B. & Snyder S.P. 1987. Pathology of Campylobacter jejuni abortion in sheep. Vet. Pathol. 24(5):419-426. PMid:3672807. http://dx.doi.org/10.1177/030098588702400509.
https://doi.org/10.1177/0300985887024005...
, Skirrow 1994Skirrow M.B. 1994. Diseases due to Campylobacter, Helicobacter and related bacteria. J. Comp. Pathol. 111(2):113-149. PMid:7806700. http://dx.doi.org/10.1016/S0021-9975(05)80046-5.
https://doi.org/10.1016/S0021-9975(05)80...
, Sanad et al. 2014Sanad Y.M., Jung K., Kashoma I., Zhang X., Kassem I.I., Saif Y.M. & Rajashekara G. 2014. Insights into potential pathogenesis mechanisms associated with Campylobacter jejuni-induced abortion in ewes. BMC Vet. Res. 10:274. PMid:25420712. http://dx.doi.org/10.1186/s12917-014-0274-8.
https://doi.org/10.1186/s12917-014-0274-...
).
A campilobacteriose trata-se de uma zoonose de distribuição mundial, que causa gastroenterite em humanos (Zonios et al. 2005Zonios D.I., Panayiotakopoulos G.D., Kabletsas E.O., Tzima E.L., Stefanou I. & Archimandritis A.J. 2005. Campylobacter fetus bacteraemia in a healthy individual: clinical and therapeutical implications. J. Infect. 51(4):329-332. PMid:16291287. http://dx.doi.org/10.1016/j.jinf.2004.08.023.
https://doi.org/10.1016/j.jinf.2004.08.0...
, de Boer et al. 2013de Boer R.F., Ott A., Güren P., van Zanten E., van Belkum A. & Kooistra-Smid A.M.D. 2013. Detection of Campylobacter species and Arcobacter butzleri in stool samples by use of real-time multiplex PCR. J. Clin. Microbiol. 51(1):253-259. PMid:23152553. http://dx.doi.org/10.1128/JCM.01716-12.
https://doi.org/10.1128/JCM.01716-12....
). No Reino Unido já foi considerada a causa mais comum de diarreia bacteriana aguda, porém em alguns países como o Brasil, os relatos de campilobacteriose humana permanecem pouco descritos, sendo subnotificada (Ketley 1997Ketley J.M. 1997. Pathogenesis of enteric infection by Campylobacter. Microbiology 143(Pt 1):5-21. PMid:9025274. http://dx.doi.org/10.1099/00221287-143-1-5.
https://doi.org/10.1099/00221287-143-1-5...
). As rotas de infecção incluem o consumo de leite cru (Heuvelink et al. 2009Heuvelink A.E., van Heerwaarden C., Zwartkruis-Nahuis A., Tilburg J.J., Bos M.H., Heilmann F.G., Hofhuis A., Hoekstra T. & de Boer E. 2009. Two outbreaks of campylobacteriosis associated with the consumption of raw cows’ milk. Int. J. Food Microbiol. 134(1-2):70-74. PMid:19167125. http://dx.doi.org/10.1016/j.ijfoodmicro.2008.12.026.
https://doi.org/10.1016/j.ijfoodmicro.20...
), água contaminada com as fezes dos animais (Said et al. 2003Said B., Wright F., Nichols G.L., Reacher M. & Rutter M. 2003. Outbreaks of infectious disease associated with private drinking water supplies in England and Wales 1970-2000. Epidemiol. Infect. 130(3):469-479. PMid:12825731.), ou o contato direto com as fezes em áreas rurais (Gilpin et al. 2008Gilpin B.J., Scholes P., Robson B. & Savill M.G. 2008. The transmission of thermotolerant Campylobacter spp. to people living or working on dairy farms in New Zealand. Zoonoses Public Health. 55(7):352-360. PMid:18667028. http://dx.doi.org/10.1111/j.1863-2378.2008.01142.x.
https://doi.org/10.1111/j.1863-2378.2008...
).
Pouco ainda se tem estudado em relação à dinâmica da infecção por Campylobacter spp. em ovinos e os fatores de risco associados, com apenas dois relatos de casos da infecção em animais no Rio Grande do Sul (Vargas et al. 2005Vargas A.C., Cecim M., Viana L.R., Spricigo D.A. & Costa M.M. 2005. Isolation of Campylobacter jejuni from ovine aborted fetus: case report. Arq. Bras. Med. Vet. Zootec. 57(3):317-320. http://dx.doi.org/10.1590/S0102-09352005000300007.
https://doi.org/10.1590/S0102-0935200500...
, Gressler et al. 2012Gressler L.T., Kirinus J.K., Machado G., Libardoni F. & Vargas A.C. 2012. Campylobacter fetus subespécie fetus: abortamento e natimortalidade em ovinos. Ciência Rural 42(4):697-700. http://dx.doi.org/10.1590/S0103-84782012000400020.
https://doi.org/10.1590/S0103-8478201200...
.) e um estudo no estado de São Paulo (Rizzo et al. 2015Rizzo H., Gregory L., Beraldi F., Carvalho A.F. & Pinheiro E.S. 2015. Campylobacter isolation from the feces of sheep with a history of reproductive disorders bred in the state of São Paulo, Brazil. Semina, Ciênc. Agrárias 36(6):4207-4214. http://dx.doi.org/10.5433/1679-0359.2015v36n6Supl2p4207.
https://doi.org/10.5433/1679-0359.2015v3...
). Diante da escassez de informações, do impacto econômico que a doença pode causar nos rebanhos, e da preocupação para a saúde pública, objetivou-se com esse estudo determinar a ocorrência e fatores de risco associados à infecção por Campylobacter spp. em criações de ovinos.
Material e Métodos
Amostragem. Foi realizado um estudo transversal entre novembro de 2014 e junho de 2015 em 20 criações de ovinos, provenientes de 19 municípios do estado de Pernambuco, que compõem a microrregião Garanhuns (Fig.1). Em cada município foi selecionada de forma não-probabilística por conveniência uma propriedade, com exceção do município Terezinha onde foram amostradas duas propriedades. Para a amostra foi considerado um total de 92.074 ovinos na área (IBGE 2012IBGE 2012. Sistema IBGE de Recuperação Automática. Instituto Brasileiro de Geografia e Estatística. Disponível em <Disponível em http://www.sidra. ibge.gov.br/bda
> Acesso em 26 Jul. 2013.
http://www.sidra. ibge.gov.br/bda...
) e uma prevalência esperada de 50% para a infecção por Campylobacter spp., com um intervalo de confiança de 95% e erro estatístico de 5%. Este parâmetro indicou um tamanho mínimo a ser examinado de 385 ovinos (Thrusfield 2007Thrusfield M. 2007. Veterinary Epidemiology. 3rd ed. Blackwell Science, Cambridge, UK.), sendo coletadas no presente estudo 421 amostras fecais de forma aleatória sistemática. Para o cálculo das amostras por propriedade foi utilizando o programa estatístico Win Episcope 2.0, considerando o número de ovinos das criações e parâmetros de prevalência, intervalo de confiança e erro estatístico supracitados. Não houve critérios de exclusão em relação à raça, sexo, idade e sistema de criação.
Área de estudo da ocorrência da infecção por Campylobacter spp. em ovinos na microrregião Garanhuns, estado de Pernambuco.
Coleta de material biológico e isolamento bacteriano. As amostras de fezes foram coletadas por palpação retal com o uso de luva de procedimento e acondicionadas em frascos estéreis contendo 20 ml de meio de transporte e enriquecimento (TEM) (Lander 1990Lander K.P. 1990. The development of a transport and enrichment medium for Campylobacter fetus. Br. Vet. J. 146(4):327-333. PMid:2397372. http://dx.doi.org/10.1016/S0007-1935(11)80025-4.
https://doi.org/10.1016/S0007-1935(11)80...
) e enviadas sob temperatura ambiente para Central de Laboratórios de Garanhuns (CENLAG) da Universidade Federal Rural de Pernambuco para seu devido processamento.
No laboratório, as amostras foram incubadas a 37 °C durante 72 horas em condições de microaerofilia (10% CO2, 6% O2, 84% N2) e posteriormente semeadas em ágar Columbia (Difco®), adicionado de 7% de sangue equino desfibrinado e suplemento seletivo Skirrow (Himedia®) para Campylobacter spp., sendo novamente incubadas durante 72 horas em microaerofilia. Após a incubação foi realizada a análise fenotípica das colônias por morfologia e coloração de Gram (Quinn et al. 2014Quinn P.J., Carter M.E., Markey B. & Carter G.R. 2014. Clinical Veterinary Microbiology. 2nd ed. Wolfe, London, UK.). As colônias com características consistentes com Campylobacter spp. tiveram seu DNA extraído a partir do “QIAGEN Easy DNA Kit de sangue e tecidos” (Qiagen®), de acordo com o protocolo do fabricante. Após a extração o DNA foi quantificado com espectrofotômetro (Picodrop P200, Cambridge, UK) e a qualidade das amostras foi analisado pela razão da absorção a 260/280nm.
Reação em cadeia da polimerase (PCR). Como template foi utilizado o DNA extraído dos isolados bacterianos conforme descrito anteriormente, e 2,5μL dessa suspensão foram adicionados a 10 μl de Gotaq Green Master Mix (Promega®). Os oligonucleotídeos usados nas reações para amplificação do material genômico de C. fetus subsp. fetus foram MG3F (5’GGTAGCCGCAGCTGCTAAGAT3‘) e MG4R (5’TAGCTA CAATAACGACAACT3’), VenSF (5’CTTAGCAGTTTGCGATATTGCCATT3‘) e VenSR (5’GCTTTTGAGATAACAATAAGAGCTT3’) (Hum et al. 1997Hum S., Quinn K., Brunner J. & On S.L. 1997. Evaluation of a PCR assay for identification and differentiation of Campylobacter fetus subspecies. Aust. Vet. J. 75(11):827-831. PMid:9404619. http://dx.doi.org/10.1111/j.1751-0813.1997.tb15665.x.
https://doi.org/10.1111/j.1751-0813.1997...
), constando de desnaturação inicial a 95°C por 10 minutos, seguida por 30 ciclos: 95°C por 45 segundos, 50° por 45 segundos, 72°C por um minuto e 30 segundos, com extensão final a 72° por dez minutos. Para C. jejuni foram utilizados os CL2 (5’TGACGCTAGTGTTGTAGGAG3’) e CR3 (5’CCATCATCGCTAAGTGCAAC3’) (Wang et al. 1999Wang H., Farber J.M., Malik N. & Sanders G. 1999. Improved PCR detection of Campylobacter jejuni from chicken rinses by a simple sample preparation procedure. Int. J. Food Microbiol. 52(1-2):39-45. PMid:10573390. http://dx.doi.org/10.1016/S0168-1605(99)00110-5.
https://doi.org/10.1016/S0168-1605(99)00...
), com desnaturação inicial a 95°C por 5 minutos, seguida por 30 ciclos: 95°C por um minuto, 54° por um minuto, 72°C por um minuto, com extensão final a 72° por dez minutos. Os controles positivos das reações para C. fetus subsp. fetus e C. fetus subsp. venerealis foram fornecidos pela Universidade Federal de Santa Maria e para C. jejuni pela Fundação Oswaldo Cruz (CCAMP0008 e CCAMP00159). Como controle negativo foi utilizada água ultrapura. Os produtos amplificados foram identificados por eletroforese em gel de agarose (1,5%), corado com Blue Green (LGCbio®), visualizado sob luz UV e documentado por sistema de captura de imagem (Loccus biotecnologia, L. PIX, Cotia, Brasil).
Análise dos fatores de risco. Foi aplicado um questionário investigativo padronizado, composto por questões objetivas sobre o manejo higiênico-sanitário e reprodutivo para coleta de dados os quais foram submetidos à análise univariada das variáveis de interesse por meio do teste qui-quadrado de Pearson, ou Exato de Fisher, quando necessário. Posteriormente foi feita uma análise multivariada através do modelo de regressão logística considerando como variável dependente a PCR (positiva ou negativa). As variáveis independentes ou explanatórias consideradas no modelo foram aquelas que apresentaram significância estatística <0,20. Essa probabilidade foi estipulada para que possíveis fatores de risco do evento não fossem excluídos da análise (Hosmer & Lemeshow 1989Hosmer D.W. & Lemeshow S. 1989. Applied logistic regression. John Wiley and Sons, New York, USA.). O programa EPIInfo 3.5.2., foi utilizado para a execução dos cálculos estatísticos.
Preparação dos mapas de ocorrência da infecção por Campylobacter spp. Foram construídos mapas temáticos com a distribuição das ocorrências da infecção por Campylobacter spp. na microrregião de Garanhuns, no estado de Pernambuco, Brasil. A localização das propriedades foi obtida com o auxílio de sistema de posicionamento por satélite (GPS 76CSx, Garmin, Chicago, USA). Para o mapeamento e identificação dos aglomerados espaciais, os dados georreferenciados foram lançados no software Terra View 3.13.
Licença da comissão de ética. A pesquisa foi aprovada pela Comissão de Ética no Uso de Animais (CEUA) da Universidade Federal Rural de Pernambuco com a licença nº 042/2014.
Resultados
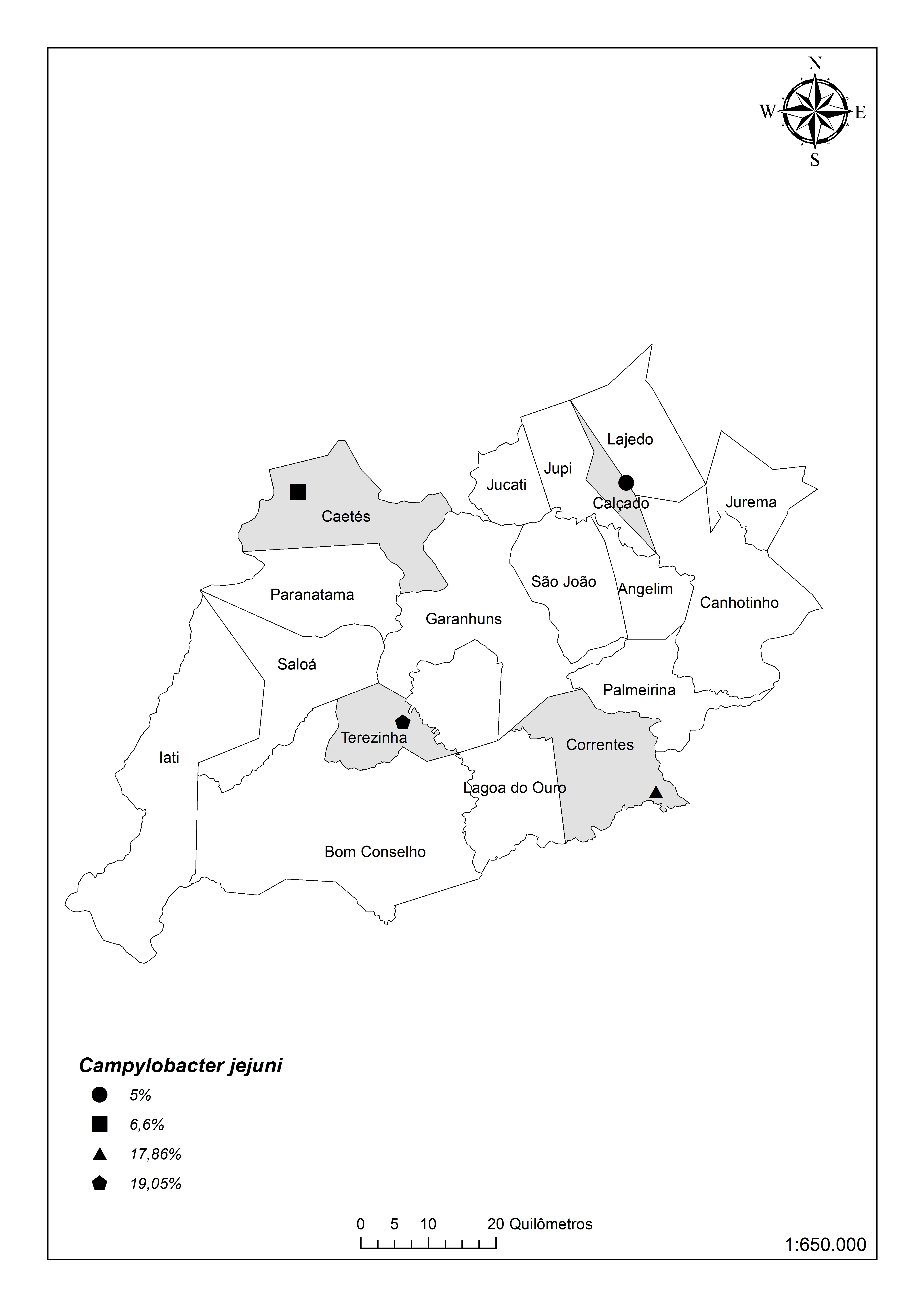
Das 421 amostras analisadas, 19 (4,5%; I.C. 2,8% - 7,1%) foram positivas para Campylobacter spp. Sendo oito (1,9%; I.C. 0,9% - 3,9%) amostras classificadas como C. fetus subsp. fetus e sete (1,7%; I.C. 0,7% - 3,6%) como C. jejuni a partir da PCR com os isolados, houve co-infecção em quatro amostras (0,95%). Em relação ao número de focos, 35,0% (7/20) das criações de ovinos estudadas apresentavam pelo menos um animal positivo (Fig.2 e 3).
Distribuição da infecção por Campylobacter fetus subsp. fetus em ovinos na microrregião Garanhuns, estado de Pernambuco.
Distribuição da infecção por Campylobacter jejuni em ovinos na microrregião Garanhuns, estado de Pernambuco.
Na análise univariada houve associação significativa para as variáveis: sistema de criação, compra de animais, não realização de quarentena e presença de problemas reprodutivos (Quadro 1). Na análise de regressão logística não foi confirmada nenhuma das variáveis como fator de risco.
Discussão
Este é o primeiro registro de infecção por Campylobacter spp. em ovinos no Nordeste do Brasil. No país, apenas três relatos da infecção foram previamente publicados. No estado do Rio Grande do Sul, Vargas et al. (2005)Vargas A.C., Cecim M., Viana L.R., Spricigo D.A. & Costa M.M. 2005. Isolation of Campylobacter jejuni from ovine aborted fetus: case report. Arq. Bras. Med. Vet. Zootec. 57(3):317-320. http://dx.doi.org/10.1590/S0102-09352005000300007.
https://doi.org/10.1590/S0102-0935200500...
identificaram C. jejuni como causador de quatro abortos em um rebanho de 22 ovelhas, com a hipótese de que a infecção teria ocorrido devido à presença de aves na propriedade, que se alimentavam e bebiam água juntamente com os ovinos. Enquanto que Gressler et al. (2012)Gressler L.T., Kirinus J.K., Machado G., Libardoni F. & Vargas A.C. 2012. Campylobacter fetus subespécie fetus: abortamento e natimortalidade em ovinos. Ciência Rural 42(4):697-700. http://dx.doi.org/10.1590/S0103-84782012000400020.
https://doi.org/10.1590/S0103-8478201200...
, por método molecular detectaram C. fetus subsp. fetus em dois natimortos e quatro fetos, naturalmente infectados, no terço final da gestação. No estado de São Paulo ocorreu isolamento de Campylobacter spp. em 3,75% (10/274) de amostras fecais de ovelhas que apresentavam histórico de problemas reprodutivos (Rizzo et al. 2015Rizzo H., Gregory L., Beraldi F., Carvalho A.F. & Pinheiro E.S. 2015. Campylobacter isolation from the feces of sheep with a history of reproductive disorders bred in the state of São Paulo, Brazil. Semina, Ciênc. Agrárias 36(6):4207-4214. http://dx.doi.org/10.5433/1679-0359.2015v36n6Supl2p4207.
https://doi.org/10.5433/1679-0359.2015v3...
).
Observou-se que embora neste estudo C. fetus subsp. fetus tenha sido identificada com uma maior frequência, não houve grande diferença entre o número de isolados desta e de C. jejuni. Em diversas regiões do mundo C. fetus subsp fetus tem sido a espécie mais frequentemente isolada, envolvida em problemas reprodutivos de rebanhos ovinos (Grogono-Thomas et al. 2003Grogono-Thomas R., Blaser M.J., Ahmadi M. & Newell D.G. 2003. Role of S-layer protein antigenic diversity in the immune responses of sheep experimentally challenged with Campylobacter fetus subsp. fetus. Infect. Immun. 71(1):147-154. PMid:12496160. http://dx.doi.org/10.1128/IAI.71.1.147-154.2003.
https://doi.org/10.1128/IAI.71.1.147-154...
, Mannering et al. 2004Mannering S.A., West D.M., Fenwick S.G., Marchant R.M., Perkins N.R. & O’Connell K. 2004. Pulsed-field gel electrophoresis typing of Campylobacter fetus subsp. fetus isolated from sheep abortions in New Zealand. N. Z.Vet. J. 52(6):358-363. PMid:15768136. http://dx.doi.org/10.1080/00480169.2004.36452.
https://doi.org/10.1080/00480169.2004.36...
, Campero et al. 2005Campero C.M., Anderson M.L., Walker R.L., Blanchard P.C., Barbano L., Chiu P., Martínez A., Combessies G., Bardon J.C. & Cordeviola J. 2005. Immunohistochemical identification of Campylobacter fetus in natural cases of bovine and ovine abortions. J. Vet. Med. B Infect. Dis. Vet. Public Health. 52(3):138-141. PMid:15876227. http://dx.doi.org/10.1111/j.1439-0450.2005.00834.x.
https://doi.org/10.1111/j.1439-0450.2005...
, Duncan et al. 2014Duncan J.S., Leatherbarrow A.J.H., French N.P. & Grove-White D.H. 2014. Temporal and farm-management-associated variation in faecal-pat prevalence of Campylobacter fetus in sheep and cattle. Epidemiol. Infect. 142(6):1196-1204. PMid:24067441. http://dx.doi.org/10.1017/S0950268813002379.
https://doi.org/10.1017/S095026881300237...
, Hamali et al. 2014Hamali H., Fallah S., Joozani R.J., Zare P. & Noorsaadat G. 2014. Detection of Campylobacter spp. in sheep aborted fetuses by PCR. TLS 3(2):49-56.). Porém, nos Estados Unidos observou-se um aumento da frequência de C. jejuni em relação a C. fetus subsp fetus (Delong et al. 1996Delong W.J., Jaworski M.D. & Ward A.C. 1996. Antigenic and restriction enzyme analysis of Campylobacter spp. associated with abortion in sheep. Am. J. Vet. Res. 57(2):163-167. PMid:8633801.). Independentemente das diferentes frequências de isolamento das espécies de Campylobacter spp. encontradas nos estudos, destaca-se que C. fetus subsp. fetus e C. jejuni podem causar problemas reprodutivos em ovinos.
No que se refere ao número de propriedades com animais positivos, observou-se uma distribuição do agente entre os rebanhos da região estudada (7/20). Isto é preocupante uma vez que já foi demonstrado que uma pequena proporção de animais pode ser responsável por grande eliminação da bactéria (Stanley & Jones 2003Stanley K. & Jones K. 2003. Cattle and sheep farms as reservoirs of Campylobacter. J. Appl. Microbiol. 94(supl.):104S-113S. PMid:12675942. http://dx.doi.org/10.1046/j.1365-2672.94.s1.12.x.
https://doi.org/10.1046/j.1365-2672.94.s...
). Através dessa distribuição espacial da infecção, pode-se estabelecer um planejamento e elaboração de medidas que possam controlar a disseminação do agente. A estruturação espacial de doenças infecciosas é considerada uma fonte de informação prévia, auxiliando atividades de investigação e de gestão relacionadas à vigilância de doenças, respostas a surtos, ou até mesmo otimização da descoberta de patógenos (Caprarelli & Fletcher 2014Caprarelli G. & Fletcher S. 2014. A brief review of spatial analysis concepts and tools used for mapping, containment and risk modelling of infectious diseases and other illnesses. Parasitology 141(5):581-601. PMid:24476672. http://dx.doi.org/10.1017/S0031182013001972.
https://doi.org/10.1017/S003118201300197...
, Murray et al. 2015Murray K.A., Preston N., Allen T., Zambrana-Torrelio C., Hosseini P.R. & Daszak P. 2015. Global biogeography of human infectious diseases. Proc. Natl Acad. Sci. 112(41):12746-12751. PMid:26417098. http://dx.doi.org/10.1073/pnas.1507442112.
https://doi.org/10.1073/pnas.1507442112....
).
Das sete criações positivas para Campylobacter spp., cinco (71,4%) tinham histórico de problemas reprodutivos e em todas elas os casos de abortos ocorreram no terço final de gestação, fato que corrobora com outros estudos sobre campilobacteriose ovina (Hedstrom et al. 1987Hedstrom O.R., Sonn R.J., Lassen E.D., Hultgren B.D., Crisman R.O., Smith B.B. & Snyder S.P. 1987. Pathology of Campylobacter jejuni abortion in sheep. Vet. Pathol. 24(5):419-426. PMid:3672807. http://dx.doi.org/10.1177/030098588702400509.
https://doi.org/10.1177/0300985887024005...
, Sanad et al. 2014Sanad Y.M., Jung K., Kashoma I., Zhang X., Kassem I.I., Saif Y.M. & Rajashekara G. 2014. Insights into potential pathogenesis mechanisms associated with Campylobacter jejuni-induced abortion in ewes. BMC Vet. Res. 10:274. PMid:25420712. http://dx.doi.org/10.1186/s12917-014-0274-8.
https://doi.org/10.1186/s12917-014-0274-...
, Skirrow 1994Skirrow M.B. 1994. Diseases due to Campylobacter, Helicobacter and related bacteria. J. Comp. Pathol. 111(2):113-149. PMid:7806700. http://dx.doi.org/10.1016/S0021-9975(05)80046-5.
https://doi.org/10.1016/S0021-9975(05)80...
). Estudos devem ser conduzidos para identificação da bactéria na placenta das ovelhas e nos fetos abortados para confirmar a participação do agente nos casos de abortos em ovinos.
Já foi demonstrada também a possibilidade de se identificar e classificar Campylobacter diretamente de amostras frescas através da PCR, pois a recuperação de células bacterianas viáveis muitas vezes se torna difícil diante da instabilidade e exigências de crescimento (Iraola et al. 2012Iraola G., Hernández M., Calleros L., Paolicchi F., Silveyra S., Velilla A., Carretto L., Rodríguez E. & Pérez R. 2012. Application of a multiplex PCR assay for Campylobacter fetus detection and subspecies differentiation in uncultured samples of aborted bovine fetuses. J. Vet. Sci. 13(4):371-376. PMid:23271178. http://dx.doi.org/10.4142/jvs.2012.13.4.371.
https://doi.org/10.4142/jvs.2012.13.4.37...
, Fallah et al. 2014Fallah S., Hamali H., Joozani R.J., Zare P. & Norsaadat G. 2014. A molecular (PCR) survey on abortions caused by Campylobacter spp. in sheep flocks located on the suburb of Tabriz. Iran. J. Vet. Sci. Technol. 6(1):23-29.).
As pesquisas desenvolvidas com Campylobacter spp. em ovinos geralmente são realizadas em rebanhos com histórico de problemas reprodutivos. Desta forma, acredita-se que estudos epidemiológicos devem ser realizados em rebanhos sem problemas reprodutivos, com o intuito de identificar a espécie ovina como reservatório para diminuir a contaminação do ambiente e prevenir casos de abortos. Estudos já indicam que ovinos saudáveis podem participar de maneira mais significativa que os bovinos na contaminação do ambiente e dos alimentos por eliminação de Campylobacter spp. (Stanley et al. 1998Stanley K.N., Wallace J.S., Currie J.E., Diggle P.J. & Jones K. 1998. Seasonal variation of thermophilic campylobacters inlambs at slaughter. J. Appl. Microbiol. 84(6):1111-1116. PMid:9717297. http://dx.doi.org/10.1046/j.1365-2672.1998.00450.x.
https://doi.org/10.1046/j.1365-2672.1998...
, Açik & Çetinkaya 2006Açik M.N. & Cetinkaya B. 2006. Heterogeneity of Campylobacter jejuni and Campylobacter coli strains from healthy sheep. Vet. Microbiol. 115(4):370-375. PMid:16574349. http://dx.doi.org/10.1016/j.vetmic.2006.02.014.
https://doi.org/10.1016/j.vetmic.2006.02...
).
Os fatores que interferem na eliminação fecal de micro-organismos zoonóticos, como Campylobacter, ainda não estão bem esclarecidos, com poucos dados disponíveis sobre animais naturalmente infectados. Estudos tem demonstrado que existe sazonalidade nessa eliminação em países de clima temperado (Stanley et al. 1998Stanley K.N., Wallace J.S., Currie J.E., Diggle P.J. & Jones K. 1998. Seasonal variation of thermophilic campylobacters inlambs at slaughter. J. Appl. Microbiol. 84(6):1111-1116. PMid:9717297. http://dx.doi.org/10.1046/j.1365-2672.1998.00450.x.
https://doi.org/10.1046/j.1365-2672.1998...
, Grove-White et al. 2010Grove-White D.H., Leatherbarrow A.J.H., Cripps P.J., Diggle P.J. & French N.P. 2010. Temporal and farm-management-associated variation in the faecal-pat prevalence of Campylobacter jejuni in ruminants. Epidemiol. Infect. 138(4):549-558. PMid:19845998. http://dx.doi.org/10.1017/S0950268809991051.
https://doi.org/10.1017/S095026880999105...
, Jorgensen et al. 2011Jorgensen F., Ellis-Iversen J., Rushton S., Bull S.A., Harris S.A., Bryan S.J., Gonzalez A. & Humphrey T.J. 2011. Influence of season and geography on Campylobacter jejuni and C. coli subtypes in housed broiler flocks reared in Great Britain. Appl. Environ. Microbiol. 77(11):3741-3748. PMid:21460110. http://dx.doi.org/10.1128/AEM.02444-10.
https://doi.org/10.1128/AEM.02444-10....
, Duncan et al. 2014Duncan J.S., Leatherbarrow A.J.H., French N.P. & Grove-White D.H. 2014. Temporal and farm-management-associated variation in faecal-pat prevalence of Campylobacter fetus in sheep and cattle. Epidemiol. Infect. 142(6):1196-1204. PMid:24067441. http://dx.doi.org/10.1017/S0950268813002379.
https://doi.org/10.1017/S095026881300237...
), porém em países de clima tropical, como o Brasil, não se tem registros da influência das estações do ano na eliminação desta bactéria.
Ainda sobre os problemas reprodutivos, alguns autores já afirmaram que as taxas de eliminação de Campylobacter spp. podem tornar-se elevadas devido ao estresse ou a infecções múltiplas, que reduzem a imunidade dos animais (Stanley & Jones 2003Stanley K. & Jones K. 2003. Cattle and sheep farms as reservoirs of Campylobacter. J. Appl. Microbiol. 94(supl.):104S-113S. PMid:12675942. http://dx.doi.org/10.1046/j.1365-2672.94.s1.12.x.
https://doi.org/10.1046/j.1365-2672.94.s...
, Yang et al. 2014Yang R., Jacobson C., Gardner G., Carmichael I., Campbell A.J. & Ryan U. 2014. Longitudinal prevalence, faecal shedding and molecular characterisation of Campylobacter spp. and Salmonella enterica in sheep. Vet. J. 202(2):250-254. PMid:25175721. http://dx.doi.org/10.1016/j.tvjl.2014.08.001.
https://doi.org/10.1016/j.tvjl.2014.08.0...
). Jones et al. (1999)Jones K., Howard S. & Wallace J.S. 1999. Intermittent shedding of thermophilic campylobacters by sheep at pasture. J. Appl. Microbiol. 86(3):531-536. PMid:10196758. http://dx.doi.org/10.1046/j.1365-2672.1999.00702.x.
https://doi.org/10.1046/j.1365-2672.1999...
observaram que quantidades mais elevadas de eliminação da bactéria coincidiam com a parição, desmame e troca de pasto, como também as ovelhas que não estavam eliminando Campylobacter spp. antes do parto iniciaram a eliminação do agente após a parição. No presente estudo, todas as amostras de fezes positivas foram oriundas de animais com mudança recente na alimentação.
Em todas as criações do estudo não se fazia qualquer tipo de controle de moscas e a presença dessas era comum nas propriedades. Foi comprovado que em propriedades onde os animais eliminam Campylobacter spp. nas fezes, as moscas podem servir como vetores, contaminando a água e os alimentos, apesar da baixa carga bacteriana carreada a partir delas (Sproston et al. 2010Sproston E.L., Ogden I.D., MacRae M., Forbes K.J., Dallas J.F., Sheppard S.K., Cody A., Colles F., Wilson M.J. & Strachan N.J.C. 2010. Multi-locus sequence types of Campylobacter carried by flies and slugs acquired from local ruminant faeces. J. Appl. Microbiol. 109(3):829-838. PMid:20337762. http://dx.doi.org/10.1111/j.1365-2672.2010.04711.x.
https://doi.org/10.1111/j.1365-2672.2010...
). Também não foram observadas boas práticas de higiene, como a limpeza das botas dos funcionários, o que pode ser importante na introdução e manutenção da exposição dos animais ao agente, bem como dos próprios funcionários (Kazwala et al. 1990Kazwala R.R., Collins J.D., Hannan J., Crinion R.A. & O’Mahony H. 1990. Factors responsible for the introduction and spread of Campylobacter jejuni infection in commercial poultry production. Vet. Rec. 126(13):305-306. PMid:2188414., Humphrey et al. 1993Humphrey T.J., Henley A. & Lanning D.G. 1993. The colonization of broiler chickens with Campylobacter jejuni: some epidemiological investigations. Epidemiol. Infect. 110(3):601-607. PMid:8519325. http://dx.doi.org/10.1017/S0950268800051025.
https://doi.org/10.1017/S095026880005102...
).
A relação entre ovinos e infecções por Campylobacter spp. em humanos já foi relatada (Raji et al. 2000Raji M.A., Adekeye J.O., Kwaga J.K.P. & Bale J.O.O. 2000. Bioserogroups of Campylobacter species isolated from sheep in Kaduna State, Nigeria. Small Rumin. Res. 37(3):215-221. PMid:10867319. http://dx.doi.org/10.1016/S0921-4488(00)00125-5.
https://doi.org/10.1016/S0921-4488(00)00...
). Os resultados obtidos com esse estudo possuem impacto para saúde pública, uma vez que a presença desse agente no ambiente pode favorecer a infecção em humanos (Whiley et al. 2013Whiley H., Van den Akker B., Giglio S. & Bentham R. 2013. The role of environmental reservoirs in human campylobacteriosis. Int. J. Environ. Res. Public. Health 10(11):5886-5907. PMid:24217177. http://dx.doi.org/10.3390/ijerph10115886.
https://doi.org/10.3390/ijerph10115886....
). Campylobacter spp. é um patógeno frequente nas infecções humanas causando desde gastroenterite até bacteremia e uma variedade de complicações sistêmicas (Adak et al. 2005Adak G.K., Meakins S.M., Yip H., Lopman B.A. & O’Brien S.J. 2005. Disease risks from foods, England and Wales, 1996-2000. Emerg. Infect. Dis. 11(3):365-372. PMid:15757549. http://dx.doi.org/10.3201/eid1103.040191.
https://doi.org/10.3201/eid1103.040191....
, Zonios et al. 2005Zonios D.I., Panayiotakopoulos G.D., Kabletsas E.O., Tzima E.L., Stefanou I. & Archimandritis A.J. 2005. Campylobacter fetus bacteraemia in a healthy individual: clinical and therapeutical implications. J. Infect. 51(4):329-332. PMid:16291287. http://dx.doi.org/10.1016/j.jinf.2004.08.023.
https://doi.org/10.1016/j.jinf.2004.08.0...
, de Boer et al. 2013de Boer R.F., Ott A., Güren P., van Zanten E., van Belkum A. & Kooistra-Smid A.M.D. 2013. Detection of Campylobacter species and Arcobacter butzleri in stool samples by use of real-time multiplex PCR. J. Clin. Microbiol. 51(1):253-259. PMid:23152553. http://dx.doi.org/10.1128/JCM.01716-12.
https://doi.org/10.1128/JCM.01716-12....
). No geral, a campilobacteriose é das doenças infecciosas mais importantes que desafiarão a saúde global nos próximos anos (Kaakoush et al. 2015Kaakoush N.O., Castaño-Rodríguez N., Mitchell H.M. & Man S.M. 2015. Global Epidemiology of Campylobacter Infection. Clin. Microbiol. Rev. 28(3):687-720. PMid:26062576. http://dx.doi.org/10.1128/CMR.00006-15.
https://doi.org/10.1128/CMR.00006-15....
).
Conclusões
A partir dos resultados obtidos observa-se que os ovinos são infectados por Campylobacter spp.
Assim, é necessária a implementação de medidas de controle e prevenção, para impedir a propagação do agente nas criações, evitando danos à produção de ovinos e os riscos para a saúde pública, uma vez que campilobacteriose é considerada uma zoonose emergente.
Agradecimentos
À FACEPE pela bolsa concedida e ao CNPq pelo apoio financeiro (processo nº447664/2014-0).
Referências
- Açik M.N. & Cetinkaya B. 2006. Heterogeneity of Campylobacter jejuni and Campylobacter coli strains from healthy sheep. Vet. Microbiol. 115(4):370-375. PMid:16574349. http://dx.doi.org/10.1016/j.vetmic.2006.02.014.
» https://doi.org/10.1016/j.vetmic.2006.02.014. - Adak G.K., Meakins S.M., Yip H., Lopman B.A. & O’Brien S.J. 2005. Disease risks from foods, England and Wales, 1996-2000. Emerg. Infect. Dis. 11(3):365-372. PMid:15757549. http://dx.doi.org/10.3201/eid1103.040191.
» https://doi.org/10.3201/eid1103.040191. - Agerholm J.S., Aalbaek B., Fog-Larsen A.M., Boye M., Holm E., Jensen T.K., Lindhardt T., Larsen L.E. & Buxton D. 2006. Veterinary and medical aspects of abortion in Danish sheep. Apmis 114(2):146-152. PMid:16519752. http://dx.doi.org/10.1111/j.1600-0463.2006.apm_362.x.
» https://doi.org/10.1111/j.1600-0463.2006.apm_362.x. - Campero C.M., Anderson M.L., Walker R.L., Blanchard P.C., Barbano L., Chiu P., Martínez A., Combessies G., Bardon J.C. & Cordeviola J. 2005. Immunohistochemical identification of Campylobacter fetus in natural cases of bovine and ovine abortions. J. Vet. Med. B Infect. Dis. Vet. Public Health. 52(3):138-141. PMid:15876227. http://dx.doi.org/10.1111/j.1439-0450.2005.00834.x.
» https://doi.org/10.1111/j.1439-0450.2005.00834.x. - Caprarelli G. & Fletcher S. 2014. A brief review of spatial analysis concepts and tools used for mapping, containment and risk modelling of infectious diseases and other illnesses. Parasitology 141(5):581-601. PMid:24476672. http://dx.doi.org/10.1017/S0031182013001972.
» https://doi.org/10.1017/S0031182013001972. - de Boer R.F., Ott A., Güren P., van Zanten E., van Belkum A. & Kooistra-Smid A.M.D. 2013. Detection of Campylobacter species and Arcobacter butzleri in stool samples by use of real-time multiplex PCR. J. Clin. Microbiol. 51(1):253-259. PMid:23152553. http://dx.doi.org/10.1128/JCM.01716-12.
» https://doi.org/10.1128/JCM.01716-12. - Delong W.J., Jaworski M.D. & Ward A.C. 1996. Antigenic and restriction enzyme analysis of Campylobacter spp. associated with abortion in sheep. Am. J. Vet. Res. 57(2):163-167. PMid:8633801.
- Duncan J.S., Leatherbarrow A.J.H., French N.P. & Grove-White D.H. 2014. Temporal and farm-management-associated variation in faecal-pat prevalence of Campylobacter fetus in sheep and cattle. Epidemiol. Infect. 142(6):1196-1204. PMid:24067441. http://dx.doi.org/10.1017/S0950268813002379.
» https://doi.org/10.1017/S0950268813002379. - Fallah S., Hamali H., Joozani R.J., Zare P. & Norsaadat G. 2014. A molecular (PCR) survey on abortions caused by Campylobacter spp. in sheep flocks located on the suburb of Tabriz. Iran. J. Vet. Sci. Technol. 6(1):23-29.
- Gilpin B.J., Scholes P., Robson B. & Savill M.G. 2008. The transmission of thermotolerant Campylobacter spp. to people living or working on dairy farms in New Zealand. Zoonoses Public Health. 55(7):352-360. PMid:18667028. http://dx.doi.org/10.1111/j.1863-2378.2008.01142.x.
» https://doi.org/10.1111/j.1863-2378.2008.01142.x. - Gressler L.T., Kirinus J.K., Machado G., Libardoni F. & Vargas A.C. 2012. Campylobacter fetus subespécie fetus: abortamento e natimortalidade em ovinos. Ciência Rural 42(4):697-700. http://dx.doi.org/10.1590/S0103-84782012000400020.
» https://doi.org/10.1590/S0103-84782012000400020. - Grogono-Thomas R., Blaser M.J., Ahmadi M. & Newell D.G. 2003. Role of S-layer protein antigenic diversity in the immune responses of sheep experimentally challenged with Campylobacter fetus subsp. fetus Infect. Immun. 71(1):147-154. PMid:12496160. http://dx.doi.org/10.1128/IAI.71.1.147-154.2003.
» https://doi.org/10.1128/IAI.71.1.147-154.2003. - Grove-White D.H., Leatherbarrow A.J.H., Cripps P.J., Diggle P.J. & French N.P. 2010. Temporal and farm-management-associated variation in the faecal-pat prevalence of Campylobacter jejuni in ruminants. Epidemiol. Infect. 138(4):549-558. PMid:19845998. http://dx.doi.org/10.1017/S0950268809991051.
» https://doi.org/10.1017/S0950268809991051. - Hamali H., Fallah S., Joozani R.J., Zare P. & Noorsaadat G. 2014. Detection of Campylobacter spp. in sheep aborted fetuses by PCR. TLS 3(2):49-56.
- Hedstrom O.R., Sonn R.J., Lassen E.D., Hultgren B.D., Crisman R.O., Smith B.B. & Snyder S.P. 1987. Pathology of Campylobacter jejuni abortion in sheep. Vet. Pathol. 24(5):419-426. PMid:3672807. http://dx.doi.org/10.1177/030098588702400509.
» https://doi.org/10.1177/030098588702400509. - Heuvelink A.E., van Heerwaarden C., Zwartkruis-Nahuis A., Tilburg J.J., Bos M.H., Heilmann F.G., Hofhuis A., Hoekstra T. & de Boer E. 2009. Two outbreaks of campylobacteriosis associated with the consumption of raw cows’ milk. Int. J. Food Microbiol. 134(1-2):70-74. PMid:19167125. http://dx.doi.org/10.1016/j.ijfoodmicro.2008.12.026.
» https://doi.org/10.1016/j.ijfoodmicro.2008.12.026. - Hosmer D.W. & Lemeshow S. 1989. Applied logistic regression. John Wiley and Sons, New York, USA.
- Hum S., Quinn K., Brunner J. & On S.L. 1997. Evaluation of a PCR assay for identification and differentiation of Campylobacter fetus subspecies. Aust. Vet. J. 75(11):827-831. PMid:9404619. http://dx.doi.org/10.1111/j.1751-0813.1997.tb15665.x.
» https://doi.org/10.1111/j.1751-0813.1997.tb15665.x. - Humphrey T.J., Henley A. & Lanning D.G. 1993. The colonization of broiler chickens with Campylobacter jejuni: some epidemiological investigations. Epidemiol. Infect. 110(3):601-607. PMid:8519325. http://dx.doi.org/10.1017/S0950268800051025.
» https://doi.org/10.1017/S0950268800051025. - IBGE 2012. Sistema IBGE de Recuperação Automática. Instituto Brasileiro de Geografia e Estatística. Disponível em <Disponível em http://www.sidra. ibge.gov.br/bda > Acesso em 26 Jul. 2013.
» http://www.sidra. ibge.gov.br/bda - Iraola G., Hernández M., Calleros L., Paolicchi F., Silveyra S., Velilla A., Carretto L., Rodríguez E. & Pérez R. 2012. Application of a multiplex PCR assay for Campylobacter fetus detection and subspecies differentiation in uncultured samples of aborted bovine fetuses. J. Vet. Sci. 13(4):371-376. PMid:23271178. http://dx.doi.org/10.4142/jvs.2012.13.4.371.
» https://doi.org/10.4142/jvs.2012.13.4.371. - Jones K., Howard S. & Wallace J.S. 1999. Intermittent shedding of thermophilic campylobacters by sheep at pasture. J. Appl. Microbiol. 86(3):531-536. PMid:10196758. http://dx.doi.org/10.1046/j.1365-2672.1999.00702.x.
» https://doi.org/10.1046/j.1365-2672.1999.00702.x. - Jorgensen F., Ellis-Iversen J., Rushton S., Bull S.A., Harris S.A., Bryan S.J., Gonzalez A. & Humphrey T.J. 2011. Influence of season and geography on Campylobacter jejuni and C. coli subtypes in housed broiler flocks reared in Great Britain. Appl. Environ. Microbiol. 77(11):3741-3748. PMid:21460110. http://dx.doi.org/10.1128/AEM.02444-10.
» https://doi.org/10.1128/AEM.02444-10. - Kaakoush N.O., Castaño-Rodríguez N., Mitchell H.M. & Man S.M. 2015. Global Epidemiology of Campylobacter Infection. Clin. Microbiol. Rev. 28(3):687-720. PMid:26062576. http://dx.doi.org/10.1128/CMR.00006-15.
» https://doi.org/10.1128/CMR.00006-15. - Kazwala R.R., Collins J.D., Hannan J., Crinion R.A. & O’Mahony H. 1990. Factors responsible for the introduction and spread of Campylobacter jejuni infection in commercial poultry production. Vet. Rec. 126(13):305-306. PMid:2188414.
- Ketley J.M. 1997. Pathogenesis of enteric infection by Campylobacter Microbiology 143(Pt 1):5-21. PMid:9025274. http://dx.doi.org/10.1099/00221287-143-1-5.
» https://doi.org/10.1099/00221287-143-1-5. - Lander K.P. 1990. The development of a transport and enrichment medium for Campylobacter fetus Br. Vet. J. 146(4):327-333. PMid:2397372. http://dx.doi.org/10.1016/S0007-1935(11)80025-4.
» https://doi.org/10.1016/S0007-1935(11)80025-4. - Mannering S.A., West D.M., Fenwick S.G., Marchant R.M., Perkins N.R. & O’Connell K. 2004. Pulsed-field gel electrophoresis typing of Campylobacter fetus subsp. fetus isolated from sheep abortions in New Zealand. N. Z.Vet. J. 52(6):358-363. PMid:15768136. http://dx.doi.org/10.1080/00480169.2004.36452.
» https://doi.org/10.1080/00480169.2004.36452. - Murray K.A., Preston N., Allen T., Zambrana-Torrelio C., Hosseini P.R. & Daszak P. 2015. Global biogeography of human infectious diseases. Proc. Natl Acad. Sci. 112(41):12746-12751. PMid:26417098. http://dx.doi.org/10.1073/pnas.1507442112.
» https://doi.org/10.1073/pnas.1507442112. - Pinto A.P., Bacha F.B., Santos B.S., Driemeier D., Antoniassi N.A., Ribas N.L. & Lemos R.A. 2012. Sheep abortion associated with Neospora caninum in Mato Grosso do Sul, Brazil. Pesq. Vet. Bras. 32(8):739-742. http://dx.doi.org/10.1590/S0100-736X2012000800010.
» https://doi.org/10.1590/S0100-736X2012000800010. - Quinn P.J., Carter M.E., Markey B. & Carter G.R. 2014. Clinical Veterinary Microbiology. 2nd ed. Wolfe, London, UK.
- Raji M.A., Adekeye J.O., Kwaga J.K.P. & Bale J.O.O. 2000. Bioserogroups of Campylobacter species isolated from sheep in Kaduna State, Nigeria. Small Rumin. Res. 37(3):215-221. PMid:10867319. http://dx.doi.org/10.1016/S0921-4488(00)00125-5.
» https://doi.org/10.1016/S0921-4488(00)00125-5. - Rizzo H., Gregory L., Beraldi F., Carvalho A.F. & Pinheiro E.S. 2015. Campylobacter isolation from the feces of sheep with a history of reproductive disorders bred in the state of São Paulo, Brazil. Semina, Ciênc. Agrárias 36(6):4207-4214. http://dx.doi.org/10.5433/1679-0359.2015v36n6Supl2p4207.
» https://doi.org/10.5433/1679-0359.2015v36n6Supl2p4207. - Rizzo H., Gregory L., Beraldi F., Carvalho A.F., Pinheiro E.S. & Paulin L.M. 2014. Ocorrência de anticorpos anti-Brucella ovis em ovinos com histórico de distúrbios reprodutivos no estado de São Paulo, Brasil. Arqs Inst. Biológico, São Paulo 81(2):99-106.
- Sahin O., Plummer P.J., Jordan D.M., Sulaj K., Pereira S., Robbe-Austerman S., Wang L., Yaeger M.J., Hoffman L.J. & Zhang Q. 2008. Emergence of a tetracycline-resistant Campylobacter jejuni clone associated with outbreaks of ovine abortion in the United States. J. Clin. Microbiol. 46(5):1663-1671. PMid:18322054. http://dx.doi.org/10.1128/JCM.00031-08.
» https://doi.org/10.1128/JCM.00031-08 - Said B., Wright F., Nichols G.L., Reacher M. & Rutter M. 2003. Outbreaks of infectious disease associated with private drinking water supplies in England and Wales 1970-2000. Epidemiol. Infect. 130(3):469-479. PMid:12825731.
- Sanad Y.M., Jung K., Kashoma I., Zhang X., Kassem I.I., Saif Y.M. & Rajashekara G. 2014. Insights into potential pathogenesis mechanisms associated with Campylobacter jejuni-induced abortion in ewes. BMC Vet. Res. 10:274. PMid:25420712. http://dx.doi.org/10.1186/s12917-014-0274-8.
» https://doi.org/10.1186/s12917-014-0274-8. - Skirrow M.B. 1994. Diseases due to Campylobacter, Helicobacter and related bacteria. J. Comp. Pathol. 111(2):113-149. PMid:7806700. http://dx.doi.org/10.1016/S0021-9975(05)80046-5.
» https://doi.org/10.1016/S0021-9975(05)80046-5. - Sproston E.L., Ogden I.D., MacRae M., Forbes K.J., Dallas J.F., Sheppard S.K., Cody A., Colles F., Wilson M.J. & Strachan N.J.C. 2010. Multi-locus sequence types of Campylobacter carried by flies and slugs acquired from local ruminant faeces. J. Appl. Microbiol. 109(3):829-838. PMid:20337762. http://dx.doi.org/10.1111/j.1365-2672.2010.04711.x.
» https://doi.org/10.1111/j.1365-2672.2010.04711.x. - Stanley K. & Jones K. 2003. Cattle and sheep farms as reservoirs of Campylobacter J. Appl. Microbiol. 94(supl.):104S-113S. PMid:12675942. http://dx.doi.org/10.1046/j.1365-2672.94.s1.12.x.
» https://doi.org/10.1046/j.1365-2672.94.s1.12.x. - Stanley K.N., Wallace J.S., Currie J.E., Diggle P.J. & Jones K. 1998. Seasonal variation of thermophilic campylobacters inlambs at slaughter. J. Appl. Microbiol. 84(6):1111-1116. PMid:9717297. http://dx.doi.org/10.1046/j.1365-2672.1998.00450.x.
» https://doi.org/10.1046/j.1365-2672.1998.00450.x. - Thrusfield M. 2007. Veterinary Epidemiology. 3rd ed. Blackwell Science, Cambridge, UK.
- Vargas A.C., Cecim M., Viana L.R., Spricigo D.A. & Costa M.M. 2005. Isolation of Campylobacter jejuni from ovine aborted fetus: case report. Arq. Bras. Med. Vet. Zootec. 57(3):317-320. http://dx.doi.org/10.1590/S0102-09352005000300007.
» https://doi.org/10.1590/S0102-09352005000300007. - Wang H., Farber J.M., Malik N. & Sanders G. 1999. Improved PCR detection of Campylobacter jejuni from chicken rinses by a simple sample preparation procedure. Int. J. Food Microbiol. 52(1-2):39-45. PMid:10573390. http://dx.doi.org/10.1016/S0168-1605(99)00110-5.
» https://doi.org/10.1016/S0168-1605(99)00110-5. - Whiley H., Van den Akker B., Giglio S. & Bentham R. 2013. The role of environmental reservoirs in human campylobacteriosis. Int. J. Environ. Res. Public. Health 10(11):5886-5907. PMid:24217177. http://dx.doi.org/10.3390/ijerph10115886.
» https://doi.org/10.3390/ijerph10115886. - Wu Z., Sippy R., Sahin O., Plummer P., Vidal A., Newell D. & Zhang Q. 2014. Genetic diversity and antimicrobial susceptibility of Campylobacter jejuni isolates associated with sheep abortion in the United States and Great Britain. J. Clin. Microbiol. 52(6):1853-1861. PMid:24648552. http://dx.doi.org/10.1128/JCM.00355-14.
» https://doi.org/10.1128/JCM.00355-14. - Yang R., Jacobson C., Gardner G., Carmichael I., Campbell A.J. & Ryan U. 2014. Longitudinal prevalence, faecal shedding and molecular characterisation of Campylobacter spp. and Salmonella enterica in sheep. Vet. J. 202(2):250-254. PMid:25175721. http://dx.doi.org/10.1016/j.tvjl.2014.08.001.
» https://doi.org/10.1016/j.tvjl.2014.08.001. - Zonios D.I., Panayiotakopoulos G.D., Kabletsas E.O., Tzima E.L., Stefanou I. & Archimandritis A.J. 2005. Campylobacter fetus bacteraemia in a healthy individual: clinical and therapeutical implications. J. Infect. 51(4):329-332. PMid:16291287. http://dx.doi.org/10.1016/j.jinf.2004.08.023.
» https://doi.org/10.1016/j.jinf.2004.08.023.
Datas de Publicação
-
Publicação nesta coleção
Fev 2018
Histórico
-
Recebido
19 Jul 2016 -
Aceito
23 Dez 2016