Resumos
A anatomia da folha, de colmo e do rizoma de Digitaria insularis foi investigada, visando identificar características que possam estar relacionadas à sua tolerância ao glyphosate. Sementes e rizomas de plantas adultas foram coletadas em campo, em área de plantio direto, onde o herbicida glyphosate vem sendo utilizado repetidamente há vários anos. As plantas provenientes dessas sementes e desses rizomas foram cultivadas em vasos com capacidade de 3 L, contendo solo de textura média, em casa de vegetação. Quando as plantas atingiram o estádio fenológico de pré-florescimento, foram coletadas três folhas totalmente expandidas por planta, entre o terceiro e o quinto nó. Simultaneamente, coletaram-se fragmentos dos rizomas e os entrenós recobertos pelas bainhas das folhas amostradas. As amostras foram fixadas em FAA50 e estocadas em etanol, para obtenção de cortes histológicos e montagem das lâminas, conforme metodologia usual. Para obtenção do índice estomático e da densidade estomática nas superfícies da epiderme, amostras das folhas foram diafanizadas, conforme método utilizado usualmente. Verificou-se que plantas provenientes de rizomas apresentavam maior índice estomático e maior número de estômatos por mm², maior espessura na epiderme das faces adaxial e abaxial e maior espessura da lâmina foliar. Foi observada coloração intensa nos rizomas submetidos ao Lugol, indicando presença de grande quantidade de amido, independentemente da origem do material.
capim-amargoso; anatomia; glyphosate; amido
The anatomy of the leaf, stem and rhizome of Digitaria insularis was studied, evaluating characteristics that could be related to its tolerance to glyphosate. Seeds and rhizomes of adult plants were collected in the field, area of no-till system, where the herbicide glyphosate had been repeatedly used for several years. The plants derived from these seeds and rhizomes were cultivated in 0.003 m³ vases, containing soil, under a greenhouse conditions. When the plants reached the preflowering stage, three totally expanded leaves were collected per plant, between the third and fifth nodes. Fragments of the internodes covered by the sheaths of the sampled leaves were collected together with the rhizomes. The samples were fixed in FAA50 and embedded in ethanol to obtain histological sections and mount the slider, according to the methodology. Leaf samples were diaphanized, following the usual methodology, to obtain the stomatal index and stomatal density at the epidermal surfaces. Plants derived from rhizomes had higher stomatal index and larger number of stomata per mm², thicker adaxial and abaxial epidermis faces and thicker leaf lamina. The intense coloration in the rhizomes treated with lugol indicated the presence of a great amount of starch, regardless of the origin of the material.
sourgrass; anatomy; glyphosate; starch
ARTIGOS
Caracterização anatômica de folha, colmo e rizoma de Digitaria insularis
Anatomical characterization of the leaf, stem and rhizome of Digitaria insularis
Machado, A.F.L.I; Meira, R.M.S.II; Ferreira, L.R.III; Ferreira, F.A.III; Tuffi Santos, L.D.IV; Fialho, C.M.T.V; Machado, M.S.V
IDoutorando do Dep. de Fitotecnia, Universidade Federal de Viçosa DFT/UFV, 36570-000 Viçosa-MG, bolsista do CNPq, <aroldomachado@yahoo.com.br>
IIProf. do Dep. de Biologia Vegetal DBV/UFV
IIIProf. do Dep. de Fitotecnia DFT/UFV
IVEngºAgrº, Doutor em Fitotecnia DFT/UFV
VGraduando em Agronomia UFV
RESUMO
A anatomia da folha, de colmo e do rizoma de Digitaria insularis foi investigada, visando identificar características que possam estar relacionadas à sua tolerância ao glyphosate. Sementes e rizomas de plantas adultas foram coletadas em campo, em área de plantio direto, onde o herbicida glyphosate vem sendo utilizado repetidamente há vários anos. As plantas provenientes dessas sementes e desses rizomas foram cultivadas em vasos com capacidade de 3 L, contendo solo de textura média, em casa de vegetação. Quando as plantas atingiram o estádio fenológico de pré-florescimento, foram coletadas três folhas totalmente expandidas por planta, entre o terceiro e o quinto nó. Simultaneamente, coletaram-se fragmentos dos rizomas e os entrenós recobertos pelas bainhas das folhas amostradas. As amostras foram fixadas em FAA50 e estocadas em etanol, para obtenção de cortes histológicos e montagem das lâminas, conforme metodologia usual. Para obtenção do índice estomático e da densidade estomática nas superfícies da epiderme, amostras das folhas foram diafanizadas, conforme método utilizado usualmente. Verificou-se que plantas provenientes de rizomas apresentavam maior índice estomático e maior número de estômatos por mm2, maior espessura na epiderme das faces adaxial e abaxial e maior espessura da lâmina foliar. Foi observada coloração intensa nos rizomas submetidos ao Lugol, indicando presença de grande quantidade de amido, independentemente da origem do material.
Palavras-chave: capim-amargoso, anatomia, glyphosate, amido.
ABSTRACT
The anatomy of the leaf, stem and rhizome of Digitaria insularis was studied, evaluating characteristics that could be related to its tolerance to glyphosate. Seeds and rhizomes of adult plants were collected in the field, area of no-till system, where the herbicide glyphosate had been repeatedly used for several years. The plants derived from these seeds and rhizomes were cultivated in 0.003 m3 vases, containing soil, under a greenhouse conditions. When the plants reached the preflowering stage, three totally expanded leaves were collected per plant, between the third and fifth nodes. Fragments of the internodes covered by the sheaths of the sampled leaves were collected together with the rhizomes. The samples were fixed in FAA50 and embedded in ethanol to obtain histological sections and mount the slider, according to the methodology. Leaf samples were diaphanized, following the usual methodology, to obtain the stomatal index and stomatal density at the epidermal surfaces. Plants derived from rhizomes had higher stomatal index and larger number of stomata per mm2, thicker adaxial and abaxial epidermis faces and thicker leaf lamina. The intense coloration in the rhizomes treated with lugol indicated the presence of a great amount of starch, regardless of the origin of the material.
Keywords: sourgrass, anatomy, glyphosate, starch.
INTRODUÇÃO
O capim-amargoso (Digitaria insularis) é uma espécie nativa de regiões tropicais e subtropicais da América, onde é freqüentemente encontrada em pastagens, lavouras de café, pomares, beira de estradas e terrenos baldios. No sistema de plantio direto de cereais, essa espécie vem se transformando em uma das mais importantes infestantes, formando touceiras e florescendo praticamente durante todo o verão (Lorenzi, 2000). Propaga-se facilmente por sementes e por rizomas (Kissmann & Groth, 1997; Lorenzi, 2000).
Em lavouras onde há presença de D. insularis e o herbicida glyphosate vem sendo aplicado repetidamente, observa-se que o seu controle tem sido ineficiente (Machado, 2006). Acredita-se que os rizomas formados pelas plantas sejam ricos em amido, constituindo uma barreira para translocação do herbicida e fonte de reserva, permitindo rápida rebrota das plantas tratadas. Tuffi Santos et al. (2004), estudando plantas da família Commelinaceae, verificaram que a tolerância ao herbicida glyphosate foi maior em Commelina diffusa quando comparada a C. benghalensis, devido à maior quantidade de amido encontrada no caule.
As diferenças na suscetibilidade de espécies de plantas daninhas a herbicidas têm sido atribuídas ao estádio de desenvolvimento da planta, à diferença na morfologia (área e forma do limbo, ângulos ou orientação das folhas em relação ao jato de pulverização), à anatomia foliar (presença de estômatos e pêlos, espessura e composição da camada cuticular) e às diferenças na absorção, translocação, compartimentalização e no metabolismo da molécula herbicida (Dall'Armellina & Zimdahl, 1989; Westwood et al., 1997; Vargas et al., 1999; Tuffi Santos et al., 2004).
Diferenças na absorção, na translocação e no metabolismo até 72 horas após aplicação do glyphosate em Amaranthus hybridus, Ipomoea grandifolia e Commelina benghalensis foram estudadas por Monqueiro et al. (2004). A. hybridus apresentou 90% de absorção, com taxa de translocação de 25%, e a maior parte do herbicida permaneceu na folha. I. grandifolia apresentou 80% de absorção, com 68,5% presente na folha tratada e 11,5% do herbicida translocado. C. benghalensis apresentou 66% absorvidos, com 26,3% do herbicida translocado, com indicações da ausência de barreiras quanto à translocação, e 40,8% do herbicida foi metabolizado. Os prováveis mecanismos de tolerância desta espécie ao glyphosate se deveram à absorção e ao metabolismo diferencial.
Apesar da importância do capim-amargoso como planta daninha, há carência de estudos sobre sua biologia, correlacionados ao manejo com herbicidas. Assim, objetivou-se neste trabalho descrever a anatomia de Digitaria insularis, identificando características que possam estar relacionadas com sua tolerância ao glyphosate.
MATERIAL E MÉTODOS
Sementes e rizomas de plantas adultas de Digitaria insularis foram coletados a campo, em área de plantio direto, onde o herbicida glyphosate vem sendo usado repetidamente no manejo das plantas daninhas. Plantas provenientes dessas sementes e desses rizomas foram cultivadas em vasos, com capacidade de 3 L de solo de textura média, em casa de vegetação, de forma que se obtivesse uma planta por vaso, em um total de três vasos por material propagativo (sementes e rizomas). A irrigação foi realizada diariamente, visando evitar possível estresse hídrico ou excesso de umidade, e a adubação, feita semanalmente, com 0,2 g do fertilizante NPK, na proporção de 15-15-20, diluído em 100 mL de água por vaso.
Quando as plantas se apresentavam no estádio fenológico de pré-florescimento, foram coletadas, de cada uma, três folhas totalmente expandidas, entre o terceiro e o quinto nó. Foram coletados simultaneamente fragmentos dos entrenós recobertos pelas bainhas das folhas amostradas e rizomas. Das bainhas foram coletadas amostras das regiões proximal, mediana e distal. As folhas, bainhas, colmos e rizomas foram imediatamente fixados em FAA50 por 24 horas (Johansen, 1940), dentro de frascos, sendo colocados em dessecador submetido a vácuo. Após a fixação, o material foi estocado em etanol 70%.
Para confecção do laminário, foram retiradas três amostras de aproximadamente 100 mm2 da bainha (regiões proximal, mediana e distal), uma amostra da região medianado limbo foliar e amostras dos colmos e rizomas das plantas.
Amostras do material fixado foram desidratadas em série etílica-butílica, incluídas em parafina histológica e emblocadas em mistura de parafina histológica e cera na proporção de 8:1 v/v. Foram obtidas secções transversais de 13 µm de espessura em micrótomo rotativo de avanço automático (RM 2155 Leica Microsystems Inc., Deerfield, USA). Após a desparafinização, os cortes foram corados com fuccina básica e azul-de-astra (Gerlach, 1984) e as lâminas, montadas com resina sintética (Permount).
Nas análises quantitativas foi utilizado o software Image-Pro Plus. Foram selecionadas nove lâminas de cada planta, e em cada lâmina foram avaliados cinco campos e realizadas três medições para cada campo, sendo consideradas como repetição as lâminas, em um total de 27 repetições. Os parâmetros avaliados foram: espessuras da lâmina foliar, da epiderme da face adaxial e da abaxial e do parênquima clorofiliano.
Parte das amostras das folhas foi cortada a fresco em micrótomo de mesa (modelo LPC), e os cortes foram submetidos ao reagente citoquímico Sudam III, para evidenciar compostos fenólicos (Johansen, 1940) e, assim, avaliar as características da cutícula.
Cortes transversais do entrenó e dos rizomas foram obtidos em micrótomo de mesa, sendo posteriormente submetidos ao reagente Lugol, para verificação da presença de amido; as lâminas foram montadas em glicerina + água 1:1 (Johansen, 1940).
Amostras da folha foram diafanizadas em solução de NaOH (Sass, 1951), sendo posteriormente lavadas e coradas com safranina (1% solução aquosa), e as lâminas, montadas com glicerina + água 1:1 (Johansen, 1940).
Para ilustração da superfície epidérmica, foram retiradas amostras das folhas e realizadas impressões paradérmicas do material (Segatto et al., 2004).
As análises e a documentação fotográfica do material histológico foram feitas utilizando-se um microscópio fotônico (modelo AX70TRF, Olympus Optical, Tokyo, Japão) com sistema U-Photo. A descrição dos caracteres anatômicos e a terminologia utilizada estão de acordo com Metcalfe (1960).
Para determinação do índice estomático e densidade estomática (estômatos mm- 2), foram realizadas 30 observações por planta para cada face epidérmica, em campos com área correspondente a 0,067 mm2. Os dados quantitativos da superfície epidérmica foram obtidos com auxílio do software Image-Pro Plus, sendo posteriormente submetidos à análise de variância. O cálculo do índice estomático foi feito de acordo com a fórmula: Índice Estomático (IE) = NE/(CE + NE), em que NE é o número de estômatos e CE o número de células epidérmicas (Cutter, 1986).
RESULTADOS E DISCUSSÃO
As folhas de D. insularis são anfiestomáticas (anfi-hipoestomática), apresentando as células-guarda dos estômatos na forma de halteres e células interestomatais com extremidades ligeiramente côncavas, com estômatos organizados em fileira ao longo das nervuras (Figura 1A), características freqüentes nas espécies da família Poaceae (Thompson & Estes, 1986).
Plantas provenientes de rizomas apresentaram folhas com maior índice estomático, quando comparadas com plantas provenientes de sementes, para as duas faces da epiderme. Em plantas provenientes de um mesmo material de origem (rizoma ou semente), a face abaxial da epiderme apresentou maior índice estomático. Com relação à densidade estomática, plantas provenientes de rizomas apresentaram, na face abaxial da epiderme foliar, maiores valores quando comparadas com plantas de sementes. Não foi observada diferença na face adaxial. Dentro do mesmo material de origem, a face abaxial das folhas apresentou maior densidade estomática (Tabela 1).
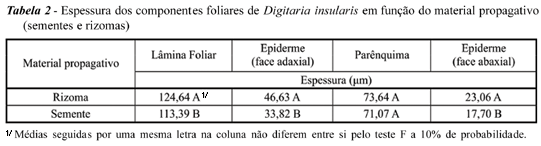
Com relação aos componentes foliares (lâmina foliar, epiderme das faces adaxial e abaxial e parênquima), plantas provenientes de rizomas mostraram lâmina foliar mais espessa, com epiderme das faces adaxial e abaxial apresentando o mesmo comportamento. Quanto à espessura de parênquima clorofiliano, não houve diferença (Tabela 2). No tocante aos demais parâmetros, não foram encontradas diferenças quando se compararam plantas provenientes de sementes e de rizomas. O limbo, em secção transversal, revela uma quilha pronunciada, em forma de U (Figura 1B), confirmando dados registrados para o gênero Digitaria (Metcalfe, 1960).
A superfície epidérmica da face adaxial está recoberta por uma cutícula mais evidente que na face abaxial. Na face adaxial, as células buliformes recobrem o parênquima clorofiliano, enquanto as células epidérmicas ordinárias encontram-se na região dos feixes. As células buliformes são maiores que as epidérmicas ordinárias e apresentam paredes delgadas, principalmente as anticlinais e as periclinais internas (Figura 1C), estando relacionadas tanto com o enrolamento da folha, em situações de déficit hídrico, quanto com a expansão foliar a partir da gema (Mauseth, 1988).
O mesofilo é homogêneo, com poucos espaços intercelulares. As folhas de D. insularis apresentam estrutura Kranz, com bainha simples (Figura 1C), estando de acordo com descrição feita por Metcalfe (1960) para o gênero Digitaria. Nesse tipo de estrutura, as células do parênquima clorofiliano dispõem-se radialmente ao redor dos feixes. Internamente a essa coroa de células do mesofilo encontra-se a bainha parenquimática clorofilada do feixe vascular.
No limbo, feixes maiores se alternam com feixes de médio e pequeno porte. Os primeiros têm forma poligonal e, envolvendo-os, encontra-se uma bainha parenquimática desenvolvida, contínua, com as células apresentando paredes ligeiramente espessadas. Nesses, uma calota esclerenquimática encontra-se voltada para a epiderme (Figura 1C). Os feixes de médio e pequeno porte são circulares, não sendo observada calota esclerenquimática.
A bainha foliar de D. insularis apresenta, em secção transversal, aspecto semicircular, em que as margens ficam parcialmente sobrepostas, envolvendo totalmente o colmo (Figura 1D). Como padrão entre as espécies da família Poaceae, as lâminas e bainhas foliares são paralelinérvias. A secção transversal da bainha não revelou a presença de uma quilha, como na lâmina foliar, porém a bainha apresenta a região central alargada, como em plantas do gênero de Brachiaria descritas por Brito & Rodella (2002).
Em secção transversal, as células epidérmicas da face adaxial, que estão em contato com o colmo, apresentaram-se achatadas, com formato retangular. Foram observados estômatos e tricomas nessa face da epiderme da bainha nas regiões mediana e distal. Logo abaixo da epiderme, em oposição aos feixes vasculares, existe uma pequena calota esclerenquimática, geralmente constituída por uma ou duas camadas de células. No mesofilo, o parênquima clorofiliano apresenta células poliédricas, grandes e de paredes delgadas, que aumentam de tamanho à medida que se aproximam da região central (Figura 1E). Na região proximal da bainha, as células da epiderme são mais compactas e o mesofilo se assemelha ao colmo, com presença de tecido de preenchimento. Os feixes vasculares são de contorno poligonal (grande porte) a circular (médio e pequeno porte) e encontram-se próximos à face abaxial. Nos feixes de médio e grande porte ocorre uma extensão da bainha de feixe, bastante pronunciada e lignificada, assim como descrito em Brachiaria humidicola e B. brizantha (Brito & Rodella, 2002). Nos feixes de pequeno porte, na face voltada para a epiderme, encontra-se uma calota esclerenquimática subepidérmica (Figura 1E).
Tanto em plantas provenientes de rizomas como de sementes ocorre uma bainha parenquimática envolvendo totalmente os feixes vasculares, como observado na lâmina foliar, caracterizando a anatomia Kranz, não apresentando, assim, diferença entre plantas originadas de rizomas ou de sementes (Figura 1E).
As células epidérmicas da face adaxial são achatadas, com paredes periclinais externas recobertas por uma camada cuticular, enquanto as da face abaxial são poliédricas, apresentando cutícula mais delgada.
O colmo da espécie apresenta uma medula oca, com contorno externo ovalado, côncavo em um dos lados (Figura 2A), semelhante ao colmo de plantas do gênero Brachiaria (Brito & Rodella, 2002). Em secção transversal, a epiderme apresenta células tetraédricas, com paredes lignificadas, principalmente as paredes periclinais externas. Os feixes vasculares são do tipo colateral fechado, estando o floema voltado para a periferia do colmo e o xilema em oposição (Figura 2B), apresentando-se em três portes: pequeno, médio e grande. Os feixes estão envoltos por uma bainha esclerenquimática. No xilema do colmo, em adição aos elementos traqueais, existe grande proporção de parênquima xilemático e de tecidos mecânicos na forma de fibras xilemáticas. Os feixes vasculares estão irregularmente dispersos no parênquima fundamental (Figura 2A), de estrutura atactostélica, segundo padrão típico das monocotiledôneas (Mauseth, 1988). O parênquima clorofiliano é subepidérmico, composto de células de contorno poliédrico, onde se observam feixes vasculares de pequeno porte. Logo abaixo do colênquima ocorre um anel esclerenquimático, com 2 - 5 camadas de células. Muitos feixes de pequeno e médio porte estão incluídos neste anel, onde a bainha esclerenquimática dos feixes se mistura ao esclerênquima. Internamente ao anel esclerenquimático ocorre o parênquima incolor, onde estão dispostos os feixes vasculares de grande porte, os quais possuem uma bainha esclerenquimática reduzida. As células parenquimáticas possuem forma circular a poliédrica, com parede delgada e espaços intercelulares. Aquelas células próximas à porção central estão parcialmente destruídas, provavelmente pela lise das células. Nestas células parenquimáticas foi observada pequena quantidade de grãos de amido de tamanho reduzido.
Os rizomas de D. insularis são morfologicamente semelhantes ao colmo, apresentando feixes vasculares do tipo colateral fechado, poligonais ou angulosos, com o floema voltado para a periferia do rizoma e o xilema em oposição (Figura 2C), apresentando-se em três portes: pequeno, médio e grande. Os feixes estão envoltos por uma bainha esclerenquimática. Verificou-se que a formação dos rizomas ocorre, em média, 45 dias após a emergência das plantas, quando provenientes de sementes, ocasionando a partir desse momento tolerância desta espécie ao glyphosate (Machado, 2006). O parênquima clorofiliano é subepidérmico, composto de células de contorno poliédrico, onde se observam feixes vasculares de pequeno porte. Neste órgão, feixes vasculares de grande porte se dispõem por entre o parênquima incolor, envolvidos por bainha esclerenquimática reduzida. As células parenquimáticas possuem forma circular a poliédrica e contêm grande quantidade de grãos de amido (Figura 2C).
Diante da descrição da espécie, os resultados não apontam diferenças marcantes na anatomia de D. insularis que possam explicar a tolerância diferencial ao glyphosate entre plantas oriundas de sementes ou de rizomas. No entanto, algumas características, como diferença na espessura da epiderme foliar e quantidade de amido, chamam a atenção e apontam para realização de estudos mais detalhados.
Dentre essas características, a presença de cutícula espessa, em plantas originadas de rizomas, atuando como interface entre o corpo da planta e o ambiente, contribui na proteção mecânica e na prevenção da perda de água dos tecidos vegetais (Bukovac et al., 1990). A cutícula é também importante barreira à entrada de microrganismos e agroquímicos. No entanto, a absorção de herbicidas não é apenas relacionada à espessura da cutícula, mas também à constituição lipídica e ao grau de impedimento de passagem de solutos (Silva et al., 2004).
O rizoma é um órgão especializado em reserva, acumulando amido na região cortical (Appezzato-da-Glória & Carmello-Guerreiro, 2003). De acordo com Tuffi Santos et al. (2004), a presença de amido em quantidade elevada pode ser responsável pela menor eficiência do glyphosate em C. diffusa, devido à menor translocação do herbicida no interior da planta, com menor quantidade acumulada no sítio de ação, possibilitando o desenvolvimento dos meristemas e a rebrota da parte aérea de plantas tratadas com o herbicida. Assim como ocorre em C. diffusa, as brotações de D. insularis originadas de rizomas também são mais difíceis de serem controladas com o glyphosate provavelmente pelo mesmo motivo que C. difusa o que a torna uma espécie de difícil controle para os cultivos de café e fruteiras e mesmo culturas geneticamente modificadas para tolerância ao glyphosate. Assim, a reserva de amido acumulada nos rizomas pode ser responsável pela tolerância de D. insularis ao glyphosate, dificultando a translocação e permitindo rápida rebrota da parte aérea após ser tratada com o herbicida. Estudos complementares, abrangendo a absorção e translocação do glyphosate nesta espécie, devem ser realizados, visando elucidar os mecanismos envolvidos na tolerância ao herbicida.
LITERATURA CITADA
Recebido para publicação em 14.3.2007 e na forma revisada em 3.1.2008.
- APPEZZATO-DA-GLÓRIA, B.; CARMELLO-GUERREIRO, S. M. (Eds). Anatomia vegetal Viçosa, MG: Universidade Federal de Viçosa, 2003. 438 p.
- BRITO, C. J. F. A.; RODELLA, R. A. Caracterização morfo-anatômica da folha e do caule de Brachiaria brizantha (Hochst. ex A. Rich.) Stapf e B. humidicola (Rendle) Schweick. (Poaceae). R. Bras. Bot., v. 25, n. 2, p. 221-228, 2002.
- BUKOVAC, M. J. et al. Sorption of organic compounds by plant cuticles. Weed Sci., v. 38, n. 3, p. 289-298, 1990.
- CUTTER, E. G. Anatomia vegetal Parte I Células e tecidos. 2.ed. São Paulo: Roca, 1986. 304 p.
- DALL'ARMELLINA, A. A.; ZIMDAHL, R. L. Effect of watering frequency, drought, and glyphosate on growth of field bindweed (Convolvulus arvensis). Weed Sci., v. 37, p. 314-318, 1989.
- GERLACH, D. Botanische mikrotechnik Stuttgard: Georg Thieme Verlag, 1984. 311 p.
- JOHANSEN, D. A. Plant microtechinique New York: MacGraw-Hill, 1940. 523 p.
- KISSMANN, K. G.; GROTH, D. Plantas infestantes e nocivas 2.ed. São Paulo: BASF, 1997. Tomo I. 825 p.
- LORENZI, H. Plantas daninhas do Brasil: terrestres, aquáticas, parasitas e tóxicas. 3.ed. Nova Odessa: Plantarum, 2000. 608 p.
- MACHADO, A. F. L. et al. Análise de crescimento de Digitaria insularis Planta Daninha, v. 24, n. 4, p. 641-647, 2006.
- MAUSETH, J. D. Plant anatomy Menlo Park: Benjamin/Cummings Publishing, 1988. 588 p.
- METCALFE, C. R. Anatomy of monocotyledons Gramineae. Oxford: Clarendon Press, 1960. v. 1. 731 p.
- MONQUEIRO, P. A. et al. Absorção, translocação e metabolismo do glyphosate por plantas tolerantes e susceptíveis a estes herbicidas. Planta Daninha, v. 22, n. 3, p. 123-132, 2004.
- SASS, J. E. Botanical microtechnique Dress, Ames: Iowa Stat College, 1951. 228 p.
- SEGATTO, F. B. et al. Técnicas para estudos da anatomia foliar de batata. Ci. Rural, v. 34, n. 5, p. 1597-1601, 2004.
- SILVA, A. A. et al. Controle de plantas daninhas Brasília: ABEAS, 2004. 268 p.
- THOMPSON, R. A.; ESTES, J. R. Anthecial and foliar micromorphology and foliar anatomy of Brachiaria (Poaceae: Paniceae). Am. J. Bot., v. 73, p. 398-408, 1986.
- TUFFI SANTOS, L. D. et al. Efeito do glyphosate sobre a morfoanatomia das folhas e do caule de commelina diffusa e C. benghalensis Planta Daninha, v. 22, n. 1, p. 101-108, 2004.
- VARGAS, L. et al. Resistência de plantas daninhas a herbicidas Viçosa, MG: Universidade Federal de Viçosa, 1999. 131 p.
- WESTWOOD, J. H. et al. Absorption and translocation of glyphosate in tolerant and susceptible biotypes of field bindweed (Convolvulus arvensis). Weed Sci., v. 45, p. 658-663, 1997.
Datas de Publicação
-
Publicação nesta coleção
15 Abr 2008 -
Data do Fascículo
Mar 2008
Histórico
-
Revisado
03 Jan 2008 -
Recebido
14 Mar 2007