Resumos
Este trabalho teve como objetivo a avaliação das características anatômicas e fisiológicas de aguapé (Eichhornia crassipes) em resposta ao estresse por arsênio. As plantas de aguapé foram cultivadas em solução nutritiva hidropônica de Hoagland em casa de vegetação sob cinco concentrações de arsênio: 0,0; 0,25; 0,5; 1,0; e 2,0 mg L-1 por período de 20 dias. As plantas demonstraram aumento na taxa fotossintética, na condutância estomática, na transpiração e na relação Ci/Ca, bem como na atividade de todas as enzimas do sistema antioxidante, com maior atividade nas folhas em relação às raízes nos tratamentos contendo arsênio. As características anatômicas das folhas das plantas sob as maiores concentrações de arsênio mostraram aumento na densidade estomática, no índice estomático e na espessura do parênquima esponjoso. A anatomia radicular não evidenciou alterações decorrentes da intoxicação por arsênio e modificações nas características do xilema e floema, porém não houve prejuízos à sua estrutura e função. Dessa forma, o estresse por intoxicação pelo arsênio, nas concentrações testadas, não é evidente nas plantas de E. crassipes, e os mecanismos de tolerância são relacionados com modificações na anatomia e fisiologia das plantas.
Eichhornia crassipes; anatomia ecológica; sistema antioxidante; fotossíntese
This work aimed to evaluate the anatomical and physiological characteristics of Eichhornia crassipes in response to arsenic stress. Plants of E. crassipes were grown in Hoagland hydroponic nutritive solution under greenhouse conditions at five arsenic levels: 0.0, 0.25, 0.50, 1.0 and 2.0 mg L-1 during 20 days. The plants showed an increase in photosynthetic rate, stomatal conductance, transpiration and Ci/Ca rate, as well as in the activity of all the enzymes in the antioxidant system, with higher activity in the leaves than in the roots, in all the treatments with arsenic. The anatomical characteristics observed on the leaves of the plants under higher arsenic levels showed an increase in stomatal density, stomatal index and spongy parenchyma thickness. Root anatomy showed no toxic evidences at any arsenic level; changes in the xylem and phloem characteristics were exhibited by the roots in the arsenic treatments, but no damage was caused to its structure and function. Thus, stress caused by arsenic intoxication at the levels tested, is not evident on E. crassipes plants, and the mechanisms of tolerance of E. crassipes are associated to anatomical and physiological changes.
Eichhornia crassipes; ecological anatomy; antioxidant system; photosynthesis
ARTIGOS
Mecanismos anatômicos e fisiológicos de plantas de aguapé para a tolerância à contaminação por Arsênio
Anatomical and physiological mechanisms of water hyacinth plants to Arsenic contamination tolerance
Pereira, F.J.I; Castro, E.M.II; Oliveira, C.III; Pires, M.F.IV; Pasqual, M.V
IBiólogo, Professor, Departamento de Biologia, Universidade Federal de Lavras DBI/UFLA, <fjprock@hotmail.com>
IIEngenheiro Florestal, Professor, DBI/UFLA
IIIEngª-Agrª., Doutoranda em Fisiologia Vegetal, DBI/UFLA
IVBióloga, Mestranda em Fisiologia Vegetal, DBI/UFLA
VEngº-Agrº., Professor, DAG/UFLA
RESUMO
Este trabalho teve como objetivo a avaliação das características anatômicas e fisiológicas de aguapé (Eichhornia crassipes) em resposta ao estresse por arsênio. As plantas de aguapé foram cultivadas em solução nutritiva hidropônica de Hoagland em casa de vegetação sob cinco concentrações de arsênio: 0,0; 0,25; 0,5; 1,0; e 2,0 mg L-1 por período de 20 dias. As plantas demonstraram aumento na taxa fotossintética, na condutância estomática, na transpiração e na relação Ci/Ca, bem como na atividade de todas as enzimas do sistema antioxidante, com maior atividade nas folhas em relação às raízes nos tratamentos contendo arsênio. As características anatômicas das folhas das plantas sob as maiores concentrações de arsênio mostraram aumento na densidade estomática, no índice estomático e na espessura do parênquima esponjoso. A anatomia radicular não evidenciou alterações decorrentes da intoxicação por arsênio e modificações nas características do xilema e floema, porém não houve prejuízos à sua estrutura e função. Dessa forma, o estresse por intoxicação pelo arsênio, nas concentrações testadas, não é evidente nas plantas de E. crassipes, e os mecanismos de tolerância são relacionados com modificações na anatomia e fisiologia das plantas.
Palavras-chave:Eichhornia crassipes, anatomia ecológica, sistema antioxidante, fotossíntese
ABSTRACT
This work aimed to evaluate the anatomical and physiological characteristics of Eichhornia crassipes in response to arsenic stress. Plants of E. crassipes were grown in Hoagland hydroponic nutritive solution under greenhouse conditions at five arsenic levels: 0.0, 0.25, 0.50, 1.0 and 2.0 mg L-1 during 20 days. The plants showed an increase in photosynthetic rate, stomatal conductance, transpiration and Ci/Ca rate, as well as in the activity of all the enzymes in the antioxidant system, with higher activity in the leaves than in the roots, in all the treatments with arsenic. The anatomical characteristics observed on the leaves of the plants under higher arsenic levels showed an increase in stomatal density, stomatal index and spongy parenchyma thickness. Root anatomy showed no toxic evidences at any arsenic level; changes in the xylem and phloem characteristics were exhibited by the roots in the arsenic treatments, but no damage was caused to its structure and function. Thus, stress caused by arsenic intoxication at the levels tested, is not evident on E. crassipes plants, and the mechanisms of tolerance of E. crassipes are associated to anatomical and physiological changes.
Keywords: Eichhornia crassipes, ecological anatomy, antioxidant system, photosynthesis
INTRODUÇÃO
A contaminação do ambiente por elementos tóxicos decorrentes de atividades industriais e agrícolas promove a sua acumulação e pode levar a prejuízos na produção agrícola, na fertilidade do solo e nas cadeias tróficas (Gratão et al., 2005). O arsênio é um dos mais tóxicos elementos encontrados no ambiente, podendo ocasionar diferentes doenças em humanos, animais e vegetais (Gosh et al., 2006).
A remoção do arsênio de locais contaminados é um processo de alto custo financeiro e ambiental, sendo impraticável em grande escala (Dhankher et al., 2002). A fitorremediação destaca-se como um processo limpo e de baixo custo, pois utiliza plantas para a remoção dos contaminantes, sendo uma alternativa para a descontaminação desses ambientes (Gratão et al., 2005; Dhankher et al., 2002).
O aguapé (Eichhornia crassipes) é uma macrófita aquática pertencente à família Pontederiaceae. É nativa do Brasil, mas, na atualidade, é encontrada em todo o mundo, possuindo intensa capacidade de crescimento em diferentes regiões (Neves et al., 2002). Essa espécie possui potencial para a fitorremediação de crômio (Faisal & Hasnain, 2003), chumbo e cádmio (Gonçalves Júnior et al., 2008), além de ser relatada como hiperacumuladora para o arsênio (Snyder, 2006).
Os efeitos do arsênio nas características fisiológicas em plantas ainda são pouco estudados. A adição de crescentes concentrações desse elemento em comunidades de microrganismos fotossintéticos reduziu a fotossíntese em concentrações de 11,5 ppm ou maiores (Giddings & Eddlemon, 1978). Miteva & Merakchyiska (2002) verificaram redução na taxa fotossintética de plantas de feijão expostas a concentrações de arsênio no solo; esse efeito também foi verificado em plantas de aveia (Stoeva & Bineva, 2003). Esses autores constataram ainda aumento na atividade da peroxidase e na peroxidação lipídica, decorrente do estresse oxidativo na presença de arsênio. As modificações anatômicas de E. crassipes sob estresse são ainda pouco relatadas; contudo, Mahmood et al. (2005) verificaram diferenças no tamanho das células dos tecidos dessa espécie crescendo sob efluentes de indústria têxtil.
Este trabalho teve como objetivo verificar modificações anatômicas e fisiológicas de plantas de E. crassipes submetidas a diferentes concentrações de arsênio, no intuito de elucidar os possíveis mecanismos que atribuam tolerância a esse elemento.
MATERIAL E MÉTODOS
As plantas de aguapé (Eichhornia crassipes) foram coletadas em açudes naturais sem aparente fonte de contaminação por arsênio, na região de Alfenas-MG. As plantas foram levadas para casa de vegetação no Departamento de Ciência do Solo da Universidade Federal de Lavras, onde foram lavadas em água corrente e cultivadas em solução nutritiva de Hoagland & Arnon a 40% da força iônica (Hoagland & Arnon, 1950), para aclimatização e eliminação do arsênio endógeno.
As plantas-filhas foram selecionadas quanto ao tamanho, número de folhas e ausência de estolões, para uniformização das plantas utilizadas no experimento. Essas plantas foram cultivadas em vasos de polipropileno com capacidade para 6 L, contendo 4 L de solução nutritiva de Hoagland & Arnon a 20% da força iônica (Hoagland & Arnon, 1950), acrescida de concentrações crescentes de arsênio: 0; 0,25; 0,50; 1,00; e 2 mg L-1. As concentrações de arsênio aplicadas foram baseadas na concentração máxima permitida pela Resolução 357 do CONAMA (Wolff et al., 2009), correspondendo ao controle (0 mg L-1) e 100, 200, 400 e 800 vezes a concentração máxima permitida, respectivamente, a partir da concentração de 0,25 mg L-1. As plantas foram deixadas nessas condições por um período de 20 dias.
Aos 15 dias de experimento, foram avaliadas as características de trocas gasosas foliares das plantas, com analisador de trocas gasosas por infravermelho (IRGA) modelo LI-6400. Foram avaliadas a taxa fotossintética (A), a condutância estomática (gs), a transpiração (E) e a relação entre carbono interno e externo (Ci/Ca). Essas variáveis foram avaliadas em folhas completamente expandidas, em cinco plantas por tratamento, a partir das 10h; a densidade de fluxo de fótons fotossinteticamente ativos foi fixada no aparelho para 1.000 μmol m-2 s-1.
Para as análises anatômicas foram coletadas plantas-filhas, completamente desenvolvidas durante o período experimental. Essas plantas foram fixadas em solução de formaldeído, ácido acético e etanol 70% (F.A.A.70) por período de 72 horas, sendo posteriormente estocadas em frascos contendo etanol 70% (Kraus & Arduin, 1997). Foram obtidas seções paradérmicas das faces adaxial e abaxial das folhas, com o uso de lâminas de aço, com posterior clarificação com hipoclorito de sódio 50%, as quais foram lavadas em água destilada duas vezes por 10 min, coradas com solução de safranina 1% e montadas em lâmina e lamínula com glicerina 50% (Kraus & Arduin, 1997). Em fragmentos de 2 cm das folhas retirados da região contendo a nervura central e em fragmentos de 2 cm removidos da região de ramificação das raízes (a 2 cm do ápice radicular) foram realizadas seções transversais com auxílio de micrótomo de mesa modelo LPC. Os cortes foram clarificados em hipoclorito de sódio, lavados em água destilada duas vezes por 10 min, corados com solução safrablau (safranina 1% e azul de astra 0,1% na proporção de 7:3) e montados em lâmina e lamínula em glicerina 50%. As lâminas foram fotografadas em microscópio Olympus modelo BX 60, acoplado à câmera digital Canon A630. As fotomicrografias foram analisadas em software para análise de imagens UTHSCSA-Imagetool, medindo-se as características quantitativas dos tecidos em três lâminas por repetição, sendo contabilizados cinco cortes por lâmina e quatro campos por corte. O índice de vulnerabilidade de Carlquist (IVC = diâmetro dos elementos traqueais/número de elementos traqueais) foi calculado segundo Carlquist (1975). Também foram calculados a densidade (número de estômatos por mm2), a funcionalidade (relação diâmetro polar/diâmetro equatorial dos estômatos) e os índices estomáticos [(número de estômatos/número de estômatos+número de células) 100].
As amostras de folhas e raízes destinadas às análises bioquímicas foram coletadas aos 20 dias de experimento, no período da manhã, sendo congeladas em nitrogênio líquido e preservadas em freezer a -80 ºC até a data das análises. Para a extração, foi pesado 0,5 g de raízes ou folhas, sendo adicionados 2,0 mL de tampão de extração constituído de 1,924 μL de tampão fosfato de potássio 0,1 M pH 7, 20 μL de EDTA 0,1 M, 8 μL de DTT 0,5 M, 16 μL de PMSF 0,1 M e 40 mg de PVPP adaptado de Bor et al. (2003). Após homogeneização em nitrogênio líquido, o extrato enzimático foi centrifugado a 14.000 g, por 20 min, na temperatura de 4 ºC; após esse período, foi coletado o sobrenadante, com o qual foram realizadas as determinações das atividades das enzimas da dismutase do íon superóxido (SOD), peroxidase do ascorbato (APX) e catalase (CAT). A atividade da peroxidase do ascorbato (APX) foi analisada segundo metodologia proposta por Nakano & Asada (1981). Na avaliação da atividade da catalase (CAT) utilizou-se a metodologia proposta por Madhusudhan et al. (2003). A análise da atividade da SOD foi realizada segundo o método proposto por Giannopolitis & Ries (1977).
O delineamento experimental foi inteiramente casualizado, com cinco tratamentos e cinco repetições. Os dados foram submetidos à análise de variância e ao teste de Scott-Knott para P<0,05, com auxílio do software estatístico Sisvar.
RESULTADOS E DISCUSSÃO
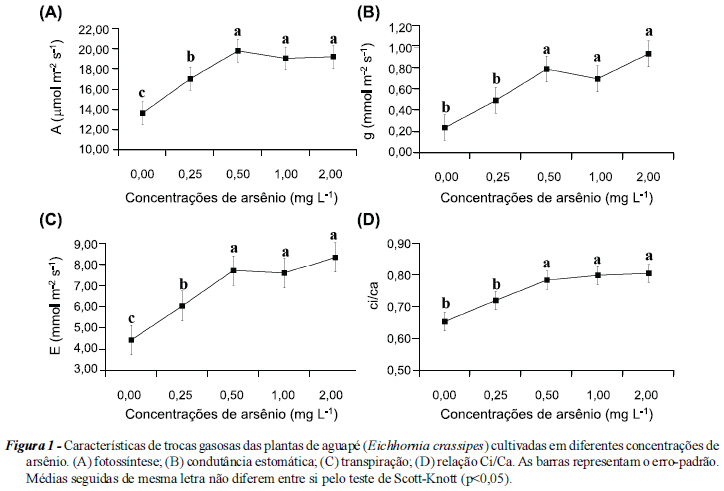
Houve aumento de 24,8% na taxa fotossintética na concentração de 25 mg L-1 de arsênio, com novo aumento de 15,9% na concentração de 0,50 mg L-1, estabilizando nas concentrações maiores (Figura 1A). Comportamento semelhante foi observado para a condutância estomática: aumento de 60% na concentração de 0,50 mg L-1, estabilizando nas demais concentrações (Figura 1B). A transpiração aumentou 36,4% na primeira concentração em relação ao controle, seguido de aumento de 27,7% na concentração de 0,50 mg L-1 (Figura 1C). A relação Ci/Ca mostrou comportamento semelhante ao observado em outras características de trocas gasosas, aumentando 19,0% na concentração de 0,50 mg L-1 (Figura 1D).
Nas folhas, a espessura da epiderme da face abaxial aumentou em 23,7% nas concentrações de 0,25 e 0,50 mg L-1, porém na face adaxial não se modificou nos diferentes tratamentos (Tabela 1). A espessura do mesofilo aumentou em 39,6% a partir da concentração de 0,50 mg L-1 (Tabela 1). A espessura do parênquima paliçádico foi reduzida em 12,0% a partir da concentração de 1,0 mg L-1, enquanto a espessura do parênquima esponjoso aumentou 57,7% nas concentrações de 0,50 e 1,0 mg L-1 (Tabela 1). A relação parênquima paliçádico/parênquima esponjoso reduziu 40,54% nos tratamentos contendo arsênio (Tabela 1). A distância dos feixes reduziu 37,9% nas concentrações de 1,0 e 2,0 mg L-1 (Tabela 1) O aerênquima foliar não se modificou na presença de arsênio (Tabela 1).
Na face abaxial, a densidade estomática aumentou 38,7% na concentração de 0,25 mg L-1 em relação ao grupo controle, seguida de aumento de 16,3% nas concentrações de 0,50 e 1,0 mg L-1 e de 12,0% na maior concentração (Tabela 2). O número de células epidérmicas aumentou 33,4% apenas na concentração de 2,0 mg L-1 (Tabela 2). Os diâmetros estomáticos e a funcionalidade estomática demonstraram diferenças significativas entre os tratamentos (Tabela 2). Entretanto, o índice estomático aumentou 36% em todos os tratamentos contendo arsênio (Tabela 2). Na face adaxial da folha, o número de estômatos e a densidade estomática aumentaram 23,1% nas concentrações de 0,25 e 0,50 mg L-1, ocorrendo novo aumento de 28,3% nas concentrações de 1,0 e 2,0 mg L-1, em relação às anteriores (Tabela 2). O número de células epidérmicas aumentou 22,3% nas concentrações de 1,0 e 2,0 mg L-1 (Tabela 2). A funcionalidade estomática não se modificou nas diferentes concentrações de arsênio (Tabela 2). O índice estomático aumentou 25,0% nas maiores concentrações de arsênio (Tabela 2).
A proporção de aerênquima na raiz e a espessura da exoderme não se modificaram nas diferentes concentrações de arsênio, em comparação ao controle (Tabela 3). A partir da concentração de 0,5 mg L-1 de arsênio houve aumento de 34,29% no diâmetro das células corticais, em relação ao grupo controle (Tabela 3). A espessura da epiderme não se modificou nas concentrações de arsênio, comparada à do grupo controle (Tabela 3). A endoderme se tornou 21,6% mais espessa nos tratamentos com arsênio, em relação ao controle (Tabela 3). O IVC foi reduzido nos tratamentos contendo arsênio (Tabela 3). A espessura do floema foi aumentada em 34,9% a partir da concentração de 0,5 mg L-1 de arsênio (Tabela 3).
A atividade das enzimas do sistema antioxidante nas plantas de aguapé é sempre maior nas folhas do que nas raízes nas condições experimentais testadas (Figura 2), independentemente da concentração de arsênio. Quanto à catalase (CAT), observa-se que não houve diferenças significativas entre os tratamentos em relação à atividade da enzima nas raízes de aguapé. Entretanto, nas folhas, observa-se aumento da atividade dessa enzima nas concentrações de 1,0 e 2,0 mg L-1 (Figura 2A). A atividade da peroxidase do ascorbato (APX) nas raízes aumentou apenas na concentração de 2,0 mg L-1. Nas folhas, a APX aumenta já na concentração de 0,25 mg L-1, sem modificações significativas nas concentrações mais altas (Figura 2B). A atividade da dismutase do íon superóxido (SOD) nas raízes aumentou a partir da concentração de 1,0 mg L-1. Nas folhas, a atividade da SOD aumentou a partir da concentração de 0,25 mg L-1 (Figura 2C).
Os resultados obtidos para a fotossíntese em solução contaminada com arsênio são diferentes dos relatados na literatura para outras espécies de plantas. Giddings & Eddlemon (1978) verificaram que altas concentrações de arsênio reduziam a taxa fotossintética de microrganismos; resultados semelhantes ocorreram com plantas de feijão (Miteva & Merakchyiska, 2002) e aveia (Stoeva & Bineva, 2003). As plantas de aguapé não demonstraram inibições na taxa fotossintética nas concentrações testadas, exibindo aumento na fotossíntese. Stoeva & Bineva (2003) verificaram que concentrações de arsênio podem levar à geração de espécies reativas de oxigênio e ao estresse oxidativo, que podem prejudicar as membranas dos cloroplastos. As plantas de E. crassipes podem ter resistido a esse efeito com a ativação do sistema antioxidante nas folhas (Figura 2). Dessa forma, a fase fotoquímica da fotossíntese pode não ter sofrido inibições, permitindo às plantas de E. crassipes tolerar os efeitos da solução nutritiva contaminada com arsênio sem inibições na taxa fotossintética.
A fotossíntese pode ser estimulada pela maior disponibilidade de CO2 e de luz (Zhou & Han, 2005); assim, o aumento na fotossíntese pode estar relacionado à maior disponibilidade de CO2 na folha. Isso pode ser confirmado pelo aumento na gs, na relação Ci/Ca e na E (Figura 1); essas características permitem verificar favorecimento ao fluxo de CO2 para o interior das folhas das plantas cultivadas em solução nutritiva contaminada com arsênio, pois o aumento na relação Ci/Ca pode indicar maior quantidade de carbono na folha (Zhou & Han, 2005). Esses resultados estão associados com modificações na anatomia foliar, que permitiram maior captação de CO2, como o aumento da densidade e índice estomáticos nas folhas das plantas cultivadas em solução nutritiva contaminada com arsênio (Tabela 2). Uma maior densidade estomática pode ser observada sob estresse ambiental, como relatam Grisi et al. (2008) para plantas de café sob estresse hídrico e Souza et al. (2010) para plantas de milho sob alagamento.
Esses resultados são apoiados pelo espessamento do mesofilo e parênquima esponjoso e pela redução observada na relação parênquima paliçádico/parênquima esponjoso nas plantas cultivadas em solução nutritiva contaminada com arsênio (Tabela 1). Eles permitem também verificar maior formação de espaços intercelulares na folha destinados a reter o CO2 uma das principais funções do parênquima esponjoso (Castro et al., 2009). Dessa forma, pode ocorrer maior fluxo desse gás e sua retenção no interior da folha, uma vez que a proporção de aerênquima foliar não se alterou, o que permite às folhas retenção de gases proporcional ao aumento em espessura. O aumento da espessura do mesofilo, parênquima paliçádico e esponjoso é relatado na literatura em diferentes tipos de estresse (Grisi et al., 2008; Costa et al., 2009; Souza et al., 2010). Assim, o aumento na fotossíntese observado em solução nutritiva contaminada com arsênio pode ser atribuído, em parte, a adaptações para o favorecimento do fluxo de CO2 para o interior da folha.
O aumento na taxa transpiratória pode não ser prejudicial a essa planta, por ser uma macrófita aquática e sem restrições hídricas, e pode contribuir para maior absorção de nutrientes. Dessa forma, também não houve mudanças na espessura da epiderme da face adaxial, que pode ser uma barreira à transpiração (Castro et al., 2009). Os valores do diâmetro polar e equatorial dos estômatos e na funcionalidade estomática podem indicar uma característica interessante para a tolerância dessa espécie ao arsênio, pois indica que não houve modificações no tamanho dos estômatos e que estes mantiveram a sua funcionalidade, permitindo um fluxo adequado de CO2 da atmosfera para a folha.
A proporção de aerênquima na raiz é uma característica essencial para as plantas que estão em ambiente aquático, podendo aumentar em condições de alagamento, como observado em plantas de milho (Pereira et al., 2008, 2010; Souza et al., 2009). Assim, o aerênquima é essencial para a sobrevivência de E. crassipes, e a proporção de aerênquima na raiz não ter sido alterada em solução nutritiva contaminada com arsênio demonstra outra característica que contribui para a tolerância dessa espécie, resultado também percebido no aumento do diâmetro das células corticais. A epiderme é o primeiro tecido a entrar em contato com a solução contaminada, estando entre os primeiros tecidos a sentir os sintomas de estresse (Castro et al., 2009); contudo, como não ocorreram modificações significativas na epiderme radicular do aguapé cultivado em solução nutritiva contaminada com arsênio, pode-se verificar a resistência desse tecido nas raízes dessa espécie, tornando-se um mecanismo de tolerância. O espessamento da endoderme pode ser um fator interessante para a tolerância de E. crasssipes, pois a endoderme funciona como uma barreira contra o fluxo de elementos tóxicos da raiz para a parte aérea (Castro et al., 2009) e pode se espessar em condições de estresse (Pereira et al., 2008). Dessa forma, as plantas de E. crassipes podem ter manifestado tolerância ao arsênio por terem restringido o fluxo desse elemento para a parte aérea com o espessamento da endoderme.
O índice de vulnerabilidade de Carlquist (IVC) permite inferir a vulnerabilidade do xilema a embolias quanto menor o IVC, maior a condutividade hidráulica da planta (Carlquist, 1975; Castro et al., 2009) e pode ser influenciado por estresses ambientais, como o alagamento (Pereira et al., 2008). O floema é diretamente relacionado com o fluxo de fotossintatos das folhas para os drenos (Castro et al., 2008). As plantas de aguapé podem ter desenvolvido maior espessura do floema e menor IVC como resposta de tolerância ao estresse, estimulando a reprodução vegetativa pelo fluxo de fotoassimilados e nutrientes, o que melhora as chances de sobrevivência da população no ambiente contaminado por arsênio.
Um fator importante nos mecanismos de tolerância do aguapé ao arsênio é percebido no estímulo do sistema antioxidante, permitindo a remoção das espécies reativas de oxigênio. Esse resultado está de acordo com os obtidos por Odjegba & Fasidi (2007), os quais constataram aumento na atividade da CAT, peroxidase do guaiacol e SOD na presença de diferentes metais pesados. Na análise das enzimas verificou-se que a atividade nas folhas respondeu a concentrações menores de arsênio em comparação com as raízes. Dessa forma, percebe-se a importância desse sistema na manutenção da fotossíntese e dos tecidos da parte aérea da planta, comprovando o potencial para a fitorremediação dessa espécie, como relatado por Faisal & Hasnain (2003), Snyder (2006) e Gonçalves Júnior et al. (2008).
Por ser o arsênio um elemento extremamente tóxico para seres humanos e produzido com intensidade por atividades industriais (Gosh et al., 2006), devido à necessidade de tecnologias novas para a remoção desse elemento do ambiente (Dhankher et al., 2002, 2006; Gratão et al., 2005), pode-se verificar que E. crassipes possui grande potencial para a fitorremediação de arsênio, exibindo mecanismos de tolerância e potencial para alta produtividade nessas condições.
As plantas de aguapé exibem aumento na fotossíntese, associado provavelmente a uma maior captação de CO2, e presença de modificações nas características anatômicas foliares e radiculares e no sistema antioxidante enzimático em solução nutritiva contaminada com arsênio, permitindo aumento na fotossíntese e desenvolvendo tolerância a esse elemento nas condições do presente trabalho.
AGRADECIMENTOS
Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico, à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior e à Fundação de Amparo à Pesquisa do Estado de Minas Gerais, pelo financiamento e bolsa concedidos.
LITERATURA CITADA
Recebido para publicação em 5.2.2011 e na forma revisada em 6.5.2011.
- Bor, M. et al. The effect of salt stress on lipid peroxidation and antioxidants in leaves of sugar beet Beta vulgaris L. and wild beet Beta maritima L. Plant Sci., v. 164, n. 1, p. 77-84, 2003.
- CARLQUIST, S. Ecological strategies of xylem evolution Berkeley: University of California Press, 1975. 259 p.
- CASTRO, E. M. et al. Histologia vegetal: estrutura e função dos órgãos vegetativos. Lavras: Universidade Federal de Lavras, 2009. 234 p.
- COSTA, F. H. S. et al. Anatomical and physiological modifications of micropropagated 'Caipira' banana plants under natural light. Sci. Agr., v. 66, n. 3, p. 323-330, 2009.
- DHANKHER, O. P. et al. Engineering tolerance and hyperaccumulation of arsenic in plants by combining arsenate reductase and g-glutamylcysteine synthetase expression. Nature Biotechnol., v. 20, p. 1140-1145, 2002.
- FAISAL, M.; HASNAIN, S. Synergistic removal of Cr (VI) by Eichhornia crassipes in conjunction with bacterial strains. Pakistan J. Biol. Sci., v. 6, n. 3, p. 264-268, 2003.
- GIANNOPOLITIS, C. N.; RIES, S. K. Superoxide dismutases: I. Occurrence in higher plants. Plant Physiol., v. 59, n. 2, p. 309-314, 1977.
- GIDDINGS, J.; EDDLEMON, G. K. Photosynthesis/respiration ratios in aquatic microcosms under arsenic stress. Water Air Soil Poll., v. 9, n. 2, p. 207-212, 1978.
- GONÇALVES JÚNIOR, A. C. et al. Remoção de metais pesados tóxicos cádmio, chumbo e cromo em biofertilizante suíno utilizando macrófita aquática (Eichornia crassipes) como bioindicador. Acta Sci. Technol., v. 30, n. 1, p. 9-14, 2008.
- GOSH, P. et al. Cytogenetic damage and genetic variants in the individuals susceptible to arsenic-induced cancer through drinking water. Inter. J. Cancer, v. 118, n. 10, p. 2470-2478, 2006.
- GRATÃO, P. L. et al. Phytorremediation: Green technology for the clean up of toxic metals in environment. Braz. J. Plant Physiol., v. 17, n. 1, p. 53-64, 2005.
- GRISI, F. A. et al. Avaliações anatômicas foliares em mudas de café 'Catuaí' e 'Siriema' submetidas ao estresse hídrico. Ci. Agrotecnol., v. 32, n. 6, p. 1730-1736, 2008.
- HOAGLAND, D. R.; ARNON, D. I. The water-culture method for growing plants without soil. Berkeley: Agricultural Experimental Station, University of California, 1950. 39 p. (Circular, 347)
- Kraus, J. E.; ARDUIM, M. Manual básico de métodos em morfologia vegetal Seropédica: EDUR, 1997. 221 p.
- Madhusudhan, R. et al. Characterization of an ascorbate peroxidase in plastids of tobacco BY-2 cells. Physiol. Plant., v. 117, n. 4, p. 550-557, 2003.
- MAHMOOD, Q. et al. Anatomical studies on water hyacinth (Eichhornia crassipes (Mart.) Solms) under the influence of textile wastewater. J. Zhejiang Univer., v. 6, n. 10, p. 991998, 2005.
- MITEVA, E.; MERAKCHYISKA, M. Response of chloroplasts and photosynthetic mechanism of bean plants to excess arsenic in soil. Bulgarian J. Agr. Sci., v. 8, n. 2, p. 151-156, 2002.
- Nakano, Y.; Assada, K. Hidrogen peroxide is scavenged by ascorbate specific peroxidase in spinach chloroplast. Plant Cell Physiol., v. 22, n. 5, p. 867-880, 1981.
- NEVES, T. et al. Controle químico do aguapé (Eichhornia crassipes). Planta Daninha, v. 20, n. 1, p. 89-97, 2002.
- PEREIRA, F. J. et al. Evolução da anatomia radicular do milho 'Saracura' em ciclos de seleção sucessivos, Pesq. Agropec. Bras., v. 43, n. 12, p. 1649-1656, 2008.
- PEREIRA, F. J. et al. Atividade do sistema antioxidante e desenvolvimento de aerênquima em raízes de milho 'Saracura'. Pesq. Agropec. Bras., v. 45, n. 5, p. 450-456, 2010.
- ODJEGBA, V. J.; FASIDI, I. O. Changes in antioxidant enzyme activities in Eichhornia crassipes (Pontederiaceae) and Pistia stratiotes (Araceae) under heavy metal stress. Inter. J. Trop. Biol., v. 55, n. 3, p. 815-823, 2007.
- SNYDER, K. V. W. Removal of arsenic from drinking water by water Hyacinths (Eichhornia crassipes). S. J. W. P., v. 1, p. 41-58, 2006.
- SOUZA, T. C. et al. Morpho-anatomical characterization of root in recurrent selection cycles for flood tolerance of maize (Zea mays L.). Plant Soil Environ., v. 55, n. 11, p. 504-510, 2009.
- SOUZA, T. C. et al. Leaf plasticity in successive selection cycles of 'Saracura' maize in response to periodic soil flooding. Pesq. Agropec. Bras., v. 45, n. 1, p. 16-24, 2010.
- STOEVA, N.; BINEVA, T. Oxidative changes and photosynthesis in oat plants grown in As-contaminated soil. Bulgarian J. Agric. Sci., v. 29, n. 1, p. 87-95, 2003.
- ZHOU, Y. M.; HAN, S. J. Photosynthetic response and stomatal behaviour of Pinus koraiensis during the fourth year of exposure to elevated CO2 concentration. Photosynthetica, v. 43, n. 3, p. 445-449, 2005.
- WOLFF, G. et al. Efeitos da toxicidade do zinco em folhas de Salvinia auriculata cultivadas em solução nutritiva. Planta Daninha, v. 27, n. 1, p. 133-137, 2009.
Datas de Publicação
-
Publicação nesta coleção
14 Out 2011 -
Data do Fascículo
Jun 2011
Histórico
-
Aceito
06 Maio 2011 -
Recebido
05 Fev 2011