Resumos
Foi analisada a floração, a frutificação e a biologia da polinização em duas espécies de Marantaceae: Ischnosiphon gracilis (Rudge) Koern. e Stromanthe porteana A. Gris. As observações foram realizadas em populações naturais no Parque Estadual Dois Irmãos (8º7'30" S e 34º52'30" W), um remanescente de Floresta Atlântica em Pernambuco. Nas duas espécies foi verificado padrão fenológico contínuo, com diferentes picos de floração e frutificação. As inflorescências em I. gracilis produziram 14,4 ± 3,4 flores e 1,3 ± 0,6 frutos, enquanto em S. porteana, produziram 125,4 ± 14,8 flores e 7,4 ± 4,9 frutos. Foram verificadas baixa razão pólen/óvulo e reduzida produção natural de frutos nas duas espécies. Em I. gracilis, a concentração de açúcares no néctar foi alta (26%-32%), característica de flores visitadas por abelhas e em S. porteana o néctar foi menos concentrado (20%), situação comum em flores visitadas por beija-flores. Ischnosiphon gracilis é polinizada por três espécies de abelhas Euglossini (Euglossa sp., Eulaema bombiformis e E. cingulata), enquanto S. porteana é polinizada por uma espécie de abelha Euglossini (Eufriesea surinamensis) e por duas espécies de beija-flores (Phaethornis ruber e Amazilia versicolor). As diferenças observadas entre as flores das duas espécies evitam partilha e competição por polinizadores, o que pode garantir a manutenção delas em seu habitat. Entretanto, a longo prazo, a baixa produção de frutos pode afetar a estrutura da população, diminuindo o sucesso reprodutivo das duas espécies.
Euglossini; Ischnosiphon gracilis; melitofilia; ornitofilia; Stromanthe porteana
We analyzed the flowering, fruiting and the pollination biology of two species of Marantaceae: Ischnosiphon gracilis (Rudge) Koern. and Stromanthe porteana A. Gris. Observations were carried out in natural populations at the "Parque Estadual Dois Irmãos" (8º7'30" S and 34º52'30" W), a remnant of Atlantic forest in Pernambuco. We verified a continuous phenological pattern in both species, with different flowering and fruiting peaks. Inflorescences of I. gracilis produced 14.4 ± 3.4 flowers and 1.3 ± 0.6 fruits whereas S. porteana produced 125.4 ± 14.8 flowers and 7.4 ± 4.9 fruits. We verified low pollen/ovule ratio and reduced fruit set under natural pollination for the studied species. Sugar concentration in the nectar of I. gracilis flowers was high (26%-32%), characteristic of bee flowers, and in S. portena the nectar was less concentrated (20%), common to hummingbird flowers. Ischnosiphon gracilis is pollinated by three species of Euglossini bees (Euglossa sp., Eulaema bombiformis and E. cingulata), whereas S. porteana is pollinated by one species of Euglossini bee (Eufriesea surinamensis) and two species of hummingbirds (Phaethornis ruber and Amazilia versicolor). The differences between the flowers of these species avoid the sharing and competition for pollinators, which can assure their maintenance in the habitat. However, in a long term, the low fruit set can affect the population structure by decreasing the reproductive success of these species.
Euglossini; Ischnosiphon gracilis; melittophily; ornithophily; Stromanthe porteana
ARTIGOS
Fenologia reprodutiva, biologia floral e polinizadores de duas espécies simpátricas de Marantaceae em um fragmento de Floresta Atlântica, Nordeste do Brasil1 1 Parte da dissertação de mestrado da primeira autora, desenvolvida junto ao Programa de Pós-Graduação em Biologia Vegetal da Universidade Federal de Pernambuco.
Reproductive phenology, floral biology and pollinators of two sympatric species of Marantaceae from an Atlantic forest fragment, northeastern Brazil
Ana Virgínia Leite; Isabel Cristina Machado2 2 Autor para correspondência: imachado@ufpe.br
Universidade Federal de Pernambuco, Departamento de Botânica, Centro de Ciências Biológicas, Av. Prof. Moraes Rego, s/n.º, Cidade Universitária, 50372-970 Recife, PE, Brasil
RESUMO
Foi analisada a floração, a frutificação e a biologia da polinização em duas espécies de Marantaceae: Ischnosiphon gracilis (Rudge) Koern. e Stromanthe porteana A. Gris. As observações foram realizadas em populações naturais no Parque Estadual Dois Irmãos (8º7'30" S e 34º52'30" W), um remanescente de Floresta Atlântica em Pernambuco. Nas duas espécies foi verificado padrão fenológico contínuo, com diferentes picos de floração e frutificação. As inflorescências em I. gracilis produziram 14,4 ± 3,4 flores e 1,3 ± 0,6 frutos, enquanto em S. porteana, produziram 125,4 ± 14,8 flores e 7,4 ± 4,9 frutos. Foram verificadas baixa razão pólen/óvulo e reduzida produção natural de frutos nas duas espécies. Em I. gracilis, a concentração de açúcares no néctar foi alta (26%-32%), característica de flores visitadas por abelhas e em S. porteana o néctar foi menos concentrado (20%), situação comum em flores visitadas por beija-flores. Ischnosiphon gracilis é polinizada por três espécies de abelhas Euglossini (Euglossa sp., Eulaema bombiformis e E. cingulata), enquanto S. porteana é polinizada por uma espécie de abelha Euglossini (Eufriesea surinamensis) e por duas espécies de beija-flores (Phaethornis ruber e Amazilia versicolor). As diferenças observadas entre as flores das duas espécies evitam partilha e competição por polinizadores, o que pode garantir a manutenção delas em seu habitat. Entretanto, a longo prazo, a baixa produção de frutos pode afetar a estrutura da população, diminuindo o sucesso reprodutivo das duas espécies.
Palavras-chave - Euglossini, Ischnosiphon gracilis, melitofilia, ornitofilia, Stromanthe porteana
ABSTRACT
We analyzed the flowering, fruiting and the pollination biology of two species of Marantaceae: Ischnosiphon gracilis (Rudge) Koern. and Stromanthe porteana A. Gris. Observations were carried out in natural populations at the "Parque Estadual Dois Irmãos" (8º7'30" S and 34º52'30" W), a remnant of Atlantic forest in Pernambuco. We verified a continuous phenological pattern in both species, with different flowering and fruiting peaks. Inflorescences of I. gracilis produced 14.4 ± 3.4 flowers and 1.3 ± 0.6 fruits whereas S. porteana produced 125.4 ± 14.8 flowers and 7.4 ± 4.9 fruits. We verified low pollen/ovule ratio and reduced fruit set under natural pollination for the studied species. Sugar concentration in the nectar of I. gracilis flowers was high (26%-32%), characteristic of bee flowers, and in S. portena the nectar was less concentrated (20%), common to hummingbird flowers. Ischnosiphon gracilis is pollinated by three species of Euglossini bees (Euglossa sp., Eulaema bombiformis and E. cingulata), whereas S. porteana is pollinated by one species of Euglossini bee (Eufriesea surinamensis) and two species of hummingbirds (Phaethornis ruber and Amazilia versicolor). The differences between the flowers of these species avoid the sharing and competition for pollinators, which can assure their maintenance in the habitat. However, in a long term, the low fruit set can affect the population structure by decreasing the reproductive success of these species.
Key words - Euglossini, Ischnosiphon gracilis, melittophily, ornithophily, Stromanthe porteana
Introdução
Estudos fenológicos conduzidos com espécies vegetais de florestas tropicais comumente têm encontrado padrão de floração anual ou supra-anual entre as espécies arbustivas e arbóreas (Newstrom et al. 1993, Machado et al. 1997), enquanto entre as ervas, o padrão observado é o de floração contínua, podendo apresentar variações de intensidade ao longo do ano (Sakai 2000). Alguns estudos têm demonstrado que sincronia na floração entre espécies simpátricas conduz à partilha e/ou competição por polinizadores (Levin & Anderson 1970, Sakai 2000). Entre espécies vegetais taxonomicamente relacionadas, a partilha de polinizadores pode resultar em hibridização, redução do sucesso reprodutivo e perda de pólen (Campbell & Motten 1985). A competição, por sua vez, pode interferir no número de polinizadores e de visitas às flores e levar os indivíduos vegetais ao isolamento reprodutivo (Murcia 1995).
Espécies da família Marantaceae apresentam elaborado mecanismo floral com apresentação secundária de pólen e liberação explosiva e irreversível do estilete (Kennedy 1978, Howell et al. 1993, Yeo 1993, Claben-Bockhoff & Pischtschan 2000, Locatelli et al. 2004). Para que haja a polinização é necessário que o estilete, que está preso sob tensão, seja liberado de sua posição inicial, sendo disparado contra o corpo do polinizador (Kennedy 1978). Assim, para a transferência do pólen, é necessária a participação de polinizadores específicos que sejam capazes de desencadear o movimento e de liberar o estilete de sua posição inicial (Kennedy 1978). Esse elaborado mecanismo floral, associado à participação de polinizadores eficientes na liberação do estilete, aumenta o sucesso na transferência e deposição de pólen entre os indivíduos (Kennedy 1978, Claben-Bockhoff & Pischtschan 2000).
Para as espécies de Marantaceae, as interações planta-polinizador são unilaterais: as plantas dependem de um grupo específico de polinizadores para a reprodução, mas os polinizadores podem utilizar recursos de diferentes espécies de plantas (Kennedy 1978, 2000). Abelhas Euglossini têm sido mencionadas como os polinizadores mais importantes para espécies desta família (Kennedy 1978, 2000), tendo sido recentemente reportada também a participação de beija-flores no processo de polinização (Kennedy 2000, Locatelli et al. 2004).
No Nordeste do Brasil, a família Marantaceae ocorre principalmente em áreas de Floresta Atlântica (Arns et al. 2002), sendo este ecossistema identificado como importante área de endemismo, com elevado número de espécies ameaçadas (Mittermeier et al. 2005). Todos os estudos e esforços são importantes para entender os processos ecológicos que mantêm a diversidade na Floresta Atlântica, reconhecida como um dos "hotspots" para a conservação da biodiversidade (Mittermeier et al. 2005).
Considerando a importância da interação plantapolinizador como processo-chave na manutenção da diversidade biológica e o papel fundamental dessa interação para espécies de Marantaceae, o presente trabalho teve como objetivo analisar a fenologia reprodutiva, a biologia floral e os polinizadores de duas espécies simpátricas de Marantaceae, Ischnosiphon gracilis (Rudge) Koern. e Stromanthe porteana A. Gris, em um fragmento de Floresta Atlântica no Estado de Pernambuco, Nordeste do Brasil. Para atender a esse objetivo, foram elaboradas as seguintes questões: (1) Qual o padrão de floração? (2) Há sobreposição na floração entre as espécies? (3) Os visitantes florais são eficientes no desencadeamento do movimento do estilete? e (4) Há partilha ou competição por polinizadores entre as espécies estudadas?
Material e métodos
O estudo foi realizado no Parque Estadual Dois Irmãos, um remanescente de Floresta Atlântica com 388,67 ha (Coutinho et al. 1998) localizado próximo a áreas urbanas no Município de Recife, Pernambuco, Nordeste do Brasil (8º7'30" S e 34º52'30" W). A precipitação média é cerca de 2.460 mm ao ano, com temperatura média anual de 25,6 ºC (Coutinho et al. 1998). O clima da região está classificado como quente e úmido, apresentando estação úmida entre março e setembro e estação seca no período de outubro a fevereiro (Coutinho et al. 1998).
Populações de Ischnosiphon gracilis (Rudge) Koern. e Stromanthe porteana A. Gris foram estudadas no interior da floresta e em áreas de clareiras. Ischnosiphon gracilis é uma planta escandente, ascendendo cerca de 8 m sobre as árvores e arbustos, enquanto S. porteana é herbácea, com altura entre 1,0 m e 2,5 m. Espécimes-testemunho foram depositados no Herbário UFP Professor Geraldo Mariz da Universidade Federal de Pernambuco (UFP 31.122 e 31.480).
As observações fenológicas foram conduzidas quinzenalmente entre fevereiro de 2001 e fevereiro de 2003 em 15 indivíduos de cada espécie, marcados aleatoriamente em 15 populações naturais. Para cada indivíduo foi estimado o percentual de botões, flores, frutos jovens e em início de dispersão, seguindo escala semiquantitativa de Fournier (1974).
A morfologia floral das espécies foi analisada através da posição e de medidas (com o uso de régua milimetrada) das estruturas florais em 20 flores de 10 indivíduos. Desenhos esquemáticos das flores, evidenciando o mecanismo de ação do estilete, foram executados sob câmara-clara acoplada a estereomicroscópio. O período de antese e a longevidade floral foram verificados em 15 flores de 10 inflorescências (n = 10 indivíduos) escolhidas aleatoriamente. Em 20 inflorescências marcadas aleatoriamente (n = 20 indivíduos), foram contados o número de flores abertas por dia, o número médio de flores produzidas por inflorescência e acompanhada a duração da inflorescência para cada espécie. O número médio de flores por inflorescência foi estimado através da contagem do total de brácteas por inflorescência e do número médio de flores em cada bráctea. Além disso, em 30 inflorescências de 15 indivíduos foi quantificado o número de frutos produzidos.
Para testar a receptividade do estigma foi utilizada solução aquosa (0,25%) de permanganato de potássio (KMnO4) (Robinsohn 1924) em 10 flores previamente ensacadas, das quais cinco foram coletadas no início de antese e cinco no final da tarde. A razão pólen/óvulo (Cruden 1977) foi determinada através da contagem direta de óvulos e de todos os grãos de pólen da antera de 20 botões em pré-antese, verificando-se também a viabilidade polínica com o uso de solução aquosa de carmim acético a 2% (Radford et al. 1974). O volume e a concentração de solutos no néctar foram medidos às 12h00 e 17h00 em 20 flores de I. gracilis e 15 flores de S. porteana (n = 10 indivíduos), previamente ensacadas, com auxílio de microsseringa (Microliter® 10 µL) e refratômetro de bolso (Atago® 0%-32%; 28%-62%), respectivamente. Foi testada a formação de frutos e sementes através de autopolinização espontânea, ensacando-se 50 botões em pré-antese de I. gracilis e 110 botões de S. porteana, distribuídos em 20 indivíduos de cada espécie. Além deste tratamento, em 10 inflorescências (n = 10 indivíduos) foram marcadas 122 e 1.200 flores, respectivamente, para estimar a produção natural de frutos em ambas as espécies.
O comportamento dos visitantes florais foi analisado durante 50 horas de observações no campo, em três indivíduos focais de I. gracilis (cinco dias de observações, entre 7h00 e 17h00) e três de S. porteana (oito dias entre 10h00 e 16h00, mais duas horas entre 15h00 e 17h00). Foi verificado o local de deposição do pólen no corpo do polinizador, o número de flores visitadas durante a permanência na planta, o período de tempo entre visitas e o recurso floral coletado. Após cada visita à flor, foi observado se o visitante acionava o mecanismo de liberação do estilete. De acordo com o tempo médio registrado entre as visitas foram definidas três classes de freqüência de visitas: (1) freqüente uma visita ao indivíduo focal a cada 15 minutos, (2) pouco freqüente uma visita a cada 1-2 horas e (3) rara quando o retorno para a coleta de recursos no indivíduo observado ocorreu em intervalos maiores que 2 horas. Alguns insetos visitantes foram capturados, identificados e depositados na coleção de insetos polinizadores do Laboratório de Biologia Floral e Reprodutiva da Universidade Federal de Pernambuco. Os beija-flores foram identificados por especialistas, através de fotografias tomadas no campo.
Foi aplicado o teste Mann-Whitney para verificar se havia diferença no comprimento do tubo floral e na produção de flores e frutos por inflorescência entre I. gracilis e S. porteana, sendo adotado um nível de significância de 5%. Para as análises estatíticas foi utilizado o programa BioEstat, 3.0 (Ayres et al. 2003).
Resultados
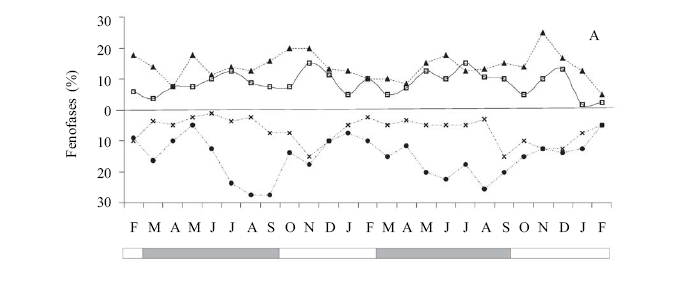
Os indivíduos de Ischnosiphon gracilis (Rudge) Koern. apresentaram flores e frutos durante todo o período de observação. A fenofase de floração (botões e flores) mostrou pouca flutuação, com leve aumento no percentual de flores durante a estação seca, e diminuição entre os meses de março e abril, na estação chuvosa e nos meses de outubro, janeiro e fevereiro, estação seca (figura 1A). Nos dois anos de estudo, a produção de frutos foi mais intensa durante a estação chuvosa, entre os meses de junho e setembro, com a dispersão ocorrendo principalmente na estação seca (figura 1A). A produção de botões e flores nos indivíduos de S. porteana A. Gris também foi contínua, sobrepondo-se com as fenofases de fruto jovem e em dispersão. Entretanto, em diferentes meses dos anos de estudo foi registrada ausência de frutos em dispersão (figura 1B). Nesta espécie, o maior percentual de floração e frutificação foi observado durante a estação chuvosa (figura 1B).
As flores das duas espécies são hermafroditas, assimétricas, apresentam longevidade de 24 horas e estão agrupadas em inflorescências racemosas terminais do tipo tirso (sensu Dahlgren et al. 1985). As flores de I. gracilis possuem 4,5 (± 0,3) cm de comprimento enquanto em S. porteana as flores medem 0,90 (± 0,05) cm de comprimento. O início de antese nas duas espécies ocorreu pela manhã, porém diferiram quanto ao horário de abertura das flores as quais ocorreram às 6h40 em I. gracilis e às 9h30 em S. porteana e também quanto ao número de flores abertas por dia por inflorescência (2,0 ± 0,0 e 5,0 ± 0,7, respectivamente). As inflorescências podem durar de um a cinco meses (I. gracilis) ou seis meses (S. porteana).
A inflorescência em I. gracilis possui 7,2 (± 1,7) brácteas e cada dois botões florais estão próximos entre si, estando completamente envolvidos por uma única bráctea verde e de consistência coriácea, havendo, assim, uma limitação estrutural, ocasionando a produção de apenas um único fruto por bráctea. Nas inflorescências de S. porteana existem 10,9 (± 1,2) brácteas e os botões florais estão envoltos apenas parcialmente por uma bráctea cimbiforme de coloração rosa brilhante, havendo a formação de 12 (± 0) flores no interior de cada bráctea. Desse modo, em S. porteana há maior número de flores (125,4 ± 14,8) e frutos (7,4 ± 4,9) por inflorescência que em I. gracilis (14,4 ± 3,4 flores; 1,3 ± 0,6 frutos), havendo diferença significativa entre as espécies (flores: U = 0; P < 0,001; frutos: U = 10; P < 0,001).
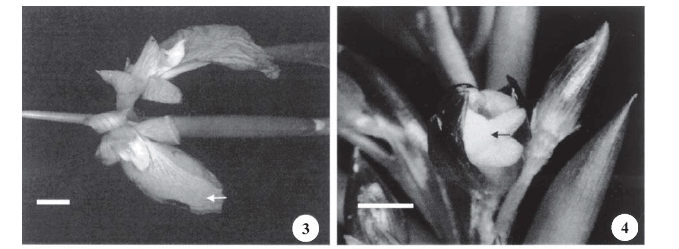
O androceu das duas espécies é composto por um estame com uma teca fértil. Três estaminódios (caloso, cuculado e petalóide) estão presentes nas flores de I. gracilis (figura 2A-C) e as regiões basais do estame e dos estaminódios são adnatos à corola, formando um tubo floral alongado, com 3,7 (± 0,18) cm de comprimento. As flores de S. porteana (figura 2D) possuem quatro estaminódios (caloso, cuculado e dois petalóides) que também se encontram adnatos à corola juntamente com o estame, constituindo um curto tubo floral com 0,69 (± 0,05) cm de comprimento, que apresenta diferença significativa quando comparado com o de I. gracilis (U = 0; P < 0,001). O estaminódio petalóide em I. gracilis é conspícuo (figura 3), de cor lilás e funciona na atração dos visitantes florais e também como uma plataforma de pouso para os polinizadores, enquanto em S. porteana eles são insconspícuos, brancos e não apresentam essas funções (figura 4). Em S. porteana, o cálice e a corola são de cor rosa brilhante e são responsáveis pela atração dos visitantes florais.
O gineceu das duas espécies é formado por um estilete curvo, com uma depressão localizada por trás da região estigmática (depressão estilar) onde o pólen é depositado ainda na fase de botão (apresentação secundária de pólen). O estilete é adnato ao tubo da corola apenas em sua região mais basal e encontra-se preso, sob tensão, pelo estaminódio cuculado que o mantém ereto, em sua posição inicial (figura 2B, E). O estaminódio cuculado possui um apêndice que funciona como um "gatilho", o qual, quando tocado pelo polinizador, libera o estilete que é projetado imediatamente para frente (figura 2C, F), em direção ao visitante, deixando no corpo do polinizador os grãos de pólen que foram previamente depositados na depressão estilar.
O estigma possui uma cavidade e está receptivo ao longo de todo o período de antese. O ovário é ínfero, portando um único óvulo, de modo que nas duas espécies a razão pólen-óvulo corresponde ao valor médio do número de grãos de pólen por antera, ou seja, 187,05 (± 15,40) para I. gracilis e 115,9 (± 22,6) para S. porteana. A viabilidade polínica foi alta tanto para I. gracilis (98%), quanto para S. porteana (88%). O néctar é produzido no nectário septal (sensu Smets et al. 2000) e armazenado na região basal do tubo floral formado pela junção dos estaminódios e estilete. A produção de néctar por flor coletado às 12h00 foi de 8,0 µL (± 4,9) para I. gracilis e 4,0 µL (± 1,2) para S. porteana, verificando-se concentração de solutos no néctar de 32% (± 2,8%) e 20% (± 0,9%), respectivamente. No final da tarde, o volume de néctar decresceu, tendo sido observados valores de 1,1 µL (± 1,4) para I. gracilis (concentração de 26,0% ± 0,7%) e 0,32 µL (± 0,66) para S. porteana. O baixo volume de néctar coletado às 17h00 em flores de S. porteana impossibilitou a medida da concentração nesse horário.
Os testes para verificação de autopolinização espontânea não produziram frutos em ambas as espécies. O percentual de produção de frutos através da polinização natural foi baixo: 6,5% (8 frutos em 122 flores de I. gracilis marcadas) e 5,1% (61 frutos em 1.200 flores de S. porteana).
Três espécies de abelhas da tribo Euglossini (Euglossa sp., E. bombiformis Packard, 1869 e Eulaema cingulata Fabricius, 1804) foram os polinizadores efetivos das flores de I. gracilis, sendo pouco freqüentes, visitando em média três a cinco flores em intervalos de ca. 2 horas, entre uma e outra rota de forrageamento. As visitas concentraram-se principalmente no início da manhã, entre 7h30 e 9h00. Durante as visitas, essas abelhas atuaram como polinizadores legítimos, desencandeando o mecanismo de polinização através da liberação do estilete e conseqüente transporte dos grãos de pólen. As abelhas pousaram no estaminódio petalóide, segurando-o com as pernas dianteiras e inseriram a língua no interior do tubo da corola para coletar o néctar. Após a flor ser desengatilhada, o estaminódio petalóide caiu imediatamente. Ao se deslocar de uma flor para outra, as abelhas permaneceram com a língua estendida. O pólen pode ficar aderido na língua do inseto ou na fossa proboscidial (sensu Kennedy 1978). Outra espécie de Euglossini (Exaerete smaragdina Guérin, 1845) e uma espécie de beija-flor (Phaethornis ruber Linnaeus, 1758) também visitaram as flores de I. gracilis (tabela 1). Indivíduos de E. smaragdina foram freqüentes, porém visitaram poucas flores (1-2) e atuaram como pilhadores de néctar, sem liberar o estilete de sua posição inicial. Indivíduos de P. ruber (figura 5) também foram freqüentes, visitando cerca de 10 flores durante uma rota de forrageamento. Entretanto, os indivíduos desta espécie de beija-flor abriam uma pequena fenda no tubo da corola (figura 6), atuando como pilhadores de néctar.
Todos os visitantes florais observados em flores de S. porteana atuaram como polinizadores efetivos, sendo duas espécies de beija-flores (Phaethornis ruber e Amazilia versicolor Vieillot, 1818) e uma espécie de abelha Euglossini (Eufriesea surinamensis Linnaeus, 1758) (tabela 1). Phaethornis ruber foi freqüente, visitando cerca de 13 flores em intervalos de 15-30 minutos, forçando também os botões em pré-antese, diferentemente de A. versicolor que foi pouco freqüente, visitando cerca de 10-12 flores em intervalos de 1-2 horas. Foram observados indivíduos desta espécie defendendo território em duas populações de S. porteana, apresentando comportamento agonístico em relação aos indivíduos de P. ruber que se aproximaram das flores para coletar néctar. Em ambas as espécies de beija-flores, os grãos de pólen ficaram aderidos na ponta do bico (figuras 7-8). A abelha Eufriesea surinamensis foi um polinizador raro, visitando 5-7 flores em intervalos acima de três horas, principalmente no período da tarde.
Tanto em I. gracilis quanto em S. porteana o estilete pode não ser liberado durante a primeira visita do polinizador, sendo necessárias repetidas visitas para desencadear o mecanismo de polinização. Entretanto, quando o estilete é liberado de sua posição inicial, todos os grãos de pólen são transferidos para o corpo do polinizador (a língua ou o bico) e a flor não é mais visitada.
Discussão
O padrão de floração contínuo (sensu Newstrom et al. 1994) observado em I. gracilis (Rudge) Koern. e S. porteana A. Gris apresenta importante função ecológica, pois mantém uma guilda de visitantes florais ao longo de todo o ano, além de representar importante fonte de nutrientes a esses animais visitantes em períodos de floração reduzida na comunidade (Murcia 1995). A frutificação seguiu padrão semelhante nas duas espécies, com ausência de frutos durante seis meses para S. porteana. Os picos de floração e frutificação diferiram entre ambas as espécies. Em S. porteana, o pico de floração e frutificação apresentou maior percentual de flores abertas e frutos que o observado para I. gracilis, ocorrendo durante a estação chuvosa. Já em I. gracilis, o pico foi observado principalmente no período seco. Entre as espécies de Marantaceae já observadas quanto ao período de floração, não há um padrão para as espécies. Têm sido relatadas espécies com período de floração mais intensa durante a estação úmida, como já observado em Calathea latifolia (Willd. ex Link) Klotzsch no Panamá (Ackerman et al. 1982), C. insignis Petersen (Kennedy 1983) e C. macrosepala K. Schum. na Costa Rica (Stiles 1978), bem como espécies apresentando floração durante a estação seca, como Thalia geniculata L. (Davis 1987) e Calathea lutea Schult. (Stiles 1978) na Costa Rica e Saranthe klotzschiana (Koern.) Eichl. no Brasil (Locatelli et al. 2004). Entre as espécies de Marantaceae já analisadas quanto à fenologia, a frutificação tem sido verificada principalmente na estação úmida, como observado para S. porteana no presente estudo. Apenas em Calathea macrosepala, C. soconuscum Matuda e C. latifolia (Kennedy 1978) e agora em I. gracilis, há registro de frutificação na estação seca.
A baixa razão pólen-óvulo (P/O) verificada em I. gracilis e S. porteana é característica de espécies com apresentação secundária de pólen (Cruden 1977), podendo estar associada à eficiência do mecanismo de polinização, em que o pouco pólen produzido é transferido para o corpo do polinizador durante a visita. Segundo Cruden (1977), a baixa razão P/O também pode indicar autogamia (Cruden 1977). A autogamia tem sido reportada em, pelo menos, 44 espécies de Marantaceae (ca. 8% da família) (Kennedy 2000) e ocorre principalmente em espécies do gênero Maranta (Andersson 1986). Entretanto, a ausência de produção espontânea de frutos indica que ambas as espécies estudadas são alógamas. Ramírez & Seres (1994) também verificaram baixa razão pólen-óvulo em duas espécies de Calathea e Stromanthe, uma das quais (Calathea sp.) foi considerada xenógama obrigatória. Desse modo, para I. gracilis e S. porteana a baixa razão P/O, a ausência de autogamia e, sobretudo, a reduzida produção natural de frutos podem também ser considerados um indicativo de xenogamia. Reduzida razão P/O e baixa produção natural de frutos são usualmente comuns em espécies auto-incompatíveis, como reportado por Schemske & Horvitz (1984) para Calathea ovandensis Matuda, cujo percentual de frutos produzidos naturalmente foi de 31,5%, bem acima do valor observado para as espécies aqui estudadas. Entretanto, análises complementares devem ser conduzidas a fim de confirmar o sistema reprodutivo dessas espécies.
Em I. gracilis e S. porteana, assim como em outras espécies de Marantaceae, as interações planta-polinizador são unilaterais, ou seja, as plantas dependem de um grupo específico de polinizadores para a reprodução enquanto os polinizadores podem utilizar recursos de diferentes espécies de plantas (Kennedy 1978, 2000). Os principais grupos de polinizadores para espécies de Marantaceae são abelhas da tribo Euglossini (Kennedy 1978, 2000, Andersson 1998, Schemske & Horvitz 1984, Ackerman 1985) e beija-flores (Stiles 1978, Davis 1987, Kennedy 2000, Locatelli et al. 2004). A partir da concentração de solutos no néctar de flores das duas espécies estudadas, verifica-se que há correspondência com a faixa de variação percentual que tem sido atribuída a diferentes vetores de polinização (sensu Baker 1975). No presente estudo, a concentração de néctar verificada para I. gracilis é característica de flores melitófilas (Baker 1975, Endress 1994), enquanto para S. porteana, o percentual observado é comumente encontrado em flores ornitófilas (Baker 1975, Bolten & Feinsinger 1978).
O baixo volume de néctar produzido por flor induz os polinizadores a se deslocarem entre indivíduos de diferentes populações para a coleta de mais recursos (Murcia 1995), induzindo um comportamento "traplining" (sensu Janzen 1971) que irá favorecer o fluxo polínico e, conseqüentemente, a polinização cruzada (Janzen 1971, Ackerman et al. 1982). Ainda, a longa fase de floração observada entre as espécies estudadas e o número reduzido de flores abertas por dia por inflorescência também pode induzir a esse tipo de comportamento. Tanto espécies de abelhas Euglossini (Janzen 1971, Ackerman 1985), quanto de beija-flores, particularmente Phaethornithinae (Linhart 1973, Gill 1988), apresentam comportamento do tipo "traplining". Em I. gracilis, a reduzida freqüência das abelhas Euglossini às flores pode ser atribuída tanto ao modo de forrageamento dessas abelhas (tipo "traplining") (Janzen 1971) quanto ao baixo volume de néctar, tendo sido ainda mais reduzido devido à presença do beija-flor Phaetornis ruber que apresentou elevada freqüência e atuou como importante pilhador primário de néctar (sensu Inouye 1980). No momento em que há redução do recurso floral, os polinizadores são forçados a procurar recursos em outros indivíduos, aumentando o fluxo polínico e promovendo a polinização cruzada.
Em S. porteana, o reduzido sucesso reprodutivo pode estar relacionado, em parte, ao comportamento territorialista observado em Amazilia versicolor (Trochilinae). Entre os indivíduos de S. porteana, além do comportamento do tipo "traplining" observado para o beija-flor Phaethornis ruber, foi verificado também comportamento territorial de Amazilia versicolor (Trochilinae). Ambos os comportamentos verificados entre os beija-flores são comumente observados em densas populações de plantas (como ocorre com S. porteana), sendo possível manter indivíduos territoriais e não territoriais (Linhart 1973). Entretanto, esses comportamentos promovem diferenças qualitativas na transferência de pólen entre indivíduos, pois espécies territoriais, diferentemente das não-territoriais, podem residir por longo período em determinado agrupamento vegetal e promover transferência de pólen apenas entre flores de um mesmo indivíduo (Linhart 1973).
Entre as espécies de Marantaceae, o sucesso reprodutivo está associado à participação de polinizadores eficientes no desencadeamento do mecanismo de disparo do estilete, bem como com a precisa transferência dos grãos de pólen para o corpo do polinizador. Para isso, há a produção de "pollenkitt" (Dobson 1989) e de uma secreção próxima à depressão estilar, que irão favorecer a adesão do pólen ao corpo do polinizador (Kennedy 1978, Andersson 1998), promovendo a polinização. Essa associação entre eficiência de polinizadores e precisa deposição dos grãos de pólen é de extrema importância para a reprodução das espécies dessa família, uma vez que o mecanismo do estilete, após ser desencadeado, não volta mais para sua posição inicial, sendo considerado um mecanismo de tudo ou nada (Claben-Bockhoff & Pischtschan 2000). Embora as espécies analisadas no presente estudo sejam simpátricas, taxonomicamente relacionadas e apresentem sobreposição entre as fenofases de floração, não partilharam polinizadores. Algumas características podem estar contribuindo para isso, tais como coloração diferenciada das flores, ausência de plataforma de pouso em S. porteana, diferença na concentração de néctar, bem como diferença no comprimento do tubo da corola entre as duas espécies (Kennedy 2000). Apesar da baixa produção de frutos, a presença de distintos polinizadores com diferentes comportamentos de forrageamento está mantendo a reprodução sexuada dessas duas espécies de Marantaceae em seu ambiente natural.
Agradecimentos À Dra. Karla Noyre Arns, pela identificação das espécies vegetais; ao Dr. Ivan Sazima (Unicamp), pela identificação das espécies de beija-flores; à MSc. Tarcila Nadia (UFPE), pelo auxílio durante as observações de campo; à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes) e ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), pelas bolsas concedidas à primeira e segunda autoras, respectivamente.
(recebido: 01 de junho de 2006; aceito: 5 de abril de 2007)
- ACKERMAN, J.D. 1985. Euglossine bees and their nectar hosts. In The botany and natural history of Panama(W.G. D'Arcy & M.D.A. Correy, eds.). Missouri Botanical Garden, St. Louis, p.225-233.
- ACKERMAN, J.D., MESLER, M.R., LU, K.L. & MONTALVO, A.M. 1982. Food-foraging behaviour of male Euglossini (Hymenoptera: Apidae): vagabonds or trapliners? Biotropica 14:241-248.
- ANDERSSON, L. 1986. Revision of Maranta subgen. Maranta (Marantaceae). Nordic Journal of Botany 6:729-756.
- ANDERSSON, L. 1998. Marantaceae. In The families and genera of vascular plants, flowering plants, Monocotiledons, Alismatanae and Commelinanae (except Gramineae) (K. Kubitzki, ed.). Springer-Verlag, Berlin, v.4, p.278-293.
- ARNS, K.N.Y., MAYO, S.J. & ALVES, M.V. 2002. Morfologia de Marantaceae ocorrente no estado de Pernambuco, Brasil. Iheringia 57:3-20.
- AYRES, M., AYRES JÚNIOR, M., AYRES, D.L. & SANTOS, A.S. 2003. BioEstat 3.0. Aplicações estatísticas nas áreas das ciências biológicas e médicas. Sociedade Civil Mamirauá: MCT-CNPq / Conservation International, Belém.
- BAKER, H.G. 1975. Sugar concentration in nectars from hummingbird flowers. Biotropica 7:37-41.
- BOLTEN, A.B. & FEINSINGER, P. 1978. Why do hummingbird flowers secrete dilute nectar? Biotropica 10:307-309.
- CAMPBELL, D.R. & MOTTEN, A.F. 1985. The mechanism of competition for pollination between two forest herbs. Ecology 66:554-563.
- CLAbEN-BOCKHOFF, R. & PISCHTSCHAN, E. 2000. The explosive style in Marantaceae - Preliminary results from anatomic studies. In Plant biomechanics (H-Ch. Spat & G. Sperl, eds.). Thieme-Verlag, New York, p.515-521.
- COUTINHO, R.Q., LIMA FILHO, M.F., SOUZA-NETO, J.S. & SILVA, E.P. 1998. Características climáticas, geológicas, geomorfológicas e geotécnicas da Reserva Ecológica de Dois Irmãos. In Reserva Ecológica de Dois Irmãos: Estudos em um remanescente de Mata Atlântica em uma área urbana (Recife, Pernambuco, Brasil) (I.C. Machado, A.V. Lopes & K.C. Pôrto, eds.). Sectma, Editora Universitária, UFPE, Recife, p.21-49.
- CRUDEN, R.W. 1977. Pollen-ovule ratios: a conservative indicator of breeding systems in flowering plants. Evolution 31:32-46.
- DAHLGREN, R.M.T., CLIFFORD, H.T. & YEO, P.F. 1985. The families of the Monocotyledons. Springer-Verlag, Berlin.
- DAVIS, M.A. 1987. The role of flower visitors in the explosive pollination of Thalia geniculata (Marantaceae), a Costa Rican marsh plant. Bulletin of the Torrey Botanical Club 114:134-138.
- DOBSON, H.E.M. 1989. Pollenkitt in plant reproduction. In The evolutionary ecology of plants (J.H. Bock & Y.B. Linhart, eds.). Westview Press, Colorado, p.227-246.
- ENDRESS, P.K. 1994. Diversity and evolutionary biology of tropical flowers. Cambridge University Press, Cambridge.
- FOURNIER, L.A. 1974. Un método cuantitativo para la medición de características fenológicas en árboles. Turrialba 24:422-423.
- GILL, F.B. 1988. Trapline foraging by hermit hummingbirds: competition for an undefended, renewable resource. Ecology 69:1933-1942.
- HOWELL, G.J., SLATER, A.T. & KNOX, R.B. 1993. Secondary pollen presentation in angiosperms and its biological significance. Australian Journal of Botany 41:417-438.
- INOUYE, D.W. 1980. The terminology of floral larceny. Ecology 61:1251-1253.
- JANZEN, D.H. 1971. Euglossine bees as long-distance pollinators of tropical plants. Science 171:203-205.
- KENNEDY, H. 1978. Systematics and pollination of the "Closed-flowered" species of Calathea (Marantaceae). University of California Publication in Botany 71:1-90.
- KENNEDY, H. 1983. Calathea insignis (hoja negra, hoja de sal, bijagua, rattlesnake plant). In Costa Rican natural history (D.H. Janzen, ed.). University of Chicago Press, Chicago, p.204-206.
- KENNEDY, H. 2000. Diversification in pollination mechanisms in the Marantaceae. In Monocots: systematics and evolution (K.L. Wilson & D.A. Morrison, eds.). Csiro, Melbourne, p.335-343.
- LEVIN, D.A. & ANDERSON, W.W. 1970. Competition for pollinators between simultaneously flowering species. American Naturalist 104:345-354.
- LINHART, Y. 1973. Ecological and behavioral determinants of pollen dispersal in hummingbird pollinated Heliconia American Naturalist 107:511-523.
- LOCATELLI, E., MACHADO, I.C. & MEDEIROS, P. 2004. Saranthe klotzschiana (Koer.) Eichl. (Marantaceae) e seu mecanismo explosivo de polinização. Revista Brasileira de Botânica 27:757-765.
- MACHADO, I.C., BARROS, L.M. & SAMPAIO, E.V.S.B. 1997. Phenology of caatinga species at Serra Talhada, PE, Northeastern Brazil. Biotropica 29:57-66.
- MITTERMEIER, R.A., GIL, P.R., HOFFMANN, M., PILGRIN, J., BROOKS, T., MITTERMEIER, C.G., LAMOREUX, J. & FONSECA, G.A.B. 2005. Hotspots revisited. Earth's biologically richest and most endangered terrestrial ecoregions. Conservation International, Sierra Madre, Cemex.
- MURCIA, C. 1995. Forest fragmentation and the pollination of neotropical plants. In Forest patches in tropical landscapes (J. Schellas & R. Greenberg, eds.). Island Press, London, p.19-36.
- NEWSTROM, L.E., FRANKIE, G.W., BAKER, H.G. & COLWELL, R.K. 1993. Diversity of long-term flowering patterns. In La Selva: Ecology and natural history of a Neotropical Rain Forest (L.A. McDade, K.S. Bawa, H.A. Hespenheide & G.S. Hartshorn, eds.). University of Chicago Press, Chicago, p.142-160.
- NEWSTROM, L.E., FRANKIE, G.W. & BAKER, H.G. 1994. A new classification for plant phenology based on flowering patterns in lowland tropical rain forest trees at La Selva, Costa Rica. Biotropica 26:141-159.
- RADFORD, A.E., DICKINSON, W.C., MASSEY, J.R. & BELL, C.R. 1974. Vascular plant systematics. Harper & Row, New York.
- RAMIREZ, N. & SERES, A. 1994. Plant reproductive biology of herbaceous monocots in a Venezuelan tropical cloud forest. Plant Systematics and Evolution 190:129-142.
- ROBINSOHN, I. 1924. Die Färbungsreaktion der narbe, stigmatochromie, als morpho-biologische Blütenuntersuchungsmethode. Sitzungsberichten Akadenuscher Wissduschaft Wien, Mathematics 133:180-213.
- SAKAI, S. 2000. Reproductive phenology of gingers in a lowland mixed dipterocarp forest in Borneo. Journal of Tropical Ecology 16:337-354.
- SCHEMSKE, D.W. & HORVITZ, C.C. 1984. Variation among floral visitors in pollination ability: a precondition for mutualism specialization. Science 225:519-521.
- SMETS, F.E., RONSE-DECRAENE, L.P., CARIS, P. & RUDALL, P.J. 2000. Floral nectaries in monocotyledons: distribution and evolution. In Monocots: systematics and evolution (K.L. Wilson & D.A. Morrison, eds.). Csrio Publishing, Collingwood, p.230-240.
- STILES, F.G. 1978. Temporal organization of flowering among the hummingbird foodplants of a tropical wet forest. Biotropica 10:194-210.
- YEO, P.F. 1993. Secondarypollen presentation. Form, function and evolution. Springer-Verlag, New York.
Datas de Publicação
-
Publicação nesta coleção
28 Set 2007 -
Data do Fascículo
Jun 2007
Histórico
-
Aceito
05 Abr 2007 -
Recebido
01 Jun 2006