Resumos
Procedimentos para validação intralaboratorial de kits de ELISA foram adotados na verificação da eficiência de um kit para detecção e quantificação de aflatoxina M1 em leite. Foram realizados ensaios com soluções padrões fornecidas pelo kit, amostras artificialmente contaminadas e amostras naturalmente contaminadas. Os valores médios de recuperação obtidos para os padrões do kit apresentaram-se entre 85,6 e 114,8%, com valores de coeficiente de variação entre 11,6 e 23,1%. Nos ensaios com amostras artificialmente contaminadas, foi definida uma faixa ótima de trabalho para análises quantitativas entre 0,019 e 0,090µg/L. A presença de aflatoxina M1 em 110 amostras de leite do estado de Minas Gerais foi investigada. Cinco das 27 amostras positivas na triagem por ELISA foram confirmadas por cromatografia em camada delgada.
leite; aflatoxina M1; validação; ELISA
Procedures for intralaboratory validation of an ELISA kit were adopted to verify its efficiency in aflatoxin M1 detection and quantification in milk. Assays were accomplished with standard solutions provided with the kit, spiked samples and naturally contaminated samples. The mean recovery values obtained for the kit standard solutions were between 85.6 and 114.8%, with coefficient of variation ranging from 11.6 to 23.1%. Working with spiked samples, a concentration range for quantitative analysis (0.019 to 0.090µg/L) was defined. The occurrence of aflatoxin M1 in 110 milk samples from the State of Minas Gerais was investigated. Five of the 27 positive samples in the screening for ELISA were confirmed by thin layer chromatography.
milk; aflatoxin M1; validation; ELISA
Eficiência de um kit de ELISA na detecção e quantificação de aflatoxina M1 em leite e investigação da ocorrência no estado de Minas Gerais1 1 Recebido para publicação em 07/05/99. Aceito para publicação em 26/01/2000.
Scheilla V. C. SOUZA2 2 Setor de Cromatografia Gasosa e Líqüida, Laboratório Regional de Apoio Animal (LARA/MG), Ministério da Agricultura e do Abastecimento (MAAb), Tel. (31) 6613000, Fax (31) 6612383, e-mail lara-mg@defesaagropecuaria.gov.br ,3 3 Departamento de Alimentos, Faculdade de Farmácia (FAFAR), Universidade Federal de Minas Gerais (UFMG), Tel. (31) 3397634, Fax (31) 3397666, e-mail junkeira@dedalus.lcc.ufmg.br , Eugênia A. VARGAS4 4 Laboratório de Micotoxinas, Laboratório Regional de Apoio Vegetal (LAV/MG), Ministério da Agricultura e do Abastecimento (MAAb), Tel. (31) 6613000, Fax (31) 6612383, e-mail gena@cdlnet.com.br , Roberto G. JUNQUEIRA3 3 Departamento de Alimentos, Faculdade de Farmácia (FAFAR), Universidade Federal de Minas Gerais (UFMG), Tel. (31) 3397634, Fax (31) 3397666, e-mail junkeira@dedalus.lcc.ufmg.br ,* * A quem a correspondência deve ser enviada.
RESUMO
Procedimentos para validação intralaboratorial de kits de ELISA foram adotados na verificação da eficiência de um kit para detecção e quantificação de aflatoxina M1 em leite. Foram realizados ensaios com soluções padrões fornecidas pelo kit, amostras artificialmente contaminadas e amostras naturalmente contaminadas. Os valores médios de recuperação obtidos para os padrões do kit apresentaram-se entre 85,6 e 114,8%, com valores de coeficiente de variação entre 11,6 e 23,1%. Nos ensaios com amostras artificialmente contaminadas, foi definida uma faixa ótima de trabalho para análises quantitativas entre 0,019 e 0,090µg/L. A presença de aflatoxina M1 em 110 amostras de leite do estado de Minas Gerais foi investigada. Cinco das 27 amostras positivas na triagem por ELISA foram confirmadas por cromatografia em camada delgada.
Palavras-chave: leite, aflatoxina M1, validação, ELISA.
SUMMARY
Efficiency of an ELISA kit on the detection and quantification of aflatoxin M1 in milk and it's occurrence in the state of Minas Gerais. Procedures for intralaboratory validation of an ELISA kit were adopted to verify its efficiency in aflatoxin M1 detection and quantification in milk. Assays were accomplished with standard solutions provided with the kit, spiked samples and naturally contaminated samples. The mean recovery values obtained for the kit standard solutions were between 85.6 and 114.8%, with coefficient of variation ranging from 11.6 to 23.1%. Working with spiked samples, a concentration range for quantitative analysis (0.019 to 0.090µg/L) was defined. The occurrence of aflatoxin M1 in 110 milk samples from the State of Minas Gerais was investigated. Five of the 27 positive samples in the screening for ELISA were confirmed by thin layer chromatography.
Keywords: milk, aflatoxin M1, validation, ELISA.
1 INTRODUÇÃO
A aflatoxina M1 é o principal metabólito hidroxilado da aflatoxina B1 presente em leite de animais que ingeriram ração contaminada por B1 [11]. Estas toxinas apresentam potencial carcinogênico e genotóxico e toxicidades semelhantes [24].
A possibilidade de contaminação do leite e de produtos lácteos com aflatoxina M1 é uma questão de saúde pública, principalmente por serem produtos amplamente consumidos pelo homem e constituírem a base da alimentação infantil [3].
Pesquisas sobre os níveis de contaminação do leite existente no mercado com aflatoxina M1 têm sido realizadas nos países mais desenvolvidos, objetivando a verificação da extensão da contaminação e uma maior conscientização. Frente aos resultados obtidos, cada país tem tentado definir limites máximos de tolerância [3], sendo considerados ainda fatores políticos e econômicos [31]. A União Européia adotou o limite de tolerância máximo de 0,05µg/L [4]. O regulamento técnico do MERCOSUL sobre limites máximos de aflatoxinas estabeleceu os níveis de 0,5µg/L e 5,0µg/kg para leite fluido e em pó, respectivamente [19], sendo estes os limites internalizados pelo Brasil [9].
Pesquisas sobre a incidência de aflatoxina M1 em leite e produtos lácteos já foram realizadas no Brasil. PRADO et al. [23] verificaram contaminação em duas das 38 amostras de leite cru do Estado de Minas Gerais, não detectando aflatoxina M1 em 60 amostras de leite em pó analisadas. MALLMANN et al. [17] obtiveram resultados positivos para 11 das 240 amostras de leite cru analisadas no Estado do Rio Grande do Sul. SABINO et al. [25] detectaram contaminação em uma das 100 amostras de leite pasteurizado e em nove das 50 amostras de leite cru analisadas no Estado de São Paulo. Entretanto, existe ainda uma lacuna de informações sobre a aflatoxina M1, tanto em relação à metodologia quanto à sua ocorrência [28].
Como o leite existente no comércio é uma mistura de leites de diferentes procedências, os níveis de aflatoxina M1 são, muitas vezes, inferiores aos limites de detecção dos métodos de análise utilizados [25, 31]. De acordo com VISCONTI et al. [33], a maioria dos resultados negativos obtidos em estudos sobre incidência de aflatoxina M1 pode ser atribuída à baixa sensibilidade dos métodos analíticos empregados. Portanto, um controle eficiente da aflatoxina M1 em leite requer métodos analíticos de elevada sensibilidade, especificidade, precisão e exatidão, além de rapidez e facilidade [7]. Segundo SYLOS & RODRIGUEZ AMAYA [28], estudos relativos à metodologias para determinação de micotoxinas em alimentos são necessários e urgentes, visando a confiabilidade dos resultados relativos à ocorrência.
Os métodos para determinação de aflatoxina M1 em leite utilizam, em sua maioria, extração com clorofórmio e purificação cromatográfica. Tanto a cromatografia em camada delgada (CCD) como a cromatografia líqüida de alta eficiência (CLAE) constituem as técnicas oficiais e convencionais para separação, detecção e quantificação de aflatoxina M1 em extratos de leite [32].
A década de 80 trouxe avanços em conhecimentos relativos a biotecnologia e aos métodos de automação para detecção de contaminantes em alimentos, destacando-se, no caso das micotoxinas, as técnicas imunoenzimáticas [22]. Estas técnicas, que constituem imunoensaios os quais envolvem interações entre micotoxinas e anticorpos específicos contra homólogos de micotoxinas, têm sido utilizadas principalmente em triagens para determinação destes contaminantes. Os dois tipos de imunoensaios mais utilizados em análises de micotoxinas são ELISA (enzyme-linked immunosorbent assay) e radioimunoensaios [12, 15].
Na determinação de aflatoxinas por ELISA pode-se contar com elevada sensibilidade [5] e, muitas vezes, não são necessárias as etapas de extração e purificação [2, 6], o que confere rapidez e simplicidade à técnica [22]. Existem, entretanto, desvantagens como o prazo de validade limitado e a possibilidade de resultados falso positivos devido às reações cruzadas [29], que podem ser minimizadas pela utilização de anticorpos monoclonais de boa preparação [22]. Para monitoramentos de rotina têm-se dado preferência a estas técnicas simplificadas em substituição às convencionais, que são mais complexas e demoradas [30].
De qualquer forma, independente da técnica analítica empregada no método, procedimentos de validação devem ser adotados, permitindo avaliar a eficiência de cada metodologia, conhecendo seu potencial aplicativo e limitações.
O objetivo do presente trabalho foi avaliar a eficiência de um kit comercial de ELISA na determinação e quantificação de aflatoxina M1 em leite e investigar a ocorrência de contaminação por esta micotoxina em amostras de leite produzido no Estado de Minas Gerais.
2 MATERIAL E MÉTODOS
2.1 Kit de ELISA
O kit avaliado foi da marca Ridascreen®, produzido pela empresa R-Biopharm, o qual foi mantido embalado, protegido da luz e sob refrigeração até a execução dos ensaios, observando o prazo de validade.
2.2 Padrões
Os padrões de aflatoxina M1 utilizados foram da marca Sigma (St. Louis, MO), mantidos sob temperatura de congelamento, devidamente protegidos da luz e vedados, até o momento do preparo das soluções. As soluções padrões foram preparadas e padronizadas conforme descrito pela AOAC [1].
2.3 Amostras artificialmente contaminadas
Foram colhidas amostras de leite cru, aleatoriamente, após ordenhas manuais diárias, na fazenda experimental do Ministério da Agricultura e do Abastecimento/Escola de Veterinária da UFMG. Estas amostras foram artificialmente contaminadas com quantidades conhecidas de soluções padrões de aflatoxina M1.
2.4 Amostras do Estado de Minas Gerais
No período de 1996 a 1997, foram colhidas 110 amostras de leite do estado de Minas Gerais, sendo recebidas 48 em 1996 e 62 em 1997, incluindo leite tipos A (3), B (12), C (82), vitaminado (6), esterilizado (UHT) integral (5) e desnatado (2). A colheita foi realizada sob supervisão do Serviço de Inspeção Federal (SIF) do Ministério da Agricultura e do Abastecimento.
Para amostragem representativa do leite produzido no Estado de Minas Gerais utilizou-se a divisão territorial (oito mesorregiões) e produção leiteira publicados pela Fundação Instituto Brasileiro de Geografia e Estatística IBGE [13, 14].
2.5 Experimental
Foram utilizados kits de um mesmo lote, sendo um para os ensaios iniciais de validação, empregando os padrões do kit e amostras artificialmente contaminadas, e três para análises das amostras do Estado de Minas Gerais.
Alíquotas de 10 mL das amostras de leite, devidamente homogeneizadas, foram pipetadas para centrifugação a 3,5 x g, por 10 minutos a 10oC, objetivando remoção da camada de gordura. Os demais procedimentos analíticos foram realizados de acordo com indicações do fabricante, contidas no manual que acompanha o kit. As medidas de absorbância foram realizadas, contra branco de ar, empregando leitora Sigma Diagnostics EIA Multi-well Reader, com filtro de 450nm.
2.5.1 - Ensaios de recuperação
Foi feita uma curva de calibração aplicando-se cada um dos seis padrões enviados (0,0; 0,005; 0,010; 0,020; 0,040 e 0,080µg/L) em oito diferentes microcavidades. Os valores de absorbância obtidos para os padrões foram multiplicados por 100 e divididos pela média dos valores determinados para o padrão 0,0µg/L, calculando-se a porcentagem de absorção. A curva de calibração foi determinada por análise de regressão, relacionando o logaritmo natural da concentração (eixo das abcissas) com a porcentagem de absorção (eixo das ordenadas).
Ensaios de recuperação foram realizados utilizando amostras artificialmente contaminadas, em níveis dentro e acima do intervalo da curva fornecida pelo fabricante do kit (0,0097; 0,019; 0,050; 0,058; 0,070; 0,078; 0,090; 0,200 e 0,970µg/L). Cada amostra artificialmente contaminada foi aplicada em cinco diferentes microcavidades. Em paralelo foram analisados brancos da amostra de leite utilizada, em duplicata, para verificação da ausência de contaminação prévia.
Com base nos valores de concentração obtidos pela equação da curva, foram calculados os valores de recuperação e coeficiente de variação para os padrões do kit e amostras artificialmente contaminadas.
2.5.2 - Análise das amostras do Estado de Minas Gerais
As amostras de leite do Estado de Minas Gerais, o ensaio controle (constituído de um branco e uma amostra artificialmente contaminada) e os seis padrões do kit foram aplicados em duplicata.
As amostras que apresentaram resultados positivos na triagem tiveram seus resultados confirmados por uma metodologia de CCD, baseada nas metodologias descritas pela AOAC [1] e KAMIMURA [16], envolvendo extração com clorofórmio, purificação em cartuchos de florisil e quantificação densitométrica [26]. As amostras positivas por CCD foram analisadas por cromatografia bidimensional [1], para nova confirmação. Nestas análises confirmatórias também foi realizado um ensaio controle constituído de branco e amostra artificialmente contaminada.
2.5.3 - Valores de referência
Os valores adotados como referência para avaliação da exatidão e precisão foram os estabelecidos CODEX [28] e internalizados pelo MERCOSUL [18], descritos na Tabela 1.
3 RESULTADOS E DISCUSSÃO
A curva de calibração para aflatoxina M1, representada na Figura 1, indica linearidade da resposta com coeficiente de correlação de 0,9494. Os valores médios de recuperação para cada padrão e os coeficientes de variação entre os resultados obtidos para um mesmo padrão aplicado em diferentes microcavidades estão descritos na Tabela 2. Os valores de recuperação médios apresentaram-se entre 85,6 e 114,8% e os de CV entre 11,6 e 23,1%, todos dentro dos intervalos estabelecidos como aceitáveis (Tabela 1). Na técnica de ELISA a precisão, determinada pelos coeficientes de variação, é dependente de fatores como erros indeterminados no procedimento analítico, preparo de reagentes, volumes aplicados, homogeneização e diferenças entre as microcavidades ou conjuntos, devidas à cobertura irregular com anticorpos [34].
O estudo com amostras artificialmente contaminadas permitiu verificar a sensibilidade e eficiência qualitativa do kit, já que todas as amostras artificialmente contaminadas apresentaram resultados positivos, mesmo aquelas com níveis correspondentes a 0,0097µg/L. Foram confirmadas as informações do fabricante de que o limite de detecção do método é menor que 0,010µg/L. De acordo com PARK et al. [21] o mínimo de quantificação para o ensaio de ELISA pode ser estimado assumindo uma variação de 0,1 unidades de absorbância abaixo do valor médio obtido para o padrão zero. Portanto, aplicando o valor de A450 = 0,853 à curva de calibração, obteve-se o limite de quantificação teórico de 0,0063µg/L.
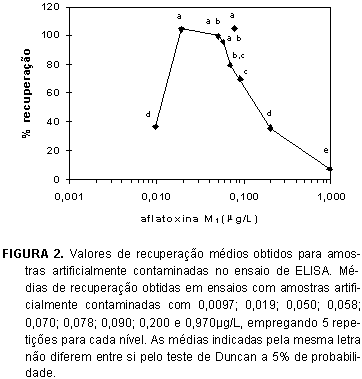
Nos ensaios com amostras artificialmente contaminadas nos níveis 0,0097; 0,019; 0,050; 0,058; 0,070; 0,078; 0,090; 0,200 e 0,970µg/L foi determinada a faixa de linearidade da resposta, considerando-se interferências da matriz, entre 0,019 e 0,090µg/L. Para os níveis de contaminação 0,0097; 0,200 e 0,970µg/L, os valores de recuperação obtidos foram 37,0; 35,9 e 7,5% respectivamente, fora dos valores considerados aceitáveis (Tabela 1) e significativamente menores (p < 0,05; teste de Duncan [32]) que os obtidos para os outros níveis estudados. Para 0,019; 0,050; 0,058; 0,070; 0,078 e 0,090µg/L os valores de recuperação apresentaram-se dentro dos intervalos estabelecidos como aceitáveis (Tabela 1), variando de 70,0 a 104,9% (Figura 2). Quando analisadas amostras contaminadas entre 0,200 e 0,970µg/L valores de recuperação muito baixos foram obtidos. Deve-se ressaltar que o limite máximo de tolerância estabelecido pelo MERCOSUL [6] encontra-se nesta faixa, o que demonstra a necessidade de confirmação, repetindo-se o teste de ELISA com amostras diluídas ou empregando-se outra técnica analítica, sempre que resultados positivos forem obtidos.
Das 110 amostras do Estado de Minas Gerais analisadas, 27 apresentaram resultados positivos por ELISA, correspondendo a 24,5% do total das amostras analisadas. Foram considerados positivos somente os resultados superiores ao limite de quantificação teórico, que foi de 0,0063µg/L. Somente 5 das 27 amostras que apresentaram resultados positivos na triagem foram confirmadas pelo método cromatográfico [26] e pela análise bidimensional (Tabela 3). A proporção de amostras destinadas à confirmação da partida analisada, 24,5%, indica especificidade para a aplicação do referido kit, entretanto, somente 18,5% das amostras positivas por ELISA tiveram seus resultados confirmados por CCD. A não detecção da contaminação nas outras amostras pode ser atribuída à diferença entre os limites de quantificação das duas técnicas e à reações cruzadas com outras aflatoxinas ou moléculas semelhantes. Esta possibilidade de resultados presuntivos positivos reafirmam a necessidade de confirmação dos resultados após execução do ensaio de ELISA.
Das cinco amostras positivas duas eram da mesorregião Noroeste, duas do Sul/Sudoeste/Campo das Vertentes e uma da Metropolitana de Belo Horizonte. Em relação ao tipo de leite, foram positivas duas do tipo C, duas de leite vitaminado e uma do tipo B. Estas cinco amostras apresentaram níveis de contaminação abaixo de 0,5µg/L, limite estabelecido pelo MERCOSUL [19], embora em quatro delas tenha sido verificada uma contaminação superior à permitida pela União Européia, 0,05µg/L [4]. Nos procedimentos de confirmação por CCD, os resultados de recuperação obtidos para o controle foram de 90,0 e 86,9% para as quantificações visual e densitométrica respectivamente, entretanto, os valores apresentados não foram corrigidos.
Não foram observadas diferenças significativas (p > 0,05; teste de t pareado) entre os resultados de recuperação obtidos para as técnicas de CCD quantificação densitométrica e ELISA (Tabela 3). SABINO et al. [27] observaram concordância entre as técnicas CCD e ELISA quanto à detecção de aflatoxina B1. OLIVEIRA et al. [20] observaram correlação entre os resultados obtidos por CCD e ELISA na quantificação de aflatoxina B1 em milho.
4 CONCLUSÕES
O kit de ELISA para análise de aflatoxina M1 em leite empregado demonstrou eficiência qualitativa, sensibilidade elevada e especificidade considerável, características satisfatórias e esperadas para este tipo técnica. A linearidade da resposta do kit foi observada pela avaliação dos valores de coeficientes de correlação obtidos para as curvas de calibração. Com base nos parâmetros de exatidão (recuperação) e precisão (coeficiente de variação) foi verificada eficiência quantitativa do kit na faixa de 0,019 a 0,090µg/L. Nos níveis de contaminação pesquisados entre 0,200 e 0,970µg/L esta eficiência não observada. Portanto, para avaliações quantitativas em amostras de contaminação desconhecida há necessidade de um procedimento confirmatório, sempre que resultados positivos forem obtidos. Das cento e dez amostras de leite analisadas no estado de Minas Gerais cinco apresentaram contaminação por aflatoxina M1. Todas obtiveram níveis de contaminação inferiores ao determinado pelo MERCOSUL e quatro continham níveis de toxina superiores ao estabelecido pela União Européia.
5 REFERÊNCIAS BIBLIOGRÁFICAS
- [1] AOAC - ASSOCIATION OF OFFICIAL ANALYTICAL CHEMISTS. Official methods of analysis of AOAC International. 16.ed. 4th ver. 1998. (Software Adobe and E-DOC/CJS).
- [2] APPLEBAUM, R. S., BRACKETT, R. E., WISEMAN, D. W., MARTH, E. H. Aflatoxin: toxicity to dairy cattle and occurrence in milk and milk products - a review. J. Food Protect., v. 45, p. 752-777, 1982.
- [3] BENTO, H., FERNANDES, A. M., BARBOSA, M. Pesquisa de aflatoxina M1 em leite corrente pasteurizado e em leite em pó. Rev. Port. Ci. Vet., v. 84, p. 163-171, 1989.
- [4] CE Comunidades Européias. Regulamento CE no 1525/98 Jornal Oficial das Comunidades Européias. [s.n. l], 1998. (Diretiva das Comunidades Européias).
- [5] CHU, F. S. Development and use of immunoassays. In: BHATNAGAR, D., LILLEHOJ, E. B., ARORA, D. K. Handbook of applied mycology, New York: Marcel and Dekker, p. 93-97, 1992. v. 5.
- [6] CHU, F. S., FANS, T. S. L., ZHANG, G. S., XU, Y. C., FAUST, S., McMOHAN, P. L. Improved enzyme-linked immunoassay for aflatoxin B1 in agricultural commodities. J. Assoc. Off. Anal. Chem., v. 70, p. 854-857, 1987.
- [7] DOMINGUEZ, L., BLANCO, J. L., GOMEZ-LUCIA, E., RODRIGUEZ, E. F., SUAREZ, G. Determination of aflatoxin M1 in milk and milk products contaminated at low levels. J. Assoc. Off. Anal. Chem., v. 70, p. 470-472, 1987.
- [8] CODEX ALIMENTARIUS. Volume 3. Residuos de medicamentos veterinarios en los alimentos 2 ed. Roma. 1993.
- [9] DOU - DIÁRIO OFICIAL DA UNIÃO. Brasília, 25 mar. 1996. Suplemento no 58. Seção 1, p. 43.
- [10] DUNCAN, D. B. Multiple range and multiple F tests. Biometrics, v. 11, p. 1-42, 1955.
- [11] HSIEH, D. P. H., WONG, Z. A., WONG, J. J., MICHAS, C., RUEBNER, B. H. Comparative metabolism of aflatoxin. In: RODRICKS, J. V., HESSELTINE, C. W., MEHLMAN, M. A. (Ed.) Mycotoxins in human and animal health Park Forest South: Pathotox Publishers, 1977. p. 37-50.
- [12] HU, W. J., WOYCHIK, N. , CHU, F. S. ELISA of picogram quantities of aflatoxin M1 in urine and milk. J. Food Protect., v. 47, p. 126-127, 1984.
- [13] IBGE FUNDAÇĂO INSTITUTO BRASILEIRO DE GEOGRAFIA E ESTATÍSTICA. Sinópse preliminar do censo demográfico de 1991 Rio de Janeiro: IBGE, 1991. Pt. 2. n. 16, Minas Gerais, p. 1-255.
- [14] IBGE FUNDAÇĂO INSTITUTO BRASILEIRO DE GEOGRAFIA E ESTATÍSTICA. Censos econômicos de 1985 Rio de Janeiro: IBGE, 1991. Pt. 2. Minas Gerais, p. 1478-1516.
- [15] JACKMAN, R. Determination of aflatoxins by enzyme-linked immunosorbent assay with special reference to aflatoxin M1 in raw milk. J. Sci. Food Agric., v. 36, p. 685-698, 1985.
- [16] KAMIMURA, H. Simple rapid cleanup method for analysis of aflatoxins and comparison with various methods. J. Assos. Off. Anal. Chem., v. 68, p. 458-461, 1985.
- [17] MALLMANN, C. A., SANTURIO, J. M., SCHNEIDER, L. G., ALMEIDA, C. A. A., FONTANA, F. Z., POZZOBON, M. C. Prevalęncia e sazonalidade da aflatoxina M1 no leite produzido e comercializado no município de Santa Maria, RS - Brasil. In: CONGRESSO LATINOAMERICANO DE MICOTOXICOLOGIA, 2, 1997, Maracay. Programa y resumenes Maracay: Universidad Central de Venezuela/Sociedade Latinoamericana de Micotoxicologia, 1997. p. 91. (Resumo).
- [18] MERCOSUL - Mercado Comum do Cone Sul. Regulamento técnico sobre limites máximos de aflatoxinas Resoluçăo no 56/94. [s.n. l.], 1994. (Publicaçăo avulsa MERCOSUL).
- [19] MERCOSUL Mercado Comum do Cone Sul. Critérios para a validação de metodologias analíticas para determinação de resíduos de princípios ativos de medicamentos veterinários (RMV) em produtos de origem animal Resolução 57/94, [s.n. l.], 1994.
- [20] OLIVEIRA, M. S., PRADO, G., JUNQUEIRA, R. G. Comparaçăo das técnicas de cromatografia em camada delgada e ELISA na quantificaçăo de aflatoxinas em amostras de milho. In: SEGUNDO SIMPOSIO INTERNACIONAL DE LA SECCIÓN DE AMERICA LATINA Y EL CARIBE DE LA AOAC INTERNATIONAL, 2, 1997, Buenos Aires. Resumos... Buenos Aires: AOAC International, 1997a. p. 72. (Resumo).
- [21] PARK, D. L., MILLER, B. M., TRUCKSESS, M. W., NESHEIM, S., VEKICH, A., BIDIGARE, B., McVEY, J. L., BROWN, L. H. Visual and semiquantitative spectrophotometric ELISA screening method for aflatoxin B1 in corn and peanut products: follow-up collaborative study. J. Assoc. Off. Anal. Chem., v. 72, p. 638-643, 1989.
- [22] PEREIRA, M. L., TOLEDO, M. C. F. Micotoxinas: impacto na saúde humana e animal e sua detecçăo pelo método de ELISA. Cad. Téc. Esc. Vet. UFMG, n. 13, p. 5-27, 1995.
- [23] PRADO, G., NICÁCIO, M. A. S., LARA, M. A. Incidęncia de aflatoxina M1 em leite cru e em pó no estado de Minas Gerais. Higiene Alimentar, v. 8, p. 34-36, 1994.
- [24] PONS, R. S., WOGAN, G. N. Toxicity and biochemical and fine structural effects of synthetic aflatoxins M1 and B1 in rat liver. J. Natl. Cancer Inst., v. 47, p. 585-592, 1971.
- [25] SABINO, M., MILANEZ, T. V., LAMARDO, C. A., NAVAS, S.A., GALVĂO, M. S., GARCIA, C. B. Avaliaçăo da eficięncia de um kit comercial para detecçăo de aflatoxina B1 em amostras de milho, raçăo, amendoim e seus produtos. In: CONGRESSO LATINOAMERICANO DE MICOTOXICOLOGIA, 2, 1997, Maracay. Programa y resumenes Maracay: Universidad Central de Venezuela/Sociedade Latinoamericana de Micotoxicologia, 1997. p. 108-109. (Resumo).
- [26] SOUZA, S.V. C. Aflatoxina M1 em leite: Meodologia e ocorręncia no estado de Minas Gerais Belo Horizonte: Universidade Federal de Minas Gerais. 1997. 55p. (Tese, Mestrado).
- [27] SABINO, M., PURCHIO, A., ZORZETTO, M. A. P. Variations in the levels of aflatoxin in cows milk consumed in the city of Săo Paulo, Brazil. Food Addit. Contam., v. 6, p. 321-326, 1989.
- [28] SYLOS, C. M., RODRIGUEZ AMAYA, D. B. Estudo comparativo de métodos para determinaçăo de aflatoxina M1 Rev. Inst. Adolfo Lutz, v. 56, p. 87-97, 1996.
- [29] TIJSSEN, P. Antibody production. In: BURDON, R. H., KNIPPENBERG VAN, R. I. Laboratory technique in biochemistry and molecular biology, v. 15, p. 60-78, 1985.
- [30] TOYODA, M., SAISHO, K., AOKI, G., KOBAYASHI, A., SAITO, Y. Repeated use of a single immunoaffinity column for sample clean-up in the HPLC determination of aflatoxin M1 in powdered milk. Int. Dairy. J., v. 4, p. 369-375, 1994.
- [31] VAN EGMOND, H. P. Aflatoxins in milk. In: EATON, D.L.; GROOPMAN, J. D. (Ed.) The toxicology of aflatoxins: human health, veterinary, and agricultural significance. San Diego: Academic Press, 1994. cap. 17. p. 365-381.
- [32] VAN EGMOND, H. P., DEKKER, W. H. Worldwide regulations for mycotoxins in 1994. Natural Toxins, v. 3, p. 332-336, 1995.
- [33] VISCONTI, A.; BOTTALICO, A.; SOLFRIZZO, M. Aflatoxin M1 in milk in southern Italy. Mycotoxin Res., v. 1, p. 71-75, 1985.
- [34] WARD, C. M., MORGAN, M. R. A. Reproducibility of a commercially available kit utilizing enzyme-linked immunosorbent assay for determination of aflatoxin in peanut butter. Food Addit. Contam., v. 8, p. 9-15, 1991.
Datas de Publicação
-
Publicação nesta coleção
21 Ago 2000 -
Data do Fascículo
Dez 1999
Histórico
-
Aceito
26 Jan 2000 -
Recebido
07 Maio 1999