Resumos
O assentamento de células de leveduras no fundo das dornas e perdas de células nas centrífugas podem ser causadas por bactérias floculantes, contaminantes naturais da fermentação alcoólica industrial. Estes problemas levam a queda no rendimento e produtividade do etanol. O presente trabalho visa a caracterização da floculação de Saccharomyces cerevisiae por Lactobacillus fermentum CCT 1396. As células de leveduras e bactérias foram misturadas e a floculação das células quantificadas por espectrofotometria. Concentrações de bactérias numa faixa de 0,4 a 3,8g/L (biomassa seca) foram testadas a fim de determinar a ótima concentração de bactérias necessária para provocar a floculação das leveduras. O efeito de pH na floculação das células de leveduras e bactérias foi determinado. 1,38g/L de bactéria foi necessário para a floculação, de 65,4g/L de células de levedura com tempo de contato entre as células (sob agitação) de 15 minutos e repouso de 20 minutos. No pH 3,0 pouco efeito na floculação celular foi detectado e as células continuaram floculadas, mas na faixa de pH 2,0 -- 2,5 a floculação foi próxima de zero. Esta técnica pode ser utilizada para o controle da floculação de leveduras de indústrias de produção de álcool, para determinar a origem desta floculação, já que trata-se de uma técnica fácil, econômica e rápida.
Saccharomyces cerevisiae; floculação; Lactobacillus fermentum; quantificação; fermentação alcoólica
The settling of flocculated yeast cells at the bottom of the industrial reactors and the loss of cells in centrifuges can be caused by flocculating bacteria, natural contaminants of industrial alcoholic fermentation. This causes problems leading to loss in ethanol yield and productivity. The present work aims the characterization of Saccharomyces cerevisiae flocculation by Lactobacillus fermentum CCT 1396. The yeast and bacteria cells were mixing and cells flocculation quantified by spectrophotometry. Concentrations of the bacteria in a range from 0.4 to 3.8g/L (dry biomass) were tested in order to determine the optimum bacteria concentration necessary to cause yeast flocculation. The pH effect on the yeast and bacteria cells flocculation was determined. 1.38g/L bacteria was necessary to flocculate, 65.4g/L yeast cells with the contact time betweem the cells (under agitation) for 15 minutes and rest time for 20 minutes. In the pH 3.0 not much effect in the cell flocculation was detected and the cells continued to flocculate, but in the range pH 2.0 -- 2.5 the flocculation was about zero. This technique could be used in yeast flocculation control of alcohol industries, to determine the origen of this flocculation since it is easy and economic with short time demand.
Saccharomyces cerevisiae; flocculation; Lactobacillus fermentum; quantification; alcoholic fermentation
QUANTIFICAÇÃO DA FLOCULAÇÃO DE SACCHAROMYCES CEREVISIAE POR BACTÉRIAS CONTAMINANTES DA FERMENTAÇÃO ALCOÓLICA1 1 Recebido para publicação em 18/07/00. Aceito para publicação em 10/04/01.
K.M. LUDWIG2 1 Recebido para publicação em 18/07/00. Aceito para publicação em 10/04/01. , P. OLIVA-NETO3 1 Recebido para publicação em 18/07/00. Aceito para publicação em 10/04/01. ,* 1 Recebido para publicação em 18/07/00. Aceito para publicação em 10/04/01. , D.F. DE ANGELIS2 1 Recebido para publicação em 18/07/00. Aceito para publicação em 10/04/01.
RESUMO
O assentamento de células de leveduras no fundo das dornas e perdas de células nas centrífugas podem ser causadas por bactérias floculantes, contaminantes naturais da fermentação alcoólica industrial. Estes problemas levam a queda no rendimento e produtividade do etanol. O presente trabalho visa a caracterização da floculação de Saccharomyces cerevisiae por Lactobacillus fermentum CCT 1396. As células de leveduras e bactérias foram misturadas e a floculação das células quantificadas por espectrofotometria. Concentrações de bactérias numa faixa de 0,4 a 3,8g/L (biomassa seca) foram testadas a fim de determinar a ótima concentração de bactérias necessária para provocar a floculação das leveduras. O efeito de pH na floculação das células de leveduras e bactérias foi determinado. 1,38g/L de bactéria foi necessário para a floculação, de 65,4g/L de células de levedura com tempo de contato entre as células (sob agitação) de 15 minutos e repouso de 20 minutos. No pH 3,0 pouco efeito na floculação celular foi detectado e as células continuaram floculadas, mas na faixa de pH 2,0 ¾ 2,5 a floculação foi próxima de zero. Esta técnica pode ser utilizada para o controle da floculação de leveduras de indústrias de produção de álcool, para determinar a origem desta floculação, já que trata-se de uma técnica fácil, econômica e rápida.
Palavras-chave: Saccharomyces cerevisiae; floculação; Lactobacillus fermentum; quantificação; fermentação alcoólica.
SUMMARY
QUANTIFICATION OF SACCHAROMYCES CEREVISIAE FLOCCULATION BY CONTAMINANT BACTERIA FROM ALCOHOLIC FERMENTATION. The settling of flocculated yeast cells at the bottom of the industrial reactors and the loss of cells in centrifuges can be caused by flocculating bacteria, natural contaminants of industrial alcoholic fermentation. This causes problems leading to loss in ethanol yield and productivity. The present work aims the characterization of Saccharomyces cerevisiae flocculation by Lactobacillus fermentum CCT 1396. The yeast and bacteria cells were mixing and cells flocculation quantified by spectrophotometry. Concentrations of the bacteria in a range from 0.4 to 3.8g/L (dry biomass) were tested in order to determine the optimum bacteria concentration necessary to cause yeast flocculation. The pH effect on the yeast and bacteria cells flocculation was determined. 1.38g/L bacteria was necessary to flocculate, 65.4g/L yeast cells with the contact time betweem the cells (under agitation) for 15 minutes and rest time for 20 minutes. In the pH 3.0 not much effect in the cell flocculation was detected and the cells continued to flocculate, but in the range pH 2.0 ¾ 2.5 the flocculation was about zero. This technique could be used in yeast flocculation control of alcohol industries, to determine the origen of this flocculation since it is easy and economic with short time demand.
Keywords:Saccharomyces cerevisiae; flocculation; Lactobacillus fermentum; quantification; alcoholic fermentation.
1 ¾ INTRODUÇÃO
O processo de produção do etanol atualmente praticado no Brasil envolve o reciclo das leveduras, e com isso ocorre o reciclo de contaminantes causando diversos distúrbios tais como: consumo de açúcar e etanol pelos contaminantes, queda da viabilidade e morte das células de levedura devido a toxinas lançadas no meio pelo contaminante [1], fermentações secundárias oriundas da atividade desses microrganismos contaminantes [2], além do problema de floculação das células de levedura provocada tanto por bactérias como por leveduras.
A floculação do fermento usado nas indústrias produtoras de etanol leva ao assentamento das leveduras nos fundo das dornas, e dificulta a conversão do açúcar em etanol porque para uma máxima conversão de açúcar em etanol e CO2, é essencial que as leveduras permaneçam suspensas no líquido de fermentação e não floculadas [13]. Este fenômeno pode causar perda de células na centrífuga e o conseqüente gasto de substrato para a reposição celular, determinando assim, queda no rendimento alcoólico. A floculação dificulta o contato entre o antibacteriano usado no processo e a bactéria causando o aumento desses contaminantes, que provocam um aumento de acidez, afetando a qualidade do etanol produzido, seja como combustível ou para a indústria de bebidas alcoólicas.
A floculação ocorre devido a vários fatores dos quais destacam-se o contato com gomas sintetizadas pelas bactérias [15], ou pelo contato entre bactérias indutoras da floculação e leveduras [21], ou ainda devido à contaminação por leveduras floculantes [16, 17]. No setor de fermentação e destilação as bactérias lácticas são as principais promotoras de fermentações indesejáveis, especialmente, o gênero Lactobacillus que é resistente ao etanol [20, 21].
Fatores protéicos associados a sais minerais e às mananas parecem estar envolvidos em qualquer tipo de floculação de leveduras e a ação de proteases é eficaz na desfloculação do fermento [7, 18, 21].
Para que a floculação se desenvolva é necessária a presença de íons cálcio [10] e também a movimentação entre as células, para que se acelere o processo de floculação, provavelmente devido ao aumento da colisão entre as células, facilitando a adesão [8, 19]. Os resíduos de aminoácidos da superfície de Lactobacillus fermentum e resíduos de carboidratos das leveduras são os responsáveis pelo desenvolvimento do fenômeno da floculação [3,14].
A acidez do "vinho" (mosto fermentado e centrifugado), causada por bactérias produtoras de ácidos orgânicos, é comprovadamente aumentada com o aumento da floculação, causando uma significativa queda no rendimento alcoólico e viabilidade de leveduras [1, 5,12]. Para o controle da infecção bacteriana, e de suas conseqüências no processo de obtenção de etanol visando uma fermentação sadia, rápida e eficiente, é fundamental a busca de soluções práticas e viáveis para atenuar ou eliminar a floculação do fermento nas destilarias, reduzindo assim o custo do etanol.
Apesar dos transtornos causados pela floculação das leveduras devido a bactérias indutoras da floculação na indústria, ainda não há métodos de controle industrial para caracterização e monitoramento destes agentes.
Devido a estes fatores o presente trabalho visou conhecer as características da floculação do fermento na presença do agente bacteriano floculador e contribuir para o estabelecimento de metodologia analítica para o monitoramento de tais bactérias.
2 ¾ MATERIAIS E MÉTODOS
2.1 ¾ Microrganismos utilizados
Foi utilizada neste estudo a linhagem de Lactobacillus fermentum CCT 1396 que foi obtida junto à Coleção de Culturas da Fundação Tropical de Pesquisa e Tecnologia "André Tosello" - Campinas.
A linhagem não floculante de Saccharomyces cerevisiae, com crescimento homogêneo, utilizada nos ensaios de floculação foi isolada do fermento de panificação, marca comercial Fleishmann Royal Ltda, em meio de cultura Potato Dextrose Ágar (PDA) da DIFCO com 0,01% de tetraciclina e 0,01% de cloranfenicol, sendo cultivadas em estufa (mod. 002CB - Fanem) a 30oC por 48 horas.
As culturas de leveduras Saccharomyces cerevisiae e Lactobacillus fermentum foram mantidas congeladas em freezer -81oC (Hetofrig - High Technology of Scandinavia) em caldo nutriente com 10% de glicerol.
Por ocasião dos testes, as bactérias foram cultivadas em meio líquido MRS [9] em estufa a 30°C por 48 horas. Após terem crescido em meio líquido MRS (DIFCO), estas bactérias foram lavadas três vezes com EDTA (Ácido etileno diamino tetracético) 0,025M através de centrifugação a 1660G por 15 minutos (centrífuga mod. 215 - Fanem) e ressuspendidas em tampão citrato pH 3,8. A levedura não floculante foi crescida em meio de melaço 2,5%, sulfato de amônia 0,625%, fosfato de amônia monobásico 0,175% e amônia 0,5% com pH 4,5 em estufa a 30oC por 24-48 horas [6] e preparadas após lavagem com EDTA até uma concentração de 200g/L-biomassa úmida em suspensão, ou seja, 200g de massa celular dissolvida em 1000 mL de tampão citrato pH 3,8, correspondente a 65,4g/L-biomassa seca.
2.2 ¾ Floculação de Saccharomyces cerevisiae por Lactobacillus fermentum
As concentrações de Lactobacillus fermentum foram determinadas por espectrofotometria (l= 600 nm) numa faixa de DO x FD (densidade óptica multiplicada pelo fator de diluição) entre 0,5 e 11,4 relacionando este valor com a massa seca obtida através de curva de calibração, usando suspensão de culturas puras lavadas três vezes e secas até peso constante [11].
Foram misturados: 20 mL de suspensão de bactérias (0,434; 0,851; 1,38; 2,65 e 3,76g/L - biomassa seca), 20mL de suspensão de leveduras (65,4g/L - biomassa seca) e 10mL de cloreto de cálcio 0,05M em erlenmeyer de 250mL. Esta mistura foi agitada durante 15 minutos em agitador orbital (Tecnal) a 30°C e 90rpm. A solução agitada foi transferida para um frasco cônico onde permaneceu em repouso por 20 minutos. A seguir, uma amostra do sobrenadante foi cuidadosamente retirada e lida sua turbidez em espectrofotômetro (Pharmacia - LKB - Ultrospec III) a um comprimento de onda de 600 nm. A separação de fases obtida foi caracterizada visualmente e também fotografada.
2.3 ¾ Efeito do pH do meio na floculação
Para se verificar a influência do pH do meio no processo de floculação, corrigiu-se o pH da suspensão de células (levedura + bactéria) com ácido clorídrico 2N e hidróxido de sódio 2N para as faixas de pH 2,0 a 4,5. Após 35 minutos de reação (15 minutos de agitação e 20 minutos de repouso), era retirada uma amostra dos sobrenadantes e lida a turbidez em espectrofotômetro a 600nm.
Alguns testes foram realizados para observar o fenômeno de reversibilidade da floculação das leveduras quando ocorreu uma elevação de pH acima de 3,0. As suspensões de células (levedura + bactéria) foram ajustadas para pH 2,5 a 3,0; após 175 minutos a solução de pH 2,5 foi alterada para o pH 4,0; por adição de NaOH 2N.
2.4 ¾ Tratamento Estatístico
O tratamento estatístico foi efetuado usando o programa SAS ou Rutgers University e foram determinadas: comparação entre médias nos diversos tratamentos por ANOVA e teste de Tukey-Kramer. A porcentagem de desfloculação das leveduras foi determinada por interpolação entre os extremos de máxima (100%) desfloculação e floculação intensa, que correspondiam respectivamente, em DO x FD, de 25 e 2, obtidas experimentalmente através da média de cinco repetições.
3 ¾ RESULTADOS E DISCUSSÃO
3.1 ¾ Floculação das leveduras
Os resultados dos testes de floculação do fermento (S. cerevisiae) por L. fermentum indicaram que houve um aumento crescente do grau de floculação (Figuras 1 e 2) com aumento da concentração de bactérias na mistura, apresentando médias de absorbância pouco elevadas (Tabelas 1 e 2). A partir da concentração 1,38g/L (biomassa seca) houve uma nítida separação de fases, semelhante àquela encontrada nas destilarias com altos índices de infecção bacteriana e floculação.
A porcentagem de floculação foi 100% na faixa de concentração bacteriana de 1,38 a 3,76g/L de biomassa seca, enquanto que nas concentrações de 0,434 e 0,851g/L de biomassa seca bacteriana este índice foi de 0 e 13-25%, respectivamente. Isto mostra que há uma concentração crítica, a partir da qual eleva-se bastante a floculação do fermento promovendo a separação de fases (Tabelas 1 e 2). 0,434g/L foi a menor concentração bacteriana testada, não apresentando floculação e pôde então ser considerada como controle do experimento. Segundo YOKOYA, OLIVA-NETO [21] com uma proporção de 51mg/50mL de bactéria indutora da floculação para 1160 mg/50 mL de levedura não floculenta (biomassa seca), relação de 23/1 (levedura/bactéria), ocorre uma diminuição drástica na turbidez do sobrenadante, sendo tal sedimentação devida a intensa floculação entre as bactérias e leveduras. Mas, com os presentes resultados podemos observar que basta 1,38g/L de bactéria (biomassa seca), relação 47/1 (levedura/bactéria), para ocorrer uma nítida separação de fases. Assim pode-se dizer que uma concentração menor de bactérias (1,38g/L biomassa seca) verificada neste trabalho, já é suficiente para causar uma floculação elevada, com nítida separação de fases (Figura 1), nos níveis normais de concentração de leveduras nas destilarias (10 a 15% - biomassa úmida). Tal situação comprometeria claramente a estabilidade da fermentação alcoólica industrial, justificando, portanto, a necessidade do controle bacteriano no processo em níveis bem inferiores a esses quantificados.
3.2 ¾ Influência do tempo de contato entre as células para a floculação
O tempo de reação não influenciou a floculação, permanecendo praticamente constante (Tabela 2 e Figura 1). Portanto, apenas para a detecção rápida de bactérias indutoras de floculação em dornas de fermentação, é suficiente o tempo de 35 min., envolvendo 15 min. de agitação e 20 min. de repouso das células misturadas. O tratamento estatístico revelou que os tempos de 35 minutos para a reação e estabilização da floculação (ANOVA F=50,992 e p<0,0001; Tukey-Kramer p<0,05) e 175 minutos de permanência (ANOVA F=112,71 e p<0,0001; Tukey-Kramer p<0,05) são suficientes para o emprego da técnica. Estes resultados coincidem com o padrão de floculação entre leveduras, já que para aumentar a agregação entre as células de leveduras é necessária uma suave agitação, que acelera a floculação, pois aumenta a probabilidade de colisão entre as células e faz com que a floculação seja imediata após a mistura das células [8, 19].
3.3 ¾ Efeito do pH sobre a floculação de leveduras
Com os devidos ajustes, visando a simplificação, esta técnica poderá ser aplicada na indústria com grande utilidade para o controle do fermento. Para as destilarias que utilizam a técnica do plaqueamento, pode ser feito o isolamento de bactérias indutoras da floculação e através do emprego desta técnica a determinação da floculação. Desta forma, o trabalho contribui também para o monitoramento industrial das condições microbiológicas das destilarias produtoras de etanol permitindo a quantificação e qualificando as cepas floculadoras do fermento.
Analisando o efeito do pH sobre a floculação de Saccharomyces cerevisiae (Tabela 3 e Figura 3) pode-se confirmar o sucesso do emprego industrial de ácido forte no tratamento do pH do fermento, entre 2,0 e 2,7. Nesta faixa, a técnica demonstrou que a suspensão de leveduras e bactérias foi desfloculada, estando o fermento quase totalmente homogeneizado, sem apresentar separação de fases. Com pH 2,0 a DO x FD foi de 25,6 (% de floculação = 0) no intervalo de 175 minutos. Tais resultados foram semelhantes também para a faixa de pH de 2,5 - 2,7.
Porém há um inconveniente no emprego do ácido sulfúrico sob agitação no tratamento do fermento industrial [2]. Apesar da eficácia na desfloculação do fermento, esta não é duradoura sendo revertida em função da alteração do pH quando o inóculo tratado é retornado à dorna de fermentação, voltando o fermento a flocular. A utilização de pHs baixos (2,0 - 2,5) podem afetar o metabolismo da levedura, diminuindo a viabilidade celular. O tempo do fermento exposto a esta faixa de pH é de 0,5 a 2 horas, e quanto maior for o tempo e menor o pH mais severo será o impacto no metabolismo da levedura.
Verifica-se também que o fator tempo não pode influenciar na desfloculação celular em função do pH, principalmente numa faixa de pH superior a 2,7; onde a diferença de floculação nos tempos 0 e 175 minutos variou de 0 a 7%. Para um pH 2,5 houve uma maior diferença, já que a redução da floculação em igual período foi de 12,5% (Tabela 3).
Na faixa de pH de 3,0 a 3,5 a floculação foi superior a 79%, porém nos pHs de 4,0 e 4,5 esta se intensificou, provocando uma maior precipitação do fermento no fundo dos frascos e a formação de um sobrenadante bastante límpido, com densidades ópticas x FD baixas, variando de 1,5 a 3,0 nos intervalos de tempo de 0 e 175 minutos, respectivamente (Figura 3). Entretanto, partindo-se do pH 4,0 com floculação de aproximadamente 95% e alterando-se este para a faixa de 2 a 2,5 houve a desfloculação das células com 0 a 12,5% de floculação (Tabela 3 e Figura 3).
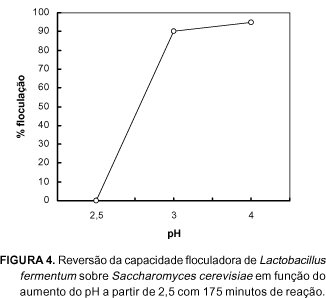
Por esta razão, o tratamento ácido da suspensão de leveduras na indústria tem efeito temporário na floculação do fermento, sendo portanto reversível. No pH 2,0 - 2,5 a floculação é baixa (20%), mas logo após uma elevação deste pH acima de 3,0, ela retorna numa faixa superior a 90% (Figura 4).
O pH do meio em que as células de levedura se encontram é muito importante para o desenvolvimento do fenômeno da floculação, seja devido àquela produzida por leveduras floculantes [4] ou por bactérias indutoras de floculação. Os resíduos de aminoácidos da superfície de Lactobacillus fermentum e resíduos de carboidratos das leveduras são os prováveis responsáveis pelo desenvolvimento do fenômeno da floculação, sendo que o grupo indol do triptofano e o grupo hidroxil fenólico da tirosina devem estar presentes na superfície celular bacteriana para a floculação ocorrer, com os resíduos de mananas da superfície celular das leveduras. O cálcio pode atuar como ponte de ligação entre os grupos negativos das fosfomananas [8, 14] e os receptores protéicos das células bacterianas [3], que foi inicialmente verificado pela ação de proteases [21].
Sabe-se que a ligação destas células ocorre devido a pontes formadas entre estes grupos mediada pelo íon positivo cálcio, que é hábil na indução da floculação, quando em pH mais elevados. Assim, durante o tratamento ácido, com pH baixos e um nível de íons H+ elevado, este compete com os íons Ca2+, desfazendo as pontes entre as células e estas se tornam desfloculadas. Quando as células entram para as dornas de fermentação, a floculação volta a se desenvolver porque o cálcio está presente naturalmente no meio, e volta a mediar a ligação entre as células, já que o pH é modificado para a faixa de 3,8 a 4,2 com a mistura da suspensão de leveduras com o mosto.
4 ¾ CONCLUSÕES
A menor concentração bacteriana necessária é suficiente para causar uma floculação elevada, com decantação das células de leveduras, provocando uma nítida separação de fases é de 1,38g/L (biomassa seca) para 65,4g/L (biomassa seca) de levedura.
O tempo de reação não influencia a floculação, visto que ela permanece praticamente constante nos diferentes tempos (35, 105 e 175 min.), sendo a reação inferior a 15 minutos, ou seja, quase instantânea. Assim, para a detecção rápida de bactérias indutoras de floculação em dornas de fermentação é suficiente o tempo de 35 min., envolvendo 15 min. de agitação e 20 min. de repouso das células misturadas.
A partir do pH 3,0 pouca ou nenhuma influência ocorre no efeito de desfloculação de Saccharomyces cerevisiae por Lactobacillus fermentum . A desfloculação do fermento ocorre com pH abaixo de 3,0, numa faixa de 2,0 a 2,5 com floculação ao redor de 100%.
Os íons H+ promovem uma desfloculação reversível, já que partindo-se de uma floculação total (100%), com pH 2,5; há uma rápida reversão do fenômeno em função de um pH mais elevado (pH 3,0 a 4,0).
O controle industrial das condições microbiológicas das destilarias produtoras de etanol pode ser auxiliado por uma técnica simples e econômica como a utilizada neste trabalho, contribuindo para o monitoramento da população de bactérias indutoras da floculação.
5 ¾ REFERÊNCIAS BIBLIOGRÁFICAS
6 ¾ AGRADECIMENTOS
Os autores agradecem à Fundação de Amparo à Pesquisa do Estado de São Paulo ¾ FAPESP pelo apoio financeiro.
2Depto. de Bioquímica e Microbiologia - Instituto de Biociências, Unesp, C.P. 199, CEP 13.506-900 - Rio Claro/SP.
3Depto. de Ciências, Biológicas - Faculdade de Ciências e Letras de Assis, Unesp, C.P. 335, CEP 19.800-000 - Assis/SP.
* A quem a correspondência deve ser enviada.
- [1] ALTHERTUM, F.; CRUZ, M.R.M.; VAIRO, M.L.R.; GAMBASSI, P.M. Efeito dos microrganismos contaminantes da fermentaçăo alcoólica nas microdestilarias. STAB Açúcar e Álcool, v.3, n.1, p.42-49, 1984.
- [2] BOVI, R.; MARQUES, M.O. O tratamento ácido na fermentaçăo alcoólica. Álcool e açúcar, v.3, n.9, p.10-13, 1983.
- [3] BROMBERG, R.; YOKOYA, F. Chemical modifications of the cell-surface components of Lactobacillus fermentum FTPT 1405 and their effect on the flocculation of Saccharomyces cerevisiae W. J. of Microbiol. Biotechnol., v.11, p.508-511, 1995.
- [4] CALLEJA, G.B. On the nature of the forces involved in the sex-directed flocculation of a fission yeast. Can. J. of Microbiol., v.20, n.6, p.797-803, 1974.
- [5] CRUZ, M.R.M; VAIRO, M.L.; GAMBASSI, D.M.; ALTERTHUM, F. Influęncia da penicilina V-ácida no controle das infecçőes bacterianas na fermentaçăo alcoólica. Rev. Microbiol., v.16, n.2, p.138-142, 1985.
- [6] FALANGHE, H. Produçăo de microrganismos. In: LIMA, U.A. et al Biotecnologia: Tecnologia das Fermentaçőes Săo Paulo, Ed. Edgard Blucher Ltda, 1975, v.1.
- [7] HENRIKSSON, A.; SZEWSYK, R.; CONWAY, P.L. Characteristics of the adhesive determinants of Lactobacillus fermentum 104. Appl. and Environm. Microbiol., v.57, n.2, p.499-502, 1991.
- [8] KIHN, J.C.; MASY, C.L.; MESDAGH, M.M. Yeast flocculation: factors affeting the measuremente of flocculence. Can. J. Microbiol., v.34, p.779-781, 1988.
- [9] MAN, J.C.; ROGOSA, M.; SHARPE, M.E. A medium for the cultivation of Lactobacilli. J. Appl. Bacteriol., v.23, n.1, p.130-135, 1960.
- [10] MILL, P.J. The nature of interactions between flocculent cells in the flocculation of Saccharomyces cerevisiae J.Gen. Microbiol., v.35, p.61-68, 1964.
- [11] O'TOOLE, D.K. Weighing technique for determining bacterial dry mass based on rate of moisture uptake. Appl. Environ. Microb., n.46, p.506-508, 1984.
- [12] OLIVA-NETO, P.; YOKOYA, F. Evaluation of bacterial contamination in a fed-batch alcoholic fermentation process. World J. Microbiol. Biothnol., v.10, p.697- 699, 1994.
- [13] ROSE, A.H. Industrial importance the Saccharomyces cerevisiae In: SKINNER, F.A. et al Biology and Activies of Yeast, Ed. Academic Press., 1980.
- [14] SANTOS, M.T.; YOKOYA, F. Characteristics of yeast cell flocculation by Lactobacillus fermentum J. Ferment. Bioeng., v.75, n.2, p.151-154, 1993.
- [15] SERRA, G.E; CEREDA, M.P.; FERES, R.J.F.; BERTOZO, M.T.; VICENTE, A.L. Contaminaçăo da fermentaçăo alcoólica: floculaçăo do fermento. Brasil Açucareiro, v.XCIII, n.6, p.336-341, 1979.
- [16] STRATFORD, M. Evidence for two mechanisms of flocculation in Saccharomyces cerevisiae Yeast, v.5, p.441-445, 1989a.
- [17] žžžžžžžžžžžž. Yeast flocculation: Calcium specificity. Yeast, v.5, p.487-496, 1989b.
- [18] STRATFORD, M.; BRUNDISH, H.M. Yeast flocculation: cationic inhibition. Yeast, v.6, p.77-86, 1990.
- [19] STRATFORD, M.; COLEMAN, H.P.; KEENAN, M.H.J. Yeast flocculation: a dynamic equilibrium. Yeast, v.4, p.199-208, 1988.
- [20] YOKOYA, F. Problemas com contaminantes na Fermentaçăo alcoólica. STAB - Álcool e Açúcar, julho/agosto, 1991.
- [21] YOKOYA, F.; OLIVA-NETO, P. Características da floculaçăo de leveduras por Lactobacillus fermentum Rev. Microb., v.22, n.1, p.12-16, 1991.
Datas de Publicação
-
Publicação nesta coleção
31 Ago 2001 -
Data do Fascículo
Jan 2001
Histórico
-
Aceito
10 Abr 2001 -
Recebido
18 Jul 2000