Resumos
As atividades de polifenoloxidases do feijão (Phaseolus vulgaris L.), cultivares: (Aruã, Aporé, A774, Carioca, Diamante Negro, Ouro Branco, Pérola, RAO 33 e Rudá) foram investigadas sob condições de cinética enzimática. O pH ótimo para o extrato bruto das nove cultivares foi em pH 7,2 utilizando catecol como substrato. Nenhuma atividade PPO foi observada na presença do ácido gálico ou D,L- DOPA.
ácido gálico; catecol; D,L-DOPA; feijão; pirogalol; polifenoloxidase
The polyphenoloxidase activity of nine bean (Phaseolus vulgaris L.) cultivars (Aruã, Aporé, A774, Carioca, Diamante Negro, Ouro Branco, Pérola, RAO 33 e Rudá) were studied. The crude enzyme extract of the nine cultivars was found to have optimum pH in 7.2 using catechol as substrate. No PPO activity in beans (Phaseolus vulgaris L.) was observed using D,L DOPA and gallic acid as substrate.
gallic acid; catechol; D,L-DOPA; beans; pyrogallol; polifenoloxidase
PROPRIEDADES FÍSICO-QUÍMICAS DE POLIFENOLOXIDASE DE FEIJÃO (PHASEOLUS VULGARIS L.)1 1 Recebido para publicação em 21/07/00. Aceito para publicação em 06/04/01.
Maria Regina Araújo GOMES2 1 Recebido para publicação em 21/07/00. Aceito para publicação em 06/04/01. , Maria Goreti de AlmeidaOLIVEIRA2 1 Recebido para publicação em 21/07/00. Aceito para publicação em 06/04/01. ,3 1 Recebido para publicação em 21/07/00. Aceito para publicação em 06/04/01. ,* 1 Recebido para publicação em 21/07/00. Aceito para publicação em 06/04/01. , Geraldo Estevam Souza CARNEIRO4 1 Recebido para publicação em 21/07/00. Aceito para publicação em 06/04/01. , Everaldo Gonçalves de BARROS2 1 Recebido para publicação em 21/07/00. Aceito para publicação em 06/04/01. ,5 1 Recebido para publicação em 21/07/00. Aceito para publicação em 06/04/01. , Maurílio Alves MOREIRA2 1 Recebido para publicação em 21/07/00. Aceito para publicação em 06/04/01. ,3 1 Recebido para publicação em 21/07/00. Aceito para publicação em 06/04/01.
RESUMO
As atividades de polifenoloxidases do feijão (Phaseolus vulgaris L.), cultivares: (Aruã, Aporé, A774, Carioca, Diamante Negro, Ouro Branco, Pérola, RAO 33 e Rudá) foram investigadas sob condições de cinética enzimática. O pH ótimo para o extrato bruto das nove cultivares foi em pH 7,2 utilizando catecol como substrato. Nenhuma atividade PPO foi observada na presença do ácido gálico ou D,L- DOPA.
Palavras-chave: ácido gálico; catecol; D,L-DOPA; feijão; pirogalol; polifenoloxidase.
SUMMARY
PHYSICAL CHEMICAL PROPERTIES OF POLIPHENOLOXIDASE FROM BEANS (PHASEOLUS VULGARIS L.). The polyphenoloxidase activity of nine bean (Phaseolus vulgaris L.) cultivars (Aruã, Aporé, A774, Carioca, Diamante Negro, Ouro Branco, Pérola, RAO 33 e Rudá) were studied. The crude enzyme extract of the nine cultivars was found to have optimum pH in 7.2 using catechol as substrate. No PPO activity in beans (Phaseolus vulgaris L.) was observed using D,L DOPA and gallic acid as substrate.
Keywords: gallic acid; catechol; D,L-DOPA; beans; pyrogallol; polifenoloxidase.
1 ¾ INTRODUÇÃO
Polifenoloxidases (EC. 1.14.18.1), PPO, também conhecidas como tirosinases, cresolases, catecolases, difenolases e fenolases são enzimas intracelulares que ocorrem em plantas, animais e fungos [8,9]. Estas enzimas contém cobre no centro ativo e catalisam dois tipos de reações, ambas envolvendo oxigênio. A primeira reação corresponde à hidroxilação de monofenóis formando orto-difenóis e a segunda à oxidação de orto-difenóis formando orto-quinonas. As polifenoloxidases atuam sobre uma grande variedade de substratos. Cita-se p-cresol, tirosina e ácido p-cumárico como substratos monofenólicos, enquanto catecol, diidroxifenilalanina e ácido clorogênico substratos difenólicos [6].
As polifenoloxidases estão envolvidas no escurecimento de frutas, vegetais, cereais e leguminosas. Muitos métodos têm sido utilizados numa tentativa de prevenir este indesejável escurecimento enzimático [1,2,4].
As reações enzimáticas que envolvem a polifenoloxidase ocorrem no alimento durante o processamento e armazenamento e têm sido muito estudada em frutas e vegetais. No entanto, poucos estudos têm sido realizados com sementes de leguminosas, especialmente o feijão [3,5].
A aceitabilidade de uma variedade de feijão está diretamente ligada ao sabor, a cor e ao tempo de cozimento do feijão e as alterações destas propriedades são provenientes de reações químicas e/ou enzimáticas.
O objetivo deste trabalho foi determinar o efeito de alguns substratos e do pH na atividade de polifenoloxidase de nove cultivares de feijão buscando determinar o pH e o substrato a serem utilizados em trabalhos posteriores.
2 ¾ MATERIAIS E MÉTODOS
2.1 ¾ Material
As amostras de feijão (Phaseolus vulgaris L.) cultivares (Aruã, Aporé, A774, Carioca, Diamante Negro, Ouro Branco, Pérola, RAO 33 e Rudá) foram obtidas pela Empresa Brasileira de Pesquisa Agropecuária (EMBRAPA ARROZ E FEIJÃO/CNPAF), localizada em Goiânia-GO, e colhidas em março de 1999.
De um total de um quilo de feijão, amostrou-se aleatoriamente 150 gramas, o qual foi moído em moinho de faca com peneira de abertura de 1mm e homogeneizada devidamente para evitar segregação das cascas e armazenadas a -30°C.
Os substratos utilizados foram obtidos da Sigma Chemical, St. Louis, Mo. Todos os demais reagentes foram de grau analítico.
As amostras foram analisadas em três repetições.
2.2 ¾ Métodos
2.2.1 ¾ Extração da Enzima
Farinha de feijão com casca (2g) foram homogeneizadas em 10mL tampão fosfato de sódio, 0,1M, pH 7,0 por 30 minutos a 4°C. O extrato foi centrifugado a 21500xg durante 15 minutos a 4ºC. O sobrenadante obtido foi centrifugado a 21500xg durante 15 minutos a 4°C, filtrado e utilizado nas determinações da atividade de polifenoloxidase e concentração de proteína.
2.2.2 ¾ Determinação da Atividade de Polifenoloxidase
A atividade de polifenoloxidase foi determinada a temperatura ambiente pela adição de 0,93mL de solução de substrato preparado em soluções tampão fosfato de sódio 0,1M em valores de pH variando de 6,4 a 8,0 e 0,07mL do extrato enzimático. Ao branco, foi adicionado 0,93mL de solução de substrato preparado em soluções tampão fosfato de sódio 0,1M em valores de pH variando de 6,4 a 8,0 e 0,07mL do tampão fosfato de sódio 0,1M, pH 7,0.
As absorvâncias foram determinadas a 420nm a cada 15 segundos por um período de 4 minutos. Os resultados foram expressos em atividade específica (A420x min-1 x mg-1).
2.2.3 ¾ Determinação da Proteína
A concentração de proteína no extrato enzimático foi determinada pelo método espectrofotométrico de WARBURG e CHRISTIAN [7].
2.2.4 ¾ Determinação da Especificidade da PPO por Substratos Fenólicos.
Os substratos utilizados na determinação da atividade de polifeniloxidase foram: ácido gálico (10mM, l = 360nm), catecol (80mM, l = 420nm), D,L-DOPA, diidroxifenilalanina, (10mM, l = 475nm) e piragalol (10mM, l = 450nm). Os substratos foram preparados no momento da análise para prevenir a auto oxidação dos mesmos, em tampão fosfato de sódio, 0,1M, com pH variando de 6,4a 8,0.
2.2.5 ¾ Efeito do pH sobre a Atividade de PPO
O efeito do pH na atividade de polifenoloxidase foi determinado utilizando-se solução de catecol 80mM em tampão fosfato de sódio, 0,1 M, com pH variando de 6,4 a 8,0, através do incremento de 0,2 unidades em cada determinação.
2.2.6 ¾ Efeito do pH e do Tempo na Oxidação dos Substratos
Os substratos ácido gálico (10mM, l = 360nm), catecol (80mM, l = 420nm), D,L-DOPA (10mM, l = 475nm) e piragolol (10mM, l = 450nm), foram preparados em tampão fosfato de sódio, 0,1M, pH 5,0; 6,0; 7,0; e 8,0. A mistura foi agitada por 10 minutos a temperatura ambiente e as absorvâncias foram registradas a cada 1 minuto por um período de 30 minutos. Ao branco foi adicionado tampão fosfato de sódio 0,1M, pH 5,0; 6,0; 7,0 e 8,0.
3 ¾ RESULTADOS E DISCUSSÃO
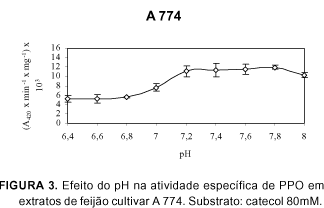
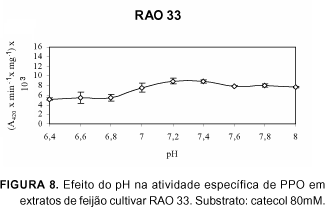
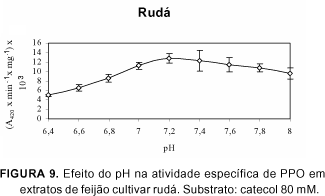
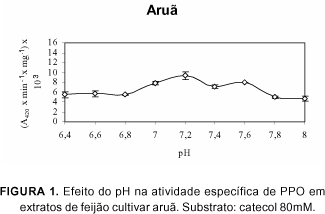
As Figuras de 1 a 9 apresentam a atividade de polifenoloxidase sobre catecol, em função do pH para as nove cultivares de feijão. O pH ótimo para a atividade máxima de polifenoloxidase foi em pH 7,2 para todas as cultivares.
O perfil de atividade específica de PPO, sobre catecol, dos cultivares de feijão aruã, aporé, A 774, carioca, diamante negro, ouro branco, pérola, RAO 33 e rudá foram bastante semelhantes.
A Tabela 1 apresenta os valores de atividade específica de PPO sobre catecol e pirogalol em pH 6,8 e 7,0 para as cultivares diamante negro, ouro branco e rudá. O maior aumento de atividade específica de polifenoloxidase, sobre o substrato pirogalol em pH 7,0, pode ser atribuído ao fato de que ambas as enzimas polifenoloxidase e peroxidase existentes no extrato bruto podem utilizar o pirogalol como substrato. Nenhuma atividade de polifenoloxidase foi observada na presença dos substratos ácido gálico e D,L-DOPA.
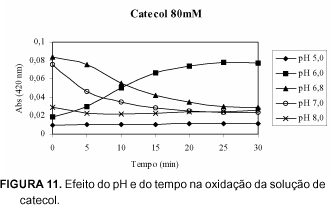
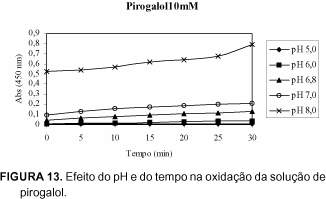
As Figuras de 10 a 13 apresentam o efeito do pH e do tempo na oxidação dos substratos: ácido gálico, catecol, D,L- DOPA e pirogalol.
Na Figura 10 verifica-se que a oxidação do ácido gálico em pH 5,0 e pH 6,0 é lenta e praticamente constante com o tempo. Em pH 6,8, ocorreu um ligeiro aumento nas absorvâncias em função do tempo. Em pH 5,0, 6,0 e 6,8 não houve mudança de cor e todas as três soluções permaneceram incolores durante 30 minutos de leitura. Quando o ácido gálico foi preparado em pH 7,0 a solução apresentou-se incolor e após 30 minutos a solução evoluiu para uma coloração esverdeada bem clara. Em pH 7,0 o ácido gálico oxidou-se rapidamente com o tempo. Em pH 8,0 a solução de ácido gálico apresentou coloração verde após ter sido preparada e mudou para verde-azulado após 30 minutos de leitura. O ácido gálico oxidou-se muito rapidamente com o tempo em pH 8,0.
Observa-se através da Figura 11 um aumento crescente nas absorvâncias em pH 6,0 para a solução de catecol. Em pH 6,0 a solução de catecol mudou de incolor para amarelo claro após 30 minutos de leitura. Um evidente decréscimo nas absorvâncias foi verificado, quando a solução de catecol foi preparada em pH 6,8 e pH 7,0 e em ambos pH as soluções mudaram de amarelo-claro para incolor. Estas mudanças de coloração podem ser explicadas pela formação de quinonas pela oxidação das hidroxilas fenólicas do catecol. Em pH 8,0 a solução de catecol apresentou-se incolor após 30 minutos de leitura e uma pequena variação nas absorvâncias foram observadas com o tempo.
Em todos os valores de pH (5,0 - 8,0) não houve mudança de cor na solução de D,L-DOPA. A solução de D,L-DOPA apresentou-se incolor até 30 minutos de leitura (Figura 12). Além disso, a oxidação da solução de D,L-DOPA foi muito mais lenta do que os outros substratos.
Na Figura 13, verifica-se que a oxidação da solução de pirogalol é crescente com o aumento do tempo e do pH. Em pH 7,0 a solução de pirogalol oxidou-se rapidamente e apresentou coloração amarela após 30 minutos de leitura. Em pH 8,0 a solução de pirogalol apresentou-se alaranjada após ter sido preparada e a intensidade da cor aumentou após 30 minutos de leitura. A oxidação da solução de pirogalol em pH 8,0 foi muito mais rápida do que nos outros pH.
4 ¾ CONCLUSÕES
Os resultados deste trabalho mostram que o pH ótimo para o extrato bruto das nove cultivares de feijão foi em pH 7,2 utilizando catecol como substrato.
Nenhuma atividade de PPO foi observada na presença de ácido gálico ou D,L-DOPA.
5 ¾ REFERÊNCIAS BIBLIOGRÁFICAS
6 ¾ AGRADECIMENTOS
Os autores agradecem à Embrapa ¾ Arroz e Feijão/CNPAF, Goiânia e à FAPEMIG pelos auxílios concedidos.
2 Instituto de Biotecnologia Aplicada à Agropecuária- BIOAGRO, Universidade Federal de Viçosa (UFV), CEP 36571-000, Viçosa, MG, Brasil.
3 Departamento de Bioquímica e Biologia Molecular, DBB/UFV.
4 EMBRAPA Arroz e Feijão, Cx. Postal 179, CEP 75375-000, Santo Antônio de Goiás, Goiânia, GO, Brasil.
5 Departamento de Biologia Geral, DBG / UFV.
* Enviar correspondência para malmeida@mail.ufv.br
- [1] GOLAN-GOLDHIRSH, A. G.; WHITAKER, J.R. Effect of ascorbic acid, sodium bisulfite, and thiol compounds on mushroom polyphenol oxidase. J. Agric. Food Chem., v. 32, p. 1003-1009. 1984.
- [2] GOMES, M. R. A.; LEDWARD, D. A. Effect of high pressure treatment on the activity of some polyphenoloxidases. Food Chem., v. 56, p. 1-5. 1996.
- [3] IADEROZA, M.; SALES, M.; BALDINI, V. L. S.; SARTORI, M. R.; FERREIRA, V. L. P. Atividade de polifenoloxidase e alteraçőes da cor e dos teores de taninos condensados em nove cultivares de feijăo (Phaseolus vulgaris L.) durante o armazenamento. Colect. ITAL, Campinas, 19, p. 154-164, 1989.
- [4] SCHWIMMER, S. Food color, the phenolases and undesirable enzymatic browning. In: AVI PUBLISHING Co (Ed.) Source Book of Food Enzymology Westport: Conn, 1981. p. 267-283.
- [5] UDAYASEKHARA RAO, P.; DEOSTHALE, Y. G. Polyphenoloxidase activity in germinated legumes seeds. J. Food Sci, v.52, p. 1549-1551, 1987.
- [6] VÁMOS-VIGYÁZÓ, L. Polyphenoloxidase and peroxidase in fruits and vegetables. CRC Critic. Rev. Food Sci. Nutr., v. 15, p. 49-127, 1981.
- [7] WARBURG O.; CHRISTIAN, W. Isohierung und Kristallisation des Gärungsferments Enolase. Biochem. Z., v. 310, p. 384-421, 1941
- [8] WHITAKER, J.R. Polyphenol oxidase. In: FENNEMA, O. R. (Ed.) Principles of Enzymology for the Food Sciences New York : Marcel Dekker Inc, 1994. p. 543-556.
- [9] ZAWISTOWSKI, J.; BILIADERIS, C. G.; ESKIN, N. A. M. Polyphenol Oxidases. In ROBISON, D. S.; ESKIN, N. A. M. (Ed.) Oxidative Enzymes in Foods 1991. p. 217-273.
Datas de Publicação
-
Publicação nesta coleção
31 Ago 2001 -
Data do Fascículo
Jan 2001
Histórico
-
Aceito
06 Abr 2001 -
Recebido
21 Jul 2000