Resumos
No presente trabalho foram estudadas as características bioquímicas das peroxidases de novos abacaxis, cultivar IAC Gomo-demel e clone IAC-1. As peroxidases dos sucos destes abacaxis apresentaram atividade ótima entre 45ºC e 50°C e entre 50°C e 55°C, respectivamente. Estas peroxidases apresentaram atividade ótima em pH 4,5 e mostraram-se estáveis na faixa de pH 4,0 a 9,0, retendo, após 24 horas de incubação a 50ºC, mais de 80% da atividade inicial. Foi observada regeneração parcial da atividade da peroxidase, após tratamento a 75ºC por 10 minutos. As peroxidases dos sucos dos abacaxis estudados foram inativadas, após tratamento a 90ºC por 2 minutos.
Ananas comosus; abacaxi; peroxidase; regeneração; inativação
In the present work, the biochemical characteristics of peroxidase enzymes from new pineapples, cultivar IAC Gomo-de-mel and clone IAC-1, were studied. The peroxidases obtained from the juice of this pineapples presented optimum activities from 45 ºC to 50 ºC and 50 ºC to 55 ºC, respectively. These peroxidases showed maximum activity at pH 4.5 and showed stability at pH 4.0 to 9.0, retaining after 24 hours of incubation at 50 ºC more than 80% of initial activity. Partial regeneration of peroxidase activity was observed after treatment at 75 ºC for 10 minutes. The peroxidases from pineapple juices studied were inactivated after treatment at 90 ºC for 2 minutes.
Ananas comosus; pineapple; peroxidase; enzyme inactivation
Características da atividade da peroxidase de abacaxis (Ananas comosus (L.) Merrill) da cultivar IAC Gomo-de-mel e do clone IAC-1
Biochemical characteristics peroxidase from pineapple (Ananas comosus (L.) Merrill): cultivar IAC Gomo-de-mel and clone IAC-1
Carlos Alexandre Koguishi de BritoI; Hélia Harumi SatoI,* * A quem a correspondência deve ser enviada. ; Ademar SpironelloII; Walter José SiqueiraII
IDepartamento de Ciência de Alimentos/Faculdade de Engenharia de Alimentos/Universidade Estadual de Campinas. End.: Cidade Universitária "Zeferino Vaz". Caixa Postal 6121; Barão Geraldo. CEP: 13083-970 Campinas/SP. E-mail: brito@bol.com.br e heliah@fea.unicamp.br
IICentro de Genética, Biologia Molecular e Fitoquímica do Instituto Agronômico de Campinas. End.: Av. Barão de Itapura, 1481, CEP: 13020-902 - Campinas/SP
RESUMO
No presente trabalho foram estudadas as características bioquímicas das peroxidases de novos abacaxis, cultivar IAC Gomo-demel e clone IAC-1. As peroxidases dos sucos destes abacaxis apresentaram atividade ótima entre 45ºC e 50°C e entre 50°C e 55°C, respectivamente. Estas peroxidases apresentaram atividade ótima em pH 4,5 e mostraram-se estáveis na faixa de pH 4,0 a 9,0, retendo, após 24 horas de incubação a 50ºC, mais de 80% da atividade inicial. Foi observada regeneração parcial da atividade da peroxidase, após tratamento a 75ºC por 10 minutos. As peroxidases dos sucos dos abacaxis estudados foram inativadas, após tratamento a 90ºC por 2 minutos.
Palavras-chave:Ananas comosus; abacaxi; peroxidase; regeneração; inativação.
SUMMARY
In the present work, the biochemical characteristics of peroxidase enzymes from new pineapples, cultivar IAC Gomo-de-mel and clone IAC-1, were studied. The peroxidases obtained from the juice of this pineapples presented optimum activities from 45 ºC to 50 ºC and 50 ºC to 55 ºC, respectively. These peroxidases showed maximum activity at pH 4.5 and showed stability at pH 4.0 to 9.0, retaining after 24 hours of incubation at 50 ºC more than 80% of initial activity. Partial regeneration of peroxidase activity was observed after treatment at 75 ºC for 10 minutes. The peroxidases from pineapple juices studied were inactivated after treatment at 90 ºC for 2 minutes.
Keywords:Ananas comosus; pineapple; peroxidase; enzyme inactivation.
1 - INTRODUÇÃO
A peroxidase (E.C.1.11.1.7., doador H2O2 oxidoredutase) é uma enzima associada a reações de deterioração oxidativa em frutas e vegetais in natura e produtos processados [6]. Na reação enzimática o peróxido de hidrogênio ou outro peróxido orgânico, como o peróxido de metila ou o etil hidrogênio, é reduzido, enquanto que um doador de elétrons (AH ) é oxidado. O doador de elétrons pode ser ascorbato, fenóis, aminas ou outros compostos orgânicos [17, 21]. Em muitos casos o produto da oxidação é colorido e serve como base para a determinação colorimétrica da atividade da peroxidase.
A peroxidase pode causar mudanças indesejáveis no aroma, gosto, cor, textura e também a perda de nutrientes [1, 5, 7, 22] . A peroxidase pode participar da destruição de vitamina C, catalizar o branqueamento dos carotenóides na ausência de ácidos graxos insaturados e a descoloração de antocianinas. Catalisa a reação de degradação de ácidos graxos insaturados, produzindo voláteis que alteram o sabor [16] .
Desde 1991, o Instituto Agronômico de Campinas vem desenvolvendo um programa de melhoramento genético do abacaxi, visando a resistência à fusariose e características agrícolas e organolépticas mais desejáveis [20].
O IAC selecionou alguns clones de abacaxi, além da cultivar IAC Gomo-de-mel, recentemente indicado para cultivo, o qual reúne vários fatores desejáveis: elevado teor de sólidos solúveis totais, acidez de baixa a moderada, consistência tenra, suculência e coloração amareloouro atraente. O abacaxi "IAC Gomo-de-mel" também apresenta como característica, gomos que podem ser destacados manualmente [20].
Por ser de interesse conhecer algumas características da enzima peroxidase do abacaxi 'IAC Gomo-de-mel' e do clone IAC-1 foram determinadas a faixa de pH e a temperatura ótima de atividade, o pH e a temperatura de estabilidade da enzima e a regeneração, após tratamento térmico e sua inativação térmica.
2 - MATERIAL E MÉTODOS
2.1 - Preparo do extrato bruto
As amostras do abacaxi 'IAC Gomo-de-mel' e do clone IAC-1, em estádio de maturação de 1/4 a 1/2 de casca amarela, foram coletadas na Estação Experimental de Agronomia de Pindorama-SP, pertencente ao Instituto Agronômico de Campinas. As amostras de polpa foram homogeneizadas em liquidificador e o suco obtido por centrifugação a 11.000.g por 10 minutos, a 5ºC, foi utilizado como fonte de peroxidase.
2.2 - Determinação da atividade de peroxidase
A atividade de peroxidase dos extratos de abacaxi baseou-se no método de KHAN & ROBINSON [9]. A mistura de 1,5mL de guaiacol a 1% em tampão de fosfato a 0,05M e pH 6,0 com 1,2mL deste tampão foi incubada, a 25 C, em cubeta do espectrofotômetro Beckman DU 70. Em seguida adicionou-se 0,1mL do extrato enzimático diluído e 0,4mL de solução de H2O2 (0,33mL de H2O2 a 30% em 100mL de tampão fosfato a 0,05M e pH 6,0). O aumento da absorbância a 470nm foi monitorado durante 5 minutos de reação a 25°C, contra um branco, no qual a solução de H O foi substituída pelo tampão.
As análises foram feitas em três repetições, utilizando-se amostras do extrato enzimático diluído. Uma unidade de atividade de peroxidase (U) foi definida como a quantidade de enzima que causa aumento na absorbância de 0,001 por minuto a 470nm, tendo o guaiacol como doador de H+ .
2.3 - Determinação das características bioquímicas das peroxidases
A determinação das características das peroxidases dos abacaxis estudados quanto à temperatura e pH ótimos, temperatura e pH para estabilidade, regeneração após tratamento térmico e inativação térmica foram realizadas em três repetições, utilizando-se amostras do extrato enzimático diluídas.
2.3.1 - Efeito da temperatura
A determinação da temperatura ótima para a atividade das peroxidases foi realizada entre 10ºC a 70ºC, com intervalos de 10ºC, que foram reduzidos para 5ºC na região da atividade ótima. A temperatura em que foi verificada a atividade ótima foi utilizada nas determinações subseqüentes.
2.3.2 - Efeito do pH
A influência do pH na atividade da peroxidase foi determinada usando-se tampões citrato-fosfato com pH variando de 2,6 a 7,0 a 0,2M, em intervalos de 0,5 unidades de pH. A determinação da faixa ótima de pH foi feita a 50ºC, substituindo-se o tampão fosfato a 0,05M e pH 6,0, da mistura de reação, pelas diferentes soluções tampão.
2.3.3 - Efeito da temperatura na estabilidade
A estabilidade térmica das peroxidases foi testada através de dois tratamentos térmicos. Inicialmente as amostras de extrato enzimático foram incubadas a 30ºC, 40ºC, 50ºC, 60ºC, 70ºC, 80ºC, 90ºC e temperatura de ebulição (97ºC), por 30 minutos. Em seguida, as amostras eram resfriadas em banho de gelo e a atividade residual determinada, nas condições ótimas de pH e temperatura para a atividade da peroxidase do abacaxi. Na segunda etapa e após se ter verificado que somente em temperaturas maiores que 70ºC ocorreu diminuição da atividade, testou-se as temperaturas de 85°C, 90°C e 95°C por 30, 60, 120 e 180 segundos.
2.3.4 - Regeneração da atividade da peroxidase após o tratamento térmico
O teste foi baseado no método descrito por MC LELLAN & ROBINSON [13]. As amostras do extrato enzimático foram aquecidas a 75ºC por 10 minutos e a 90ºC por 2 minutos, sendo em seguida armazenadas a 5ºC e 25ºC. A atividade residual da enzima foi determinada após 3 horas e 24 horas de incubação nas condições ótimas de atividade da peroxidase, pH 4,5 e 50ºC.
2.3.5 - Efeito do pH na estabilidade
O efeito do pH na estabilidade das peroxidases foi testado na faixa de 3,0 a 9,0, em tampão citrato-fosfato a 0,05M e borato/ácido bórico a 0,05M, a intervalos de 1 unidade de pH. Alíquotas de 0,5mL do extrato enzimático e 0,5mL das soluções tampão foram incubadas a 5ºC por 24 horas, a 25 ºC por 3 horas e a 50ºC por 3 horas e 24 horas. Após essa incubação, foi adicionado o tampão citrato-fosfato a 0,05M e pH 4,5, para ajustar todas as amostras para um mesmo pH e em seguida determinou-se a atividade residual, nas condições ótimas de atividade da peroxidase, pH 4,5 e 50ºC.
3. RESULTADOS E DISCUSSÃO
As peroxidases dos abacaxis "IAC Gomo-de-mel" e do clone IAC-1 apresentaram temperatura ótima para a atividade, na faixa de 45°C a 50°C e de 50 °C a 55°C, respectivamente (Figura 1). Estes resultados são similares aos obtidos para as peroxidases de carambola [8], kiwi [19] e melão [10], que apresentaram temperatura ótima para atividade na faixa de 50ºC a 55 C. As peroxidases de maçã [15], morango [3] e pêssego [12] mostraram atividade na faixa de 50ºC a 55ºC. As peroxidases de maçã[15], morango[3] e pêssego[12] mostraram atividade ótima a 25ºC, 30ºC e 40ºC, respectivamente.
As peroxidases dos abacaxis 'IAC Gomo-de-mel' e IAC-1 apresentaram atividade ótima em pH 4,5, a 50 C, e baixa atividade em pH 2,6 e superiores a 7,0 (Figura 2). As peroxidases desses abacaxis atuam melhor em pH ácido, concordando com os resultados obtidos por BEAUDREAU & YASUNOBU [2] que relataram que a peroxidase de abacaxi apresentava pH ótimo de atividade em pH 4,2, e por FERREIRA & CABRAL [4] que verificou que a peroxidase de abacaxi cv. Pérola, apresentava atividade ótima em pH 5,0.
As peroxidases dos abacaxis apresentaram atividade em pH mais ácido quando comparada com as peroxidases de outras frutas. As peroxidases de pêssego [12] e manga [9] mostraram atividade ótima em pH 5,0, as de carambola [8] e kiwi [19] apresentaram em torno de pH 5,5, enquanto que as do morango [3] e açaí [18] mostraram-na em pH 6,0. A peroxidase de melão [10] apresentou atividade ótima em pH na faixa de pH 6,0 a 7,0, a 30ºC, e na faixa de pH 5,5 a 7,5, a 50ºC.
Estas peroxidases mostraram-se estáveis, após 30 minutos, em temperaturas inferiores a 50ºC. Após 30 minutos de tratamento a 70 ºC, a atividade residual da peroxidase reduziu-se a 15% (Figura 3). Após 30 minutos a 80 ºC, elas foram inativadas.
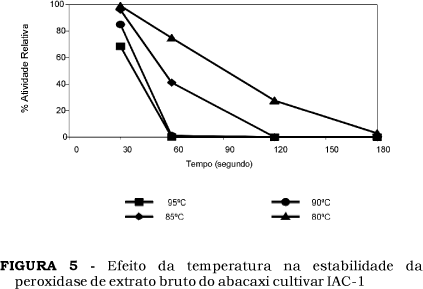
Estas peroxidases foram inativadas com tratamentos a 60 e 120 segundos a 90 ºC, respectivamente, conforme o mostrado nas Figuras 4 e 5.
Estes resultados foram semelhantes aos obtido por LIMA [11] que relatou o processamento de suco de abacaxi utilizando-se evaporadores, em que o suco é aquecido a 90ºC e 95ºC, durante 30 e 40 segundos.
MELLO & CLEMENTE [14] verificaram que a peroxidase solúvel de abacaxi 'Pérola' perdeu cerca de 70% da atividade, após 420 segundos de tratamento térmico a 60 C e cerca de 90% da atividade, após 600 segundos a 75 C.
As peroxidases dos abacaxis 'IAC Gomo-de-mel' e IAC-1, da mesma forma que outras peroxidases de frutas, apresentaram estabilidade térmica em temperaturas inferiores a 75°C, sendo inativada em temperaturas iguais ou superiores a 80ºC.
LOURENÇO E NEVES [12] observaram que a peroxidase de pêssego apresentou rápida inativação acima de 70 ºC, com perda praticamente total após tratamento a 80 ºC durante 30 segundos. A peroxidase de melão [10] mostrou-se estável em temperaturas inferiores a 40 ºC e perdeu 90% da atividade após tratamento a 80 ºC durante 20 minutos.A peroxidase de açaí [18] mostrou-se termoestável,retendo cerca de 70% da atividade inicial após 10 minutos de tratamento a 70 ºC e cerca de 20% da atividade após 5 minutos a 90 ºC .
A inativação das peroxidases dos extratos brutos dos abacaxis estudados mostraram comportamento não linear, o que também ocorreu em extrato bruto de peroxidase solúvel e peroxidase iônica de abacaxi, submetidos a tratamento a 60ºC e 75ºC por 10 minutos no máximo[14].
A Tabela 1 indica que o tratamento da peroxidase do abacaxi 'IAC Gomo-de-mel' por 10 minutos a 75ºC e incubação durante 3 e 24 horas a 5ºC e 25ºC, houve 10 -12% de regeneração de sua atividade, enquanto que após 2 minutos de aquecimento a 90°C não se observou regeneração da peroxidase.A Tabela 2 indica que, após tratamento a 75C por 10 minutos e incubação durante 3 e 24 horas a 5°°C e 25 C, a peroxidase do abacaxi IAC-1 apresenta cerca de 5% de regeneração, enquanto que após tratamento por 2 minutos a 90°C, ela não apresenta regeneração.
O resultado obtido foi semelhante ao de MC LELLAN & ROBINSON [13], que estudaram a regeneração da atividade de peroxidase de laranja após tratamento a 60°C, 65°C, 70 C e 75°C por 10 minutos que também foram baixas, enquanto que SANTOS [18] estudando a peroxidase de açaí observou regeneração de 30% e de 5%, após 5 minutos de tratamento a 80ºC e 90ºC, respectivamente.
As Figuras 6 e 7 indicam que as peroxidases dos abacaxis IAC-1 e 'IAC Gomo-de-mel' se mostraram estáveis na faixa de pH 4,0 a 9,0, após 24 horas de incubação a 50ºC, retendo mais de 80% de atividade, sendo que em pH 3,0 a peroxidase do IAC-1 reteve cerca de 45% da atividade inicial e 'IAC Gomo-de-mel' 60%.
As peroxidades dos abacaxis estudados da mesma forma que as peroxidases de outras frutas, apresentaram estabilidade em ampla faixa de pH. A peroxidase de carambola apresentou estabilidade na faixa de pH 6,0 a 9,0 [8], enquanto que a do morango em pH 4,0 a 11,0, sendo que entre 6,0 e 7,5 manteve 90% da atividade inicial [3]. A peroxidase de açaí [18] apresentou estabilidade em ampla faixa de pH, mantendo mais que 50% da atividade inicial após 24 horas de incubação a 5 ºC na faixa de pH 2,6 a 10,0.
4 - CONCLUSÕES
As peroxidases dos abacaxis "IAC Gomo-de-mel" e IAC-1 apresentaram atividade ótima a 45 - 50°C e 50 -55°C, respectivamente. Essas peroxidases apresentaram atividade ótima em pH 4,5 e mostraram-se estáveis na faixa de pH 4,0 - 9,0, após 24 horas de incubação a 50ºC, retendo mais que 80% de atividade inicial. Foi observada regenaração das peroxidases dos abacaxis da ordem de 5% no IAC-1 e de 10-12% no 'IAC Gomo-de-mel', após aquecimento a 75ºC por 10 minutos, seguido de incubação a 5ºC ou a 25ºC. As peroxidases destes abacaxis foram inativadas após 2 minutos a 90ºC, não sendo observado regeneração.
5 - REFERÊNCIAS BIBLIOGRÁFICAS
5 - AGRADECIMENTOS
À FAPESP - Fundação de Amparo à Pesquisa do Estado de São Paulo, pela concessão de auxílio financeiro. Processo número: 99/11092-4.
Recebido para publicação em 23/04/2003. Aceito para publicação em 17/03/2005 (001102).
- [1] BRAVERMAN, J.B.S. Vitaminas. In:_____ Introduction ala bioquímica de los alimentos Barcelona: Omega, 1967, cap. 14, p. 206-239.
- [2] BEAUDREAU,C, YASUNOBU, K.T. Heme Proteins.VI Crystaline pineapple peroxidase B . Biochemistry Washington DC., v.5, n.4., p.1404-1412, 1966.
- [3] CIVELLO ,P .M ; MARTINEZ,G .A .; CHAVES,A.R.; AÑON,M.C. Peroxidase from strawberry fruit (Fragaria ananassa Duch) : Partial purification and determination of some properties. Journal of Agricultural and Food Chemistry, Washington DC, v.43, p.2596-2601, 1995
- [4] FERREIRA, F. R.; CABRAL, J.R.S. Melhoramento genético. Abacaxi: tecnologia de produção e comercialização. Informe Agropecuário, Belo Horizonte, 1998, v.19,n.195, p.24-28.
- [5] HAARD, N.F. Physiologycal roles of peroxidase in postharvest fruits and vegetables. In: ORY, R.L; S.t ANGELO, A.T., Ed. Enzymes in food and beverages process, ACS Symposium Series, 1977. cap.9, p. 143-171.
- [6] HAMMER, F.E. Oxidoredutases. In: NAGODAWITHANA,T., REED, G (Ed) Enzymes in food processing, England: Academic Press, 1993, p.233-243.
- [7] HEMEDA, H.M.; KLEIN, B. P. Effects of naturally occuring antioxidants on peroxidase activity of vegetables extracts. Journal of Food Science, New York, v. 55, p. 184-185, 1990.
- [8] HOLSCHUCH, H.J. Isolamento, purificação e caracterização bioquímica da peroxidase de carambola (Averrhoa carambola,L.) 2000. 159 p. Tese (Doutorado em Ciência de Alimentos). Faculdade de Engenharia de Alimentos, Universidade Estadual de Campinas.
- [9] KHAN, A. A.; ROBINSON, D.S. Hydrogen donor specifity of mango isoperoxidases. Food Chemistry, Londres, v. 49, n. 4, p. 407-410, 1994.
- [10] LAMIKANRA, O; WATSON,M.A. Cantaloupe melon peroxidase: Characterization and effects of additives on activity. Nahrung-Food, Berlim, v.44, n.3, p.168-172, 2000.
- [11] LIMA, U. A. Agroindustrialização de frutas Piracicaba: Fundação de Estudos Agrários "Luiz de Queiroz", 1998,v.5, p.151.
- [12] LOURENÇO, E.J.; NEVES, V.A., Peroxidase solúvel de pêssego: Purificação parcial e propriedades. Ciênc. Tecnol. Aliment., Campinas, v.17, n.1. p.42-48,1997.
- [13] MC LELLAN K. M.; ROBINSON, D.S. Heat stability of peroxidases from orange. Food Chemistry, Londres,v. 13, p. 139-147, 1984.
- [14] MELLO, E.T.; CLEMENTE, E. Thermostability of crude extract of peroxidase from pineapple. Revista Unimar, Marília, v. 18, n. 4, p. 757-763, 1996.
- [15] MOULDING ,P.H., GRANT,H.F., McLELLAN,K.M., ROBINSON,D.S., Heat stability of soluble and ionically bound peroxidases extracted from apples. International Journal of Food Science and Technology, London,v.22, p.291-397,1987
- [16] RICHARDSON, T., HYSLOP,D.B. Enzymes. In: FENNEMA, O. R. Food chemistry, 2 ed. ,New York: Marcel Dekker, Inc. 1985, p. 451-452.
- [17] ROBINSON, D.S. Peroxidases and their significance in fruits and vegetables. In: FOX, P.F. (Ed), Food enzymology London and New York: Editora, p. 399-426, 1991.
- [18] SANTOS, E.R. Caracterização bioquímica da peroxidase e da polifenoloxidase de açaí (Euterpe oleraceae). 2002. 104p. Tese (Mestrado em Ciência de Alimentos) Faculdade de Engenharia de Alimentos, Universidade Estadual de Campinas.
- [19] SODA, I., HASEGAWA,T., SUZUKI,T., OGURA,N., Purification and some properties of peroxidase from kiwifruit. Agricultural and Biological Chemistry, Tokyo, v.55, n.6, p.1677-1678, 1991.
- [20] USBERTI FILHO, J. A.; SIQUEIRA, W. J.; SPIRONELLO,A.; TANAKA, M.A.S.; SIGRIST, J.M.M.; MARTINS, A.L.M.; BORTOLETTO, N.; TSUHAKO AT.; GUSHIKEN, A. IAC Gomo-de-mel Campinas: Instituto Agronômico de Campinas, 1999. (Folder)
- [22] VÁMOS-VIGYÁZÓ, L. Polyphenoloxidase and peroxidase in fruits and vegetable. CRC Criticals Reviews in Food Science and Nutrition, Cleveland, 1981, v.15, p. 49-127.
- [22] WHITAKER,J.R. Catalase and Peroxidase. Principles of enzymology for the food science, 2 ed., New York ,Marcel Dekker- Inc., 1994, p. 565-577.
Datas de Publicação
-
Publicação nesta coleção
17 Ago 2005 -
Data do Fascículo
Jun 2005
Histórico
-
Aceito
17 Mar 2005 -
Recebido
23 Abr 2003