Resumos
Os índices séricos de glicose e lipídios, a microbiota intestinal e a produção de ácidos graxos voláteis de cadeias curtas (AGV) foram determinados em ratos Wistar submetidos às dietas: padrão (AIN-P), padrão modificada (AIN-M) e às dietas contendo frações de parede celular de levedura: glicana insolúvel (GI), manana (M) e glicana mais manana (G+M), como única fonte de fibra alimentar. O fracionamento da parede celular (PC) foi realizado por processos físicos e químicos de extração, centrifugação e secagem em "spray dryer". Os índices séricos foram dosados através de "kits" comerciais. A microbiota e a produção de AGV foram determinadas nos conteúdos intestinais, incluindo cólon, ceco e reto. Considerando os níveis de colesterol no tempo (T0) e no tempo 28 (T28), as dietas AIN-P, AIN-M e M apresentaram efeito hipocolesterolêmico, tendo em vista que a composição das dietas eram de natureza hipercolesterolêmica. Em relação à glicose sérica, no tempo (T0) observou-se uma elevação geral da glicemia, sugerindo um efeito hiperglicêmico das dietas estudadas. A dieta G+M foi a que apresentou valores significantemente mais elevados de lipídios séricos no tempo T14, e os níveis mais baixos foram observados na dieta M e na dieta GI no T14 e nas dietas AIN-M e AIN-P. A dieta AIN-P foi a que apresentou valor significantemente mais elevado de triacilgliceróis nos tempos T14 e T28. Os níveis mais baixos nos tempos T14 foram constatados para as dietas G+M e GI e no tempo T28 para as dietas AIN-M e M. De um modo geral, não houve modificações significativas na microbiota intestinal dos animais em nenhuma das dietas. Dentre os AGV, o ácido acético foi o predominante, seguido do propiônico e do butírico, em todas as dietas estudadas.
parede celular; glicana insolúvel; manana; índices séricos
The blood serum indexes of glucose and lipids, the intestinal microbiota and the production of volatile fatty acids (VFA) were determined in Wistar rats which were fed a standard (AIN-P) diet, a modified standard (AIN-M) diet, and diets containing the following yeast cell wall fractions: insoluble glycan (IG), mannan (M), and a mixture of glycan + mannan (G+M) as the only source of dietary fiber. Fractionation of the cell wall was carried out by means of physicochemical extraction processes, centrifugation, and drying in a "spray dryer". Serum indexes were dosed by means of commercial kits and the influence of the fractions on the intestinal microbiota and the production of short-chain volatile fatty acids (VFA) were carried out by collecting intestinal contents (colon, cecum, and rectum). Considering the cholesterol levels at time zero (T0) and at time 28 (T28), diets AIN-P, AIN-M, and M presented a hypocholesterolemic effect considering the hypercholesterolemic nature of the diets. Regarding serum glucose, at the onset of the experiment (T0), a general increase in glycemia was observed which suggests a hyperglycemic effect of the examined diets. The G+M diet yielded the highest significant values of serum lipids at T14 and the lowest values were found in the M diet and the IG diet at T14 and in the AIN-M and AIN-P diets. The AIN-P diet yielded the highest significant values of triacylglycerols at T14 and T28. The lowest levels at T14 were found in the G+M and IG diets and at T28 for the AIN-M and M diets. In general, there were no significant modifications in the intestinal microbiota of the rats in any diet. Regarding the VFA, the acetic acid was predominant, followed by the propionic and butyric acids in all the tested diets.
cell wall; insoluble glycan; mannan; serum indexes
Influência de frações da parede celular de levedura (Saccharomyces cerevisiae) sobre os índices séricos de glicose e lipídios, microbiota intestinal e produção de ácidos graxos voláteis (AGV) de cadeias curtas de ratos em crescimento
Influence of yeast (Saccharomyces cerevisiae) cell wall fractions on serum indexes of glucose and lipids, intestinal microbiota and production of short-chain volatile fatty acids (VFA) in growing rats
Saula Goulart ChaudI; Valdemiro Carlos SgarbieriI, * * A quem a correspondência deve ser enviada ; Eduardo VicenteII; Neusely da SilvaII; Adriana Barreto AlvesII; José Alvaro Ribeiro de MattosII
IFaculdade de Tecnologia de Alimentos, Departamento de Alimentos e Nutrição, Universidade Estadual de Campinas UNICAMP, Rua Monteiro Lobato, 80, CEP 13083-970, Campinas - SP, Brasil, E-mail: sgarb@fea.unicamp.br
IICentro de Química de Alimentos, Instituto de Tecnologia de Alimentos ITAL
RESUMO
Os índices séricos de glicose e lipídios, a microbiota intestinal e a produção de ácidos graxos voláteis de cadeias curtas (AGV) foram determinados em ratos Wistar submetidos às dietas: padrão (AIN-P), padrão modificada (AIN-M) e às dietas contendo frações de parede celular de levedura: glicana insolúvel (GI), manana (M) e glicana mais manana (G+M), como única fonte de fibra alimentar. O fracionamento da parede celular (PC) foi realizado por processos físicos e químicos de extração, centrifugação e secagem em "spray dryer". Os índices séricos foram dosados através de "kits" comerciais. A microbiota e a produção de AGV foram determinadas nos conteúdos intestinais, incluindo cólon, ceco e reto. Considerando os níveis de colesterol no tempo (T0) e no tempo 28 (T28), as dietas AIN-P, AIN-M e M apresentaram efeito hipocolesterolêmico, tendo em vista que a composição das dietas eram de natureza hipercolesterolêmica. Em relação à glicose sérica, no tempo (T0) observou-se uma elevação geral da glicemia, sugerindo um efeito hiperglicêmico das dietas estudadas. A dieta G+M foi a que apresentou valores significantemente mais elevados de lipídios séricos no tempo T14, e os níveis mais baixos foram observados na dieta M e na dieta GI no T14 e nas dietas AIN-M e AIN-P. A dieta AIN-P foi a que apresentou valor significantemente mais elevado de triacilgliceróis nos tempos T14 e T28. Os níveis mais baixos nos tempos T14 foram constatados para as dietas G+M e GI e no tempo T28 para as dietas AIN-M e M. De um modo geral, não houve modificações significativas na microbiota intestinal dos animais em nenhuma das dietas. Dentre os AGV, o ácido acético foi o predominante, seguido do propiônico e do butírico, em todas as dietas estudadas.
Palavras-chave: parede celular; glicana insolúvel; manana; índices séricos.
ABSTRACT
The blood serum indexes of glucose and lipids, the intestinal microbiota and the production of volatile fatty acids (VFA) were determined in Wistar rats which were fed a standard (AIN-P) diet, a modified standard (AIN-M) diet, and diets containing the following yeast cell wall fractions: insoluble glycan (IG), mannan (M), and a mixture of glycan + mannan (G+M) as the only source of dietary fiber. Fractionation of the cell wall was carried out by means of physicochemical extraction processes, centrifugation, and drying in a "spray dryer". Serum indexes were dosed by means of commercial kits and the influence of the fractions on the intestinal microbiota and the production of short-chain volatile fatty acids (VFA) were carried out by collecting intestinal contents (colon, cecum, and rectum). Considering the cholesterol levels at time zero (T0) and at time 28 (T28), diets AIN-P, AIN-M, and M presented a hypocholesterolemic effect considering the hypercholesterolemic nature of the diets. Regarding serum glucose, at the onset of the experiment (T0), a general increase in glycemia was observed which suggests a hyperglycemic effect of the examined diets. The G+M diet yielded the highest significant values of serum lipids at T14 and the lowest values were found in the M diet and the IG diet at T14 and in the AIN-M and AIN-P diets. The AIN-P diet yielded the highest significant values of triacylglycerols at T14 and T28. The lowest levels at T14 were found in the G+M and IG diets and at T28 for the AIN-M and M diets. In general, there were no significant modifications in the intestinal microbiota of the rats in any diet. Regarding the VFA, the acetic acid was predominant, followed by the propionic and butyric acids in all the tested diets.
Keywords: cell wall; insoluble glycan; mannan; serum indexes.
1 Introdução
A biomassa de levedura (Saccharomyces sp.) tem sido produzida no Brasil em três setores industriais importantes: o setor sucroalcooleiro, com uma produção de aproximadamente 240 mil t/ano, como subproduto da produção de etanol19; o setor cervejeiro, contribuindo com cerca de 35.000 t/ano e o setor de panificação, com uma produção de 120 mil t/ano46. O Brasil é o maior produtor mundial de álcool de cana-de-açúcar, com uma produção de 12 milhões de metros cúbicos de álcool anidro e hidratado na safra de 1999/0026 e que utiliza levedura na transformação do açúcar em álcool19.
O fracionamento da levedura produz derivados que podem ser adicionados em alimentos. Alguns desses derivados são o autolisado, obtido pelo processo de autólise das células; o extrato de levedura e a parede celular (PC), obtidos pelo fracionamento do autolisado em fração solúvel (extrato) e insolúvel (parede celular) e, ainda, o concentrado protéico63.
A fração referente à parede celular integral da levedura é composta de polissacarídeos que podem servir como fonte de fibra dietética tendo sido considerada como agente hipocolesterolêmico2.
De acordo com SGARBIERI e PACHECO55, a ação da fibra alimentar na redução dos riscos de câncer de cólon pode ser atribuída a algumas propriedades: a) redução da exposição a agentes carcinogênicos, pelo aumento do bolo fecal ou diminuição do tempo de trânsito do bolo intestinal; b) redução da produção de ácidos biliares secundários (desoxicólico, litocólico), pela diminuição de bactérias produtoras de enzimas (7-a-desidroxilases) responsáveis pela conversão dos ácidos biliares primários (cólico e quenodesoxicólico) nos ácidos secundários, que são pró-carcinogênicos; c) efeito ligante da fibra a hormônios (estrógenos promotores de câncer de cólon e de mama); e d) produção de ácidos graxos de cadeias curtas que contribuem para o abaixamento do pH do bolo intestinal e desempenham papel fisiológico importante em nível de tecido epitelial e hepático.
Oligossacarídeos de manose (MOS), derivados de células de levedura (parede celular), têm proporcionado uma melhora na saúde e desempenho de animais monogástricos. Os MOS (manooligossacarídeos) podem bloquear a fixação de certas bactérias patogênicas na parede intestinal42.
As fibras apresentam grande importância na alimentação e na manutenção da saúde. Por isso, faz-se necessário avaliar e pesquisar mais sobre este componente alimentar e suas interações com outros componentes da dieta em nível metabólico. Tendo em vista que a parede celular de levedura é composta por carboidratos que auxiliam na redução do colesterol, é de interesse estudar a eficiência das frações obtidas (G+M, M e GI) da parede celular como fonte de fibra alimentar. Na tentativa de elucidar os efeitos da fibra contida na PC, o presente trabalho teve como objetivos: analisar sua influência sobre os índices séricos de glicose e lipídios, produção de ácidos graxos voláteis (AGV) de cadeias curtas e influência das frações G e M sobre a microbiota intestinal.
2 Material e métodos
2.1 Material
A biomassa de levedura (Saccharomyces sp.) coletada sem sofrer o processo de termólise foi recebida da usina São José, Zillo Lorenzetti (Macatuba - SP), em suspensão de aproximadamente 20% (p.v -1) de células. A higienização e posterior fracionamento das células em extrato de levedura (EX) e parede celular bruta (PC) na forma desidratada foram realizados como descrito por SGARBIERI et al.54.
A fração lipídica foi isolada da PC desidratada com etanol 95% na proporção de 1:2 (p.v -1) (2 extrações), n-hexano na proporção de 1:2 (p.v -1) (4 extrações). A combinação dos extratos obtidos com etanol e com n-hexano foi filtrada e concentrada em rotavapor, conforme metodologia descrita por KOLLAR et al.30 com algumas modificações, tais como: as extrações com etanol 95% (2 extrações), n-hexano (4 extrações) foram realizadas utilizando rotação de 14.000 g durante 20 minutos, à temperatura de 10 °C.
As frações da PC utilizadas neste trabalho foram obtidas seguindo a metodologia proposta por OTERO et al.44 a partir da parede celular desengordurada (Figura 1).
As frações obtidas em todo o processo de fracionamento, três repetições, foram reunidas e dialisadas (membrana MWCO 6000 a 8000 Da, 50 mm x 30 m, Thomas, Swedesboro - New Jersey - EUA) em água destilada a 4 °C, com agitação e troca de 3 vezes ao dia (volume 10 L) durante 3 dias. O objetivo da diálise foi eliminar o NaCl e compostos de baixo peso molecular (PM < 8000 Da). Em seguida, as amostras dialisadas foram liofilizadas ou desidratadas em "spray dryer" e pesadas para determinação do rendimento, sendo armazenadas a 18 °C para posterior realização dos estudos programados.
2.2 Ensaio com ratos
Foram utilizados para o estudo ratos machos Wistar adquiridos do Centro de Bioterismo da UNICAMP (CEMIB), com idade de 21 dias, os quais foram inicialmente pesados e separados em grupos. Cada grupo continha 8 animais que foram sacrificados nos tempos T14 e T28. Os ensaios biológicos tiveram duração de 28 dias.
Preparo das dietas
As dietas foram elaboradas seguindo-se as recomendações da AIN-93G49, com algumas modi-ficações: dieta controle com 17% de caseína e 5% de celulose (AIN-P); dieta controle modificada (AIN-M) com 10% de celulose comercial, adicionada de 1% de colesterol e 10% de gordura de coco. A gordura de coco contém elevada percentagem de ácidos graxos saturados (ácido láurico, ácido mirístico, ácido palmítico, ácido cáprico, ácido caprílico, etc.) e é freqüentemente usada em dietas experimentais semipurificadas39 com o objetivo de promover hipercolesterolemia.
As dietas experimentais foram preparadas contendo 10% de cada fração da PC, mais 1% de colesterol e 10% de gordura de coco, e foram denominadas dietas G+M, M ou GI, conforme a fração incorporada. Os outros nutrientes foram ajustados de acordo com a dieta controle (AIN-93G), utilizando-se caseína como fonte protéica (17% p.p-1).
Instalação do ensaio (animais, regime de alimentação, tratamentos, condições do biotério)
Os animais foram mantidos em gaiolas metabólicas individuais, com livre acesso às dietas e à água. Durante o ensaio, a temperatura do laboratório foi mantida em 22 ± 2 °C e a iluminação controlada, com períodos de luz e escuro de 12 horas.
Para a realização do ensaio foram selecionados 88 animais, dos quais 8 foram sacrificados no início do experimento (T0), após jejum de 16 horas, para coleta de sangue por punção cardíaca e extração de conteúdo intestinal (ceco, cólon e reto) para ensaios microbiológicos e análise dos ácidos graxos voláteis de cadeia curta (AGV). O plasma e o conteúdo do ceco, cólon e reto foram analisados, e os valores em T0, considerados como referência. Os demais foram distribuídos em 5 grupos de 16 animais. Oito animais de cada tratamento foram sacrificados após 14 dias (T14) e oito foram sacrificados aos 28 dias (T28) para as respectivas análises (coleta de sangue, ensaios microbiológicos e análises de ácidos graxos voláteis no conteúdo intestinal).
2.3 Determinações químicas e bioquímicas
A composição centesimal foi realizada para os seguintes materiais: parede celular (PC), glicana mais manana (G+M), manana (M) e glicana insolúvel (GI). Os cálculos foram feitos a partir da média de três repetições analíticas com estimativas de desvio padrão.
O sangue dos animais foi coletado por punção cardíaca, no início (T0), após 14d (T14) e no final do experimento (T28), após jejum de 16 horas. As amostras de sangue individuais foram deixadas em banho-maria a 37 °C por 30 minutos e a seguir centrifugadas a 2.500 rpm/15 minutos. Os soros, sobrenadantes, foram recolhidos para as análises bioquímicas.
Composição centesimal das frações
Os teores de umidade e de sólidos totais foram determinados segundo a A.O.A.C.1. Os sólidos totais foram obtidos pela diferença entre o peso total da amostra e o conteúdo em umidade, pela secagem em estufa a 105 °C até peso constante. O teor de cinza1 representou o resíduo que permaneceu após a incineração da amostra a 500-550 °C, com destruição da matéria orgânica. Os teores de fibra solúvel e insolúvel foram obtidos por método enzimático e gravimétrico48. O nitrogênio foi determinado pelo método de Kjeldahl semi-micro1 multiplicando-se o teor de N pelo fator 6,25 para obtenção do conteúdo de proteína bruta. Os lipídios polares e apolares (lipídios totais) foram determinados gravimetricamente após extração com uma mistura dos solventes (clorofórmio:metanol:água) na proporção de 10:20:0,8 e evaporação do solvente6.
Lipídios séricos totais
Os lipídios séricos foram determinados pelo método de FRINGS e DUNN18. Os lipídios séricos, incluindo os ácidos graxos insaturados livres e esterificados e o colesterol livre e seus ésteres, foram colocados a reagir com a vanilina em ácido fosfórico, primeiramente reagindo com ácido sulfúrico aquecido. O cromóforo rosa violáceo assim obtido foi lido espectrofotometricamente em 530 nm e foi proporcional à concentração dos lipídios totais da amostra; utilizou-se Kit CELM (Cia. Equipadora de Laboratórios Modernos, Barueri - SP).
Triacilgliceróis
Para a determinação de triacilgliceróis foi utilizado o método de BUCOLO e DAVID7. Utilizou-se Kit Labtest (Labcenter, Campinas - SP). Os triacilgliceróis foram extraídos com uma mistura de varsol, isopropanol e ácido sulfúrico, havendo separação em fases, com recuperação quantitativa dos triacilgliceróis na fase não-polar (superior), juntamente com as proteínas. Os triacilgliceróis extraídos foram saponificados a glicerol e ácidos graxos. O glicerol foi oxidado a formaldeído, formando o complexo dihidrolutidina (amarelo), através da reação de Hantzch.
Colesterol
Para a determinação do colesterol total utilizou-se o Kit Labtest (Labcenter, Campinas - SP). A determinação foi baseada na reação de Lieberman-Buchard e o método foi o descrito por HUANG et al.24.
Glicose sérica
Para a determinação de glicose sérica foi utilizado o método enzimático-colorimétrico (GOD-POD), segundo LOTT e TURNER34. Utilizou-se o Kit CELM (Cia. Equipadora de Laboratórios Modernos, Barueri - SP). A leitura foi realizada em espectrofotômetro a 505 nm.
Ácidos graxos voláteis de cadeias curtas (AGV)
A extração dos ácidos graxos foi feita a partir do conteúdo do ceco, cólon e reto de 4 animais de cada grupo, nos tempos T0, T14 e T28. O material cuidadosamente coletado foi tratado com etanol (40% v.v -1) mais formaldeído (1% v.v -1) e homogeneizado. O homogenato foi submetido à centrifugação (20.000 g, 15 minutos). O volume do sobrenadante foi medido e estocado em refrigerador ou congelador até a análise57. A quantificação dos ácidos graxos de cadeias curtas, acético, propiônico e butírico foi feita pelo método de COCHRANE11 com algumas modificações. Utilizou-se um cromatógrafo VARIAN 3700, equipado com detector de ionização de chama (FID) e coluna Megabore (AT-WAX, 30 m de comprimento, diâmetro interno 0,53 mm, espessura de filme 2,50 µm). Todos os resultados da análise cromatográfica foram expressos em miligramas por grama de conteúdo intestinal (base úmida).
As condições da análise cromatográfica foram as seguintes: temperatura da coluna - isotérmica 120 °C, após 8 minutos 220 °C por 10 minutos (para limpeza da coluna); temperatura do injetor 150 °C; temperatura do detector 230 °C; vazões - coluna: 30 µL por minuto (H2); injetor: split 30 mL por minuto; detector: H2, 30 mL por minuto (H2 da coluna). Ar: 300 mL por minuto. Make-up: 30 mL por minuto (N2). Sensibilidade do detector: 10-12 (A.mv -1).
Antes de cada injeção de amostra, foi injetado 1 µL de ácido fórmico (98%) para evitar o aparecimento de picos fantasmas. Após 2 minutos foi injetado 1 µL de amostra. Foram usados padrões para identificação dos ácidos graxos, com base nos tempos de retenção.
2.4 Análises microbiológicas
A coleta do conteúdo intestinal (cólon, ceco e reto) foi realizada em 4 animais de cada grupo nos tempos T14 e T28, utilizando-se pinças e tesouras estéreis. O material foi recolhido em placas de Petri estéreis e encaminhado ao laboratório de Microbiologia do Instituto de Tecnologia de Alimentos (ITAL) (não ultrapassando 8 horas após a coleta). Foram utilizadas jarras de anaerobiose contendo o Kit Anaerobac (Probac do Brasil) para o transporte das amostras, o que garantiu a atmosfera anaeróbica. Foi pesado 1,0 g do conteúdo intestinal (cólon, ceco e reto) e transferido assepticamente, com espátula estéril, para um tubo de ensaio contendo 9,0 mL de diluente, conforme metodologia descrita por TANAKA e MUTAI59. Em seguida, foram realizadas as diluições decimais necessárias e o plaqueamento em superfície (0,1 mL) nos meios específicos para cada microrganismo.
Contagem de microrganismos viáveis
A contagem de microrganismos viáveis foi realizada em meio de Caldo de Carne e Levedura com 0,2% glicose (MVL-G)59, incubação a 37 °C/48 horas em jarra de anaerobiose, utilizando sistema comercial de geração de atmosfera anaeróbica.
Contagem de bifidobactérias
Para a contagem de bifidobactérias foi utilizado o Meio 25 para Bifidobactérias (BIM-25)21,41, incubação a 37 °C/72 horas em jarra de anaerobiose, utilizando o sistema comercial de geração de atmosfera anaeróbica (GasPak Anaerobic System BBL 70304, Gas Generating Kit Oxoid BR 38, Anaerocult A Merck 13829).
Contagem de clostrídios
Para a contagem de clostrídios foi utilizado o Meio Reforçado para Clostrídio (RMC) (DIFCO 1808, Merck 5411, BBL 11566, Oxoid CM 149), incubação a 37 °C/48 horas em jarra de anaerobiose, utilizando sistema comercial de geração de atmosfera anaeróbica.
Contagem de bacteróides
A contagem de bacteróides foi realizada em Meio de Caldo de Carne e Levedura com 0,2% glicose (MVL-G)59 suplementado com 7,5 µg.mL-1 de vancomicina e 5 µg.mL-1 de gentamicina64, incubação a 37 °C/48 horas em jarra de anaerobiose, utilizando sistema comercial de geração de atmosfera anaeróbica.
Contagem de enterobactérias
Para a contagem de enterobactérias foi utilizado o Agar Desoxicolato sulfeto de Hidrogênio Lactose (DHL) (Merck 11435)64 e incubação a 37 °C/24 horas.
Contagem de enterococos
A contagem de enterococos foi realizada em Agar KF Streptococus (DIFCO 0496, Merck 10707, BBL 11313, OXOID CM 701)64 e incubação a 37 °C/48 horas.
2.5 Análise estatística
Os resultados foram analisados por meio da análise de variância (ANOVA) e as diferenças significativas entre as médias (p < 0,05) pelo teste de Tukey22, utilizando-se o programa Statistica: Basic Statistics and Tables.
3 Resultados e discussão
As frações extraídas da Parede Celular (PC) com maior rendimento corresponderam às mananas 25,1% e às glicanas 42,9%.
A literatura traz poucas referências sobre a quantidade e proporção de frações de polissacarídeos na parede celular de Saccharomyces cerevisiae. Além disso, três aspectos se destacam: a) são referências das décadas de 50 e 60; b) são analisadas células cultivadas em meio sintético de laboratório, em condições de crescimento ideais; e c) os dados referem-se exclusivamente a duas frações denominadas glicana e manana.
MACWILLIAM36 relata que as glicanas e as mananas representam 30 a 45% do peso seco da parede celular de levedura de cervejaria. Cita, ainda, que o valor médio para cada uma dessas frações é de 40%. ROSE51 afirma que 60 a 90% da parede celular de S. cerevisiae é composta por polissacarídeos. Assim, a literatura aponta para a existência de glicanas e mananas em proporções praticamente iguais na parede celular de S. cerevisiae e com teor total entre 60 a 90%.
A composição centesimal da PC de levedura e de suas respectivas frações, obtidas nesta pesquisa, está apresentada na Tabela 1. Pode-se observar que a composição centesimal da parede semipurificada é muito semelhante à relatada na literatura por vários pesquisadores do Brasil e do exterior14,45.
Na PC, o componente quantitativamente mais importante é a fibra (77,8%), com predominância de fibra solúvel (74%), permanecendo, mesmo depois de lavada exaustivamente com água, de 18 a 20% de proteínas, que são glicoproteínas estruturais8,61.
Resultados do presente estudo demonstraram também que a fibra se apresenta na forma predominante de fibra solúvel (70,3%) para as mananas (M) e 74% para a PC. A fração GI é representada por 75% de fibra insolúvel.
Manana e glicana insolúvel apresentaram cerca de 6% de proteína, enquanto que a fração G+M, por ainda conter as glicoproteínas, apresentou teor bem mais alto de proteína (21,4%).
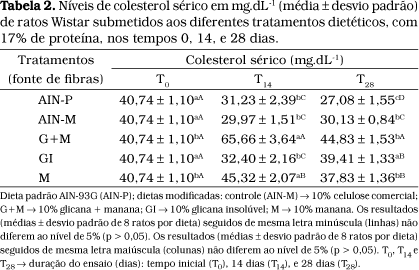
Na Tabela 2, estão apresentadas as concentrações obtidas de colesterol sérico para a média dos ratos submetidos aos vários tratamentos. Pode-se observar que a dieta G+M apresentou valor significativamente mais elevado nos tempos T14 e T28, enquanto a dieta M, apesar de ter produzido uma elevação em T14, revela nível abaixo do inicial em T28.
Comparando-se os níveis obtidos de colesterol no tempo zero (T0) e no tempo 28 (T28), nota-se que as demais dietas, com exceção da GI e G+M, apresentaram efeito hipocolesterolêmico (Tabela 2), considerando que a composição das dietas era de natureza hipercolesterolêmica.
MATHESON et al.37 estudando a atividade da enzima 7a-hidroxilase em experimentos realizados com ratos, observaram que a presença de fibra solúvel influenciou o metabolismo do colesterol, causando alterações no perfil dos ácidos biliares circulantes.
HORTON et al.23 verificaram, em experimentos realizados com hamsters, um efeito hipocolesterolêmico pela adição de 7,5% de psilium (fibra solúvel) à ração. Os autores atribuíram este efeito ao aumento da atividade da enzima 7a-hidroxilase, que é similar àquele produzido pela presença de 1% de colesteramina.
Em trabalho realizado por DERIVI e POURCHET-CAMPOS13, estudando duas variedades de feijões: feijão carioca (Phaseolus vulgaris) e feijão macassar (Vigna sinensis), a pectina foi identificada como um componente hipocolesterolêmico presente nas leguminosas. Os autores verificaram que o acentuado efeito hipocolesterolêmico apresentado pelo feijão carioca era devido à presença de um alto teor de pectina solúvel (1,46 g%), enquanto que este efeito não foi observado no feijão macassar que apresentava 0,64 g% de pectina solúvel em sua composição.
De acordo com EASTWOOD e KAY15, o efeito hipocolesterolêmico das fibras solúveis se deve à sua propriedade de hidratação no meio aquoso intestinal formando géis e ligações cruzadas com ácidos biliares, dificultando a reabsorção e aumentando a excreção desses ácidos, o que concorre para a diminuição do colesterol circulante.
Em relação aos níveis de glicose sérica (Tabela 3), observase que todas as dietas apresentaram valores significativamente maiores que T0 no tempo T14. Porém, observou-se após 28 dias (T28) uma diminuição dos níveis de glicose em todas as dietas. Os níveis mais baixos de glicose sérica foram observados na dieta AIN-P aos 14 dias (T14) e na dieta G+M aos 28 dias (T28). Comparando-se a glicose sérica no início do experimento (T0), observou-se, em todas as dietas estudadas, uma elevação geral da glicemia sugerindo efeito hiperglicêmico (Tabela 3).
JENKIN et al.28 observaram, em diferentes estudos in vitro, que a adição de fibra solúvel viscosa em bolsas de diálises diminuiu a difusão de glicose através da membrana.
Alguns estudos in vivo relatam que a suplementação com fibras viscosas diminui a resposta glicêmica frente a uma ingestão elevada de hidratos de carbono10,16,20,32,62. A causa deste efeito, segundo os autores, pode estar na ação dos polissacarídeos viscosos sobre as propriedades físicas do conteúdo intestinal, porém este mecanismo fisiológico não está totalmente esclarecido, já que existem outros fatores que podem contribuir para este fenômeno, tais como: o atraso no esvaziamento gástrico, que segundo alguns autores seria o principal fator na modificação da movimentação intestinal; a redução na velocidade de difusão da glicose nas células da mucosa e, por último, o aumento da viscosidade do conteúdo intestinal e a diminuição do acesso da enzima alfa-amilase a seu substrato.
Os resultados apresentados nesta investigação (Tabela 3) representam duas tendências consistentes e opostas, nos dois períodos considerados. No período inicial de duas semanas (T0-T14), houve um aumento significativo da glicose sérica para todos os tratamentos; já no período (T14-T28), houve uma diminuição significativa e igualmente consistente em todos os tratamentos, exceto o tratamento AIN-P para os níveis de glicose sérica.
Uma tentativa de explicação para essa inversão de tendência procura conciliar os dados da Tabela 3 com dados da literatura. No período T0-T14, os ratos eram jovens (recém desmamados), provavelmente com suas barreiras intestinais ainda não totalmente desenvolvidas. A introdução a uma dieta artificial, rica em carboidratos e em fibras induziu a uma rápida absorção de glicose resultando em significativa elevação de seus níveis séricos. É provável também que neste curto período (2 semanas) de exposição às dietas a barreira de gel que dificulta a absorção de glicose, ainda não tivesse sido completamente formada, permitindo uma absorção rápida e significativa de glicose, em todas as dietas. No período T14-T28, a barreira intestinal natural dos ratos deve ter atingido um estágio de maior maturação e maior seletividade quanto à absorção de nutrientes, além do que, a camada de gel protetor formada pelas fibras, particularmente as fibras solúveis, deve ter-se consolidado, passando a oferecer maior obstáculo para absorção da glicose, resultando em diminuição significativa da glicemia em todas as dietas, exceto na dieta padrão (AIN-P) em que a glicemia continuou aumentando, provavelmente pelo fato desta dieta conter apenas 5% de celulose, como fibra. As fibras insolúveis, em concentração elevada, aumentam o volume fecal e reduzem a absorção de glicose3,9,47. Esta explicação, embora teórica, e um tanto especulativa, harmoniza os dados aqui apresentados com os resultados da literatura.
A Tabela 4 apresenta as concentrações obtidas de lipídios séricos dos ratos submetidos aos diferentes tratamentos e demonstra que a dieta G+M foi a que apresentou valor significativamente mais elevado no tempo T14. No tempo T28, as dietas G+M e GI se igualaram apresentando os valores mais elevados. Os níveis mais baixos de lipídios séricos foram observados na dieta M e na dieta GI no T14 e nas dietas AIN-M e AIN-P, seguida pela dieta M no T28.
Na dieta GI foi observado que não houve variações significativas nos níveis de lipídios séricos nos tempos T14 e T28. Porém, em relação às dietas AIN-P, AIN-M, M e G+M observou-se uma diminuição nos níveis de lipídios séricos aos 28 dias (T28).
Considerando o tempo zero (T0) e T28, todas as dietas provocaram uma queda dos índices lipidêmicos, apesar da natureza hiperlipidêmica da composição das dietas, sugerindo uma ação hipolipidêmica dos vários tipos de fibras que compuseram as dietas.
Estudos têm demonstrado que componentes da dieta, como fibras de grãos de leguminosas e outros vegetais apresentaram resposta na alteração do metabolismo lipídico, em humanos e animais de experimentação, com redução dos lipídios circulantes e aumento da excreção fecal de ácidos biliares4,17,25,29,31.
Dessa forma, outros estudos revelaram que a inclusão de 5% de fibra (farelo de trigo, soja e milho) em dietas hipercolesterolêmicas contendo 1% de colesterol, reduziu os níveis de lipídios totais do plasma e dos tecidos hepático e cardíaco de ratos machos Wistar durante um período de 4 semanas de alimentação60.
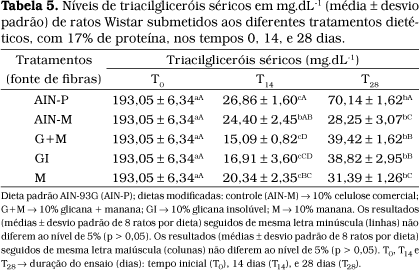
Os resultados obtidos na determinação dos níveis de triacilgliceróis demonstraram que a dieta AIN-P foi a que apresentou valor significativamente mais elevado nos tempos T14 e T28 (Tabela 5). Os níveis mais baixos de triacilgliceróis nos tempos T14 foram constatados para as dietas G+M e GI e no tempo T28 para as dietas AIN-M e M. Observou-se também que aos 28 dias (T28) houve uma tendência à elevação dos níveis de triacilgliceróis séricos em todos os tratamentos analisados, quando comparados com o T14, embora ainda tivessem permanecido significativamente inferiores aos níveis do tempo T0, sugerindo mais uma vez um efeito hipolipidêmico das dietas, que pode ser atribuído à fração fibra.
Resultados semelhantes foram encontrados em estudos realizados por ROBBINS e SEELY50, com 20 ratos albinos (10 machos e 10 fêmeas) que receberam dietas hipercolesterolêmicas (1% de colesterol) com adição de 5 e 20% de celulose, ou 20% de parede celular de levedura (b-glicana), por um período de 5 meses, no qual se constatou que a dieta com 20% de parede celular (b-glicana) reduziu os níveis de triacilgliceróis quando comparada às dietas contendo 5 ou 20% de celulose.
Os resultados reportados por ROBBINS e SEELY50 foram importantes para mostrar a capacidade da fibra de levedura em baixar os níveis de triacilgliceróis circulantes em ratos, embora não se possam fazer comparações diretas entre os resultados reportados com os apresentados neste trabalho, por se tratar da parede celular íntegra e não de frações da PC, como investigada no presente trabalho, além das concentrações usadas nas dietas terem sido diferentes nos dois trabalhos.
Pelos resultados obtidos nas análises microbiológicas, constatou-se que não houve variação significativa na contagem de bactérias anaeróbicas viáveis, bifidobactérias, enterococos e lactobacilos, quando comparadas às várias dietas empregadas durante os tempos T0, T14 e T28, como também não se observou variação estatística significativa entre os vários tratamentos (Tabelas 6 e 7).
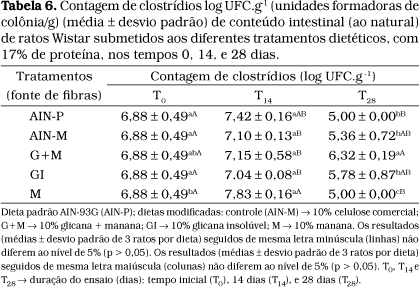
A importância em se investigar a presença de clostrídios baseia-se no fato de que os mesmos são bactérias putrefativas e patogênicas que produzem componentes tóxicos no cólon, como: amônia, aminas, nitrosaminas, fenóis, cresóis, indol, ácidos biliares secundários e agliconas. A concentração desses compostos é baixa no cólon, porém seus efeitos tóxicos não podem ser ignorados por estarem presentes no intestino e em contato com a membrana da mucosa intestinal por longo período na vida humana40.
No presente estudo, foi observada diminuição em relação à contagem de clostrídios no tempo T28 para as dietas AIN-P, AIN-M, GI e M. A dieta G+M foi a que apresentou valor relativo mais elevado no T28 (Tabela 6) não diferindo do T0 . Exceção feita à dieta G+M: observou-se diminuição de clostrídios no T28 em relação a T-0 após ter havido ligeira elevação no tempo T14.
Em relação à contagem de enterobactérias (Tabela 7), foi constatado aumento significativo em todas as dietas analisadas no T14 e no T28 em relação ao T0. O maior aumento ocorreu com a dieta M no T14. Contudo, observou-se que no T28 ocorreu diminuição desse valor para a dieta M, permanecendo significativamente superior ao T0. O menor aumento foi verificado na dieta GI no T14, valor que permaneceu no T28.
A microbiota intestinal é relativamente estável em indivíduos saudáveis, podendo ser alterada por vários fatores endógenos, como: a disponibilidade de nutrientes, tipo de dieta, pH do lúmen intestinal, diarréia, e por fatores exógenos, como: terapia com antibióticos, tensão emocional, desordem do sistema imunológico e doenças do fígado. As enterobactérias possuem como produtos finais do seu metabolismo o ácido acético, fórmico e butírico, e os distúrbios no ecossistema intestinal são geralmente caracterizados pelo aumento na contagem de bactérias, principalmente enterobactérias no intestino delgado, havendo redução das bactérias benéficas como bifidobactérias58.
Os principais produtos do metabolismo dos prebióticos são os AGV, (acetato, propionato e butirato) e os gases (dióxido de carbono, metano e hidrogênio)12,43. Esses ácidos graxos de cadeia curta (AGV) são produtos intermediários e finais da degradação microbiana endógena e exógena, sendo componentes derivados do trato gastrointestinal de todas as espécies de mamíferos, embora a relativa importância de sua produção varie de espécie para espécie. Essa produção se dá através da ação de várias espécies bacteria-nas e através de diferentes vias metabólicas38. Acredita-se que os AGV sejam eficientemente absorvidos e utilizados pelas células epiteliais humanas, estimulando a absorção de sais e água, o crescimento de células epiteliais e a motilidade intestinal53. A quantidade e tipo de AGV produzido no cólon depende do tipo de carboidrato e da composição da microbiota intestinal52,53.
Em se tratando do acetato, propionato e butirato, sabe-se que os mesmos são produzidos pela fermentação da fibra solúvel no intestino e podem ser utilizados como substrato energético pelas células intestinais ou ser absorvidos pela mucosa intestinal, passando para a corrente sangüínea. O ácido acético é o único dos ácidos que alcança a circulação sistêmica podendo ser utilizado como fonte de energia na lipogênese5,35. O ácido propiônico é metabolizado no fígado e é o único dos ácidos graxos voláteis (AGV) com ação gliconeogênica, podendo influenciar algumas fases do metabolismo hepático, como a síntese de colesterol, bem como pode produzir, por apoptose, a morte de células cancerígenas no colo e no reto27, o ácido butírico alcança muito pouco o fígado, e é o ácido graxo menos utilizado como fonte de energia para o enterócito colônico podendo, entretanto, apresentar ação antiinflamatória, agindo sobre o sistema imunológico e antitumoral promovendo apoptose de células cancerígenas e hiperacetilação da histona H4 e a estabilização de oncogenes56.
Juntos, os AGV apresentam implicações positivas na prevenção do câncer de cólon52. Especialmente o butirato, que vem sendo estudado quanto ao seu efeito no processo biológico, envolvendo a carcinogênese33. O butirato é a maior fonte de energia para as células epiteliais do cólon, e uma baixa concentração deste composto causa alteração celular, podendo inibir o carcinoma de cólon43,58.
Comparando-se as dietas estudadas (Figura 2), pode-se observar que a dieta AIN-M foi a que produziu a maior quantidade de ácido acético (2,95 mg.g -1 de conteúdo intestinal) no T14; a dieta M foi a que produziu a maior quantidade de ácido propiônico (1,56 mg.g -1 de conteúdo intestinal) e de ácido butírico (0,53 mg.g -1 de conteúdo intestinal) no T14. No T28, a dieta AIN-M foi a que apresentou maior quantidade de ácido acético (2,26 mg.g -1 de conteúdo intestinal); a dieta M foi a que apresentou a maior quantidade de ácido propiônico (1,60 mg.g -1 de conteúdo intesti-nal) e as dietas G+M, GI e M as que apresentaram as maiores quantidades de ácido butírico (0,58 mg.g -1; 0,57 mg.g -1; 0,58 mg.g -1 de conteúdo intestinal) respectivamente.
Em relação aos tempos T0 e T28, constatou-se que houve um aumento significativo de ácidos graxos voláteis (AGV) de cadeia curta em todas as dietas estudadas. O ácido acético foi o predominante, seguido do propiônico e do butírico (Figura 2).
4 Conclusões
Os resultados encontrados e discutidos nesta pesquisa permitiram concluir que: a parede celular de levedura (Saccharomyces cerevisiae) parcialmente purificada e suas frações (glicana e manana) são ricas em fibras solúveis (manana) e insolúveis (glicana); as frações glicana insolúvel, manana ou glicana mais manana quando utilizadas na concentração de 10% das dietas hipercolesterolêmicas para ratos, promoveram consistentemente a redução dos níveis séricos de colesterol, triacilgliceróis e lipídios totais evidenciando propriedades hipolipidêmicas; em todas as dietas as frações de levedura promoveram drástica elevação de glicose (hiperglicemia) nos primeiros 14 dias da dieta, seguindo-se uma queda da glicemia aos 28 dias e mantendo-se ainda alta em relação ao tempo zero (T0); os ácidos graxos voláteis (acético, propriônico, butírico) aumentaram significativamente no conteúdo intestinal dos ratos que receberam dietas com os vários tipos de fibra. A microbiota intestinal variou muito pouco em função dos tipos de fibra, observando-se diminuição na contagem de clostrídeos nas dietas contendo glicana insolúvel e manana. O estudo contribuiu para mostrar alguns benefícios bioquímico-nutricionais importantes das fibras provenientes de levedura permitindo ampliar o leque de aplicações desse material ainda muito pouco utilizado no Brasil.
Agradecimentos
Os autores agradecem à FAPESP (Fundação de Amparo à Pesquisa de São Paulo) pelo apoio financeiro e pela bolsa de estudos concedida à Saula Goulart Chaud. Agradecem também à Copersucar pelo apoio técnico e financeiro.
Recebido para publicação em 4/7/2006
Aceito para publicação em 23/4/2007 (001787)
- 1. A.O.A.C. Association of Official Agricultural Chemists, official methods of analysis. HORWITZ, W. (ed.), 17 ed., Gaithersburg, Maryland, 2000.
- 2. ABREU, J.; MILLÁN N. Effect of addition of brewer's yeast to soy protein and casein on plasma cholesterol levels of rabbits. Archivos Latinoamericanos de Nutrición v. 44, n. 1, p. 18-22, 1994.
- 3. AREAS, M. A.; REYES, F. G. R. Fibras alimentares. International Life Sciences - Seção Regional Brasil, São Paulo, v. iv, n. 3, p. 1-2, 1995.
- 4. ARVILL, A.; BODIN, L. Effect of short-term ingestion of Konjac glucomannan on serum cholesterol in healthy men. American Journal of Clinical Nutrition, Bethesda, v. 61, n. 3, p.585-589, 1995.
- 5. BASSON, M. D.; SGAMBATI, S. A. Effects of short-chain fatty acids on human rectosigmoid mucosal colonicyte brush-border enzymes. Metabolism, Amsterdam, v. 47, n. 2, p. 133-134, 1998.
- 6. BLIGH, E. G.; DYER, W. J. A rapid method of total lipid extraction and purification. Canadian Journal of Biochemistry and Physiology, Ottawa, v. 37, n. 8, p. 911-917, 1959.
- 7. BUCOLO, G.; DAVID, E. Quantitative determination of serum triglycerides by the use of enzymes. Clinical Chemistry, Baltimore, v. 19, n. 5, p.476-482, 1973.
- 8. CAMERON, D. R.; COOPER, D. G.; NEUFELD, R. J. The mannoprotein of Saccharomyces cerevisiae is an effective bioemulsifier. Applied and Environmental Microbiology, Washington, v. 54, n. 6, p. 1420-1425, 1988.
- 9. CAVALCANTI, M. L. F. Fibras Alimentares. Revista de Nutrição, Puccamp, Campinas, v. 2, n.1, p. 88-97, 1989.
- 10. CHERBUT, C.; et al. Involvement of small intestinal mobility in blood glucose response to dietary fiber in man. British Journal of Nutrition, Cambridge, v. 71, n. 5, p. 675685, 1994.
- 11. COCHRANE, G. C. A review of the analysis of free fatty acids. Journal of Chromatographic Science, Niles, v. 13, n. 9, p. 440447, 1975.
- 12. CUMMINGS, J.; MACFARLANE, G.; ENGLYST, H. Prebiotic digestion and fermentation. American Journal of Clinical Nutrition, New York, v. 73, p. 4155-4205, 2001.
- 13. DERIVI, S. C. N.; POURCHET-CAMPOS, M. A. Ação da pectina da fração fibra de leguminosa sobre as taxas de colesterol sérico em coelhos. Ciência e Tecnologia de Alimentos, Campinas, v. 4, p. 130-138, 1984.
- 14. DZIEZAK, J. D. (Ed.). Yeasts and yeast derivatives: Definitions, characteristics, and processing. Food Technology, Chicago, v. 41, n. 2, p. 104-112, 119-120, 1987a.
- 15. EASTWOOD, M. A.; KAY, M. R. Hypothesis for action of dietary fiber along the gastrointestinal tract. American Journal of Clinical Nutrition, New York, v. 32, n. 2, p. 364-367, 1979.
- 16. ELLIS, P. R.; et al. The effect of high-molecular-weight guar gum on net apparent glucose absorption and net apparent insulin and gastric inhibitory polypeptide production in the growing pig: Relationship to rheological changes in jejumal digestion. British Journal of Nutrition, Cambridge, v. 74, p. 539-556, 1995.
- 17. FELDMAN, E. B. Fruits and vegetables and the risk of stroke. Nutrition Review, New York, v. 59, n. 1, p. 24-27, 2001.
- 18. FRINGS, C. S.; DUNN, R. T. A colorimetric method for determination of total serum lipids based on the sulfo-phospho-vanillin reaction. American Journal of Clinical Pathology, Philadelphia, v. 53, n. 1, p. 89-91, 1970.
- 19. FURCO, A. M. Produção de biomassa de levedura em destilarias de álcool. In: "WORKSHOP" sobre produção de biomassa de levedura: utilização em alimentação humana e animal. Anais... p. 52-58, 1996. Instituto de Tecnologia de Alimentos, Campinas, SP.
- 20. GATTI, E.; et al. Effects of guar enriched pasta in the treatment of diabetes and hiperlipidemia. Annals of Nutrition and Metabolism, Switzerland, v. 28, n. 1, p. 1-10, 1984.
- 21. GIBSON, G. R.; WANG, X. Regulation effects of bifidobacteria on the growth of other colonic bacteria. Journal of Applied Bacteriology, Cambridge, v. 77, n. 4, p. 412-420, 1994.
- 22. GOMES, F. P. Curso de estatística experimental 10 ed., São Paulo: Nobel, 430 p. 1982.
- 23. HORTON, J. D.; CUTHBERT, J. A.; SPADY, D. K. Regulation of hepatic 7 alpha hydroxylase expression by dietary psillium in the hamster. Journal of Clinical Investigation, New York, v. 93, n. 5, p. 2084-2092, 1994.
- 24. HUANG, T. C.; CHEN, C. P.; WEFLR, V.; RATTERY, A. A. A stable reagent for the Lilberman-Buchard reaction. Analytical Chemistry, Washington, v. 33, n. 10, p. 1405-1407, 1961.
- 25. HYUN, I. O.; SUN, Y. L. A study on nutrition characteristics of common Korean dietary fiber rich foods. Journal of the Korean Society of Food Science and Nutrition, Pusan, v. 27, n. 2, p. 296304.
-
26IEE - INSTITUTO DE ELETROTÉCNICA E ENERGIA DA UNIVERSIDADE DE SÃO PAULO. Cana-de-açúcar no Brasil online.. extraído em: 26.03.04. Disponível em: <http://infoener.iee.usp.br/scripts/biomassa/br_cana.asp>
- 27. JAN, G.; et al. Proprionibacteria induce apoptosis of colorectal carcinoma cells via short-chain fatty acids acting on mitochondria. Cell Death and Differentiation, v. 9, p. 179-188, 2002.
- 28. JENKINS, D. J. A.; et al. Slow release carbohydrate: mechanism of action of viscous fibers. Journal of Clinical Nutrition Gastroenterology, New York, v. 1, p. 237-241, 1986.
- 29. JENKINS, D. J. A.; KENDALL, C. W. C.; RANSOM, T. P. P. Dietary fiber, the evolution of the human diet and coronary heart disease. Nutrition Research, Larrytown, v. 18, n. 4, p. 633-652, 1998.
- 30. KOLLAR, R.; STURKIK, E.; SAJBIDOR, J. Complete fractionation of Saccharomyces cerevisiae biomass. Food Biotechnology, New York, v. 6, n. 3, p. 225-237, 1992.
- 31. KRITCHEVSKY, D. Cereal fiber and lipidemia. Cereal Foods World, Philadelphia, v. 42, n. 2, p. 81-85, 1997.
- 32. LECLERE, C. J.; et al. Role of viscous guar gum in lowering the glycemic response after a solid a meal. American Journal of Clinical Nutrition, New York, v. 59, n. 4, p.914-921, 1994.
- 33. LHOSTE, E. F.; et al. The fermentation of lactose in rats inoculated with clostridium paraputrificum influences the activities of liver and intestinal xenobiotic-metabolising enzymes. Journal of the Science of Food and Agriculture, London, v. 81, n. 14, p. 3671404, 2001.
- 34. LOTT, J. A.; TURNER, K. Evaluation of Trinder's glucose oxidase method for measuring glucose in serum and urine. Clinical Chemistry, Easton, v. 21, n. 12, p.1754-1760, 1975.
- 35. MACFARLANE, G. T.; CUMMINGS, J. H. The colonic flora, fermentation and large bowel digestive function. In: PHILLIPS, S.F.; PEMBERTON, J.H.; SHORTER, R.G. (eds.) The large Intestine: Physiology, Pathophysiology and Disease. New York: Raven Press, 1991.
- 36. MACWILLIAM, I. C. The structure, synthesis and functions of the yeast cell wall - A review. Journal of the Institute of Brewing, London, v. 76, n. 6, p. 524-535, 1970.
- 37. MATHESON, H. B.; COLÓN, I. S.; STORY, J. A.; Cholesterol 7a-hydroxylase activity is increased by dietary modification with psyllium hydrocolloid, pectin, cholesterol and chlolestyramine in rats. Journal of Nutrition, Bethesda, v. 125, n. 3, p. 454-458, 1995.
- 38. MIDTVEDT, T. Microbial Functional Activities. In: HANSON, A.; YOLKEN, R. Probiotics other nutrition factors, and intestinal microflora Lippincott-Raven, Philadelphia, 1999, v. 42, p. 7996.
- 39. MILLÁN, N.; ABREU, J. Effect of the type of dietary fat on cholesterolemia in rabbits fed brewer's yeast. Archivos Latinoamericanos de Nutrición, Caracas, v. 46, n. 1, p. 1-17, 1996.
- 40. MIZOTA, T. Functional and nutritional foods containing bifidogenic factors. Bulletin of the International Dairy Federations, Brussels, v. 313, p. 31-35, 1996.
- 41. MUNOA, F. J.; PARES, R. Selective medium for isolation and enumeration of Bifidobacterium spp. Applied and Environmental Microbiology, Washington, v. 54, n. 7, p. 17151718, 1988.
- 42. NEWMAN, K. E.; JACQUES, K.; BUEDE, R. Effect of mannanoligosaccharide on performance of calves fed acidified and non-acidified milk replacer. Journal Animal Science, Chicago, v. 71, p. 271, 1993.
- 43. O'SULLIVAN, M. G. Metabolism of bifigogenic factors by gut flora. Bulletin of the international Dairy Federation, Brussels, v. 313, p. 23-30, 1996.
- 44. OTERO, M. A.; et al. A process for the complete fractionation of baker's yeast. Journal of Chemistry Technology and Biotechnology, London, v. 67, n. 1, p. 6771, 1996.
- 45. PACHECO, M. T. B.; CABALLERO-CÓRDOBA, G. M.; SGARBIERI, V. C. Composition and nutritive value of yeast biomass and yeast protein concentrates. Journal of Nutritional Sciences and Vitaminology, Tokyo, v. 43, n. 6, p. 601-612, 1997.
- 46. PEIXOTO, N. Processamento de produtos de biomassa de levedura para alimentação humana: potencial, mercado interno e externo. In: "WORKSHOP" sobre produção de biomassa de levedura: utilização em alimentação humana e animal, 1996, Campinas. Anais... Campinas: Instituto de Tecnologia de Alimentos, 1996. p. 90-98.
- 47. PERIAGO, M. J.; et al. Componentes de la fibra dietetica y sus efeitos fisiológicos. Revistas Espanhola de Ciência y Tecnologia de Alimentos, Valência, v. 33, n. 3, p.229-247, 1993.
- 48. PROSKY, L; et al. Determination of insoluble, soluble and total dietary fiber in foods and food products: interlaboratory study. Journal Association of Official Analytical Chemists, Gaithersburg, v. 71, n. 5, p. 1017-1023, 1988.
- 49. REEVES, P. G.; NIELSEN, F. H.; FAHEY, J. G. C. AIN-93G purified diets for laboratory rodents: final report of the American Institute of Nutrition ad hoc writing committee on the reformulation of the AIN-76A rodent diet. Journal of Nutrition, Philadelphia, v. 123, n. 11, p. 1939-1951, 1993.
- 50. ROBBINS, E. A; SEELEY, R. D. Cholesterol lowering effect of dietary yeast and yeast fractions. Journal of Food Science, Chicago, v. 42, n. 3, p. 694-698, 1977.
- 51. ROSE, A. H. Composition of the envelope layer of Saccharomyces cerevisiae in relation to floculation and ethanol tolerance. Journal of Applied Bacteriology Symposium Supplement. Oxford, v. 74, supp. 22, p. 1105-1185, 1993.
- 52. RYCROFT, C. E.; et al. A comparative in vitro evaluation of the fermentation properties of prebiotic oligosaccharides. Journal of Applied Microbiology, London, v. 91, p. 878-887, 2001.
- 53. SAKO, T.; MATSUMOTO, K.; TANAKA, R.; Recent progress on research and application of non-digestible galacto-oligosaccharides. International Dairy Journal, Barking, v. 9, n. 1, p. 69-80, 1999.
- 54. SGARBIERI, V. C.; et al. Produção piloto de derivados de levedura (Saccharomyces sp.) para uso como ingredientes na formulação de alimentos. Brazilian Journal of Food Technology, Campinas, v. 2, n. 1/2, p. 119125, 1999.
- 55. SGARBIERI, V. C.; PACHECO, M. T. B. Alimentos funcionais fisiológicos. Brazilian Journal of Food Technology, Campinas, v. 2, n. 1/2, p. 7-19, 1999.
- 56. SMITH, J. C.; YOKOHAMA, W. H.; GERMAN, J. B. Dietary butyric acid-implications for gene expression. CRC Critical Reviews in Food Science and Nutrition, v. 38, p. 259-297, 1998.
- 57. SPILLER, G. A.; et al. Effect of purified cellulose, pectin, and bow-residue diet on fecal volatile fatty acids, transit time, and fecal weight in humans. American Journal of Clinical Nutrition, Bethesda, v. 33, n. 4, p. 754-759, 1980.
- 58. SUSKOVIC, J.; et al. Role of lactic acid bacteria and bifidobacteria in synbiotic effect. Food Tecnology and Biotechnology, Ljubljana, v. 39, n. 3, p. 227-235, 2001.
- 59. TANAKA, R.; MUTAI, M. Improved medium for selective isolation and enumeration of Bifidobacterium Applied and Environmental Microbiology, Washington, v. 40, n. 5, p. 866 869, 1980.
- 60. UBEROI, S. K.; VADHERA, S.; SONI, G. L. Role of dietary fiber from pulses and cereals as hypocholesterolemic and hypolipidemic agent. Journal of Food Science and Technology, London, v. 29, n. 5, p. 281-283, 1992.
- 61. VUKOVIC, R.; HUNDINA-DOM LADO VEC, M.; MRSA, V. Structure of the Saccharomyces cerevisiae cell wall. Croatica Chemica Acta, Zagreb, v. 68, n. 3, p. 597-605, 1995.
- 62. WOOD, P. J. Physiochemical characteristics and physiological properties of oat (1®3), (1®4)-b-D-glucan. In: Oat bran (WOOD, P. I. eds.) Minnesota: A.A.C.C., 163 p. 1993.
- 63. YAMADA, E. A.; SGARBIERI, V. C. Yeast (Saccharomyces cerevisiae) protein concentrate: preparation, chemical composition and nutritional functional properties. Journal of Agricultural and Food Chemistry, Washington, v. 53, n. 10, p. 3931-3936, 2005.
- 64. YOSHIOKA, H.; ISEKI, K.; FUJITA, K. Development and difference of intestinal flora in the neonatal period in breast-fed and bottle-fed infants. Pediatrics, Elk Grove Village, v. 72, n. 3, p. 317-321, 1983.
Datas de Publicação
-
Publicação nesta coleção
12 Set 2007 -
Data do Fascículo
Jun 2007
Histórico
-
Aceito
23 Abr 2007 -
Recebido
04 Jul 2006