Resumos
O isolamento e a identificação de antioxidantes naturais, extraídos de plantas, contribuem para a descoberta de novas fontes de compostos químicos. A alfavaca (Ocimum gratissimum L.) é uma planta conhecida por seus aspectos medicinais e pelo uso na culinária. A atividade antioxidante do extrato bruto e do óleo essencial das folhas de alfavaca foi comprovada através do método do tiocianato férrico. A porcentagem de inibição da oxidação lipídica foi de 96,89% para o extrato bruto e de 92,44% para o óleo essencial, ambos na concentração de 0,02%. O extrato bruto foi purificado através da cromatografia em coluna com sílica-gel e fase móvel hexano:acetato de etila em diferentes proporções. Para a identificação, foram utilizadas análises espectrais (infravermelho, ressonância magnética de hidrogênio e carbono 13). A substância isolada foi o eugenol, que apresentou 86,56% de atividade antioxidante. Alguns constituintes do óleo essencial foram caracterizados por cromatografia de fase gasosa, sendo o eugenol o principal componente (53,90%). Desta forma, a alfavaca apresenta-se como uma nova fonte de eugenol e, conseqüentemente, de antioxidante natural.
antioxidante; eugenol; alfavaca; oxidação lipídica
The isolation and identification of natural antioxidants from plants contribute to the discovery of new sources of chemical compounds. Wild basil (Ocimum gratissimum L.) is used as a herbal medicine and also as a culinary spice. The antioxidant activity of wild basil leaf crude extract and essential oil was confirmed by the ferric thiocyanate method. The crude extract showed 96.89% inhibition of lipid oxidation, while the essential oil showed 92.44% inhibition, both in a 0.02% concentration. The crude extract was purified by column chromatography using silica gel and different proportions of hexane:ethyl acetate as an eluant. The plant’s chemical compounds were identified by spectral analyses using NMR (hydrogen and 13C) and infrared spectroscopy. The isolated substance was eugenol, which presented antioxidant activity of 86.56%. Some of the constituents of the essential oil were characterized by gas chromatography, which showed eugenol as the main component (53.90%). It was concluded that wild basil is a new source of eugenol and, hence, of natural antioxidant.
antioxidant; eugenol; wild basil; lipid oxidation
Estudo da atividade antioxidante do extrato e do óleo essencial obtidos das folhas de alfavaca (Ocimum gratissimum L.)
Study of the antioxidant activity and essential oil from wild basil (Ocimum gratissimum L.) leaf
Cíntia Alessandra Matiucci PereiraI, II,* * A quem a correspondência deve ser enviada ; June Ferreira MaiaI, III
IUniversidade Federal de Viçosa, Departamento de Tecnologia de Alimentos, Av. Ph Rolfs, s/n, CEP 36571-000, Viçosa - MG, Brasil
IICentro Universitário Central Paulista UNICEP, Av. Miguel Petroni, 5111, CEP 13563-470, São Carlos - SP, Brasil,
E-mail: matiucci@yahoo.com.br
IIICentro Universitário Vila Velha UVV, Avenida Comissário José Dantas de Mello, 21, Boa Vista I, CEP 29102-920, Vila Velha - ES, Brasil
RESUMO
O isolamento e a identificação de antioxidantes naturais, extraídos de plantas, contribuem para a descoberta de novas fontes de compostos químicos. A alfavaca (Ocimum gratissimum L.) é uma planta conhecida por seus aspectos medicinais e pelo uso na culinária. A atividade antioxidante do extrato bruto e do óleo essencial das folhas de alfavaca foi comprovada através do método do tiocianato férrico. A porcentagem de inibição da oxidação lipídica foi de 96,89% para o extrato bruto e de 92,44% para o óleo essencial, ambos na concentração de 0,02%. O extrato bruto foi purificado através da cromatografia em coluna com sílica-gel e fase móvel hexano:acetato de etila em diferentes proporções. Para a identificação, foram utilizadas análises espectrais (infravermelho, ressonância magnética de hidrogênio e carbono 13). A substância isolada foi o eugenol, que apresentou 86,56% de atividade antioxidante. Alguns constituintes do óleo essencial foram caracterizados por cromatografia de fase gasosa, sendo o eugenol o principal componente (53,90%). Desta forma, a alfavaca apresenta-se como uma nova fonte de eugenol e, conseqüentemente, de antioxidante natural.
Palavras-chave: antioxidante; eugenol; alfavaca; oxidação lipídica.
ABSTRACT
The isolation and identification of natural antioxidants from plants contribute to the discovery of new sources of chemical compounds. Wild basil (Ocimum gratissimum L.) is used as a herbal medicine and also as a culinary spice. The antioxidant activity of wild basil leaf crude extract and essential oil was confirmed by the ferric thiocyanate method. The crude extract showed 96.89% inhibition of lipid oxidation, while the essential oil showed 92.44% inhibition, both in a 0.02% concentration. The crude extract was purified by column chromatography using silica gel and different proportions of hexane:ethyl acetate as an eluant. The plants chemical compounds were identified by spectral analyses using NMR (hydrogen and 13C) and infrared spectroscopy. The isolated substance was eugenol, which presented antioxidant activity of 86.56%. Some of the constituents of the essential oil were characterized by gas chromatography, which showed eugenol as the main component (53.90%). It was concluded that wild basil is a new source of eugenol and, hence, of natural antioxidant.
Keywords: antioxidant; eugenol; wild basil; lipid oxidation.
1 Introdução
A medicina popular tem, por muito tempo, dado ênfase a extratos e óleos essenciais de plantas da família Labiatae, usados devido às propriedades antimicrobiana, antivirótica, carminativa e espasmolítica. Além disso, a utilização destas plantas como condimento é de reconhecida importância24.
A alfavaca (Ocimum gratissimum L.) pertence ao gênero Ocimum e à família Labiatae. O gênero Ocimum contém aproximadamente 30 espécies nativas dos trópicos e subtrópicos, com algumas espécies cultivadas em áreas temperadas40. De acordo com Paton29, a alfavaca foi trazida ao Brasil pelos escravos africanos e se naturalizou rapidamente no País. Acredita-se que os escravos tiveram um importante papel na disseminação de Ocimum, pois foram responsáveis por introduzir diferentes espécies em muitas regiões do Brasil, com o objetivo de preservar a tradicional medicina africana.
É uma planta robusta que cresce naturalmente em muitas regiões tropicais do mundo: ilhas do Pacífico Sul, Taiti e Nova Celidônia, Ilhas Seychelles, Comores, Madagascar, Indonésia, África e sul da Rússia. A planta é cultivada em pequena escala no sul da França e no norte da África1.
Existem dois tipos importantes de Ocimum gratissimum L.: um deles se distingue pelo alto teor de timol e o outro por conter alto teor de eugenol1. O timol, 5-metil-2-(1-metiletil) fenol, é um monoterpeno fenólico derivado do cimeno e isômero de carvacrol, sendo a principal fonte o óleo essencial de tomilho15. O eugenol, 4-hidroxi-3-metoxialilbenzeno, é um alilbenzeno largamente distribuído no reino vegetal, sendo encontrado principalmente no óleo de cravo, canela, noz-moscada e plantas do gênero Ocimum2,10,17.
A alfavaca que possui alto teor de timol tem o seu óleo destilado no oeste da África e na África Central. O óleo vai do amarelo-escuro até o amarelo-alaranjado ou amarronzado1. O tipo que possui alto teor de eugenol tem maior interesse para os países onde só há uma fonte importante de eugenol, como, por exemplo, o óleo de cravo1.
O quimiótipo de alfavaca que possui alto teor de eugenol tem seu óleo destilado no Brasil, no Taiti e na Indonésia. Este quimiótipo tem atraído muito mais interesse do que o outro, e no Brasil alguns experimentos com cultivos seletivos têm resultado em bons rendimentos do óleo essencial com aproximadamente 80% de eugenol. Esse óleo vai de amarelo-amarronzado a amarelo-pálido e possui cheiro forte e aromático, com reminiscência de cheiro de óleo de cravo1.
SAINSBURY e SOFOWORA33 estudaram o óleo essencial das folhas e da inflorescência de alfavaca. O principal componente do óleo, da espécie coletada em Taiwan, foi o eugenol (62%).
A espécie nigeriana mostrou conter timol, mas não eugenol. Na Nigéria, alfavaca é cultivada como planta medicinal, e o chá obtido pela decocção das folhas ou da planta toda é utilizado como antitérmico, como diaforético, para problemas estomacais e laxantes e como anti-helmíntico. O óleo volátil obtido de alfavaca é estudado em razão de suas propriedades antimicrobianas; foi demonstrado que o vapor do óleo tem ação antiprotozoária4. Na Rússia, alfavaca é cultivada para extração do óleo essencial e usada como fonte doméstica de eugenol4.
VOSTROWSKY et al.41 determinaram, por cromatografia gasosa acoplada à espectrometria de massa e ressonância magnética nuclear, que o óleo essencial obtido de folhas de alfavaca da Amazônia continha metileugenol (46,83%) e eugenol (19,26%) como principais constituintes.
VIEIRA e SIMON40 caracterizaram 14 acessos de espécies brasileiras de Ocimum. Os óleos voláteis de plantas em floração extraídos por hidrodestilação foram analisados por GC/MS. Acessos de O. gratissimum mostraram alto teor de eugenol (40-66%) e timol (31%) em percentagem relativa do teor de óleo total.
OBASEIKI-EBOR et al.27 estudaram os extratos de diferentes solventes orgânicos das folhas de alfavaca com relação à atividade antimutagênica. O extrato metanólico foi o que mostrou maior atividade. Os extratos obtidos foram estáveis ao calor, mostrando que, mesmo depois do cozimento das folhas como alimento, a atividade está presente.
Poucos trabalhos correlacionam a alfavaca com atividade antioxidante. TREVISAN et al.38 caracterizaram os voláteis e avaliaram a capacidade antioxidante dos óleos essenciais de cinco diferentes espécies de Ocimum, dentre elas O. gratissimum. A capacidade antioxidante foi avaliada por dois métodos in vitro - sistema hipoxantina/xantina oxidase em HPLC e frente ao método do radical livre DPPH (2,2-difenil-1-picrilidrazila); e foi correlacionada com a presença em alta proporção de compostos que possuem um anel fenólico, como o eugenol.
LEAL et al.20 obtiveram o extrato de alfavaca por extração com CO2 supercrítico. O extrato, analisado por cromatografia gasosa com detector de ionização de chama, apresentou eugenol e b-selineno como componentes majoritários. O teor de eugenol variou de 35 a 60%, enquanto que o de b-selineno permaneceu constante. A atividade antioxidante foi avaliada pela reação de b-caroteno e ácido linolênico, a qual variou de 62 a 84% comparada ao controle.
Com relação ao gênero Ocimum, Ocimum basilicum L., conhecido popularmente como manjericão, é o mais estudado nesse sentido.
Foi demonstrado que os extratos de manjericão retardam a oxidação de óleo de girassol. A efetividade dos extratos foi estimada com base no período de indução, determinado por curva cinética durante a oxidação do óleo de girassol a 100 °C23.
CHUNG et al.5 estudaram 51 extratos metanólicos de temperos com relação ao poder seqüestrante de OH. O manjericão apresentou aproximadamente 60% de inibição da oxidação, quando usado na concentração de 1 µg.mL1, e em torno de 90%, quando a concentração foi aumentada para 10 µg.mL1.
O poder antioxidante do manjericão é atribuído ao ácido rosmarínico, um dos ésteres de ácido caféico37. No entanto, ECONOMOU et al.20 não encontraram atividade antioxidante nesses extratos.
GULÇIN et al.14 determinaram a atividade antioxidante e a capacidade de seqüestrar radicais livres dos extratos etanólico e aquoso de manjericão por diferentes métodos in vitro, dentre eles o método do tiocianato férrico. Os extratos etanólico e aquoso, na concentração de 50 µg.mL1 apresentaram 94,8 e 97,5% de inibição da oxidação lipídica, respectivamente.
Outra espécie de Ocimum, Ocimum sanctum, teve sua atividade antiinflamatória confirmada por vários estudos36,13. Esta atividade pode ser atribuída principalmente à inibição da biossíntese de prostaglandinas13, com o bloqueio das enzimas ciclooxigenase e lipoxigenase do metabolismo do ácido araquidônico36.
Considerando as propriedades terapêuticas e funcionais que são atribuídas à alfavaca e em função de existirem poucos trabalhos que relacionem as suas substâncias ativas a efeitos antioxidantes, objetivou-se com esta pesquisa a comparação da atividade antioxidante do extrato bruto e do óleo essencial das folhas de alfavaca. Também foi realizado o isolamento e a identificação do componente principal do extrato.
2 Material e métodos
2.1 Matéria-prima e secagem das folhas
As folhas de alfavaca (Ocimum gratissimum L.) foram colhidas em Viçosa, MG. A secagem das folhas foi realizada em estufa de secagem e esterilização, modelo 320 SE, com circulação de ar mecânica, a 30 °C, por 72 horas.
2.2 Extração do óleo essencial por arraste a vapor
Para obtenção do óleo essencial por arraste a vapor dágua, as folhas desidratadas (63 g) foram moídas e submetidas a tamização utilizando-se apenas o material de granulometria entre 0,5 e 1,0 mm. Em seguida, foram transferidas para um balão de três bocas (de 1.000 mL de capacidade), pelo qual passa o vapor de arraste.
Um recipiente com água destilada e um ebulidor (gerador de vapor) produzem um fluxo contínuo de vapor que passa pelo material vegetal desidratado, sendo o hidrolato (água + óleo essencial) recolhido em um frasco coletor de 1.000 mL e mantido em banho com água e gelo.
Foram coletados 2 litros de hidrolato. O hidrolato foi dividido em 2 porções de 1.000 mL e cada porção foi submetida à extração com éter de petróleo (3 x 60 mL). Os extratos orgânicos provenientes da extração do hidrolato foram reunidos e secos sobre sulfato de magnésio anidro. O sulfato de magnésio foi removido por filtragem a vácuo e o éter, posteriormente, destilado sob pressão reduzida em evaporador rotativo. Em seguida, o material foi transferido para frascos de vidro. A massa do óleo obtido foi determinada. Foram feitas três repetições.
2.3 Obtenção do extrato bruto
O extrato bruto foi obtido por extração de 260,2 g de folhas secas de alfavaca, previamente moídas, com 4 L de etanol, em aparelho Soxhlet por 72 horas. A remoção do solvente, por destilação em evaporador rotatório sob pressão reduzida, levou à obtenção de 50 g de extrato.
2.4 Avaliação da atividade antioxidante do óleo essencial e do extrato bruto
A atividade antioxidante dos extratos etanólicos foi medida de acordo com a metodologia descrita por Mitsuda et al. e Osawa e Namiki, citados por KIKUZAKI e NAKATANI16, com modificações. Uma mistura de 1 mL de amostra em etanol 99,5%, 1,1 mL de ácido linoléico 2,51% em etanol 99,5%, 2 mL de tampão fosfato 0,05 M (pH 7,0) e 0,9 mL de água foi colocada num frasco âmbar com tampa de plástico rosqueável e estocada em estufa a 50 °C, no escuro. Para 0,1 mL desta solução foram adicionados 9,7 mL de etanol 75 %, 0,1 mL de tiocianato de amônio 30% e 0,1 mL de cloreto ferroso 0,02 M. Depois de exatamente 3 minutos de reação à temperatura ambiente, foi lida a absorvância em 500 nm, a cada 24 horas, até que não houvesse um acréscimo no valor máximo de absorvância do controle.
A porcentagem de inibição na oxidação lipídica foi calculada de acordo com a fórmula:
2.5 Isolamento dos antioxidantes do extrato bruto de alfavaca
O extrato bruto foi incorporado à sílica gel (60-200 mesh) e pré-fracionado em coluna filtrante (funil com vidro sinterizado, com 13,5 cm de diâmetro e 10,5 cm de altura), acoplada a um kitazato de 2 L. Foram obtidas cinco frações: fração 1 (13, 54 g) e fração 2 (4,10 g), obtidas com hexano:acetato de etila (4:1); fração 3 (4,37 g), obtida com hexano: acetato de etila (1:1); fração 4 (11,84 g), obtida com acetato de etila puro e acetato de etila: metanol (1:1); e fração 5 (3,85 g), obtida com metanol puro. As frações obtidas foram agrupadas de acordo com o solvente utilizado e analisadas por cromatografia de camada delgada em placas cobertas com sílica-gel 60-GF254 (0,25 mm de espessura) utilizando o mesmo sistema de solventes como fase móvel. Depois do desenvolvimento do cromatograma ascendente unidimensional, as placas foram secas e reveladas, com luz ultravioleta e com ácido fosfomolíbdico e aquecidas para a revelação. Os valores de Rf foram calculados para cada uma das manchas observadas. As frações foram, então, avaliadas quanto à atividade antioxidante.
2.6 Identificação da substância antioxidante
Para identificação da substância antioxidante, foram realizadas análises espectrais. O espectro no infravermelho foi obtido utilizando-se o espectrofotômetro no infravermelho médio, modelo 1000 da Perkin Elmer, sendo a amostra analisada como filme líquido. Os espectros de ressonância magnética nuclear de 1H e de 13C foram registrados em espectrômetro Bruker DPX 200, sendo utilizados CDCl3 como solvente e tetrametilsilano como referência interna.
2.7 Análise cromatográfica do óleo essencial
O óleo essencial de alfavaca (1,9 µL) foi analisado em cromatógrafo a gás Hewllett Packard HP, modelo 5890, série II, com detector de ionização de chama, modo split, com uma razão de divisão de 100:1. Utilizou-se uma coluna capilar HP-1, de 25 m de comprimento e 0,2 mm de diâmetro interno, com fase estacionária de metilsilicone de 0,33 µm de espessura. O hidrogênio foi o gás carreador, sendo a vazão de 1,02 mL.minuto1 e a pressão na cabeça da coluna, de 95 KPa. A temperatura da coluna foi programada para permanecer a 75 °C por 2 minutos e, em seguida, para aumentar 4 °C por minuto, até 150 °C. As temperaturas do injetor e do detector foram fixadas em 250 °C. O tempo de análise foi de 29 minutos.
Para o composto principal foram preparadas soluções-padrão, utilizando o etanol como solvente. A resposta registrada nos cromatogramas de cada solução-padrão foi relacionada com as concentrações, e, assim, foi determinada a curva-padrão. Na análise da amostra, foi feita a transformação dos valores de resposta registrados para o teor do composto principal, segundo a curva-padrão obtida.
3 Resultados e discussão
3.1 Avaliação da atividade antioxidante do extrato bruto e do óleo essencial de alfavaca
O extrato bruto e o óleo essencial de alfavaca foram avaliados quanto ao potencial antioxidante. O extrato bruto apresentou 96,39% de inibição da oxidação lipídica, e o óleo essencial, 92,44% de inibição. Apesar da pouca diferença entre as porcentagens, o extrato bruto apresentou valor maior, por ser obtido por extração exaustiva em Soxhlet. Depois de 72 horas, quando o controle já apresentava o ácido linoléico completamente oxidado, o óleo essencial e o extrato bruto de alfavaca ainda inibiam quase que inteiramente a oxidação.
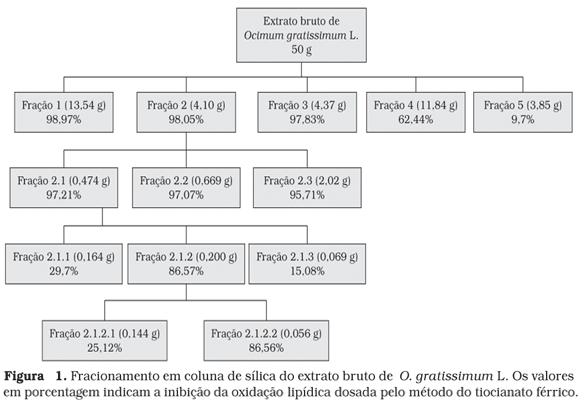
A Figura 1 exibe um fluxograma com todos os valores da porcentagem de inibição da oxidação lipídica das frações isoladas. A fração 2 foi a escolhida para dar continuidade ao estudo da atividade antioxidante, uma vez que apresentou melhor comportamento cromatográfico ocasionando um processo de purificação mais rápido. Foi obtida como fração pura e com alta atividade antioxidante, a fração 2.1.2.2, que foi então submetida às análises espectrais.
A porcentagem de inibição da oxidação lipídica de 86,56%, atribuída à fração 2.1.2.2, foi considerada satisfatória por se tratar de uma substância isolada, uma vez que, os extratos brutos apresentam atividade alta; mas, quando eles têm seus compostos isolados, a atividade diminui, decorrente do efeito sinergístico que várias substâncias exercem.
3.2 Identificação da substância antioxidante
Espectroscopia no infravermelho
O espectro no infravermelho da fração pura (Figura 2) apresentou as principais absorções em 3.512 cm1, característica de deformação axial de OH; 3.072 cm1, como deformação axial de =C-H; 2.930 cm1, indicando deformação axial assimétrica de CH2; 2.854 cm1, deformação axial simétrica de CH2; 1.648 cm1, caracterizando deformação axial de C=C, sendo confirmada pela banda em 913 cm1, que indica a deformação angular fora do plano de =CH; e 1.600 e 1.513 cm1, característico de deformação axial de C=C de anel.
O espectro obtido mostrou-se muito semelhante ao do padrão de eugenol obtido por POUCHERT30, indicando ser o composto antioxidante isolado da alfavaca.
Espectroscopia de ressonância magnética nuclear de hidrogênio e carbono 13
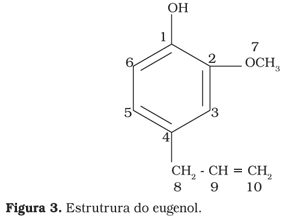
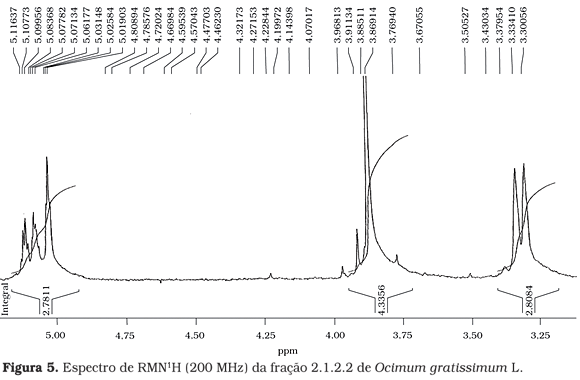
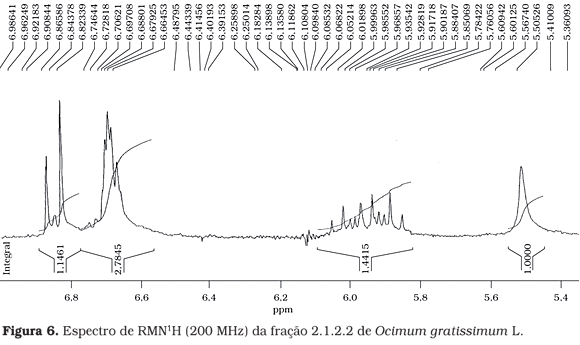
A estrutura proposta como sendo o eugenol (Figura 3) foi confirmada pelos espectros de RMN de 1H (Figuras 4, 5 e 6).
A caracterização do eugenol foi confirmada mediante a observação dos deslocamentos químicos no espectro de RMN de 13C (50 MHz) (Figura 7) e DEPT 135 (Figura 8). O espectro DEPT 135 apresenta como característica os sinais de CH e CH3 em fase oposta aos sinais de CH2, além da ausência dos sinais correspondentes aos carbonos quaternários, observados normalmente no espectro de RMN de 13C35.
Os deslocamentos químicos em d 143,92; 146,45 e 131,93 foram atribuídos aos carbonos quaternários, em virtude do desaparecimento deste sinal no espectro de DEPT 135.
O eugenol, 4-hidroxi-3-metoxialilbenzeno, encontra-se distribuído no reino vegetal como constituinte dos óleos essenciais de plantas10. Propriedades já conhecidas do eugenol são as funções antioxidante, anticarminativa, antiespasmódica, antisséptica e antimicrobiana25. O eugenol é o princípio ativo do cravo (85-92%)2, de plantas do gênero Ocimum, da canela e noz-moscada17.
FARAG et al.8 analisaram várias amostras de óleo de semente de algodão refinado com adição de óleo essencial de cravo (eugenol é o principal componente) e óleo essencial de tomilho (timol é o principal componente) e sem adição de aditivos. Os métodos utilizados para dosar a oxidação foram índice de peróxido e TBA, além da análise sensorial. Os resultados obtidos demonstram que os óleos de cravo e tomilho possuem atividade antioxidante, sendo o óleo de cravo superior ao de tomilho. Apesar do intenso flavor dos óleos essenciais, a avaliação sensorial indica que a adição de óleo essencial de cravo ou de tomilho nas concentrações de 50 a 1.200 ppm não afetou o odor, a cor e a aparência do produto.
FARAG et al.9 adicionaram óleos essenciais de cravo, cominho, alecrim, salsa e tomilho em uma solução aquosa emulsificada + ácido linoléico, para verificação da atividade antioxidante. A atividade antioxidante dos óleos essenciais foi proporcional à concentração. A comparação feita entre óleos essenciais e seus principais componentes mostra que, para apresentar atividade, o componente principal deve possuir um anel fenólico com um grupo doador de elétrons na posição orto a hidroxila. Já se sabe que compostos fenólicos agem como doadores de hidrogênio, e, dessa forma, a produção de hidroperóxidos é diminuída. Neste trabalho, foi observado que a formação de dienos conjugados é lenta; conseqüentemente, isto indica que o óleo de cravo e o de tomilho agem como doadores de hidrogênio para radicais peroxil. Portanto, retardam a autoxidação do ácido linoléico, por terminarem com a reação em cadeia9.
OYA et al.28 estudaram alguns componentes de temperos quanto à sua propriedade de seqüestrar radicais livres. Entre os muitos componentes estudados, o eugenol mostrou ser o de maior capacidade para seqüestrar radicais livres, devido ao grupo hidroxil fenólico.
Alguns temperos utilizados na Ásia, como o cravo, apresentam propriedades antioxidantes e antiinflamatórias31. PULLA REDDY e LOKESH32 demonstraram que o eugenol inibe a peroxidação lipídica induzida in vitro. A habilidade do eugenol em prevenir a oxidação de lipídios polinsaturados em fígado de ratos foi comparada in vitro com BHT, BHA e vitamina E.
A administração simultânea de eugenol (10,7 mg.kg 1 do peso corpóreo/dia) com tetracloreto de carbono (CCl4) (1,195 g.kg 1 do peso corpóreo, sendo três vezes por semana, no período de duas semanas) para ratos protegeu a perda da integridade funcional e das alterações lipídicas da membrana em células vermelhas do sangue induzidas por estresse oxidativo. O eugenol inibiu a acumulação da peroxidação lipídica produzida nas células vermelhas do sangue e manteve a atividade das enzimas antioxidantes como a superóxido dismutase, catalase, glutationa peroxidase, glutationa S-transferase, glutationa redutase e glutationa-6-fosfato desidrogenase, em níveis normais. A fluidez da membrana induzida pelo tetracloreto de carbono foi diminuída pelo eugenol, e as atividades alteradas das enzimas ligadas à membrana Na+K+-ATPase, NADH-desidrogenase e Ca+2-ATPase foram normalizadas. Dessa forma, verifica-se que o eugenol protege a membrana do ataque de radicais livres e mantém as atividades das enzimas antioxidantes em níveis normais, removidos pelo estresse oxidativo imposto por CCl417.
Análise cromatográfica do óleo essencial
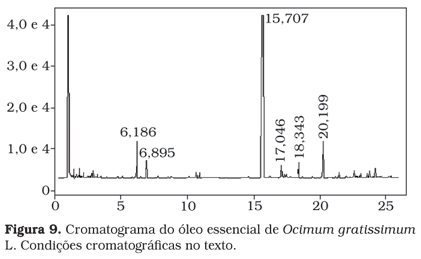
O óleo essencial de alfavaca foi analisado por cromatografia gasosa (Figura 9). A análise quantitativa do principal componente, eugenol (tR = 15,707 minutos), foi obtida pela construção da curva-padrão de eugenol. A equação da reta obtida pela curva-padrão foi área = 27.798 µg + 97.247, com um R2 = 0,9671 e as concentrações do padrão variando de 10 a 50 µg de eugenol, e o teor de eugenol foi de 53,90 %.
O teor de eugenol no óleo essencial de alfavaca varia muito, dependendo de uma série de fatores, como, por exemplo, da região geográfica onde a planta foi colhida. LAWRENCE19, em uma extensa revisão sobre o assunto, cita vários trabalhos relativos à determinação do teor de eugenol em alfavaca. Nestes trabalhos, foram encontrados teores de eugenol variando de 21,1 a 90,5% em alfavaca de diferentes regiões geográficas. Também Haiki (1970), citado por VOSTROWSKY et al.41, encontrou teores de eugenol em alfavaca variando de 67 a 73%.
No Brasil, a primeira análise do óleo essencial de Ocimum gratissimum L. foi realizada por MAIA et al.22 Nesta análise, foram encontrados 13% de timol, mas o eugenol não estava entre os principais constituintes isolados. Em outro trabalho, VOSTROWSKY et al.41 encontraram metileugenol (46,83%) como o principal constituinte do óleo essencial de alfavaca da Amazônia; o teor de eugenol encontrado neste óleo foi de 19,26%. O eugenol foi o principal componente encontrado no óleo essencial de alfavaca colhida nas cidades de Campinas - SP (93,9%)34, Goiânia - GO (57,82%)21 e Maringá - PR (67%)26.
O teor de 53,9% de eugenol encontrado para alfavaca colhida na região de Viçosa - MG, em comparação a outras pesquisas, dá indícios que plantas de regiões geográficas diferentes podem apresentar teores de eugenol distintos. Além disso, variações nos teores de eugenol podem ocorrer entre plantas de uma mesma região, desde que elas sejam colhidas em diferentes horários ou que a secagem das folhas seja feita de maneira distinta41.
VASCONCELOS SILVA et al.39 demonstraram que a composição química do óleo essencial de alfavaca varia muito ao longo do dia. O rendimento de óleo essencial é influenciado pela luz e favorecido em condições de estresse hídrico.
As condições climáticas e de disponiblidade de água no solo podem afetar o metabolismo secundário do vegetal, e conseqüentemente, alterar a composição dos óleos essenciais nas diferentes estações do ano12. FREIRE et al.12 obtiveram óleo essencial de alfavaca nas diferentes estações do ano. Em todas elas, eugenol e 1,8-cineol foram os compostos em maior abundância, e, na primavera, apresentaram a maior porcentagem relativa de sesquiterpenos.
Em contraste com outros alilbenzenos, o eugenol é reconhecido pela Food and Drug Administration (FDA) como seguro quando usado em alimentos em concentrações de até 1.500 µg.mL1 11. Em alimentos, o eugenol vem sendo usado basicamente como flavorizante, mas tem também aplicações como repelente de insetos e em preparações farmacêuticas25.
Outra propriedade do eugenol que vem sendo muito estudada e tem aplicação na área de alimentos é a sua ação antimicrobiana, apesar do seu mecanismo exato de ação ainda não estar bem esclarecido. Para BOONCHIRD e FLEGEL3 e BLANK et al.2, é possível que parte do efeito antimicrobiano do eugenol esteja relacionada com sua natureza fenólica. Em estudos acerca da atividade in vitro do eugenol e de seus derivados sobre o crescimento de fungos, leveduras, bactérias e vírus, LAEKEMAN et al.18 demonstraram apenas a ausência de atividade antiviral. Estes autores ainda verificaram que o grupamento hidroxila livre do eugenol é necessário para a sua atividade antibacteriana, mas não para a atividade antifúngica. A adição do eugenol ao meio de cultura de Lactobacillus plantarum e Lactobacillus brevis promoveu alteração no conteúdo celular de ácidos graxos dessas espécies2. Segundo WENDAKOON e SAKAGUCHI42, o mecanismo de ação do eugenol ocorre em nível de membrana plasmática, juntamente com a inativação de enzimas, e, ou, no material genético celular. Em razão da similaridade estrutural entre eugenol e butilhidroxianisol, é provável que sua ação esteja relacionada com alterações dos lipídios celulares, perda de material intracelular e inibição da síntese de ácidos nucléicos6.
4 Conclusões
O potencial da alfavaca como fonte de antioxidantes naturais foi comprovado. O extrato bruto e o óleo essencial, avaliados pelo método do tiociananto férrico, mostraram ser capazes de retardar a oxidação do ácido linolêico. A substância ativa do extrato bruto, responsável pela atividade antioxidante, foi isolada, identificada e caracterizada como eugenol. O eugenol também foi identificado como principal componente (53,90%) do óleo essencial.
Considerando a preocupação atual com efeitos adversos que os antioxidantes sintéticos podem causar ao organismo, observa-se que os extratos de plantas com propriedades medicinais podem apresentar-se como uma fonte nova e alternativa de antioxidantes naturais. O extrato e o óleo podem ser utilizados como uma fonte acessível de antioxidantes naturais e como um possível suplemento alimentício ou em aplicações farmacêuticas. Além disso, pode ser utilizado como um aditivo contra a deterioração oxidativa.
Recebido para publicação em 6/10/2006
Aceito para publicação em 23/4/2007 (001876)
- 1. ARCTANDER, S. Perfume and flavor materials of natural origin p. 458-459, 1960.
- 2. BLANK, G.; ADEJUMO, A. A.; ZAWISTOWSKI, J. Eugenol induced changes in the fatty acid content of two Lactobacillus species. Lebensm. Wiss. u- Technol, v. 24, n. 3, p. 231-235, 1991.
- 3. BOONCHIRD, C.; FLEGEL, T. W. In vitro antifungal activity of eugenol and vanilin against Candida albicans and Cryptococcus neoformans Can. J. Microb, v. 28, n. 11, p. 1235-1241, 1982.
- 4. CHARLES, D. J.; SIMON, J. E. A new geraniol chemotype of Ocimum gratissimum L. J. of Essential Oil Res, v. 4, n. 3, p. 231-234, 1992.
- 5. CHUNG, S. K.; OSAWA, T.; KAWAKISHI, S. Hydroxyl radical-scavenging effects of spices and scavengers from brown mustard (Brassica nigra). Biosc. Biotech. Biochem, v. 61, n. 1, p. 118-123, 1997.
- 6. DEGRÉ, R.; SYLVESTRE, M. Effect of butylated hydroxyanisole on the cytoplasmic membrane of Staphylococcus aureus Wood 46. J. Food Protect, v. 46, n. 3, p. 206-209, 1983.
- 7. ECONOMOU, K. D.; OREOPOULOU, V.; THOMOPOULOS, C. D. Antioxidant activity of some plant extracts of the family Labiatae. J. Am. Oil Chem. Soc, v. 68, n. 2, p. 109-113, 1991.
- 8. FARAG, R. S.; BADEL, A. Z. M. A.; EL BAROTY, G. S. A. Influence of thyme and clove essential oils on cottonseed oil oxidation., J. Am. Oil Chem Soc., v. 66, n. 6, p. 800-804, 1989a.
- 9. FARAG, R. S.; BADEL, A. Z. M. A.; HEWEDI, F. M. et al. Antioxidant activity of some spice essential oils on linoleic acid oxidation in aqueous media. J. Am. Oil Chem. Soc, v. 66, n. 6, p. 792-799, 1989b.
- 10. FISCHER, I. U.; DENGLER, H. J. Sensitive high-performance liquid chromatographic assay for the determination of eugenol in body fluids. J. Chromatogr, v. 525, n. 2, p. 369-377, 1990.
- 11. FISCHER, I. U.; VON UNRUH, G. E.; DENGLER, H. J. The metabolism of eugenol in man. Xenobiotica, v. 20, n. 2, p. 209-222, 1990.
- 12. FREIRE, C. M. M.; MARQUES, M. O. M.; COSTA, M. Effects of seasonal variation on the central nervous system activity of Ocimum gratissimum L. essential oil. J. Ethnopharmacol, v. 105, n. 1/2, p. 161-166, 2006.
- 13. GODHWANI, S. J. L.; VYAS, D. S. Ocimum sanctum: an experimental study evaluating its anti-inflammatory, analgesic and antipyretic activity in animals. J. Ethnopharmacol, v. 21, n. 2, p. 153-163, 1987.
- 14. GULÇIN, I.; ELMASTAS, M.; ABOUL-ENEIN, H. Y. Determination of antioxidant and radical scavenging activity of basil (Ocimum basilicum L. family Lamiaceae) assayed by different methodologies. Phytother. Res, Disponível em: < http://www3.interscience.wiley.com/cgi-bin/jissue/114194235> Publicado on line 15. jan. 2007
- 15. HAY, R. K. M.; SVOBODA, K. P. Botany. In: HAY, R.K.M., WATERMAN, P. G. (eds.). Volatile oil crops: their biology, biochemistry and production. London: Longman Scientific & Technical, 1993. p. 5-20.
- 16. KIKUZAKI, H.; NAKATANI, N. Antioxidant effects of some ginger constituents. J. Food Sci, v. 58, n. 6, p. 1407-1410, 1993.
- 17. KUMARAVELU, P.; SUBRAMANIYAM, S.; DAKSHINAMOORTHY, D. P., et al. The antioxidant effect of eugenol on CCl4 - induced erythrocyte damage in rats. Nutricional Biochem, v. 7, n. 1, p. 23-28, 1996.
- 18. LAEKEMAN, G. M.; HOOF, L. V.; HAEMERS, A. et al. Eugenol a valuable compound for in vitro experimental research and worthwhile for further in vivo investigation. Phytoth. Res, v. 4, n .3, p. 90-96, 1990.
- 19. LAWRENCE, B. M. Ocimum gratissimum Oil. Perfurmer and Flavorist, v. 22, p. 70-74, 1997.
- 20. LEAL, P. F. et al. Global yields, chemical compositions and antioxidant activities of clove basil (Ocimum gratissimum L.) extracts obtained by supercritical fluid extraction. J. Food Process Eng, v. 29, n. 5, p. 547-559, 2006.
- 21. LEMOS, J. A. et al. Antifungal activity from Ocimum gratissimum L. towards Crytococcus neoformans Mem. Inst. Oswaldo Cruz, v. 100, n. 1, p. 55-58, 2005.
- 22. MAIA, J. G. et al. Uncommon Brazilian essential oils of the Labiatae and Compositae. In: LAWRENCE, B. M.; MOOKHERJEE, B. D.; WILLIS, B. J. (eds). Flavours and Fragance: a world perspective. Amsterdam: Elsevier Sci. Publ., 1988. p. 177-188.
- 23. MARINOVA, E. M.; YANISHLIEVA, N. V. Antioxidative activity of extracts from selected species of the family Lamiaceae in sunflower oil. Food Chem, v. 58, p. 245-248, 1997.
- 24. MIRANDA, R. P. Bioactive natural products from traditionally used mexican plants. In: ARNASON, J.T., MATA, R., ROMEO, J.T. Phytochemistry of medicinal plants New York: Plenum Press, 1995. p. 84-85.
- 25. MYINT, S. et al. Temperature-dependent diffusion coefficient of soluble substances during ethanol extraction of clove. J. Amer. Oil Chem Soc., v. 73, p. 603-610, 1996.
- 26. NAKAMURA, C. V. et al. Antibacterial activity of Ocimum gratissimum L. essential oil. Mem. Inst. Oswaldo Cruz, v. 94, n. 5, p. 675-678, 1999.
- 27. OBASEIKI-EBOR, E. E. et al. Antimutagenic activity of extracts of leaves of four common edible vegetable plants in Nigeria (West Africa). Mutation Res, v. 302, n. 2, p. 109-117, 1993.
- 28. OYA, T.; OSAWA, T.; KAWAKISHI, S. Spice constituents scavenging free radicals and inhibiting pentosidine formation in a model system. Biosc. Biotech. Biochem, v. 61, n. 2, p.263-266, 1997.
- 29. PATON, A. A synopsis of Ocimum L. (Labiatae) in Africa. Kew Bulletin, v. 47, n. 3, p. 403-435, 1992.
- 30. POUCHERT, C. J. The Aldrich library of infrared spectra Milwankee: Aldrich Chemical, 1981.
- 31. PULLA REDDY, A.C., LOKESH, B.R. Dietary unsatured fatty acids, vitamina E, curcumin and eugenol alter serum and liver lipid peroxidation in rats. Nutrition Res, v. 14, n. 9, p. 1423-1437, 1994.
- 32. PULLA REDDY, A. C., LOKESH, B. R. Studies on spice principles as antioxidants in the inhibition of lipid peroxidation of rat liver microsomes. Mol. Cel. Biochem, v. 111, n. 1/2, p. 117-124, 1992.
- 33. SAINSBURY, M., SOFOWORA, E.A. Essential oil from the leaves and inflorescence of Ocimum gratissimum Phytochemistry, v. 10, n. 12, p. 3309-3310, 1971.
- 34. SARTORATTO, A. et al. Composition and antimicrobial activity of essential oils from aromatic plants used in Brazil. Braz. J. Microbiol, v. 35, n. 4, p. 275-280, 2004.
- 35. SILVERSTEIN, R. M.; BASSLER, G. G.; MORRIL, T. C. Identificação espectrométrica de compostos orgânicos Rio de Janeiro: Editora Guanabara Koogan S.A, 1994. 387p.
- 36. SINGH, S.; MAJUMDAR, D. K., REHAN, H. M. S. Evaluation of anti-inflammatory potential of fixed oil of Ocimum sanctum (Holybasil) and its possible mechanism of action. J. Ethnopharmacol, v. 54, n. 1, p. 19-26, 1996.
- 37. TADA, H. et al. Rosmarinic acid and related phenolics in hairy root cultures of Ocimum basilicum Phytochemistry, v. 42, n. 2, p. 431-434, 1996.
- 38. TREVISAN, M. T. S. et al. Characterization Of The Volatile Pattern And Antioxidant Capacity Of Essential Oils From Different Species Of The Genus Ocimum J.Agric. Food Chem, v. 54, n. 12, p. 378-4382, 2006.
- 39. VASCONCELOS SILVA, M. G. et al. Chemical variation during daytime of constituents of the essential oil of Ocimum gratissimum leaves. Fitoterapia, v. 70, n. 1, p. 32-34, 1999.
- 40. VIEIRA, R. F.; SIMON, J. E. Chemical characterization of basil (Ocimum spp.) found in the markets and used in traditional medicine in Brazil. Economic Botany, v. 54, n. 2, p. 207-216, 2000.
- 41. VOSTROWSKY, O. et al. Essential oil of Alfavaca, Ocimum gratissimum L., from Brazilian Amazon. Zeitschrift-fur-Naturforchung, v. 45, n. 9-10, p. 1073-1076, 1990.
- 42. WENDAKOON, C. N.; SAKAGUCHI, M. Combined effect of sodium chloride and clove on growth and biogenic amine formation of Enterobacter aerogenes in mackerel muscle extract. J. Food Protect, v. 56, n. 5, p. 410-413, 1993.
Datas de Publicação
-
Publicação nesta coleção
29 Out 2007 -
Data do Fascículo
Set 2007
Histórico
-
Recebido
06 Out 2006 -
Aceito
23 Abr 2007