Resumo
A doença renal do diabetes (DRD) é uma complicação crônica do diabetes mellitus associada à elevada morbidade e mortalidade, considerada um problema de saúde mundial. Dentre os fatores associados ao desenvolvimento e à progressão da DRD, destacam-se os microRNAs, que consistem em pequenas moléculas de RNA que regulam a expressão gênica por meio da degradação pós-transcricional do RNA mensageiro ou inibição translacional da síntese proteica. Este estudo teve como objetivo realizar uma revisão narrativa buscando investigar os microRNAs como auxiliares no diagnóstico, monitoramento e tratamento da DRD. Vários microRNAs estão envolvidos na patogênese da DRD, enquanto que outros têm papel nefroprotetor, consistindo assim em alvos terapêuticos promissores para o tratamento da DRD. A dosagem laboratorial dos microRNAs no soro e na urina também é muito promissora para o diagnóstico precoce e o monitoramento da DRD, já que os níveis de alguns microRNAs se alteram antes do aumento da albuminúria e da diminuição da taxa de filtração glomerular e podem ainda se alterar com a progressão da DRD.
Palavras-chave:
Nefropatias Diabéticas; MicroRNAs; Tratamento Farmacológico; Biomarcadores; Diagnóstico Precoce; Prognóstico
Abstract
Diabetic kidney disease (DKD) is a chronic complication of diabetes mellitus associated with significant morbidity and mortality regarded as a global health issue. MicroRNAs - small RNA molecules responsible for the post-transcriptional regulation of gene expression by degradation of messenger RNA or translational repression of protein synthesis - rank among the factors linked to the development and progression of DKD. This study aimed to offer a narrative review on investigations around the use of microRNAs in the diagnosis, monitoring, and treatment of DKD. Various microRNAs are involved in the pathogenesis of DKD, while others have a role in nephroprotection and thus serve as promising therapeutic targets for DKD. Serum and urine microRNAs levels have also been considered in the early diagnosis and monitoring of individuals with DKD, since increases in albuminuria, decreases in the glomerular filtration rate, and progression of DKD have been linked to changes in the levels of some microRNAs.
Keywords:
Diabetic Nephropathies; MicroRNAs; Drug Therapy; Biomarkers; Early Diagnosis; Prognosis
Introdução
O diabetes mellitus (DM) está associado a vários distúrbios debilitantes, incluindo a doença renal do diabetes (DRD), uma das principais razões pelas quais o paciente precisa de uma diálise dispendiosa.11 Kato M, Arce L, Wang M, Putta S, Lanting L, Natarajan R. A microRNA circuit mediates transforming growth factor-β1 autoregulation in renal glomerular mesangial cells. Kidney Int 2011;80:358-68. A DRD se tornou uma das principais causas de insuficiência renal e um problema de saúde cada vez mais globalmente proeminente, consistindo em uma das principais causas de morte entre pacientes diabéticos.22 Ma J, Zhang L, Hao J, Li N, Tang J, Hao L. Up-regulation of microRNA-93 inhibits TGF-β1 induced EMT and renal fibrogenesis by down-regulation of Orai1. J Pharmacol Sci 2018;136:218-27.
O diagnóstico precoce da DRD é fundamental, pois o tratamento precoce pode evitar a progressão da doença renal e o surgimento de eventos cardiovasculares.33 Diretrizes da Sociedade Brasileira de Diabetes 2017-2018. São Paulo: Editora Clannad; 2017. Contudo, a avaliação da taxa de filtração glomerular (TFG) e da excreção urinária de albumina (EUA) apresentam limitações para a detecção da DRD nos estágios iniciais, sendo importante a descoberta de novos marcadores para avaliação da função renal.44 Porto JR, Gomes KB, Fernandes AP, Domingueti CP. Avaliação da função renal na doença renal crônica. Rev Bras Anal Clin 2017;49:26-35.
Alguns marcadores promissores consistem no neutrophil gelatinase associate lipocalin (NGAL), N-acetylglucosaminidase (NAG), kidney injury molecule (KIM-1), α1- e β2-microglobulinas, fatty acid binding protein (L-FABP) e retinol binding protein (RBP4).33 Diretrizes da Sociedade Brasileira de Diabetes 2017-2018. São Paulo: Editora Clannad; 2017. Alguns desses marcadores podem ser detectados antes do aumento da EUA e da redução da TFG.55 Peres LAB, Cunha Júnior AD, Schäfer AJ, Silva AL, Gaspar AD, Scarpari DF, et al. Biomarcadores da injúria renal aguda. J Bras Nefrol 2013;35:229-36. Os microRNAs também têm se mostrado marcadores promissores, não apenas para o diagnóstico precoce, mas também para o monitoramento da progressão da DRD.66 Moura J, Børsheim E, Carvalho E. The Role ofMicroRNAs in Diabetic Complications-Special Emphasis on Wound Healing. Genes (Basel) 2014;5:926-56.
Os microRNAs são um grupo de moléculas de RNA de sequência simples, não codificadoras, constituídos por cerca de 22 nucleotídeos. Eles são responsáveis por regular a expressão gênica por meio da degradação pós-transcricional do RNA mensageiro ou inibição translacional da síntese proteica.77 Wang G, Kwan BC, Lai FM, Chow KM, Li PK, Szeto CC. Urinary sediment miRNA levels in adult nephrotic syndrome. Clin Chimi Acta 2013;418:5-11. Os microRNAs têm sido considerados poderosos reguladores de várias doenças com potencial impacto crítico no início e/ou na progressão da doença, incluindo a DRD.88 Kölling M, Kaucsar T, Schauerte C, Hübner A, Dettling A, Park JK, et al. Therapeutic miR21 Silencing Ameliorates Diabetic Kidney Disease in mice. Mol Ther 2017;25:165-80.,99 Kumar M, Nath S, Prasad HK, Sharma GD, Li Y. MicroRNAs: a new ray of hope for diabetes mellitus. Protein Cell 2012;3:726-38. Portanto, este estudo teve como objetivo realizar uma revisão bibliográfica narrativa para investigar os microRNAs como auxiliares no diagnóstico, monitoramento e tratamento da DRD.
Material e métodos
A busca de artigos foi realizada nas bases de dados Medline/PubMed e SciELO, sendo incluídos artigos que avaliaram a utilidade promissora dos microRNAs no diagnóstico e monitoramento da DRD por meio da dosagem de microRNAs em amostras humanas de soro ou urina e estudos realizados com animais ou cultura de células que avaliaram os microRNAs como potenciais alvos terapêuticos na DRD.
Doença renal do diabetes
O DM consiste em um conjunto de disfunções metabólicas, as quais possuem em comum a hiperglicemia. A hiperglicemia crônica pode ocasionar lesões nos capilares glomerulares dos rins, resultando em doença renal crônica (DRC).1010 Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int Suppl 2013;3:1-150. A DRC é definida como anormalidades da estrutura ou função renal, presentes por mais de três meses, que acarretam danos para a saúde.66 Moura J, Børsheim E, Carvalho E. The Role ofMicroRNAs in Diabetic Complications-Special Emphasis on Wound Healing. Genes (Basel) 2014;5:926-56. A DRD é uma DRC que ocorre de maneira progressiva, é assintomática e evolui para um quadro de perda da função renal, tornando necessário um tratamento com diálise em estágios mais avançados ou até mesmo transplante. Ela reduz a qualidade de vida do paciente e eleva o risco de morte precoce, principalmente por causas cardiovasculares, independentemente do grau de comprometimento renal.33 Diretrizes da Sociedade Brasileira de Diabetes 2017-2018. São Paulo: Editora Clannad; 2017.
A DRD é uma das principais complicações tanto do diabetes mellitus tipo 1 (DM1) quanto do tipo 2 (DM2). As características histológicas predominantes da DRD são expansão mesangial, hipertrofia mesangial, redução do número de podócitos e acúmulo de proteínas na matriz extracelular, no glomérulo renal e nos compartimentos tubulares, inclusive o colágeno, o qual está relacionado com a fibrose. Sinais dessa patologia são albuminúria e proteinúria glomerular. A DRD acomete cerca de 20% a 40% dos pacientes com DM e é a principal causa de doença renal em estágio terminal.1111 American Diabetes Association (ADA). Diabetes Advocacy. Sec. 14. In Standards of Medical Care in Diabetes 2016. Diabetes Care 2016;39:s105-s106.
A investigação da DRD deve ter início logo após ser diagnosticado o DM2 e cinco anos após o diagnóstico do DM1, exceto quando o paciente com DM1 estiver na puberdade ou apresentar hiperglicemia descontrolada; nesse caso, a triagem deve ser iniciada mais cedo. Essa investigação deve ser realizada anualmente por meio da determinação da EUA e da TFG.33 Diretrizes da Sociedade Brasileira de Diabetes 2017-2018. São Paulo: Editora Clannad; 2017.
Os critérios que avaliam a DRD são a TFG inferior a 60 mL/min/1,73m2 e/ou a EUA aumentada por um período igual ou superior a três meses. A EUA aumentada é definida pela relação albumina/creatinina (RAC) ≥ 30 mg/g creatinina ou albuminúria em urina de 24 horas ≥ 30 mg/24 horas. A avaliação simultânea da TFG e da EUA auxilia no diagnóstico precoce e possibilita a classificação da DRC em diferentes estágios (Quadro 1), com o objetivo de estipular o prognóstico e as medidas terapêuticas cabíveis a cada estágio nesses pacientes.11 Kato M, Arce L, Wang M, Putta S, Lanting L, Natarajan R. A microRNA circuit mediates transforming growth factor-β1 autoregulation in renal glomerular mesangial cells. Kidney Int 2011;80:358-68.)(22 Ma J, Zhang L, Hao J, Li N, Tang J, Hao L. Up-regulation of microRNA-93 inhibits TGF-β1 induced EMT and renal fibrogenesis by down-regulation of Orai1. J Pharmacol Sci 2018;136:218-27.
Estágios de classificação da doença renal crônica, com base na taxa de filtração glomerular e excreção urinária de albumina
Atualmente, os objetivos do tratamento da DRD consistem na redução da EUA, prevenção da progressão da doença e diminuição do decréscimo da TFG, além da prevenção de eventos cardiovasculares.33 Diretrizes da Sociedade Brasileira de Diabetes 2017-2018. São Paulo: Editora Clannad; 2017. Para tanto, é fundamental otimizar o controle da glicemia, mantendo os níveis de hemoglobina glicada (HbA1c) inferiores a 7,0% e o controle da pressão arterial (≤ 140/90 mmHg se EUA < 30 mg/24h e ≤ 130/80 se EUA ≥ 30 mg/24h) para diminuir o risco ou reduzir a evolução da DRD.1010 Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int Suppl 2013;3:1-150.,1111 American Diabetes Association (ADA). Diabetes Advocacy. Sec. 14. In Standards of Medical Care in Diabetes 2016. Diabetes Care 2016;39:s105-s106.
A presença de DRD em combinação com dislipidemia provoca aumento do risco cardiovascular preexistente isoladamente nessas duas condições, o que acarreta alto risco de mortalidade por doenças cardiovasculares nos pacientes com DM1 e DM2. É indicado tratamento hipolipemiante aos pacientes com DM com ou sem DRC que possuem mais de 40 anos e um ou mais fatores de risco cardiovascular, tais como níveis de colesterol LDL ≥ 100 mg/dL, hipertensão arterial, tabagismo, sobrepeso ou obesidade, diagnóstico prévio de doença coronariana.1111 American Diabetes Association (ADA). Diabetes Advocacy. Sec. 14. In Standards of Medical Care in Diabetes 2016. Diabetes Care 2016;39:s105-s106.
A utilização de medicamentos nefroprotetores também é importante para evitar a progressão da DRD. Os bloqueadores do eixo renina-angiotensina-aldosterona têm efeito positivo bem estabelecido, tanto na preservação da TFG quanto na redução da albuminúria. Os mecanismos nefroprotetores se associam com a melhora da hemodinâmica glomerular, restauração funcional da barreira de filtração glomerular e limitação dos efeitos da angiotensina II e aldosterona, como fibrose e disfunção do endotélio vascular. Os inibidores da enzima conversora de angiotensina (IECA) e os bloqueadores dos receptores de angiotensina (BRA) consistem nos medicamentos de escolha para o controle pressórico em todos os pacientes com DM, objetivando a prevenção do risco e diminuição da progressão de DRD.1212 Sociedade Brasileira de Diabetes (SBD), Sociedade Brasileira de Endocrinologia e Metabologia (SBEM), Sociedade Brasileira de Nefrologia (SBN). Prevenção, diagnóstico e conduta terapêutica na doença renal do diabetes. Posicionamento Oficial Tripartite nº 01/2016. São Paulo: Sociedade Brasileira de Diabetes, Sociedade Brasileira de Endocrinologia e Metabologia, Sociedade Brasileira de Nefrologia; 2016.
Como há poucos medicamentos nefroprotetores disponíveis para o tratamento da DRD, torna-se necessário buscar novos alvos terapêuticos, de modo a possibilitar a descoberta de fármacos mais eficazes.33 Diretrizes da Sociedade Brasileira de Diabetes 2017-2018. São Paulo: Editora Clannad; 2017. Alguns estudos têm demonstrado que diferentes microRNAs estão envolvidos na patogênese da DRD, o que os torna alvos terapêuticos bastante interessantes.1313 Kato M, Natarajan R. MicroRNAs in diabetic nephropathy: functions, biomarkers, and therapeutic targets. Ann N Y Acad Sci 2015;1353:72-88.,1414 Bhatt K, Kato M, Natarajan R. Minireview: emerging roles of microRNAs in the pathophysiology of renal diseases. Am J Physiol Renal Physiol 2016;310:F109-18.
MicroRNAs
Os microRNAs foram descobertos há aproximadamente vinte anos e estão envolvidos em diversos processos biológicos e na patologia de diversas doenças.1313 Kato M, Natarajan R. MicroRNAs in diabetic nephropathy: functions, biomarkers, and therapeutic targets. Ann N Y Acad Sci 2015;1353:72-88. Porém, apesar desse longo tempo de descoberta, ainda não se tem conhecimento claro e abrangente de suas funções e seus mecanismos de ação. No genoma humano, há mais de 1000 microRNAs, e a estimativa é que aproximadamente 60% dos genes que codificam proteínas humanas podem ser regulados por microRNAs, de modo que estes podem influenciar significativamente a expressão de várias proteínas.1515 Kato M, Castro NE, Natarajan R. MicroRNAs: potential mediators and biomarkers of diabetic complications. Free Radic Biol Med 2013;64:85-94.
MicroRNAs são moléculas pequenas, com cerca de 22 nucleotídeos, produzidas dentro das células como RNAs reguladores não codificadores curtos. Têm a capacidade de atuar na regulação de muitas vias biológicas fundamentais e em várias funções celulares,1515 Kato M, Castro NE, Natarajan R. MicroRNAs: potential mediators and biomarkers of diabetic complications. Free Radic Biol Med 2013;64:85-94. e podem assim induzir condições patológicas e normais em vários sistemas biológicos.1414 Bhatt K, Kato M, Natarajan R. Minireview: emerging roles of microRNAs in the pathophysiology of renal diseases. Am J Physiol Renal Physiol 2016;310:F109-18. Podem ser encontrados em animais, plantas e alguns vírus, atuam no silenciamento do RNA e regulam a expressão gênica na pós-transcrição.1616 Costa EBO, Pacheco C. MicroRNAs: perspectivas atuais da regulação da expressão gênica em eucariotos. Biosaúde 2012;14:81-93.
Geralmente, os microRNAs são encontrados no meio intracelular, mas também podem estar no meio extracelular, como microRNAs circulantes.1717 Sohel MH. Extracellular/Circulating MicroRNAs: Release Mechanisms, Functions and Challenges. Achiev Life Sci 2016;10:175-86. Os microRNAs reduzem a expressão de genes alvo, acarretando mudanças na proliferação celular, apoptose e diferenciação durante a evolução de mamíferos.1818 He F, Xia X, Wu XF, Yu XQ, Huang FX. Diabetic retinopathy in predicting diabetic nephropathy in patients with type 2 diabetes and renal disease: a meta-analysis. Diabetologia 2013;56:457-66. Eles silenciam os genes-alvo ligando-se a 3'UTR durante a transcrição e reprimem o RNA mensageiro-alvo ou promovem a degradação do RNA mensageiro pela clivagem.1919 Padmashree DG, Swamy NR. Molecular signaling cascade of miRNAs in causing Diabetes Nephropathy. Bioinformation 2013;9:401-8. Uma característica interessante dos microRNAs é que são heterogêneos, ou seja, podem se ligar a diversos RNAs mensageiros, promovendo o silenciamento de diversos genes simultaneamente.2020 Novák J, Kružliak P, Bienertová-Vašků J, Slabý O, Novák M. MicroRNA-206: a Promising Theranostic Marker. Theranostics 2014;4:119-33.
Pequenas alterações nos níveis de microRNAs podem acarretar importantes efeitos celulares. Além disso, mudanças na expressão de microRNAs podem ser observadas no desenvolvimento de diversas doenças humanas.1414 Bhatt K, Kato M, Natarajan R. Minireview: emerging roles of microRNAs in the pathophysiology of renal diseases. Am J Physiol Renal Physiol 2016;310:F109-18. Um estudo recente investigou o efeito da cirurgia bariátrica nos níveis de expressão de microRNAs séricos em pacientes com DM2. Os níveis de expressão de microRNA29a-3p, microRNA122-5p, microRNA124-3p e microRNA320a, os quais estão associados ao DM2, reduziram após a cirurgia bariátrica. Portanto, houve alteração no perfil de expressão de microRNAs após a cirurgia bariátrica quanto à promoção da secreção de insulina induzida pela glicose; diminuição da resistência à insulina; e proteção da função das células beta.2121 Zhu Z, Yin J, Li DC, Mao ZQ. Role of microRNAs in the treatment of type 2 diabetes mellitus with Roux-en-Y gastric bypass. Braz J Med Biol Res 2017;50:e5817. Esses resultados sugerem que a alteração no perfil de expressão dos microRNAs que ocorre na obesidade pode estar relacionada ao desenvolvimento do DM2.
Alguns microRNAs foram encontrados nos rins e são considerados primordiais para o seu bom funcionamento. A alteração na expressão desses microRNAs pode contribuir significativamente para o desenvolvimento de doenças renais, tais como DRD, doença renal aguda, nefrite lúpica, doença renal policística, dentre outras, já que exercem efeito sobre os genes que estão envolvidos na patogênese dessas doenças. Desse modo, consistem em interessantes alvos terapêuticos para o tratamento dessas doenças renais.1414 Bhatt K, Kato M, Natarajan R. Minireview: emerging roles of microRNAs in the pathophysiology of renal diseases. Am J Physiol Renal Physiol 2016;310:F109-18.
Os microRNAs ainda consistem em potenciais marcadores prognósticos e preditivos de diferentes doenças renais, já que têm grande estabilidade e estão presentes em várias amostras biológicas. Portanto, é promissor o desenvolvimento de novas técnicas diagnósticas e terapêuticas envolvendo os microRNAs, que poderão ser utilizadas clinicamente para diagnóstico, tratamento e prevenção de várias doenças renais.1414 Bhatt K, Kato M, Natarajan R. Minireview: emerging roles of microRNAs in the pathophysiology of renal diseases. Am J Physiol Renal Physiol 2016;310:F109-18.
Os microRNAs são marcadores muito promissores para o diagnóstico precoce e monitoramento da DRD, pois são estáveis na urina e no plasma; e alguns deles são específicos para a DRD. Além disso, a urina e o soro de pacientes com DRD têm sedimentos com microRNAs, os quais podem se correlacionar com fases específicas da doença renal, fibrose e redução da função renal. A presença de exossomos na urina é uma excelente ferramenta para análise do perfil de microRNAs em doenças renais, já que muitos têm origem nas células renais.1515 Kato M, Castro NE, Natarajan R. MicroRNAs: potential mediators and biomarkers of diabetic complications. Free Radic Biol Med 2013;64:85-94.
Portanto, os microRNAs estão ganhando força como biomarcadores renais, representando atualmente boa perspectiva para o futuro clínico da DRD, podendo complementar a determinação da TFG e da albuminúria para o diagnóstico e monitoramento da doença.2222 Nassirpour R, Raj D, Townsend R, Argyropoulos C. MicroRNA biomarkers in clinical renal disease: from diabetic nephropathy renal transplantation and beyond. Food Chem Toxicol 2016;98:73-88.
Utilidade promissora dos microRNAs no diagnóstico e monitoramento da doença renal do diabetes
MicroRNAs são estáveis e podem ser detectados em fluidos humanos. A detecção de perfis de microRNAs em amostras biológicas é importante na pesquisa clínica para o desenvolvimento de biomarcadores de diagnóstico da DRD, visto que o diagnóstico precoce da DRD pode evitar a progressão da insuficiência renal e o desenvolvimento de eventos cardiovasculares.1515 Kato M, Castro NE, Natarajan R. MicroRNAs: potential mediators and biomarkers of diabetic complications. Free Radic Biol Med 2013;64:85-94.
Em um estudo recente, realizado por AlKafaji,2323 Al-Kafaji G, Al-Mahroos G, Al-Muhtaresh HA, Skrypnyk C, Sabry MA, Ramadan AR. Decreased expression of circulating microRNA-126 in patients with type 2 diabetic nephropathy: A potential blood-based biomarker. Exp Ther Med 2016;12:815-22. verificou-se a associação entre a expressão do microRNA-126 com o DM2 e a DRD. Foram avaliados 52 pacientes com DM2 e albuminúria normal, 50 pacientes com DM2 e albuminúria aumentada (sendo 29 com albuminúria moderadamente aumentada e 21 com albuminúria intensamente aumentada) e 50 indivíduos saudáveis e não diabéticos. Foi observado que os níveis de expressão do microRNA-126 estavam significativamente menores nos pacientes com DM2 e ainda menores nos pacientes com DRD quando comparados aos de indivíduos do grupo controle. Os níveis do microRNA-126 também foram correlacionados com o grau de albuminúria, sendo que a expressão deste microRNA foi significativamente menor nos pacientes com albuminúria moderadamente aumentada e ainda menor naqueles com albuminúria intensamente aumentada em relação à dos pacientes com DM2 e albuminúria normal. Os níveis do microRNA-126 se correlacionaram negativamente com a albuminúria e positivamente com a TFG. Portanto, esses achados indicam que a redução da expressão do microRNA-126 circulante pode estar relacionada ao desenvolvimento de DRD em pacientes com DM2, sugerindo que esse microRNA possa ter papel nefroprotetor, além de consistir em um biomarcador promissor para o diagnóstico e o monitoramento da DRD.
Em um estudo longitudinal realizado por Argyropoulos,2424 Argyropoulos C, Wang K, McClarty, Huang D, Bernardo J, Ellis D, et al. Urinary microRNA profiling in the nephropathy of type 1 diabetes. PLoS One 2013;8:e54662. foram estudados perfis de microRNAs na urina de pacientes com DM1 e DRD. O estudo procedeu-se com 40 pacientes com DM1, os quais foram acompanhados durante 20 anos, sendo: 10 sem DRD, 10 com albuminúria intensamente aumentada, 10 com albuminúria moderadamente aumentada intermitente e 10 com albuminúria moderadamente aumentada persistente. No início do estudo, os pacientes com albuminúria moderadamente aumentada persistente apresentaram níveis reduzidos de microRNA-323b-5p e aumentados de microRNA-122-5p e microRNA-429, em comparação aos daqueles com albuminúria moderadamente aumentada intermitente. O surgimento de albuminúria moderadamente aumentada foi associado à diminuição dos níveis do microRNA-323b-5p e elevação dos níveis do microRNA-429. Nove microRNAs (microRNA-619; microRNA-486-3p; microRNA-335-5p; microRNA-552; microRNA-1912; microRNA-1224-3p; microRNA-424-5p; microRNA-141-3p; microRNA-29b-1-5p) tiveram expressão aumentada na urina dos pacientes que desenvolveram albuminúria intensamente aumentada, enquanto que um microRNA (microRNA-221-3p) apresentou expressão reduzida. Portanto, esse estudo demonstrou que perfis urinários de microRNAs divergem nos diferentes estágios da DRD, consistindo em marcadores úteis para o diagnóstico e a estratificação do risco da DRD em pacientes com DM1.
Em outro estudo longitudinal mais recente de Argyropoulos,2525 Argyropoulos C, Wang K, Bernardo J, Ellis D, Orchard T, Galas D, et al. Urinary MicroRNA Profiling Predicts the Development of Microalbuminuria in Patients with Type 1 Diabetes. J Clin Med 2015;4:1498-517. foi avaliada a expressão de 723 microRNAs na urina de 27 pacientes com DM1 e albuminúria normal, dos quais 10 não desenvolveram DRD e 17 desenvolveram albuminúria moderadamente aumentada. Dezoito microRNAs foram significativamente associados a posterior desenvolvimento de albuminúria moderadamente aumentada, indicando que essa alteração no perfil de microRNAs possa ser útil para a predição do desenvolvimento da DRD e para o diagnóstico precoce da doença. Por outro lado, microRNA-10, microRNA-23, microRNA-30 e microRNA-200 estavam entre os microRNAs com maior expressão na urina do grupo que não desenvolveu a DRD, indicando um possível papel nefroprotetor desses microRNAs.
A expressão de microRNAs em exossomos na urina foi avaliada em um estudo realizado por Barutta2626 Barutta F, Tricarico M, Corbelli A, Annaratone L, Pinach S, Grimaldi S, et al. Urinary exosomal microRNAs in incipient diabetic nephropathy. PLoS One 2013;8:e73798. em 12 pacientes com DM1 e albuminúria normal e em 12 pacientes com DM1 e albuminúria moderadamente aumentada. Foram observados maiores níveis do microRNA-130a e do microRNA-145, e menores níveis do microRNA-155 e do microRNA-424 nos exossomos urinários dos pacientes com albuminúria moderadamente aumentada em comparação com aqueles com albuminúria normal. Essa alteração no conteúdo de microRNAs exossomais urinários nos pacientes com DM1 e DRD sugere que possa consistir em biomarcadores da DRD.
Os níveis séricos de 377 microRNAs foram avaliados por Barutta2727 Barutta F, Bruno G, Matullo G, Chatuverdi N, Grimaldi S, Schalkwijk C, et al. MicroRNA-126 and micro-/macrovascular complications of type 1 diabetes in the EURODIAB Prospective Complications Study. Acta Diabetol 2017;54:133-9. em um estudo transversal que incluiu 455 pacientes portadores de DM1, dos quais 312 tinham uma ou mais complicações do DM e 143 não tinham nenhuma evidência de complicação do DM. Foi observada uma alteração na expressão de 25 microRNAs nos pacientes que apresentavam uma ou mais complicações do DM. Dentre esses microRNAs, o microRNA-126 foi escolhido para ser avaliado por qRT-PCR, sendo verificado que os níveis desse microRNA estavam significativamente menores nos pacientes com albuminúria aumentada (n = 179) em comparação aos do grupo controle, sugerindo um efeito benéfico desse microRNA para os rins em pacientes com DM1 e uma potencial utilidade clínica da dosagem desse microRNA para o diagnóstico da DRD.
Em um estudo longitudinal, a expressão de 13 microRNAs foi avaliada antes e após o transplante de pâncreas e rins em 14 pacientes com DM1 que apresentavam DRD. Foi observado que a expressão dos microRNAs normalizou após o transplante, indicando que possam apresentar efeito patogênico na DRD, além de consistirem em biomarcadores dessa complicação do DM. Nesse mesmo estudo, também foi realizada uma análise transversal, na qual o grupo de pacientes com DM1 e TFG < 30 mL/min (n = 21) foi comparado com o grupo de pacientes com DM1 e TFG ≥ 30 mL/min (n = 15). Os pacientes com TFG < 30 mL/min apresentaram maior expressão do microRNA181a e do microRNA-326 e menor expressão do microRNA-126 e do microRNA-574-3p em comparação à dos pacientes com TFG ≥ 30 mL/min, demonstrando que há uma alteração na expressão desses microRNAs nos estágios mais avançados da DRD, o que sugere uma utilidade clínica desses microRNAs para o monitoramento da progressão da DRD.2828 Bijkerk R, Duijs JM, Khairoun M, Ter Horst CJ, Van der Pol P, Mallat MJ, et al. Circulating microRNAs associate with diabetic nephropathy and systemic microvascular damage and normalize after simultaneous pancreas kidney transplantation. Am J Transplant 2015;15:1081-90.
Wang et al.2929 Wang C, Wan S, Yang T, Niu D, Zhang A, Yang C, et al. Increased serum microRNAs are closely associated with the presence of microvascular complications in type 2 diabetes mellitus. Sci Rep 2016;6:20032. avaliaram os níveis de expressão de microRNAs em amostras de soro de 184 pacientes com DM2, sendo 92 com complicações microvasculares e 92 sem complicações, com idade e gênero similares. Cinco microRNAs foram significativamente mais expressos nos pacientes com DM2 que tinham complicações microvasculares em comparação com aqueles sem complicações. Esses cinco microRNAs ainda apresentaram uma correlação positiva com os níveis séricos de glicose e de triglicérides e uma correlação negativa com os níveis séricos de colesterol da lipoproteína de alta densidade (cHDL). Esses dados sugerem que a regulação positiva desses cinco microRNAs em pacientes com DM2 pode estar envolvida na patogênese do DM2 e em complicações microvasculares diabéticas.
El-Samahy et al.3030 El-Samahy MH, Adly AA, Elhenawy YI, Ismail EA, Pessar SA, Mowafy ME, et al. Urinary miRNA-377 and miRNA-216a as biomarkers of nephropathy and subclinical atherosclerotic risk in pediatric patients with type 1 diabetes. J Diabetes Complications 2018;32:185-92. avaliaram o microRNA-377 e o microRNA-216a como biomarcadores de DRD e do risco de aterosclerose em crianças com DM1 comparados com os do grupo controle. Os resultados mostraram que os níveis do microRNA-377 na urina estavam significativamente maiores, enquanto que os níveis do microRNA-216a estavam significativamente menores nos pacientes com albuminúria aumentada (n = 24) em comparação aos dos pacientes com albuminúria normal (n = 26). A precisão do microRNA-377 urinário na detecção de albuminúria moderadamente aumentada entre os pacientes com DM1 revelou 92% de sensibilidade e 85% de especificidade, sendo que, para o microRNA-216, a sensibilidade foi de 91,3% e a especificidade, de 84,1%. Correlações positivas significativas foram encontradas entre o microRNA-377 urinário e HbA1c, RAC e espessura da camada íntima das carótidas, enquanto o microRNA-216a urinário foi negativamente correlacionado com essas variáveis. Portanto, o microRNA-377 e o microRNA-216a urinários podem ser considerados biomarcadores precoces da nefropatia e do processo aterosclerótico subclínico no DM1.
Os principais resultados desses estudos que avaliaram a utilidade dos microRNAs no diagnóstico e monitoramento da DRD estão resumidos na Tabela 1. Os microRNAs com menor ou maior expressão na DRD nesses estudos estão apresentados na Tabela 2. Os microRNAs cuja expressão se encontrou elevada ou reduzida na DRD variaram amplamente entre os estudos. O microRNA-126 foi o único que apresentou expressão reduzida na DRD sistematicamente em três estudos. Uma meta-análise3131 Park S, Moon SR, Lee K, Park IB, Lee DH, Nam S. Urinary and Blood MicroRNA-126 and -770 are Potential Noninvasive Biomarker Candidates for Diabetic Nephropathy: a Meta-Analysis. Cel Physiol Biochem 2018;46:1331-40. também verificou que o microRNA-126 apresenta expressão significativamente reduzida no soro de pacientes com DRD, enquanto que o microRNA-770 apresenta expressão significativamente aumentada.
Estudos que avaliaram a utilidade dos microRNAs no diagnóstico e monitoramento da doença renal do diabetes
Em uma revisão da literatura, Yang et al.3232 Yang Y, Xiao L, Li J, Kanwar YS, Liu F, Sun l. Urine miRNAs: potential biomarkers for monitoring progression of early stages of diabetic nephropathy. Med Hypotheses 2013;81:274-8. observaram a partir da análise de diferentes estudos que microRNA-377, microRNA-192, microRNA-216/217 e microRNA-144 estão aumentados nos fluidos corporais de pacientes com DRD, enquanto que microRNA-21 e microRNA-375 estão diminuídos. Eles também verificaram que, embora tenham sido observadas diferenças significativas na excreção urinária dos microRNAs na DRD, geralmente não há correlação com seus níveis séricos, indicando que a dosagem de microRNAs na urina é mais interessante do que a dosagem no soro para auxiliar no diagnóstico da DRD.
Uma revisão sistemática3333 Assmann TS, Recamonde-Mendoza M, de Souza BM, Bauer AC, Crispim D. MicroRNAs and diabetic kidney disease: Systematic review and bioinformatic analysis. Mol Cell Endocrinol 2018;477:90-102. verificou que os microRNA-21-5p, microRNA-29a-3p, microRNA-126-3p, microRNA-192-5p, microRNA-214-3p e microRNA-342-3p estão envolvidos na patogênese da DRD, consistindo em potenciais biomarcadores dessa patologia. Uma meta-análise3434 Gholaminejad A, Abdul Tehrani H, Gholami Fesharaki M. Identification of candidate microRNA biomarkers in diabetic nephropathy: a meta-analysis of profiling studies. J Nephrol 2018;31:813-31. demonstrou que os microRNA-21-5p, microRNA-146a-5p e microRNA-10a-5p apresentam maior expressão, enquanto que os microRNA-25-3p e microRNA-26a-5p apresentam menor expressão na DRD. Outra meta-análise3535 Gholaminejad A, Abdul Tehrani H, Gholami Fesharaki M. Identification of candidate microRNA biomarkers in renal fibrosis: a meta-analysis of profiling studies. Biomarkers 2018;23:713-24. ainda observou que os microRNA-142-3p, microRNA-223-3p, microRNA-21-5p, microRNA-142-5p e microRNA-214-3p são mais expressos, enquanto que os microRNA-29c-3p e microRNA-200a-3p são menos expressos na fibrose renal.
MicroRNAs como alvos terapêuticos na doença renal do diabetes
Um estudo realizado por Kang e Xu3636 Kang WL, Xu GS. Atrasentan increased the expression of klotho by mediating miR-199b-5p and prevented renal tubular injury in diabetic nephropathy. Sci Rep 2016;6:19979. verificou que o atrasentan, um antagonista seletivo do receptor de endotelina A, é um fármaco promissor para o tratamento da DRD. Observou-se que o atrasentan diminuiu a expressão do microRNA-199b-5p, o que resultou em elevação de klotho, uma proteína transmembranar antienvelhecimento que propicia controle da sensibilidade do organismo à insulina. A elevação de klotho sérico, mediada pelo microRNA-199b-5p, consiste em um possível mecanismo pelo qual o atrasentan previne lesões tubulares renais na DRD.
Agentes bloqueadores do sistema renina-angiotensina-aldosterona são úteis na redução da pressão intraglomerular e da hiperfiltração e são conhecidos também por reduzir a proteinúria tanto no DM1 quanto no DM2.3737 Marshall SM. Recent advances in diabetic nephropathy. Postgrad Med J 2004;80:624-33. Em um estudo conduzido por Zhu,3838 Zhu X, Zhang C, Fan Q, Liu X, Yang G, Jiang Y, et al. Inhibiting MicroRNA-503 and MicroRNA-181d with Losartan Ameliorates Diabetic Nephropathy in KKAy Mice. Med Sci Monit 2016;22:3902-9. verificou-se que o losartan promoveu inibição da expressão do microRNA-503 e do microRNA-181d nos glomérulos dos ratos, o que resultou em melhora da DRD, sendo perceptível a melhora da albuminúria e das lesões patológicas renais dos ratos. Portanto, os resultados desse estudo indicam que o efeito nefroprotetor do losartan envolve o aumento da expressão de alguns microRNAs, os quais consistem em importantes alvos terapêuticos para o tratamento da DRD.
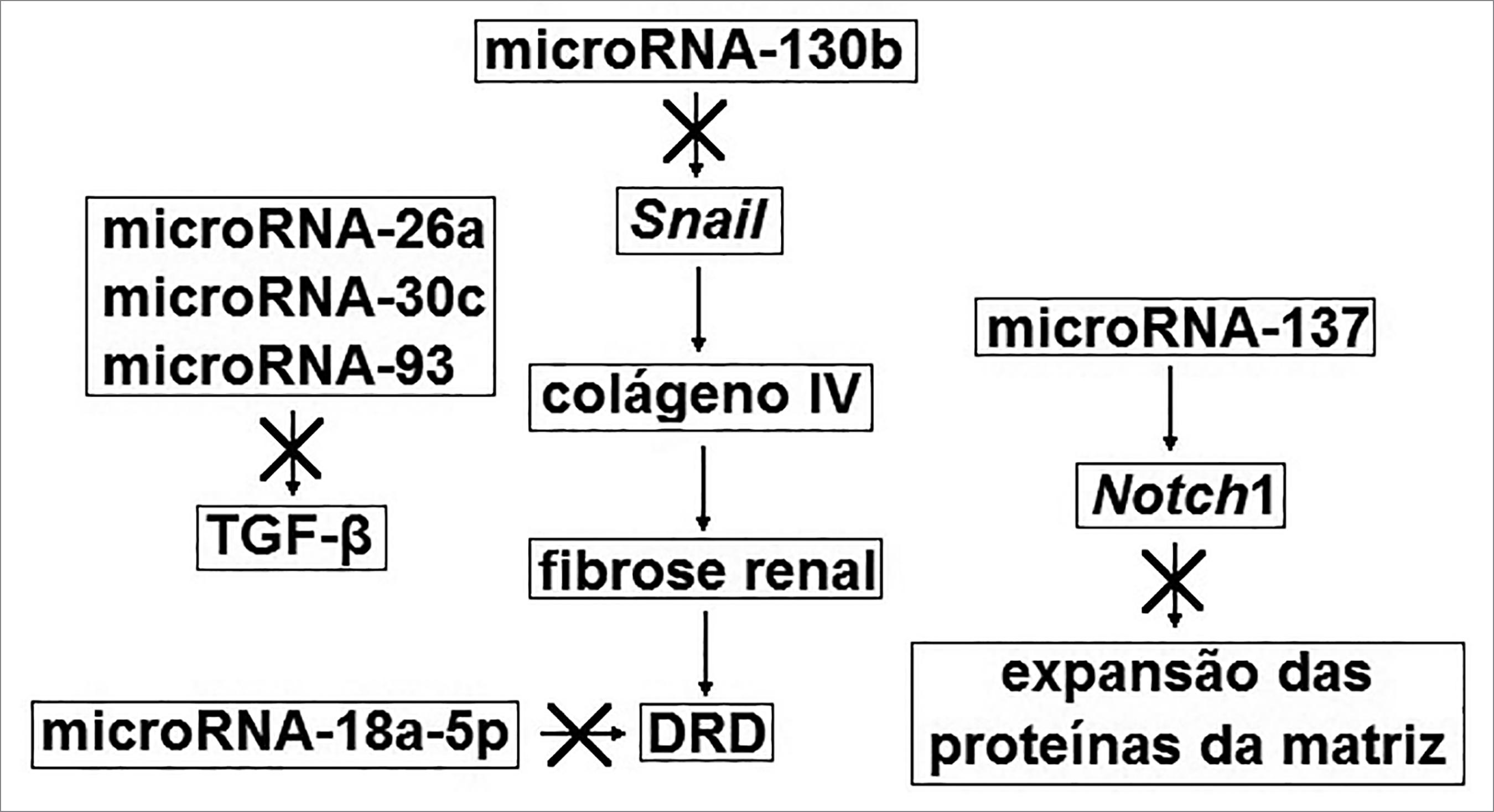
Bai3939 Bai X, Geng J, Zhou Z, Tian J, Li X. MicroRNA-130b improves renal tubulointerstitial fibrosis via repression of Snail-induced epithelial-mesenchymal transition in diabetic nephropathy. Sci Rep 2016;6:20475. e colaboradores demonstraram que os níveis do microRNA-130b estão significativamente reduzidos nos pacientes com DRD e que estes apresentam uma correlação negativa com a creatinina sérica, β2-microglobulina e proteinúria. Foi também verificado que a inibição do microRNA-130b aumentou a expressão de Snail em cultura de células expostas a altas concentrações de glicose. O aumento da expressão de Snail está associado ao aumento da expressão de colágeno IV, que pode contribuir para a fibrose túbulo intersticial na DRD. Portanto, o microRNA-130b é um alvo bastante promissor para o tratamento da DRD.
Vários estudos demonstraram uma associação entre microRNAs e marcadores inflamatórios na DRD, alguns estão citados abaixo. Guo et al.4040 Guo J, Li J, Zhao J, Yang S, Wang L, Cheng G, et al. MiRNA-29c regulates the expression of inflammatory cytokines in diabetic nephropathy by targeting tristetraprolin. Sci Rep 2017;7:2314. observaram que o microRNA-29 estimula a expressão de interleucina 6 (IL6) e fator de necrose tumoral alfa (TNF-α) nos glomérulos de ratos. Shao et al.4141 Shao Y, Lv C, Wu C, Zhou Y, Wang Q. Mir-217 promotes inflammation and fibrosis in high glucose cultured rat glomerular mesangial cells via Sirt1/HIF-1α signaling pathway. Diabetes Metab Res Rev 2016;32:534-43. verificaram que o microRNA-217 estimula a produção do fator de crescimento transformante beta (TGFβ), endotelina e fibronectina nas células mesangiais glomerulares de ratos, resultando em fibrose renal. O microRNA-192 também foi associado ao aumento da expressão de TGFβ,4242 Zheng Z, Guan M, Jia Y, Wang D, Pang R, Lv F, et al. The coordinated roles of miR-26a and miR-30c in regulating TGFβ1-induced epithelial-to-mesenchymal transition in diabetic nephropathy. Sci Rep 2016;6:37492. enquanto que o microRNA-26a, o microRNA-30c e o microRNA-93 foram associados à menor expressão de TGFβ22 Ma J, Zhang L, Hao J, Li N, Tang J, Hao L. Up-regulation of microRNA-93 inhibits TGF-β1 induced EMT and renal fibrogenesis by down-regulation of Orai1. J Pharmacol Sci 2018;136:218-27.,4343 Wu L, Wang Q, Guo F, Ma X, Ji H, Liu F, et al. MicroRNA-27a Induces Mesangial Cell Injury by Targeting of PPARγ, and its In Vivo Knockdown Prevents Progression of Diabetic Nephropathy. Sci Rep 2016;6:26072. nas células mesangiais de ratos, promovendo redução da fibrose renal, apresentando assim efeito nefroprotetor.
Wu et al.4444 Civantos E, Bosch E, Ramirez E, Zhenyukh O, Egido J, Lorenzo O, et al. Sitagliptin ameliorates oxidative stress in experimental diabetic nephropathy by diminishing the miR-200a/Keap-1/Nrf2 antioxidant pathway. Diabetes Metab Syndr Obes 2017;10:207-22. observaram que a exposição a altas concentrações de glicose aumentou a expressão do microRNA-27a em cultura de células mesangiais glomerulares de ratos diabéticos. A inibição do microRNA-27a com antagonista em camundongos resultou em menor proliferação de células mesangiais induzida por concentrações elevadas de glicose, menor expressão de genes pró-fibróticos associados à matriz extracelular e diminuição da fibrose renal e da hipertrofia renal, indicando que os inibidores do microRNA-27a são promissores para o tratamento da DRD.
A sitagliptina, um medicamento utilizado na terapia do DM2, também tem se mostrado promissora para o tratamento da DRD, já que promoveu melhora do estresse oxidativo mediado pelo microRNA-200a em ratos com DRD.4545 Xu XH, Ding DF, Yong HJ, Dong CL, You N, Ye XL, et al. Resveratrol transcriptionally regulates miRNA-18a-5p expression ameliorating diabetic nephropathy via increasing autophagy. Eur Rev Med Pharmacol Sci 2017;21:4952-65. Xu et al.4646 Han F, Wang S, Chang Y, Li C, Yang J, Han Z, et al. Triptolide prevents extracellular matrix accumulation in experimental diabetic kidney disease by targeting microRNA-137/Notch1 pathway. J Cell Physiol 2018;233:2225-37. ainda verificaram que o resveratrol estimula a expressão do microRNA18a-5p nos podócitos de ratos, resultando em melhora da DRD, um indício de que a estimulação desse microRNA pode ser uma terapia promissora no tratamento da DRD.
Kolling et al.88 Kölling M, Kaucsar T, Schauerte C, Hübner A, Dettling A, Park JK, et al. Therapeutic miR21 Silencing Ameliorates Diabetic Kidney Disease in mice. Mol Ther 2017;25:165-80. demonstraram que o microRNA-21 está entre os microRNAs mais expressos nos rins de camundongos com DRD e que a inibição desse microRNA in vitro e in vivo diminuiu a expansão da matriz mesangial, da fibrose intersticial, da infiltração de macrófagos, da perda de podócitos, da albuminúria e da expressão de moléculas inflamatórias e fibróticas. Portanto, antagonistas do microRNA-21 podem promover melhora em parâmetros estruturais e funcionais nos rins de camundongos com DRD, consistindo em fármacos promissores para o tratamento dessa complicação do diabetes.
Han et al.4646 Han F, Wang S, Chang Y, Li C, Yang J, Han Z, et al. Triptolide prevents extracellular matrix accumulation in experimental diabetic kidney disease by targeting microRNA-137/Notch1 pathway. J Cell Physiol 2018;233:2225-37. avaliaram o efeito do triptolide no tratamento da DRD mediado pelo microRNA-137. A expressão do microRNA-137 estava significativamente diminuída nas células expostas à hiperglicemia e nos tecidos renais dos ratos diabéticos, mas foi estimulada pelo triptolide. O aumento da expressão do microRNA-137 exerceu efeitos semelhantes aos do triptolide, enquanto que a inibição do microRNA-137 agravou o acúmulo de proteínas na matriz extracelular. Os efeitos dependentes do microRNA-137 foram associados a um aumento da expressão de Notch1, que, por sua vez, inibe a expressão de proteínas na matriz extracelular, mediadoras importantes da glomeruloesclerose.
O mecanismo de ação dos microRNAs que apresentam possível efeito nefroprotetor ou nefropatogênico está esquematizado nas Figuras 1 e 2, respectivamente. A estimulação da expressão dos microRNAs que possivelmente apresentam efeito nefroprotetor e a inibição da expressão daqueles que apresentam possível efeito nefropatogênico consistem em estratégias promissoras para o tratamento da DRD.
Mecanismo de acao dos microRNAs com possivel efeito nefroprotetor. DRD = doenca renal do diabetes; TGFβ = fator transformante de crescimento beta.
Mecanismo de acao dos microRNAs com possivel efeito nefropatogenico. DRD = doenca renal do diabetes; IL6 = interleucina 6; TGFβ = fator transformante de crescimento beta; TNFα = fator de necrose tumoral alfa.
Conclusões
Vários microRNAs estão envolvidos na patogênese da DRD por meio do aumento da expressão de moléculas inflamatórias, fibróticas e do estresse oxidativo, e por isso são alvos terapêuticos promissores para o tratamento da DRD. Alguns microRNAs ainda têm papel nefroprotetor, de modo que a estimulação da sua expressão pode auxiliar na prevenção e na terapêutica da DRD.
Como os níveis séricos e urinários de diferentes microRNAs se alteram antes do aumento da albuminúria ou do declínio da TFG, e eles são relativamente estáveis nessas amostras biológicas, os microRNAs são biomarcadores interessantes para o diagnóstico precoce da DRD. Além disso, os níveis de alguns microRNAs se alteram com a progressão da DRD, de modo que a sua dosagem laboratorial pode ser útil para o monitoramento da evolução da DRD.
Apesar das limitações deste trabalho, é possível concluir que as perspectivas em relação aos microRNAs são muito promissoras, já que eles poderão complementar futuramente os biomarcadores já existentes no diagnóstico precoce e no monitoramento da DRD, além de ser alvos de fármacos que poderão auxiliar no tratamento da DRD.
References
-
1Kato M, Arce L, Wang M, Putta S, Lanting L, Natarajan R. A microRNA circuit mediates transforming growth factor-β1 autoregulation in renal glomerular mesangial cells. Kidney Int 2011;80:358-68.
-
2Ma J, Zhang L, Hao J, Li N, Tang J, Hao L. Up-regulation of microRNA-93 inhibits TGF-β1 induced EMT and renal fibrogenesis by down-regulation of Orai1. J Pharmacol Sci 2018;136:218-27.
-
3Diretrizes da Sociedade Brasileira de Diabetes 2017-2018. São Paulo: Editora Clannad; 2017.
-
4Porto JR, Gomes KB, Fernandes AP, Domingueti CP. Avaliação da função renal na doença renal crônica. Rev Bras Anal Clin 2017;49:26-35.
-
5Peres LAB, Cunha Júnior AD, Schäfer AJ, Silva AL, Gaspar AD, Scarpari DF, et al. Biomarcadores da injúria renal aguda. J Bras Nefrol 2013;35:229-36.
-
6Moura J, Børsheim E, Carvalho E. The Role ofMicroRNAs in Diabetic Complications-Special Emphasis on Wound Healing. Genes (Basel) 2014;5:926-56.
-
7Wang G, Kwan BC, Lai FM, Chow KM, Li PK, Szeto CC. Urinary sediment miRNA levels in adult nephrotic syndrome. Clin Chimi Acta 2013;418:5-11.
-
8Kölling M, Kaucsar T, Schauerte C, Hübner A, Dettling A, Park JK, et al. Therapeutic miR21 Silencing Ameliorates Diabetic Kidney Disease in mice. Mol Ther 2017;25:165-80.
-
9Kumar M, Nath S, Prasad HK, Sharma GD, Li Y. MicroRNAs: a new ray of hope for diabetes mellitus. Protein Cell 2012;3:726-38.
-
10Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int Suppl 2013;3:1-150.
-
11American Diabetes Association (ADA). Diabetes Advocacy. Sec. 14. In Standards of Medical Care in Diabetes 2016. Diabetes Care 2016;39:s105-s106.
-
12Sociedade Brasileira de Diabetes (SBD), Sociedade Brasileira de Endocrinologia e Metabologia (SBEM), Sociedade Brasileira de Nefrologia (SBN). Prevenção, diagnóstico e conduta terapêutica na doença renal do diabetes. Posicionamento Oficial Tripartite nº 01/2016. São Paulo: Sociedade Brasileira de Diabetes, Sociedade Brasileira de Endocrinologia e Metabologia, Sociedade Brasileira de Nefrologia; 2016.
-
13Kato M, Natarajan R. MicroRNAs in diabetic nephropathy: functions, biomarkers, and therapeutic targets. Ann N Y Acad Sci 2015;1353:72-88.
-
14Bhatt K, Kato M, Natarajan R. Minireview: emerging roles of microRNAs in the pathophysiology of renal diseases. Am J Physiol Renal Physiol 2016;310:F109-18.
-
15Kato M, Castro NE, Natarajan R. MicroRNAs: potential mediators and biomarkers of diabetic complications. Free Radic Biol Med 2013;64:85-94.
-
16Costa EBO, Pacheco C. MicroRNAs: perspectivas atuais da regulação da expressão gênica em eucariotos. Biosaúde 2012;14:81-93.
-
17Sohel MH. Extracellular/Circulating MicroRNAs: Release Mechanisms, Functions and Challenges. Achiev Life Sci 2016;10:175-86.
-
18He F, Xia X, Wu XF, Yu XQ, Huang FX. Diabetic retinopathy in predicting diabetic nephropathy in patients with type 2 diabetes and renal disease: a meta-analysis. Diabetologia 2013;56:457-66.
-
19Padmashree DG, Swamy NR. Molecular signaling cascade of miRNAs in causing Diabetes Nephropathy. Bioinformation 2013;9:401-8.
-
20Novák J, Kružliak P, Bienertová-Vašků J, Slabý O, Novák M. MicroRNA-206: a Promising Theranostic Marker. Theranostics 2014;4:119-33.
-
21Zhu Z, Yin J, Li DC, Mao ZQ. Role of microRNAs in the treatment of type 2 diabetes mellitus with Roux-en-Y gastric bypass. Braz J Med Biol Res 2017;50:e5817.
-
22Nassirpour R, Raj D, Townsend R, Argyropoulos C. MicroRNA biomarkers in clinical renal disease: from diabetic nephropathy renal transplantation and beyond. Food Chem Toxicol 2016;98:73-88.
-
23Al-Kafaji G, Al-Mahroos G, Al-Muhtaresh HA, Skrypnyk C, Sabry MA, Ramadan AR. Decreased expression of circulating microRNA-126 in patients with type 2 diabetic nephropathy: A potential blood-based biomarker. Exp Ther Med 2016;12:815-22.
-
24Argyropoulos C, Wang K, McClarty, Huang D, Bernardo J, Ellis D, et al. Urinary microRNA profiling in the nephropathy of type 1 diabetes. PLoS One 2013;8:e54662.
-
25Argyropoulos C, Wang K, Bernardo J, Ellis D, Orchard T, Galas D, et al. Urinary MicroRNA Profiling Predicts the Development of Microalbuminuria in Patients with Type 1 Diabetes. J Clin Med 2015;4:1498-517.
-
26Barutta F, Tricarico M, Corbelli A, Annaratone L, Pinach S, Grimaldi S, et al. Urinary exosomal microRNAs in incipient diabetic nephropathy. PLoS One 2013;8:e73798.
-
27Barutta F, Bruno G, Matullo G, Chatuverdi N, Grimaldi S, Schalkwijk C, et al. MicroRNA-126 and micro-/macrovascular complications of type 1 diabetes in the EURODIAB Prospective Complications Study. Acta Diabetol 2017;54:133-9.
-
28Bijkerk R, Duijs JM, Khairoun M, Ter Horst CJ, Van der Pol P, Mallat MJ, et al. Circulating microRNAs associate with diabetic nephropathy and systemic microvascular damage and normalize after simultaneous pancreas kidney transplantation. Am J Transplant 2015;15:1081-90.
-
29Wang C, Wan S, Yang T, Niu D, Zhang A, Yang C, et al. Increased serum microRNAs are closely associated with the presence of microvascular complications in type 2 diabetes mellitus. Sci Rep 2016;6:20032.
-
30El-Samahy MH, Adly AA, Elhenawy YI, Ismail EA, Pessar SA, Mowafy ME, et al. Urinary miRNA-377 and miRNA-216a as biomarkers of nephropathy and subclinical atherosclerotic risk in pediatric patients with type 1 diabetes. J Diabetes Complications 2018;32:185-92.
-
31Park S, Moon SR, Lee K, Park IB, Lee DH, Nam S. Urinary and Blood MicroRNA-126 and -770 are Potential Noninvasive Biomarker Candidates for Diabetic Nephropathy: a Meta-Analysis. Cel Physiol Biochem 2018;46:1331-40.
-
32Yang Y, Xiao L, Li J, Kanwar YS, Liu F, Sun l. Urine miRNAs: potential biomarkers for monitoring progression of early stages of diabetic nephropathy. Med Hypotheses 2013;81:274-8.
-
33Assmann TS, Recamonde-Mendoza M, de Souza BM, Bauer AC, Crispim D. MicroRNAs and diabetic kidney disease: Systematic review and bioinformatic analysis. Mol Cell Endocrinol 2018;477:90-102.
-
34Gholaminejad A, Abdul Tehrani H, Gholami Fesharaki M. Identification of candidate microRNA biomarkers in diabetic nephropathy: a meta-analysis of profiling studies. J Nephrol 2018;31:813-31.
-
35Gholaminejad A, Abdul Tehrani H, Gholami Fesharaki M. Identification of candidate microRNA biomarkers in renal fibrosis: a meta-analysis of profiling studies. Biomarkers 2018;23:713-24.
-
36Kang WL, Xu GS. Atrasentan increased the expression of klotho by mediating miR-199b-5p and prevented renal tubular injury in diabetic nephropathy. Sci Rep 2016;6:19979.
-
37Marshall SM. Recent advances in diabetic nephropathy. Postgrad Med J 2004;80:624-33.
-
38Zhu X, Zhang C, Fan Q, Liu X, Yang G, Jiang Y, et al. Inhibiting MicroRNA-503 and MicroRNA-181d with Losartan Ameliorates Diabetic Nephropathy in KKAy Mice. Med Sci Monit 2016;22:3902-9.
-
39Bai X, Geng J, Zhou Z, Tian J, Li X. MicroRNA-130b improves renal tubulointerstitial fibrosis via repression of Snail-induced epithelial-mesenchymal transition in diabetic nephropathy. Sci Rep 2016;6:20475.
-
40Guo J, Li J, Zhao J, Yang S, Wang L, Cheng G, et al. MiRNA-29c regulates the expression of inflammatory cytokines in diabetic nephropathy by targeting tristetraprolin. Sci Rep 2017;7:2314.
-
41Shao Y, Lv C, Wu C, Zhou Y, Wang Q. Mir-217 promotes inflammation and fibrosis in high glucose cultured rat glomerular mesangial cells via Sirt1/HIF-1α signaling pathway. Diabetes Metab Res Rev 2016;32:534-43.
-
42Zheng Z, Guan M, Jia Y, Wang D, Pang R, Lv F, et al. The coordinated roles of miR-26a and miR-30c in regulating TGFβ1-induced epithelial-to-mesenchymal transition in diabetic nephropathy. Sci Rep 2016;6:37492.
-
43Wu L, Wang Q, Guo F, Ma X, Ji H, Liu F, et al. MicroRNA-27a Induces Mesangial Cell Injury by Targeting of PPARγ, and its In Vivo Knockdown Prevents Progression of Diabetic Nephropathy. Sci Rep 2016;6:26072.
-
44Civantos E, Bosch E, Ramirez E, Zhenyukh O, Egido J, Lorenzo O, et al. Sitagliptin ameliorates oxidative stress in experimental diabetic nephropathy by diminishing the miR-200a/Keap-1/Nrf2 antioxidant pathway. Diabetes Metab Syndr Obes 2017;10:207-22.
-
45Xu XH, Ding DF, Yong HJ, Dong CL, You N, Ye XL, et al. Resveratrol transcriptionally regulates miRNA-18a-5p expression ameliorating diabetic nephropathy via increasing autophagy. Eur Rev Med Pharmacol Sci 2017;21:4952-65.
-
46Han F, Wang S, Chang Y, Li C, Yang J, Han Z, et al. Triptolide prevents extracellular matrix accumulation in experimental diabetic kidney disease by targeting microRNA-137/Notch1 pathway. J Cell Physiol 2018;233:2225-37.
Datas de Publicação
-
Publicação nesta coleção
07 Fev 2019 -
Data do Fascículo
Jul-Sep 2019
Histórico
-
Recebido
01 Ago 2018 -
Aceito
30 Nov 2018