Resumo
Este estudo teve por objetivo comparar os efeitos do exercício agudo com carga de trabalho relativa em gastrocnêmio de ratos Wistar com três e 18 meses. Os animais foram divididos em quatro grupos (n = 6): controle de três e 18 meses; exercício de três e 18 meses. Os grupos exercitados foram submetidos a uma única sessão de corrida na esteira com 60 minutos em velocidade de 0,8 km/h e 1,2 km/h. Foram analisados parâmetros do metabolismo (níveis de lactato, conteúdo de glicogênio, níveis de succinato desidrogenase, citocromo c oxidase e de estresse oxidativo (SOD, CAT e GPX). Os resultados mostraram um aumento nos marcadores metabólicos após o exercício agudo independentemente da idade dos animais e similaridade nos danos oxidativos apesar de as enzimas antioxidantes apresentarem modulação diferenciada nos animais mais velhos em comparação com animais jovens.
PALAVRAS-CHAVE
Exercício agudo; Envelhecimento; Dano oxidativo; Estresse oxidativo; Músculo
Abstract
The effects of exercise on the generation of reactive oxygen species and the response to muscle oxidative stress determines longevity. This study compares the effects of acute exercise with similar relative workload in rats with 3 and 18 months. The animals were divided into four groups (n = 6): control 3-months; exercise 3-months; control 18-months and exercise 18-months. Exercised groups underwent to a single bout of running with 60 minutes in the speed 0.8 km/h (18 months) and 1.2 km/h (3 months). Metabolic parameters (lactate levels, glycogen content, succinate dehydrogenase levels, cytochrome c oxidase) and oxidative stress (activity of superoxide dismutase, catalase and glutathione peroxidase). The results showed an increase in metabolic markers after acute exercise regardless of the age and similarity in oxidative damage even if the antioxidant enzymes are age-dependent. These results suggest that the effects of acute exercise at moderate intensity, affects the metabolism independent of age, and, that the differential response in enzymatic antioxidant system between groups do not promote protection against oxidative damage.
KEYWORDS
Acute exercise; Aging; Oxidative damage; Oxidative stresso; Muscle
Este estudio ha tenido como objetivo comparar los efectos del ejercicio agudo con carga de trabajo relativamente similar en el gastrocnemio de ratas Wistar con 3 y 8 meses. Se separó a los animales en cuatro grupos (n = 6): control de 3 y 18 meses, y ejercicio de 3 y 18 meses. Se sometió a los grupos de ejercicio a una sola sesión de carrera en la cinta durante 60 minutos con una velocidad de 0,8 km/h y 1,2 km/h. Se analizaron algunos parámetros del metabolismo (niveles de lactato, contenido de glucógeno, niveles de succionato-deshidrogenasa, citocromo c-oxidasa e de estrés oxidativo [superóxido-dismutasa, catalasa y glutatión-peroxidasa]). Los resultados mostraron un aumento de los marcadores metabólicos después del ejercicio agudo independientemente de la edad de los animales y la similitud de los daños oxidativos aunque las enzimas antioxidantes presentan modulación diferenciada en animales viejos en comparación con animales jóvenes.
PALABRAS CLAVE
Ejercicio agudo; Envejecimiento; Daño oxidativo; Estrés oxidativo; músculo
Introdução
Estudos sobre o envelhecimento ou senescência e exercício têm sido amplamente feitos, principalmente porque os dados epidemiológicos têm demonstrado que um estilo de vida fisicamente ativo tem vários benefícios para a saúde na redução do risco de doenças associadas à idade, tais como doenças cardiovasculares e neurológicas, diabetes tipo 2, câncer e osteoporose (Larson et al., 2006Larson EB, Wang L, Bowen JD, McCormick WC, Teri L, Crane P, et al. Exercise is associated with reduced risk for incident dementia among persons 65 years of age and older. Ann Intern Med. 2006;144(2):73-81.).
A senescência é marcada por um declínio progressivo da função muscular, que ocorre em nível molecular, celular e nos tecidos do organismo (Campisi, 2012Campisi J. Aging, cellular senescence, and cancer. Annu Rev Physiol. 2012;75:685-705.
https://doi.org/10.1146/annurev-physiol-...
), e está ligado ao estresse oxidativo devido à produção excessiva de espécies reativas de oxigênio (ERO). Danos a biomoléculas por ERO promovem mutações genéticas, alteraram a homeostase celular e formam resíduos químicos e outros compostos relacionados com o processo de envelhecimento (Halliwell & Gutteridge, 2007Halliwell B, Gutteridge MC. Free radicals in biology and medicine. Oxford: university press; 2007. p. 888.).
Em condições normais, os músculos esqueléticos mais velhos são mais suscetíveis à produção de ERO do que músculos jovens (Haak et al., 2009Haak JL, Buettner GR, Spitz DR, Kregel KC. Aging augments mitochondrial susceptibility to heat stress. Am J Physiol Regul Integr Comp Physiol. 2009;296(3):R812-20, http://dx.doi.org/10.1152/ajpregu.90708.2008
http://dx.doi.org/10.1152/ajpregu.90708....
). Essa observação é importante porque essas espécies podem aumentar a taxa de oxidação de proteínas e lipídeos, bem como levar à oxidação do DNA. Além disso, os músculos esqueléticos mais velhos são mais susceptíveis ao impacto e aos consequentes processos inflamatórios que podem modificar a homeostase intracelular oxidante-antioxidante.
Programas de exercícios físicos são altamente recomendados para pessoas de todas as idades. No entanto o exercício aumenta a produção de ROS e, consequentemente, provoca estresse oxidativo em vários órgãos e tecidos (Tromm et al., 2012Tromm CB, Rosa GL, Bom K, Mariano I, Pozzi B, Tuon T, et al. Effect of different frequencies weekly training on parameters of oxidative stress. Rev Bras Cineantropom Desempenho Hum. 2012;14(1).). Por outro lado, vários estudos têm demonstrado que o exercício físico moderado altera o estado redox das células e tecidos positivamente e melhora parâmetros de estresse oxidativo (Scheffer et al., 2012Scheffer DL, Silva LA, Tromm CB, Rosa GL, Silveira PC, Souza CT, et al. Impact of different resistance training protocols on muscular oxidative stress parameters. Appl Physiol Nutr Metab. 2012;37(6):1239-46.; Silva et al., 2013Silva LA, Tromm CB, Da Rosa G, Bom K, Luciano TF, Tuon T, et al. Creatine supplementation does not decrease oxidative stress and inflammation in skeletal muscle after eccentric exercise. J Sports Sci. 2013;31(11):1164-76.).
O exercício agudo é também bem conhecido por aumentar acentuadamente o metabolismo celular e os parâmetros inflamatórios, o que pode conduzir a um aumento da geração de ERO e resultar em danos oxidativos. Assim, diferentes modelos e intensidade de exercício promovem respostas diferentes nos níveis de stress oxidativo e, por esse motivo, a depender da dose-resposta do exercício no músculo, os mecanismos de proteção podem ser diferenciados (Pinho et al., 2010Pinho RA, Silva LA, Pinho CA, Scheffer DL, Souza CT, Benetti M, et al. Oxidative stress and inflammatory parameters after an Ironman race. Clin J Sport Med. 2010;20(4):306-11.). Alterações agudas promovidas pelo exercício físico no contexto da atividade das enzimas antioxidantes podem fornecer maior proteção contra o estresse oxidativo. No entanto, o sistema de defesa antioxidante dos músculos esqueléticos mais velhos pode se adaptar de forma menos eficiente para se defender contra a produção de ERO em relação aos animais jovens. Contudo, estudos que mostrem essa hipótese ainda são inconclusivos. Desse modo, o objetivo deste estudo foi comparar parâmetros de estresse oxidativo no músculo gastrocnêmio após o exercício agudo com carga de trabalho semelhante em animais de diferentes idades.
Material e métodos
Animais: neste estudo foram usados ratos Wistar machos com três e 18 meses, pesavam 325 g ± 18 e 575 g ± 35 respectivamente. Foram alojados cinco animais por gaiola, num ciclo claro/escuro de 12 h de luz (luzes acesas às 7h), com acesso livre a alimento (Nuvilab CR1, Nuvital Nutrientes S/A, Brasil) e água. Todos os procedimentos experimentais foram feitos de acordo com as Diretrizes Brasileiras para o Cuidado e Uso de Animais para Fins Científicos e Didáticos (DOU 27/5/13, MCTI, p. 7) e aprovado pelo Comitê de Ética da Universidade do Extremo Sul Catarinense (protocolo 016/2013), Criciúma (SC).
Protocolos de exercícios: todos os animais foram familiarizados com corrida em esteira por uma semana (0,6 km/h, sem inclinação, 10 min/dia). Vinte e quatro horas após o período de adaptação, os animais foram divididos em quatro grupos (n = 6), que foram denominados: controle de três meses; exercício de três meses; controle de 18 meses e exercício de 18 meses. Todos os grupos foram submetidos a uma única sessão de exercício com 60 minutos de duração em esteira. O exercício foi feito com uma velocidade de 0,8 km/h para os animais de 18 meses e 1,2 km/h para animais de três meses. A intensidade da sessão de exercício foi cuidadosamente aplicada nesses dois grupos para corresponder aproximadamente a 60% do máximo de absorção de oxigênio, de acordo com estudo prévio de Koltai et al. (Koltai et al., 2012aKoltai E, Hart N, Taylor AW, Goto S, Ngo JK, Davies KJ, et al. Age-associated declines in mitochondrial biogenesis and protein quality control factors are minimized by exercise training. Am J Physiol Regul Integr Comp Physiol. 2012;303(2):R127-34.).
Coleta do tecido: imediatamente após a sessão de exercício, os animais foram eutanasiados e o músculo gastrocnêmio foi removido cirurgicamente. Uma amostra de tecido foi processada para medir o teor de glicogênio muscular e outra foi homogeneizada para dosar a proteína intracelular por Western blot. O homogenato foi então centrifugado a 11.000 rpm durante 40 min para remover os materiais insolúveis. O sobrenadante foi usado para determinar a concentração de proteína, com o uso do método de Bradford. O extrato total foi armazenado em freezer a -80 ºC para posterior análise. O restante da amostra foi aliquotado e armazenado imediatamente num congelador a -80 ºC para análise posterior de parâmetros de estresse oxidativo.
Marcadores metabólicos: os níveis de lactato foram determinados em uma amostra de sangue retirado da veia caudal com o uso do lactímetro (Accutrend Lactate, Roche, Barcelona, Espanha) imediatamente após a sessão de exercício nos grupos treinados. Os níveis de lactato foram expressos como nmol lactato.L-1 de sangue. O conteúdo de glicogênio muscular foi quantificado pela reação com iodeto de potássio (KI) mais iodo (l2) (Krisman, 1962Krisman CR. A method for the colorimetric estimation of glycogen with iodine. Anal Biochem. 1962;4:17-23.).
Danos oxidativos: a oxidação de lípidos foi avaliada através da formação de espécies reativas do ácido tiobarbitúrico (TBARS) durante uma reação em aquecimento (Draper & Hadley, 1990Draper HH, Hadley M. Malondialdehyde determination as index of lipid peroxidation. Meth Enzymol. 1990;186:421-31.). A oxidação das proteínas foi avaliada por meio da determinação de grupos carbonil baseado na reação com dinitrofenilhidrazina (DNPH) (Levine et al., 1990Levine RL, Garland D, Oliver CN, Amici A, Climent I, Lenz AG, et al. Determination of carbonyl content in oxidatively modified proteins. Meth Enzymol. 1990;186:464-78.). O índice de oxidação da proteína também foi avaliada pelo conteúdo de tióis totais com o uso da técnica Aksenov e Markesbery (Aksenov & Markesbery, 2001Aksenov MY, Markesbery WR. Changes in thiol content and expression of glutathione redox system genes in the hippocampus and cerebellum in Alzheimer's disease. Neurosci Lett. 2001;302:141-5.).
Enzimas antioxidantes: a superóxido dismutase (SOD) foi determinada por inibição da oxidação da adrenalina de acordo com o estudo feito por Bannister & Calabrese, 1987Bannister JV, Calabrese L. Assay for SOD. Meth Biochem Anal. 1987;32:279-312.). A catalase (CAT) foi determinada com base na taxa de decomposição de peróxido de hidrogênio (H2O2) pela enzima presente na amostra, de acordo com Aebi (Aebi, 1984Aebi H. Catalase in vitro. Meth. Enzymol. 1984;105:121-6.). A atividade da glutationa peroxidase (GPX) foi determinada a partir da dismutação tert butil hidroperóxido por oxidação de GSH catalisada pela GPX e formação de GSSG como descrito por Flohé e Günzler (Flohé & Gunzler, 1984Flohé L, Gunzler W. Assays of glutathione peroxidase. Meth Enzymol. 1984;105:114-21.).
Conteúdo proteico: o conteúdo de proteína foi mensurado com o uso de albumina de soro bovino como padrão, como descrito por Lowry et al. (Lowry et al., 1951Lowry OH, Rosebrough NJ, Farr AL, Randall RJ. Protein measurement with the Folin phenol reagent. J Biol Chem. 1951;193:265-7.).
Análise proteica por immunoblotting: as proteínas foram ressuspensas e conservadas em tampão de Laemmli, que continha 100 mmol/L de DTT, e, posteriormente, foi feita a determinação do immunoblot com anticorpos específicos. Alíquotas que continham 250 µg de proteína por amostra foram aplicadas sobre gel de poliacrilamida (SDS-PAGE). A eletroforese foi feita com solução tampão para eletroforese, previamente diluída. As proteínas separadas foram transferidas para a membrana de nitrocelulose e incubadas em solução de bloqueio por 2 h à temperatura ambiente. A imunotransferência foi conduzida com antissuccinato desidrogenase, SDH (SC-25.851) (1:1000) e anti-Citocromo C oxidase, cit-C oxidase (SC-13560) (1:1.000) de Santa Cruz (Santa Cruz Biotecnologia, CA, EUA) sob agitação constante, overnight, a 4 ºC. Após, as membranas foram incubadas em solução com anticorpo secundário conjugado com peroxidase, durante 2 h à temperatura ambiente, seguido por incubação por 2 min em substrato enzimático (e expostas ao filme de RX em cassete de revelação autorradiográfica). A visualização das bandas foi determinada por exposição das membranas a películas-RX. Intensidades de banda foram quantificadas por densitometria óptica (software Scion Image, ScionCorp, Frederick, MD) e os resultados foram expressos como unidades arbitrárias.
Análise estatística: os dados foram expressos como média e o erro padrão das médias (média ± SEM) e analisados estatisticamente com o uso de Anova de uma via, seguida pelo post hoc de Tukey. O nível de significância foi fixado em 95% (p < 0,05). Os dados foram analisados com o uso de SPSS.
Resultados
Marcadores metabólicos: de acordo com a figura 1, os animais de três meses expostos ao exercício apresentaram um aumento nos níveis lactato (5,05 ± 0,13 nmol/L), nível de proteína de SDH (6428 ± 365 unidades arbitrárias) e cit-C oxidase (4.638 ± 302 unidades arbitrárias) e uma redução no conteúdo de glicogênio muscular (1,0 ± 0,07 µg/mg músculo), quando comparados com os animais controles (1,45 ± 0,18nmol/L; 2.345 ± 187 unidades arbitrárias; e 1.717 ± 239 unidades arbitrárias, 1,7 ± 0,1 µg/mg músculo respectivamente). Esses mesmos efeitos do exercício agudo observado nos animais jovens foram observados nos animais com 18 meses, os quais apresentaram um aumento no nível de lactato (4,22 ± 0,18nmol/L), SDH (4.501 ± 311 unidades arbitrárias) e Cit-C oxidase (2.913 ± 211 unidades arbitrárias) e uma redução no conteúdo de glicogênio (1,1 ± 0,2 µg/mg múscular) em relação ao grupo controle (2,2 ± 0,20 nmol/L; 2109 ± 194 unidades arbitrárias; e 1.631 ± 295 unidades arbitrárias, 1,8 ± 0,1 µg/mg muscular, respectivamente). Adicionalmente, uma redução nos níveis de Cit-C foram observados nos animais exercitados de 18 meses em comparação com os animais de três meses.
Efeitos do exercício físico agudo sobre os níveis de lacato sanguíneo (A), conteúdo do glicogênio (B), nível da succinato desidrogenase (C) e atividade da citocromo c oxidase (D) no gastrocnêmio de ratos Wistar com de três e 18 meses. Os dados foram expressos como média ± erro padrão da média. Um p ≤ 0,05 foi considerado estatisticamente diferente ao comparar os animais exercitados aos respectivos controles (*) e aos animais exercitados de três meses (#). Foi usada a Anova, seguida pelo teste post hoc de Tukey.
Enzimas antioxidantes: a figura 2 mostra uma redução na atividade da SOD e da CAT nos animais de três meses expostos ao exercício (0,14 ± 0,04U/mg de proteína; 0,006 ± 0,001U/mg de proteína, respectivamente) quando comparados com os do grupo controle (0,28 ± 0,02U/mg de proteína; 0,017 ± 0,0009U/mg de proteína). Os animais de 18 meses expostos ao exercício também exibiram uma atividade da CAT reduzida (0,01 ± 0,002U/mg de proteína) em comparação com o controle (0,02 ± 0,001U/mg de proteína). Entretanto, a atividade da SOD (0,35 ± 0,03U/mg de proteína) foi aumentada quando comparado com o controle (0,28 ± 0,02 U/mg de proteína) e aos animais de três meses. Um aumento da atividade da GPx foi observado apenas nos animais de 18 meses expostos ao exercício (0,21 ± 0,03nmol NADPH/min/mg de proteína) quando comparado com grupos controle e três meses (0,13 ± 0,02nmol NADPH/min/mg de proteína, 0,13 ± 0,03 nmol NADPH/min/mg de proteína, respectivamente).
Efeitos do exercício físico agudo sobre a atividade da superóxido dismutase (A), caltalase (B) e glutationa peroxidase (C) no gastrocnêmio de ratos Wistar de três e 18 meses. Os dados foram expressos como média ± erro padrão da média. Um p ≤ 0,05 foi considerado estatisticamente diferente ao comparar os animais exercitados aos respectivos controles (*) e aos animais exercitados de três meses (#). Foi usada a Anova, seguida pelo teste post hoc de Tukey.
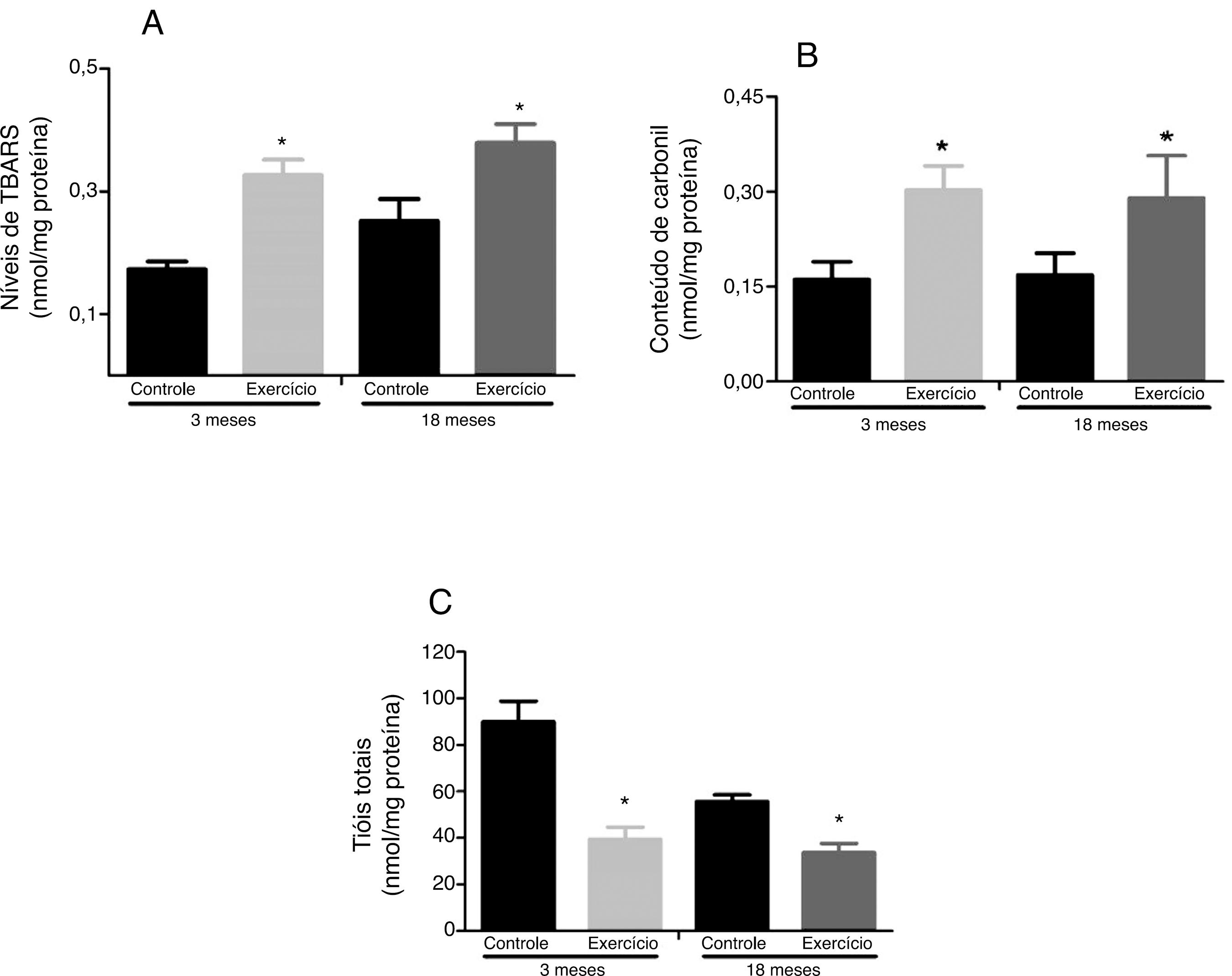
Marcadores de danos oxidativos: os dados da figura 3 mostram um aumento na peroxidação lipídica nos animais de três meses (0,32 ± 0,02nmol/mg de proteína) e 18 meses (0,37 ± 0,03nmol/mg de proteína) expostos ao exercício quando comparados com os respectivos controles (0,17 ± 0,01nmol/mg de proteína; 0,25 ± 0,03nmol/mg de proteína). Similarmente aos efeitos do exercício observados na lipoperoxidação, o conteúdo de grupo carbonila também foi aumentado em ambos os grupos exercitados (três meses, 0,30 ± 0,03nmol/mg de proteína; 18 meses, 0,28 ± 0,07nmol/mg de proteína) quando comparado com os respectivos controles (três meses, 0,16 ± 0,02nmol/mg de proteína; 18 meses, 0,16 ± 0,03nmol/mg de proteína). Os animais de três meses e 18 meses expostos ao exercício agudo exibiram reduzidos níveis de tióis totais (39,4 ± 5,2 TNB/mg de proteína; 33,7 ± 3,8 TNB/mg de proteína, respectivamente) quando comparado com os respectivos controles (89,9 ± 8,8 TNB/mg de proteína; 55,6 ± 2,9 TNB/mg de proteína).
Efeitos do exercício físico agudo sobre o nível de substâncias reativas ao aquecimento do ácido tiobarbitúrico, TBARS (A), conteúdo de proteínas carboniladas (B) e oxidação de grupamentos sulfidrilas (C) no gastrocnêmio de ratos Wistar de três e 18 meses. Os dados foram expressos como média ± erro padrão da media. Um p ≤ 0,05 foi considerado estatisticamente diferente ao comparar os animais exercitados com os respectivos controles (*) e aos animais exercitados de três meses (#). Foi usada a Anova, seguida pelo teste post hoc de Tukey.
Discussão
A presente investigação examinou os efeitos do exercício agudo sobre os parâmetros metabólicos e de estresse oxidativo no gastrocnêmio de ratos de diferentes idades. Embora vários estudos tenham identificado o papel do estresse oxidativo muscular durante o processo de envelhecimento, ainda há inconsistência sobre os efeitos do exercício físico agudo sobre a musculatura esquelética em diferentes idades, particularmente sobre os parâmetros do metabolismo oxidativo, da capacidade de defesa antioxidante e dano oxidativo muscular.
Uma das principais alterações do exercício agudo é a mudança no conteúdo e na atividade de enzimas glicolíticas e oxidativas dos músculos envolvidos, as quais regulam o estado redox celular. Os efeitos do exercício sobre o estado redox são inconclusivos, pois a literatura tem relatado que o exercício melhora (Ghosh et al., 2011Ghosh S, Lertwattanarak R, Lefort N, Molina-Carrion M, Joya-Galeana J, Bowen BP, et al. Reduction in reactive oxygen species production by mitochondria from elderly subjects with normal and impaired glucose tolerance. Diabetes. 2011;60:2051-60.), atenua (Hatao et al., 2006Hatao H, Oh-ishi S, Itoh M, Leeuwenburgh C, Ohno H, Ookawara T, et al. Effects of acute exercise on lung antioxidant enzymes in young and old rats. Mech Ageing Dev. 2006;127(4):384-90.) ou, ainda, não afeta (Radak et al., 2011Radak Z, Bori Z, Koltai E, Fatouros IG, Jamurtas AZ, Douroudos II, et al. Age-dependent changes in 8-oxoguanine-DNA glycosylase activity are modulated by adaptive responses to physical exercise in human skeletal muscle. Free Radic Biol Med. 2011;51:417-23.) a homeostase redox do músculo. As alterações que ocorrem no estado redox muscular são dependentes da tensão imposta sobre a via metabólica (Pinho et al., 2012Pinho RA, Silva LD, Pinho CA, Daufenbach JF, Rezin GT, Silva LA, et al. Alterations in muscular oxidative metabolism parameters in incremental treadmill exercise test in untrained rats. Eur J Appl Physiol. 2012;112(1):387-96.). Contudo, a alteração no metabolismo oxidativo celular e na sua capacidade de geração de energia é importante no equilíbrio entre a produção de oxidantes, como as espécies reativas de oxigênio, e o sistema de defesa antioxidante, particularmente os de origem enzimáticas.
Nesse estudo os níveis de lactato e conteúdo de glicogênio muscular foram usados como indicadores da intensidade do exercício, bem como do metabolismo glicolítico. Os dados apresentados na figura 1A e 1B sugerem similaridade no uso da via glicolítica entre as diferentes idades. O modelo da intensidade do exercício usado causou, praticamente, um aumento de três vezes, no pós-exercício, na concentração de lactato sanguíneo, o que sugere um componente glicolítico na sessão do exercício feito. A depleção acelerada do glicogênio muscular com consequente formação de metabólitos, como o lactato, em exercícios com intensidade progressiva parecem não ser dependente da diferença de idade, provavelmente porque um aumento da atividade glicolítica decorre da demanda metabólica imposta pelo esforço, o que estimula a atividade das enzimas catalíticas que compõem o metabolismo glicolítico muscular. Por outro lado, o metabolismo oxidativo parece ser mais afetado pelo envelhecimento de animais expostos a uma única sessão de esforço.
Independentemente da idade dos animais, o protocolo de exercício agudo promoveu significativos níveis ne SDH e citocromo c oxidase, o que sugere que sob essas intensidades o papel desempenhado pelo metabolismo oxidativo é mais predominante. No entanto, os animais de 18 meses exibiram níveis reduzidos de citocromo C oxidase após o exercício quando comparados com os animais mais jovens. Provavelmente, isso decorre devido às mudanças na biossíntese mitocondrial e que estão diretamente associadas ao envelhecimento.2 Resultados de estudos prévios indicam que os ratos mais velhos apresentam significativamente menos citocromo C em comparação com ratos jovens (Haak et al., 2009Haak JL, Buettner GR, Spitz DR, Kregel KC. Aging augments mitochondrial susceptibility to heat stress. Am J Physiol Regul Integr Comp Physiol. 2009;296(3):R812-20, http://dx.doi.org/10.1152/ajpregu.90708.2008
http://dx.doi.org/10.1152/ajpregu.90708....
). Nossos resultados estão de acordo com o estudo de Koltai et al. (Koltai et al., 2012bKoltai E, Hart N, Taylor AW, Goto S, Ngo JK, Davies KJ, et al. Age-associated declines in mitochondrial biogenesis and protein quality control factors are minimized by exercise training. Am J Physiol Regul Integr Comp Physiol. 2012;303(2):R127-34.) em que sugere que os níveis de proteínas oxidativas são mais elevados em animais mais jovens após o exercício. Taxas mais baixas na síntese de proteínas mitocondriais, distúrbios na atividade das enzimas mitocondriais e menor capacidade oxidativa e consequente síntese de ATP são relatados em tecido envelhecido como fatores que levam à redução dos níveis das proteínas oxidativas (Iqbal et al., 2013Iqbal S, Ostojic O, Singh K, Joseph AM, Hood DA. Expression of mitochondrial fission and fusion regulatory proteins in skeletal muscle during chronic use and disuse. Muscle Nerve. 2013;48(6):963-70.).
No envelhecimento, os níveis de estresse oxidativo são elevados e a capacidade antioxidante musculoesquelética é prejudicada (Cakatay et al., 2003Cakatay U, Telci A, Kayali R, Tekeli F, Akcay T, Sivas A. Relation of aging with oxidative protein damage parameters in the rat skeletal muscle. Clin Biochem. 2003;36:51-5.). Nesse sentido, é razoável supor que a senescência altera os eventos redox e aumenta a susceptibilidade dos músculos para lesão oxidativa durante o exercício. Mais de uma década atrás, Bejma e Ji (Jackson et al., 2007Jackson MJ, Pye D, Palomero J. The production of reactive oxygen and nitrogen species by skeletal muscle. J Appl Physiol. 2007;102(4):1664-70.) mostraram que após o exercício agudo a produção de oxidantes no músculo esquelético de ratos idosos é aumentada em relação a ratos jovens.
As alterações na atividade de enzimas antioxidantes foram observadas nos animais de três e 18 meses após exposição aguda ao exercício físico, porém as atividades enzimáticas mantiveram-se em patamares diferenciados. Após o exercício, animais de três meses apresentaram uma significativa redução na atividade da SOD e da CAT, enquanto que nos animais de 18 meses a atividade da SOD e da GPX foi aumentada e reduzida a atividade da CAT. Em níveis basais, atividades reduzidas de enzimas antioxidantes, como a SOD e CAT, em detrimento da produção de oxidantes, sugerem menos proteção contra a exposição a ERO. Entretanto, após o exercício o aumento na atividade da SOD observado nos animais de 18 meses pressupõe produção aumentada de peróxido de hidrogênio no tecido muscular. Na ausência de enzimas catalíticas como a CAT, os danos oxidativos podem ser mais evidentes. Contudo, animais de 18 meses também apresentaram atividade aumentada de GPX, o que pode compensar a atividade reduzida da CAT e, por conseguinte, promover a degradação o peróxido de hidrogênio produzido, o que não implica necessariamente menor dano oxidativo desses animais em relação aos animais mais jovens.
Estudos são divergentes em relação às mudanças relacionadas à idade e às defesas antioxidantes em vários órgãos (Hatao et al., 2006Hatao H, Oh-ishi S, Itoh M, Leeuwenburgh C, Ohno H, Ookawara T, et al. Effects of acute exercise on lung antioxidant enzymes in young and old rats. Mech Ageing Dev. 2006;127(4):384-90.). Tais mudanças dependem do tipo de fibra muscular que está mais ativada, o que sugere que as fibras de contração rápida parecem ser mais suscetíveis ao estresse oxidativo relacionado com a idade do que as fibras de contração lenta (Pinho et al., 2012Pinho RA, Silva LD, Pinho CA, Daufenbach JF, Rezin GT, Silva LA, et al. Alterations in muscular oxidative metabolism parameters in incremental treadmill exercise test in untrained rats. Eur J Appl Physiol. 2012;112(1):387-96.; Jackson et al., 2007Jackson MJ, Pye D, Palomero J. The production of reactive oxygen and nitrogen species by skeletal muscle. J Appl Physiol. 2007;102(4):1664-70.).
Baixos níveis de enzimas antioxidantes e/ou elevados níveis de oxidantes levam a danos oxidativos em biomoléculas como lipídeos, proteínas e ácidos nucleicos. Os resultados observados no presente estudo mostram que os danos oxidativos induzidos pelo exercício são independentes da idade. Estudos prévios como os de Bejma e Ji (Bejma, 1999Bejma J, and Ji LL (1999) Aging and acute exercise enhance free radical generation in rat skeletal muscle. J Appl Physiol 87(1):465-70.) e Nikolaidis et al. (Nikolaidis et al., 2013Nikolaidis MG, Kyparos A, Spanou C, Paschalis V, Theodorou AA, Panayiotou G, et al. Aging is not a barrier to muscle and redox adaptations: applying the repeated eccentric exercise model. Exp Gerontol. 2013;48(8):734-43.) apresentaram achados diferentes. Bejma e Ji (Bejma, 1999Bejma J, and Ji LL (1999) Aging and acute exercise enhance free radical generation in rat skeletal muscle. J Appl Physiol 87(1):465-70.) demonstraram que o conteúdo de MDA e carbonila foi influenciado pela idade ou pelo exercício. Uma das possíveis razões para a diferença de idade não promover resultados distintos pode estar relacionada à intensidade do exercício. Nikolaidis et al. (Nikolaidis et al., 2013Nikolaidis MG, Kyparos A, Spanou C, Paschalis V, Theodorou AA, Panayiotou G, et al. Aging is not a barrier to muscle and redox adaptations: applying the repeated eccentric exercise model. Exp Gerontol. 2013;48(8):734-43.) demonstraram maior oxidação de proteínas nos animais jovens e idosos após o exercício agudo excêntrico, mas um maior nível de peroxidação lipídica foi observado apenas em animais idosos. O modelo de exercício usado, com intensidade aproximada a 60% do VO2max, não foi suficiente para levar a danos oxidativos em diferentes níveis entre os animais de três e 18 meses.
Os grupamentos sufidrilas (tiol) são altamente susceptíveis à presença de ERO, os quais são facilmente oxidáveis, modificam a estrutura e a função das proteínas. Contudo, desempenham um papel antioxidante importante, somado às reações de catálise, regulação e transporte de elétrons e preservação da estrutura correta das proteínas (Hernanz et al., 2000Hernanz A, Fernández-Vivancos E, Salazar RM, Arnalich F. Homocysteine and other thiol compounds in ageing. Biofactors. 2000;11(1-2):47-9.). Vários estudos têm mostrado uma redução dependente da idade nos níveis totais de grupos sulfidrila. Iciek et al. (Hernanz et al., 2000Hernanz A, Fernández-Vivancos E, Salazar RM, Arnalich F. Homocysteine and other thiol compounds in ageing. Biofactors. 2000;11(1-2):47-9.) mostraram que a eficiência de S-tiolação (conjugação de proteínas com tióis e tióis não proteicos) como um mecanismo de defesa antioxidante diminui com a idade (de acordo com o nosso grupo de controle da mesma idade), o que leva a um aumento do risco de oxidação irreversível de grupos sulfidrila de proteínas. Nesse sentido, é possível que os resultados obtidos assegurem o papel antioxidante do tiol nos animais de três e 18 meses devido ao provável aumento na produção de ERO durante o exercício agudo, independentemente de níveis de repouso entre as diferentes idades.
Em conclusão, evidências nesse estudo mostraram que mudanças no metabolismo glicolítico e oxidativo são similares nos dois grupos exercitados, sugerem que o exercício agudo em uma intensidade moderada afeta o metabolismo independentemente da idade. Além disso, a musculatura esquelética (gastrocnêmio) de animais de três e 18 meses é similarmente susceptível aos danos oxidativos, embora a idade promova respostas diferenciadas no sistema antioxidante enzimático.
Comitê de ética
Todos os procedimentos experimentais foram feitos de acordo com as Diretrizes Brasileiras para o cuidado e uso de animais para fins científicos e didáticos (DOU 27/5/13, MCTI, p. 7) e aprovados pelo Comitê de Ética (protocolo 016/2013) da Universidade do Extremo Sul Catarinense (Criciúma, Brasil).
-
Apoio financeiroEsta pesquisa foi apoiada por doações do Fundo de Apoio à Manutenção e Desenvolvimento da Educação Superior (Fumdes), da Universidade do Extremo Sul Catarinense (Unesc), da Fundação de Amparo à Pesquisa do Estado de Santa Catarina (Fapesc), Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes) e Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq).
Referências
- Larson EB, Wang L, Bowen JD, McCormick WC, Teri L, Crane P, et al. Exercise is associated with reduced risk for incident dementia among persons 65 years of age and older. Ann Intern Med. 2006;144(2):73-81.
- Campisi J. Aging, cellular senescence, and cancer. Annu Rev Physiol. 2012;75:685-705.
» https://doi.org/10.1146/annurev-physiol-030212-183653 - Halliwell B, Gutteridge MC. Free radicals in biology and medicine. Oxford: university press; 2007. p. 888.
- Haak JL, Buettner GR, Spitz DR, Kregel KC. Aging augments mitochondrial susceptibility to heat stress. Am J Physiol Regul Integr Comp Physiol. 2009;296(3):R812-20, http://dx.doi.org/10.1152/ajpregu.90708.2008
» http://dx.doi.org/10.1152/ajpregu.90708.2008 - Tromm CB, Rosa GL, Bom K, Mariano I, Pozzi B, Tuon T, et al. Effect of different frequencies weekly training on parameters of oxidative stress. Rev Bras Cineantropom Desempenho Hum. 2012;14(1).
- Scheffer DL, Silva LA, Tromm CB, Rosa GL, Silveira PC, Souza CT, et al. Impact of different resistance training protocols on muscular oxidative stress parameters. Appl Physiol Nutr Metab. 2012;37(6):1239-46.
- Silva LA, Tromm CB, Da Rosa G, Bom K, Luciano TF, Tuon T, et al. Creatine supplementation does not decrease oxidative stress and inflammation in skeletal muscle after eccentric exercise. J Sports Sci. 2013;31(11):1164-76.
- Pinho RA, Silva LA, Pinho CA, Scheffer DL, Souza CT, Benetti M, et al. Oxidative stress and inflammatory parameters after an Ironman race. Clin J Sport Med. 2010;20(4):306-11.
- Koltai E, Hart N, Taylor AW, Goto S, Ngo JK, Davies KJ, et al. Age-associated declines in mitochondrial biogenesis and protein quality control factors are minimized by exercise training. Am J Physiol Regul Integr Comp Physiol. 2012;303(2):R127-34.
- Krisman CR. A method for the colorimetric estimation of glycogen with iodine. Anal Biochem. 1962;4:17-23.
- Draper HH, Hadley M. Malondialdehyde determination as index of lipid peroxidation. Meth Enzymol. 1990;186:421-31.
- Levine RL, Garland D, Oliver CN, Amici A, Climent I, Lenz AG, et al. Determination of carbonyl content in oxidatively modified proteins. Meth Enzymol. 1990;186:464-78.
- Aksenov MY, Markesbery WR. Changes in thiol content and expression of glutathione redox system genes in the hippocampus and cerebellum in Alzheimer's disease. Neurosci Lett. 2001;302:141-5.
- Bannister JV, Calabrese L. Assay for SOD. Meth Biochem Anal. 1987;32:279-312.
- Aebi H. Catalase in vitro. Meth. Enzymol. 1984;105:121-6.
- Flohé L, Gunzler W. Assays of glutathione peroxidase. Meth Enzymol. 1984;105:114-21.
- Lowry OH, Rosebrough NJ, Farr AL, Randall RJ. Protein measurement with the Folin phenol reagent. J Biol Chem. 1951;193:265-7.
- Ghosh S, Lertwattanarak R, Lefort N, Molina-Carrion M, Joya-Galeana J, Bowen BP, et al. Reduction in reactive oxygen species production by mitochondria from elderly subjects with normal and impaired glucose tolerance. Diabetes. 2011;60:2051-60.
- Hatao H, Oh-ishi S, Itoh M, Leeuwenburgh C, Ohno H, Ookawara T, et al. Effects of acute exercise on lung antioxidant enzymes in young and old rats. Mech Ageing Dev. 2006;127(4):384-90.
- Radak Z, Bori Z, Koltai E, Fatouros IG, Jamurtas AZ, Douroudos II, et al. Age-dependent changes in 8-oxoguanine-DNA glycosylase activity are modulated by adaptive responses to physical exercise in human skeletal muscle. Free Radic Biol Med. 2011;51:417-23.
- Pinho RA, Silva LD, Pinho CA, Daufenbach JF, Rezin GT, Silva LA, et al. Alterations in muscular oxidative metabolism parameters in incremental treadmill exercise test in untrained rats. Eur J Appl Physiol. 2012;112(1):387-96.
- Koltai E, Hart N, Taylor AW, Goto S, Ngo JK, Davies KJ, et al. Age-associated declines in mitochondrial biogenesis and protein quality control factors are minimized by exercise training. Am J Physiol Regul Integr Comp Physiol. 2012;303(2):R127-34.
- Iqbal S, Ostojic O, Singh K, Joseph AM, Hood DA. Expression of mitochondrial fission and fusion regulatory proteins in skeletal muscle during chronic use and disuse. Muscle Nerve. 2013;48(6):963-70.
- Cakatay U, Telci A, Kayali R, Tekeli F, Akcay T, Sivas A. Relation of aging with oxidative protein damage parameters in the rat skeletal muscle. Clin Biochem. 2003;36:51-5.
- Jackson MJ, Pye D, Palomero J. The production of reactive oxygen and nitrogen species by skeletal muscle. J Appl Physiol. 2007;102(4):1664-70.
- Bejma J, and Ji LL (1999) Aging and acute exercise enhance free radical generation in rat skeletal muscle. J Appl Physiol 87(1):465-70.
- Nikolaidis MG, Kyparos A, Spanou C, Paschalis V, Theodorou AA, Panayiotou G, et al. Aging is not a barrier to muscle and redox adaptations: applying the repeated eccentric exercise model. Exp Gerontol. 2013;48(8):734-43.
- Hernanz A, Fernández-Vivancos E, Salazar RM, Arnalich F. Homocysteine and other thiol compounds in ageing. Biofactors. 2000;11(1-2):47-9.
Datas de Publicação
-
Publicação nesta coleção
Jul-Sep 2018
Histórico
-
Recebido
4 Nov 2015 -
Aceito
24 Mar 2018