RESUMO
Objetivou-se avaliar alterações imunes, entre obesidade e exercício (natação). Ratas Wistar foram alocadas, conforme regime dietético: Grupo Labina (GL) e Grupo Hiperlipídico (GH); e, aos 60 dias, segundo o exercício. Após protocolo de exercício, avaliaram-se parâmetros murinométricos, gordura visceral, série branca do sangue e cultura de macrófagos. Observamos aumento nos parâmetros murinométricos, na gordura visceral do GH sedentário e nos linfócitos, neutrófilos e basófilos do GH exercitado. A taxa de fagocitose e a produção de óxido nítrico estimulado com lipopolissacarídeos aumentaram nos ratos exercitados. A natação parece reverter o fenótipo de sobrepeso, promovido pela dieta hiperlipídica, atenuou os efeitos dessa no sistema imune e melhorou sua resposta.
Palavras Chave:
Dieta hiperlipídica; Exercício físico; Imunidade; Macrófagos
ABSTRACT
The aim was to evaluate immune changes between obesity and swimming. Wistar rats were allocated according to dietary regimen: Labina Group (LG) and Hyperlipid Group (HG); and at 60 days, according to the exercise. After exercise protocol, murinometric parameters, visceral fat, white blood series and macrophage culture were evaluated. We observed an increase in the murinometric parameters and visceral fat of the sedentary HG, and in the lymphocytes, neutrophils and basophils of the exercised HG. The rate of phagocytosis and the production of nitric oxide stimulated with lipopolysaccharides increased in the exercised rats. Swimming seems to reverse the overweight phenotype promoted by the hyperlipid diet and attenuated the effects it on the immune system, improving its response.
Keywords:
Fat diet; Exercise; Immunity; Alveolar macrophages
RESUMEN
El objetivo de este artículo fue evaluar cambios inmunológicos entre obesidad y ejercicio (natación). Se distribuyó a ratas Wistar según el régimen dietético: grupo labina (GL) y grupo hiperlipídico (GH). Y a los 60 días, según el ejercicio. Después del protocolo de ejercicio, se evaluaron los parámetros murinométricos, grasa visceral, serie blanca de la sangre y cultivo de macrófagos. Se observó un aumento de los parámetros murinométricos y de la grasa visceral del GH sedentario, así como en los linfocitos, neutrófilos y basófilos del GH ejercitado. La tasa de fagocitosis y la producción de óxido nítrico estimulado con lipopolisacárido aumentaron en las ratas ejercitadas. Parece que la natación revierte el fenotipo de sobrepeso promovido por la dieta hiperlipídica y atenúa los efectos de esta en el sistema inmunitario, por lo que mejora su respuesta.
Palabras Clave:
Dieta hiperlipídica; Ejercicio; Inmunidad; Macrófagos alveolares
INTRODUÇÃO
A obesidade é o acúmulo excessivo de gordura no organismo, em que, além do aspecto sistêmico, fatores metabólicos, nutricionais e endócrinos estariam envolvidos na resposta imune (Lamas et al., 2002Lamas O, Martinez JA, Marti A. T helper lymphopenia and decreased mitogenic response in cafeteria diet-induced obese rats. Nut Res 2002;22:496-507.). Esse estado de inflamação crônica pode acarretar uma maior produção de espécies reativas de oxigênio e citocinas que induzem alterações e danos ao DNA (Wang et al., 2016Wang YT, Chiang HH, Huang YS, Hsu CL, Yang PJ, Juan HF, et al. Alink betweenadipogenesis and innate immunity: RNase-L promotes 3T3-L1adipogenesis bydestabilizing Pref-1 mRNA. CellDeathDis 2016;7(11):e2458, 10.). Pesquisas apontam o impacto negativo sobre a imunidade na obesidade (Spielmann et al., 2017Spielmann J, Hanke J, Knauf D, Ben-Eliyahu S, Jacobs R, Stangl GI, et al. Significantly enhanced lung metastasis and reduced organ NKcell functions in diet-induced obese rats. BMC Obes 2017;3(4):24.; Fernandes et al., 2017Fernandes CR, Kannen V, Mata KM, Frajacomo FT, Jordão Junior AA. High-Fat and Fat-Enriched Diets Impair the Benefits of Moderate Physical Training in the Aorta and the Heart in Rats. Front Nutr 2017;4:21.). No estudo experimental, manipulação com dieta rica em gordura acarretou prejuízos à função linfocitária (Verwaerde et al., 2006Verwaerde C, Delanoye A, Macia L, Tailleux A, Wolowczuk I. Influence of high-fat feeding on both naive and antigenexperienced T-cell immune response in DO10.11 mice. Scand J Immunol 2006;64(5):457-66., redução da função das células natural killers (NK) contra células tumorais (Spielmann et al., 2017Verwaerde C, Delanoye A, Macia L, Tailleux A, Wolowczuk I. Influence of high-fat feeding on both naive and antigenexperienced T-cell immune response in DO10.11 mice. Scand J Immunol 2006;64(5):457-66.) e linfopenia, com menor resposta mitógena dos esplenócitos (Lamas et al., 2002Lamas O, Martinez JA, Marti A. T helper lymphopenia and decreased mitogenic response in cafeteria diet-induced obese rats. Nut Res 2002;22:496-507.); além de comprometer a resposta antioxidativa, quando associada ao treino físico (Fernandes et al., 2017Fernandes CR, Kannen V, Mata KM, Frajacomo FT, Jordão Junior AA. High-Fat and Fat-Enriched Diets Impair the Benefits of Moderate Physical Training in the Aorta and the Heart in Rats. Front Nutr 2017;4:21.). Estudo com animais submetidos à dieta relata aumento na adiposidade, intolerância à glicose, além de inflamação (Sampey et al., 2011Sampey BP, Vanhose AM, Winfield HM, Freemerman AJ, Muehlbauer MJ, et al. Cafeteria Diet Is a Robust Model of Human Metabolic Syndrome With Liver and Adipose Inflammation: Comparison to High-Fat Diet. Obes 2011;19:1109-17.).
Ademais, são bem definidos na literatura os benefícios do exercício físico sobre a imunidade (Schöler et al., 2016Schöler CM, Marques CV, da Silva GS, Heck TG, de Oliveira Junior LP, et al. Modulation of rat monocyte/macrophage innate functions by increasing intensities of swimming exercise is associated with heat shock protein status. Mol CellBiochem 2016;421(1-2):111- 25.; Oliveira et al., 2013Oliveira AG, Araujo TG, Carvalho BM, Guadagnini D, Rocha GZ, Bagarolli RA, et al. Acute exercise induces a phenotypic switch in adipose tissue macrophage polarization in dietinduced obese rats. Obes (SilSpr) 2013;21(12):2545-56.), os quais são dependentes da intensidade, duração e frequência da atividade (Leandro et al., 2007Leandro CG, Levada AC, Hirabara SM, et al. A program of mode- rate physycal training for Wistar rats based on maximal oxigen consumption. JlofStrandCond Res 2007;21(3):751-6.). Estudos apontam o exercício moderado como promotor de adaptações fisiológicas e imunológicas benéficas para o organismo (Zhao et al., 2016Zhao F, Pang W, Zhang Z, Zhao J, Wang X, Liu Y, et al. Pomegranate extract and exerciseprovide additive benefits on improvement of immune functionby inhibiting inflammation andoxidative stress in high-fat-diet-induced obesity in rats. JNutrBiochem 2016;32:20-8.; Oliveira et al., 2013Ortega E. Neuroendocrine mediators in the modulation of phagocytosis by exercise: physiological implications. ExercImmunol Rev 2003;9:70-93.), tais como, prevenção ou retardo na progressão de alguns tumores (Spielmann et al., 2017Spielmann J, Hanke J, Knauf D, Ben-Eliyahu S, Jacobs R, Stangl GI, et al. Significantly enhanced lung metastasis and reduced organ NKcell functions in diet-induced obese rats. BMC Obes 2017;3(4):24.; Ferreira et al., 2010Ferreira CKO, Prestes J, Donatto F, Verlengia R, Navalta JW, Cavaglieri CR. Phagocytic responses of peritoneal macrophages and neutrophils are different in rats following prolonged exercise. Clin 2010;65(11):1167-73.). Em humanos hospitalizados, o uso do cicloergômetro passivo promoveu redução no estresse oxidativo, sem outras alterações relacionadas à imunidade (França et al., 2017França EE, Ribeiro LC, Lamenha GG, Magalhães IK, Figueiredo TG, Costa MJ, et al. Oxidative stress and immune system analysis after cycle ergometer use in critical patients. Clin 2017;72(3):143-9.). Pesquisas em animais têm-se voltado para a resposta imune a diversos agentes indutores de estresse, como a nutrição e o exercício físico (Zhao et al., 2016Zila D, Mokra J, Kopincova M, Kolomaznik M, Javorka M, Calkovska A. Vagal-Immune Interactions Involved in Cholinergic Anti-Inflammatory Pathway. Physiol 2017;66(Suppl. 2):S139-45, Res.; Oliveira et al., 2013Ortega E. Neuroendocrine mediators in the modulation of phagocytosis by exercise: physiological implications. ExercImmunol Rev 2003;9:70-93.; Nascimento et al., 2004Nascimento E, Cavalcante T, Pereira S, Palmeira A, Rocha MC, Viana MT. O exercício físico crônico altera o perfil leucocitário e a taxa de fagocitose de ratos estressados. RevPort C do Desp 2004;4(3):26-33.). E, nesse contexto, os achados que relacionam nutrição, natação e produção de óxido nítrico (ON) são distintos na literatura (Zhao et al., 2016Zila D, Mokra J, Kopincova M, Kolomaznik M, Javorka M, Calkovska A. Vagal-Immune Interactions Involved in Cholinergic Anti-Inflammatory Pathway. Physiol 2017;66(Suppl. 2):S139-45, Res.; Oliveira et al., 2013Ortega E. Neuroendocrine mediators in the modulation of phagocytosis by exercise: physiological implications. ExercImmunol Rev 2003;9:70-93.; Delmondes et al., 2012Delmondes GMB, De Oliveira DC, Dos Santos PCP, Viana MT, Santos MSB, De Castro CMMB, et al. , Andrade MA. Efeito do treinamento físico moderado e intenso sobre os mecanismos de defesa de ratos adultos. Mot 2012;18(4):699-707.). Não há consenso em relação aos mecanismos envolvidos para promover a melhor resposta imune (Leandro et al., 2007Leandro CG, Levada AC, Hirabara SM, et al. A program of mode- rate physycal training for Wistar rats based on maximal oxigen consumption. JlofStrandCond Res 2007;21(3):751-6.). Como exemplo, temos o ON como responsável pela defesa local dos pulmões (Delves e Roitt., 2000Delves PJ, Roitt EIM. The immune system First of two parts. The N Eng J of Med 2000;343(1):37-49.).
O aumento na produção de ON e na taxa de fagocitose de macrófagos alveolares em animais submetidos à natação foi visto em atividades de curta duração (20 minutos) (Schöler et al., 2016Schöler CM, Marques CV, da Silva GS, Heck TG, de Oliveira Junior LP, et al. Modulation of rat monocyte/macrophage innate functions by increasing intensities of swimming exercise is associated with heat shock protein status. Mol CellBiochem 2016;421(1-2):111- 25.) e longa duração (seis semanas, cinco dias/semana) (Delmondes et al., 2012Delmondes GMB, De Oliveira DC, Dos Santos PCP, Viana MT, Santos MSB, De Castro CMMB, et al. , Andrade MA. Efeito do treinamento físico moderado e intenso sobre os mecanismos de defesa de ratos adultos. Mot 2012;18(4):699-707.), além de maior atividade fagocítica e linfocitária em ratos treinados inoculados com tumor (Spielmann et al., 2017Spielmann J, Hanke J, Knauf D, Ben-Eliyahu S, Jacobs R, Stangl GI, et al. Significantly enhanced lung metastasis and reduced organ NKcell functions in diet-induced obese rats. BMC Obes 2017;3(4):24.; Ferreira et al., 2010Ferreira CKO, Prestes J, Donatto F, Verlengia R, Navalta JW, Cavaglieri CR. Phagocytic responses of peritoneal macrophages and neutrophils are different in rats following prolonged exercise. Clin 2010;65(11):1167-73.). Acredita-se que o aumento da intensidade do exercício pode interferir negativamente na fagocitose (Delmondes et al., 2012). Assim, questionam-se evidências acerca das alterações decorrentes da obesidade na imunidade e quanto o exercício de natação é capaz de repercutir sobre esse sistema. Diante do exposto, torna-se necessário esclarecer o impacto nos parâmetros murinométricos e imunes de ratas submetidas ou não à dieta hiperlipídica associada ao exercício de natação.
MÉTODOS
O estudo foi aprovado pelo Comitê de Ética em Experimentação Animal do Centro de Ciências Biológicas da Universidade Federal de Pernambuco (CEEA-UFPE), sob o protocolo nº 23076.020153/2010-75, seguiu as normas do Comitê Brasileiro de Experimentação Animal (Cobea). Animais: usaram-se de ratas albinas da linhagem Wistar (n=32), provenientes da colônia do Departamento de Nutrição (DN-UFPE). Aos 21 dias, pós-natal, os filhotes foram separados das mães (desmame) e manipulados segundo o regime dietético: Grupo Labina® (Purina, Paulínia, SP, Brasil) (n=16), ração padrão do biotério, e Grupo Hiperlipídico (n=16), que teve como ingredientes ração Labina ®, amendoim torrado, chocolate ao leite e biscoito maisena, na proporção 3:2:2:1, respectivamente (Estadella et al., 2004Estadella D, Oyama lM, Damaso AR, Ribeiro EB, do Nascimento CMO. Effect of Palatable Hyperlipidic Diet on Lipid Metabolism of Sedentary and Exercised Rats. Bas Nut Inv 2004;20: 218-24.). Dieta oferecida em forma de péletes. Em todo o experimento, os animais receberam ração e água, ad libitium, e foram mantidos num biotério de ciclo claro-escuro invertido, com temperatura ambiente de 22±2ºC, constante. Aos 60 dias, pós-natal, foram subdivididos em Sedentários (S) e Exercitados (E), originaram quatro grupos: LS e HS (labina e hiperlipídico sedentários [n=8], respectivamente) e LE e HE (labina e hiperlipídico exercitados [n=8], respectivamente). Os animais foram submetidos a um exercício físico moderado de natação, adaptado de Nascimento et al. (2004)Nascimento E, Cavalcante T, Pereira S, Palmeira A, Rocha MC, Viana MT. O exercício físico crônico altera o perfil leucocitário e a taxa de fagocitose de ratos estressados. RevPort C do Desp 2004;4(3):26-33.. O protocolo experimental de seis semanas, cinco dias/semana e 45min/dia. Os grupos LS e HS foram submetidos a um estresse aquático, numa gaiola com água em torno de 05cm de profundidade, no mesmo período e tempo (sem esforço físico) do exercitado. Temperatura da água entre 30±2ºC.
Delineamento experimental
No fim do protocolo de exercício, o peso corporal e o índice de massa corporal (IMC) dos animais foram aferidos, usou-se uma balança eletrônica Marte (ASF11). Para obter o IMC, partimos da relação entre peso corporal (g)/comprimento nasoanal (cm2) (Nery et al., 2011Nery CS, Pinheiro IL, Muniz GS, Vasconcelos DGA, França SP, Nascimento E. Medidas murinométricas e eficiência alimentar em ratos provenientes de ninhadas reduzidas na lactação e submetidos ou não ao exercício de natação. Rev Br Med Esp 2011;17(1):49-55.), em que os animais foram anestesiados para a medição do comprimento nasoanal (CNA), obtida em papel milimetrado. Após traqueostomia, fez-se uma incisão no abdome, no qual os órgãos foram retirados e a gordura visceral separada e pesada em balança, Marte (ASF11). No início, e imediatamente após o exercício, o lactato foi coletado em semanas intervaladas, as amostras de sangue venoso foram obtidas por uma pequena incisão superficial na extremidade final da cauda do animal e depositadas em fitas de leituras, em aparelho da Accutrend Lactato® Roche (Nery et al., 2011Nery CS, Pinheiro IL, Muniz GS, Vasconcelos DGA, França SP, Nascimento E. Medidas murinométricas e eficiência alimentar em ratos provenientes de ninhadas reduzidas na lactação e submetidos ou não ao exercício de natação. Rev Br Med Esp 2011;17(1):49-55.).
Análise do sistema imune
As células sanguíneas foram coletadas antes do início do exercício e 24h após a última sessão; uma pequena alíquota de sangue (1mL) da cauda dos animais, devidamente anestesiados, para contagem total e diferencial de leucócitos do sangue periférico (103/mm3). O sangue extraído foi depositado em tubo de 5ml previamente acrescido de uma gota (20µl) do anticoagulante ácido etileno diamino tetra acético a 3% (EDTA). Os dados foram automatizados pelo laboratório do Hospital das Clínicas (ULAB-HC-UFPE). Os macrófagos alveolares foram obtidos 24h após a última sessão de exercício. Os animais foram anestesiados (solução dos anestésicos cloralose e urethane, em concentrações respectivas de 0,5 e 12,5%, via intraperitoneal, na proporção de 1mL/100g de peso do animal) (Leandro et al., 2007Leandro CG, Levada AC, Hirabara SM, et al. A program of mode- rate physycal training for Wistar rats based on maximal oxigen consumption. JlofStrandCond Res 2007;21(3):751-6.). O lavado broncoalveolar (LBA) foi adquirido por injeção de soro fisiológico através de cânula plástica inserida na traqueia (De Castro et al., 1997De Castro CMMB, De Castro RM, Andrade AD, Brandt CT. LPS bacteriano: um mediador de inflamação. An Fac Med Um Fed Pern 1997;42(2):78-83.). O LBA recolhido foi centrifugado a 1.500rpm durante 10 minutos. Após essa etapa, o precipitado, que corresponde às células, foi ressuspendido com RPMI 1.640 para lavagem e, em seguida, foram contadas. A contagem dos macrófagos colhidos foi feita em Câmara de Neubauer, colocaram-se a suspensão de células e o corante azul tripan a 0,05% na diluição de 1:10. Após a contagem, as células foram ressuspendidas em meio de cultura RPMI 1.640 que continha soro fetal bovino a 3% e antibióticos (penicilina 100U/mL e estreptomicina 100µg/mL, anfotericina B 0,25µg/mL) (Sigma) em uma densidade de 1x106 células/mL; foram usados fungos (Saccharomyces cerevisae), segundo a técnica de Malagueno et al., 1998Malagueno E, Albuquerque C, De Castro CMMB, Gadelha M, Inácio-irmão J, Santana JV. Effect of biomphalariastraminea plasma of biomphalariaglabratahemolymph cells. Mem InstOsw C 1998;93(1):301-2.. Tais fungos foram lavados duas vezes com solução tampão de fosfato (PBS) a 0,01M; contados 107 células em 200µL de PBS e em seguida foram adicionados à suspensão de macrófagos (800µL de RPMI 1640, com 1x106 células). As células foram distribuídas em lâminas de microscopia óptica e incubados a 37ºC, em atmosfera úmida por uma hora. A taxa foi obtida como percentual de macrófagos que englobaram o fungo em uma contagem total de 100 células.
Índice de adesividade (IA): alíquotas do sobrenadante que continham células não aderentes, após a primeira hora da cultura, foram adicionadas ao corante azul Tripan e levadas para contagem das células em hemocitômetro. O IA foi calculado pela fórmula descrita por De La Fuente et al., 1991De La Fuente M, Del Rio M, Ferrandez MD, Hernanz A. Modulation of phagocytic function in murine peritoneal macrophages by bombesin, gastrin-releasing peptide and neuromedin C. Imm 1991;73(2):205-11, 1991.. Óxido nítrico (ON): a produção de ON foi mensurada de forma indireta a partir da concentração de nitritos presentes no sobrenadante de cultura de células pelo método colorimétrico quantitativo de Griess (Ding et al., 1988Ding AH, Nathan CF, Stuehr J. Release of nitrogen intermediates and reactive oxygen intermediates from mouse peritoneal macrophages. J of Imm 1988;141:2407-12.). Amostras do sobrenadante foram colhidas em triplicata. A absorbância foi obtida num comprimento de onda de 550nm; assim, foi determinada a concentração de nitrito por meio de uma curva-padrão construída com nitrato de sódio nas concentrações de 0-100µM. Todas as amostras foram avaliadas em relação a um branco correspondente a RPMI 1640. Os resultados foram expressos em µM de nitrito/ milhão de células. Viabilidade celular (MTT-test): a viabilidade foi avaliada pela redução mitocondrial do MTT a cristais de formazan de acordo com Akao et al., 1995Akao N, Sugimoto N, Thu AM, Kondo K, Tsuda Y, Fujita K. A tetrazorium dye (MTT) assay for testing larval viability using second-stage Larvae of Toxocaracanis. JPar 1995;44:1-5..
Análise estatística
Os dados foram analisados com o software Statistical Package for the Social Sciences (SPSS) 15,0. Conforme a normalidade dos dados (Kolmogorov-Smirnov), foi empregada a análise de variância (Anova oneway). Quando a Anova revelou a existência de diferença significativa, foi usado o teste de Tukey, a fim de identificar que grupos diferiram entre si. A significância estatística considerada foi de p<0,05 em todos os casos.
RESULTADOS
Após 105 dias pós-natal das ratas submetidas à dieta e/ou à natação, observou-se que nas medidas murinométricas não houve diferença significativa no peso corpóreo e CNA. A dieta nesse período foi eficaz em aumentar o IMC e gordura visceral no grupo HS em relação ao grupo-padrão. Verificou-se que a natação foi capaz de reduzir o estoque de tecido adiposo e o IMC no grupo HE em relação ao sedentário (Tabela 1). Durante o protocolo de natação, os valores de lactato intragrupos antes (LE±3,38 e HE±2,71) e imediatamente após o exercício (LE±3,94 e HE±3,47) confirmaram que o exercício foi moderado, valores de referência (2-4 mmmol) (Nery et al., 2011Nery CS, Pinheiro IL, Muniz GS, Vasconcelos DGA, França SP, Nascimento E. Medidas murinométricas e eficiência alimentar em ratos provenientes de ninhadas reduzidas na lactação e submetidos ou não ao exercício de natação. Rev Br Med Esp 2011;17(1):49-55.).
Parâmetros murinométricos e gordura visceral em ratas Wistar sobre o efeito da dieta hiperlipídica e da natação aos 105 dias pós-natal. Os valores correspondem à média ± EPM (Anova oneway) com post-hoc de Tukey (p < 0,05). Efeito dieta intergrupos (a) e efeito treino intragrupos (b).
Com relação à série branca do sangue, foram comparados os grupos, segundo o efeito da dieta (*), efeito exercício (#), entre o início e o fim do protocolo de natação. Os valores totais de leucócitos do sangue periférico (103/mm3) foram expressos em média±erro-padrão (EPM), aos 60 dias: LS (7.360±423,8), LE (7.200±502), HS (13.183±1.634,9) e HE (13.240±792,8); diferença significativa entre os grupos submetidos à dieta HS e LS, p=0,004. Para os demais não houve significância. Após o exercício, aos 105 dias, houve efeito da natação: HS (8.100±351,2) em comparação com o HE (11.780±480,0), p=0, 001. Efeito da dieta entre os exercitados, HE e LE p=0, 001. Para os demais grupos: LS (8.083±339) em relação ao LE (8.220±222,3) não houve significância estatística (Figura 1).
Leucócitos totais do sangue periférico, antes e após protocolo de natação. Dados como média ± EPM (Anova oneway) com post-hoc de Turkey (p < 0,05). Efeito dieta, intergrupos (*) e efeito treino intragrupos (#).
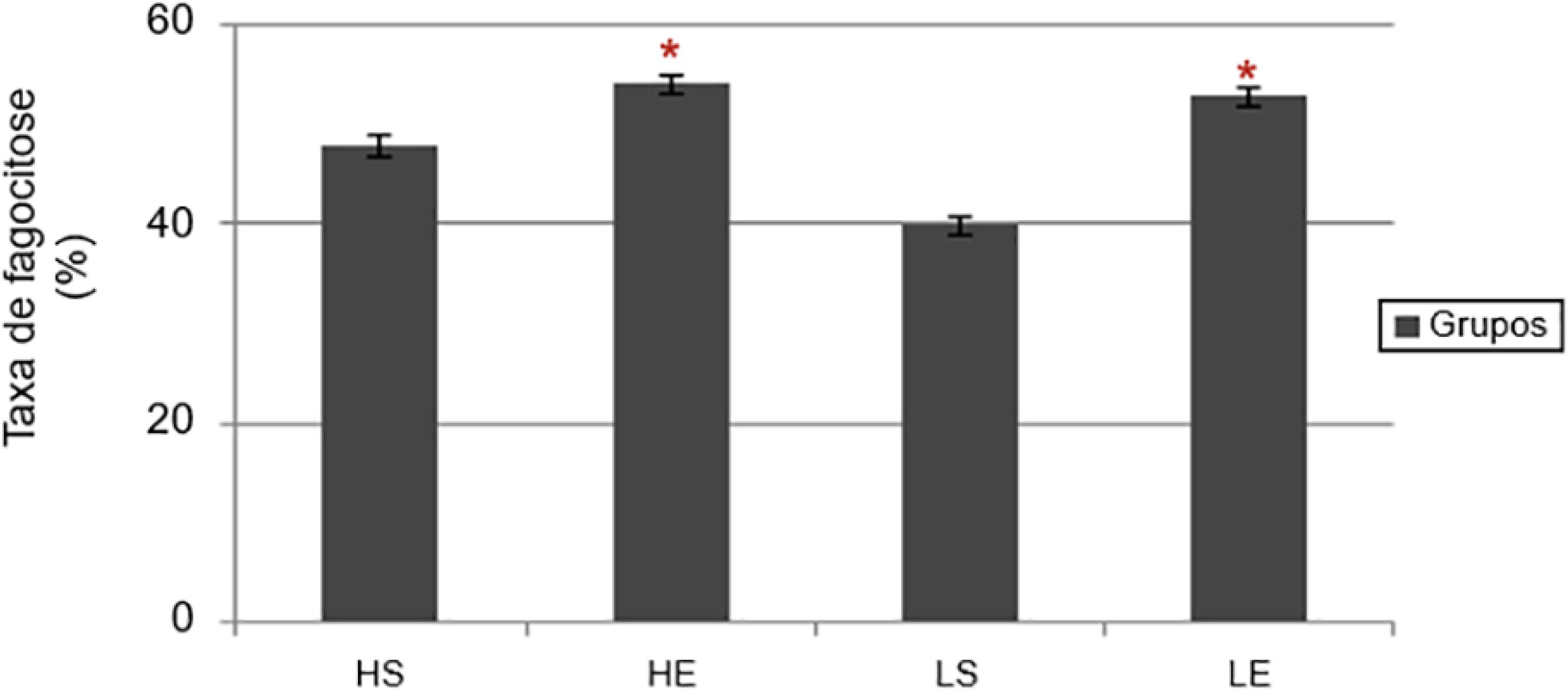
Após o término do protocolo de natação, verificou-se alteração significativa nos linfócitos apenas entre os exercitados, LE e HE (p=0,014). Com relação aos neutrófilos, houve efeito da natação entre o HS e HE (p=0,024) e efeito da dieta entre o LS e HS (p=0,021). Entretanto, os eosinófilos não obtiveram alteração significativa. Os basófilos obtiveram valores significantes entre HS e HE (p=0,042), LS e HS (p=0,002) e LS e LE (p=0,015). Para os monócitos apenas o efeito do exercício obteve significância entre o HS e HE (p=0,024). Não houve alteração significativa para os demais grupos (Tabela 2). A taxa de fagocitose verificou nos exercitados significância em relação aos sedentários, HE (52,29±0,94) em relação ao HS (46±0,58) (p=0,002) e LE (54,14±0,59) em comparação com LS (46,7±1,54), p=0,001(Figura 2). Houve aumento não significativo no índice de adesividade nos exercitados. Dados em (%): HS (91,9±2,7) em relação ao HE (93,0±2,4) e LS (93,4±3,0) em comparação com LE (94,4±1,2).
Efeito da dieta hiperlipídica e da natação após protocolo de natação, sobre valores absolutos e relativos da série branca do sangue periférico em ratas Wistar. Dados em média ± EPM (Anova oneway) com post-hoc de Tukey (p < 0,05). Efeito dieta intergrupos (a) e efeito treino intragrupos (b).
Taxa de fagocitose em macrófagos alveolares após o programa de exercício físico. Dados como média ± EPM (Anova oneway) com post-hoc de Turkey (p < 0,05). Efeito do exercício (*).
A produção ON em meio de cultura não estimulado (Ǿ) foi maior para os exercitados em relação aos sedentários. Entre os animais exercitados, houve efeito da dieta no grupo hiperlipídico. Em meio estimulado por lipopolissacarídeos (LPS), a produção de ON também foi maior os grupos exercitados; não observado efeito da dieta. Para as demais comparações não houve significância (Tabela 3). A viabilidade celular dos macrófagos alveolares foi em torno de 89% e não houve significância entre os grupos (dados não mostrados).
Produção de ON pelos macrófagos alveolares estimulados por LPS ou não (Ø), após protocolo de natação. Valores (mM/mL) expressos em média ± EPM (Anova oneway) com post-hoc de Tukey (p < 0,05). Efeito dieta intergrupos (a) e efeito treino intragrupos (b).
DISCUSSÃO
Neste estudo observamos aumento nos parâmetros murinométricos e gordura visceral do grupo HS, como também nos linfócitos, neutrófilos e basófilos do HE. A taxa de fagocitose e a produção de ON estimulado com LPS aumentaram nos exercitados. O peso corporal foi equivalente para os grupos, submetidos ou não à dieta. Achados similares foram obtidos em outros estudos (Fernandes et al., 2017Fernandes CR, Kannen V, Mata KM, Frajacomo FT, Jordão Junior AA. High-Fat and Fat-Enriched Diets Impair the Benefits of Moderate Physical Training in the Aorta and the Heart in Rats. Front Nutr 2017;4:21.; Nery et al., 2011Nery CS, Pinheiro IL, Muniz GS, Vasconcelos DGA, França SP, Nascimento E. Medidas murinométricas e eficiência alimentar em ratos provenientes de ninhadas reduzidas na lactação e submetidos ou não ao exercício de natação. Rev Br Med Esp 2011;17(1):49-55.; Bernardes et al., 2004Bernardes D, Manzoni MSJ, Souza CP, Tenório N, Dâmaso AR. Efeitos da dieta hiperlipídica e do treinamento de natação sobre o metabolismo de recuperação ao exercício em ratos. RevBr Ed Fís e Esp 2004;18(2):191-200.). Houve aumento do IMC em animais submetidos à dieta induzida; entretanto, outro estudo não observou diferença (Novelli et al., 2007Novelli ELB, Diniz YS, Galhardi CM, Ebaid Rodrigues GMX, Mani F. Anthropometrical parameters and markers of obesity in rats. Lab An 2007;41:111-9.). A dieta manipulada foi capaz de aumentar a gordura visceral, o mesmo visto por diferentes autores (Eguchi et al., 2008Eguchi R, Cheik NC, Oyama LM, do Nascimento CMO, Mello MT, De Tufik S, et al. Efeitos do exercício crônico sobre a concentração circulante da leptina e grelina em ratos com obesidade induzida por dieta. Revista Brasileira de Medicina do Esporte 2008;14(3):182-7.; Estadella et al., 2004Estadella D, Oyama lM, Damaso AR, Ribeiro EB, do Nascimento CMO. Effect of Palatable Hyperlipidic Diet on Lipid Metabolism of Sedentary and Exercised Rats. Bas Nut Inv 2004;20: 218-24.). Segundo a literatura, a dieta hiperlipídica pode ser eficiente em gerar obesidade exógena em ratos (Fernandes et al., 2017Fernandes CR, Kannen V, Mata KM, Frajacomo FT, Jordão Junior AA. High-Fat and Fat-Enriched Diets Impair the Benefits of Moderate Physical Training in the Aorta and the Heart in Rats. Front Nutr 2017;4:21.; Estadella et al., 2004Estadella D, Oyama lM, Damaso AR, Ribeiro EB, do Nascimento CMO. Effect of Palatable Hyperlipidic Diet on Lipid Metabolism of Sedentary and Exercised Rats. Bas Nut Inv 2004;20: 218-24.). Sabe-se que a gordura visceral está associada a alterações metabólicas e aumento do risco de doenças crônicas (Zhao et al., 2016Zhao F, Pang W, Zhang Z, Zhao J, Wang X, Liu Y, et al. Pomegranate extract and exerciseprovide additive benefits on improvement of immune functionby inhibiting inflammation andoxidative stress in high-fat-diet-induced obesity in rats. JNutrBiochem 2016;32:20-8.; Oliveira et al., 2013Oliveira AG, Araujo TG, Carvalho BM, Guadagnini D, Rocha GZ, Bagarolli RA, et al. Acute exercise induces a phenotypic switch in adipose tissue macrophage polarization in dietinduced obese rats. Obes (SilSpr) 2013;21(12):2545-56.). A inclusão do exercício, após 60 dias, diminuiu a gordura visceral nos ratos exercitados no fim do protocolo; o mesmo foi visto por Bernardes et al. (2004)Bernardes D, Manzoni MSJ, Souza CP, Tenório N, Dâmaso AR. Efeitos da dieta hiperlipídica e do treinamento de natação sobre o metabolismo de recuperação ao exercício em ratos. RevBr Ed Fís e Esp 2004;18(2):191-200.. Entretanto, a natação não reduziu a gordura epididimal, mas foi eficaz em reverter a resistência à insulina, induzida pela dieta gordurosa (Oliveira et al., 2013Ortega E. Neuroendocrine mediators in the modulation of phagocytosis by exercise: physiological implications. ExercImmunol Rev 2003;9:70-93.). Em ninhadas reduzidas, não foi eficaz em reduzir o peso corpóreo (Nery et al., 2011Nery CS, Pinheiro IL, Muniz GS, Vasconcelos DGA, França SP, Nascimento E. Medidas murinométricas e eficiência alimentar em ratos provenientes de ninhadas reduzidas na lactação e submetidos ou não ao exercício de natação. Rev Br Med Esp 2011;17(1):49-55.). É bem estabelecido que o exercício aeróbio promova maior mobilização dos estoques de lipídios (Fernandes et al., 2017Fernandes CR, Kannen V, Mata KM, Frajacomo FT, Jordão Junior AA. High-Fat and Fat-Enriched Diets Impair the Benefits of Moderate Physical Training in the Aorta and the Heart in Rats. Front Nutr 2017;4:21.; Oliveira et al., 2013Ortega E. Neuroendocrine mediators in the modulation of phagocytosis by exercise: physiological implications. ExercImmunol Rev 2003;9:70-93.).
Segundo Dâmaso e Oller Do Nascimento (1998)Dâmaso AR, Oller Do Nascimento CM. Efeitos do exercício realizado durante o ciclo reprodutivo sobre o metabolismo lipídico: análise de estudos utilizando animaisexperimentais. Rev Paul Ed Fís 1998;12:54-70., há maior atividade da enzima lipase de lipoproteínas, que reduz o volume dos adipócitos. Animais submetidos à dieta gordurosa tiveram maiores valores de leucócitos em relação à padrão. Contudo, Lamas et al. (2002)Lamas O, Martinez JA, Marti A. T helper lymphopenia and decreased mitogenic response in cafeteria diet-induced obese rats. Nut Res 2002;22:496-507. observaram linfopenia em ratos por dieta induzida. Aumento de gordura corporal promoveu maior contagem de leucócitos, monócitos e neutrófilos circulantes (Nieman e Pedersen, 1999Nieman DC, Pedersen BK. Exercise and Immune Function: Recent Dev Sports Med 1999;27(2):73-80.). Segundo Wang et al. (2016)Wang YT, Chiang HH, Huang YS, Hsu CL, Yang PJ, Juan HF, et al. Alink betweenadipogenesis and innate immunity: RNase-L promotes 3T3-L1adipogenesis bydestabilizing Pref-1 mRNA. CellDeathDis 2016;7(11):e2458, 10., essa inflamação não seria apenas resultado da indução dietética, mas também um fator adipogênico relacionado ao metabolismo de RNA e à imunidade inata. No fim do protocolo de natação, contagem de leucócitos, linfócitos, neutrófilos, basófilos e monócitos foi maior para o grupo HE; contudo, não houve alteração quanto aos eosinófilos. Achados similares foram obtidos por Delmondes et al. (2012)Delmondes GMB, De Oliveira DC, Dos Santos PCP, Viana MT, Santos MSB, De Castro CMMB, et al. , Andrade MA. Efeito do treinamento físico moderado e intenso sobre os mecanismos de defesa de ratos adultos. Mot 2012;18(4):699-707.. No entanto, Nascimento et al. (2004)Nascimento E, Cavalcante T, Pereira S, Palmeira A, Rocha MC, Viana MT. O exercício físico crônico altera o perfil leucocitário e a taxa de fagocitose de ratos estressados. RevPort C do Desp 2004;4(3):26-33. não verificaram alteração nesses parâmetros. O potencial antioxidante promovido pelo exercício parece estar reduzido, quando se promove indução dietética de obesidade nos animais (Fernandes et al., 2017Fernandes CR, Kannen V, Mata KM, Frajacomo FT, Jordão Junior AA. High-Fat and Fat-Enriched Diets Impair the Benefits of Moderate Physical Training in the Aorta and the Heart in Rats. Front Nutr 2017;4:21.; Oliveira et al., 2013Oliveira AG, Araujo TG, Carvalho BM, Guadagnini D, Rocha GZ, Bagarolli RA, et al. Acute exercise induces a phenotypic switch in adipose tissue macrophage polarization in dietinduced obese rats. Obes (SilSpr) 2013;21(12):2545-56.). Essas diferenças podem ser atribuídas a distintos desenhos experimentais que propiciam resultados diversos no exercício (sobrecarga, duração, frequência) e/ou manipulação dietética (Zhao et al., 2016Zhao F, Pang W, Zhang Z, Zhao J, Wang X, Liu Y, et al. Pomegranate extract and exerciseprovide additive benefits on improvement of immune functionby inhibiting inflammation andoxidative stress in high-fat-diet-induced obesity in rats. JNutrBiochem 2016;32:20-8.; Leandro et al., 2007Leandro CG, Levada AC, Hirabara SM, et al. A program of mode- rate physycal training for Wistar rats based on maximal oxigen consumption. JlofStrandCond Res 2007;21(3):751-6.).
Exercício a 60% VO2máx aumenta a atividade oxidativa e a fagocitose de neutrófilos e macrófagos (Delmondes et al., 2012Delmondes GMB, De Oliveira DC, Dos Santos PCP, Viana MT, Santos MSB, De Castro CMMB, et al. , Andrade MA. Efeito do treinamento físico moderado e intenso sobre os mecanismos de defesa de ratos adultos. Mot 2012;18(4):699-707.; Ferreira et al., 2010Ferreira CKO, Prestes J, Donatto F, Verlengia R, Navalta JW, Cavaglieri CR. Phagocytic responses of peritoneal macrophages and neutrophils are different in rats following prolonged exercise. Clin 2010;65(11):1167-73.) e melhora os recursos de defesa, auxilia também na atividade oxidativa dos neutrófilos (Leandro et al., 2007Leandro CG, Levada AC, Hirabara SM, et al. A program of mode- rate physycal training for Wistar rats based on maximal oxigen consumption. JlofStrandCond Res 2007;21(3):751-6.). A associação das catecolaminas ou glicocorticoides e a migração das células endoteliais para o sangue (fenômeno de redistribuição) sugerem ser um dos promotores da leucocitose dos neutrófilos e linfocitose (Ferreira et al., 2010Ferreira CKO, Prestes J, Donatto F, Verlengia R, Navalta JW, Cavaglieri CR. Phagocytic responses of peritoneal macrophages and neutrophils are different in rats following prolonged exercise. Clin 2010;65(11):1167-73.; Pedersen e Hoffman-goetz, 2000Pedersen KBE, Hoffman-goetz L. Exercise and the immune system: regulation, integration and adaptation. Phys Rev 2000;80(3):1055-81.). Outro meio dessa ativação de moléculas de adesão endotelial seria resultante de maior atividade nervosa simpática que regularia os movimentos transendoteliais de monócitos e macrófagos (Abboud e Singh, 2017Abboud FM, Singh MV. Autonomic regulation of the immune system in cardiovascular diseases. Adv Physiol Educ 2017;41:578-93.). Estudo de Nielsen e Pedersen (1997)Nielsen HB, Pedersen BK. Lymphocyte proliferation in response to exercise. Eur J Appl Physiol 1997;75:375-9. indicou que maior parte da linfocitose induzida pelo exercício é decorrente da liberação de células oriundas do baço e órgãos linfoides. Essa ativação imune seria gerada pela liberação de norepinefrina, nos terminais nervosos pela atividade simpática que inerva baço e órgãos linfoides (Ganta et al., 2005Ganta CK, Lu N, Helwig BG, Blecha F, Ganta RR, Zheng L, et al. Central angiotensin II-enhanced splenic cytokine gene expression is mediated by the sympathetic nervous system. Am J Physiol Heart Circ Physiol 2005;289:1683-91.). Sugere, assim, um elo entre os nervos simpáticos e o sistema imune (Abboud e Singh, 2017Abboud FM, Singh MV. Autonomic regulation of the immune system in cardiovascular diseases. Adv Physiol Educ 2017;41:578-93.). Evidências referem que a resposta inflamatória e o sistema nervoso autônomo (SNA) estão ligados aos nervos simpáticos e vagais (Zila et al., 2017Zila D, Mokra J, Kopincova M, Kolomaznik M, Javorka M, Calkovska A. Vagal-Immune Interactions Involved in Cholinergic Anti-Inflammatory Pathway. Physiol 2017;66(Suppl. 2):S139-45, Res.; Martelli et al., 2014Martelli D, Mckinley MJ, Mcallen RM. The cholinergic antiinflammatory pathway: a critical review. Auton Neurosci 2014;182:65-9.).
Também observamos maior taxa de fagocitose de macrófagos alveolares nas ratas exercitadas. Achados similares, com maior atividade dos macrófagos alveolares ou peritoneais, foram relatados (Zhao et al., 2016Zhao F, Pang W, Zhang Z, Zhao J, Wang X, Liu Y, et al. Pomegranate extract and exerciseprovide additive benefits on improvement of immune functionby inhibiting inflammation andoxidative stress in high-fat-diet-induced obesity in rats. JNutrBiochem 2016;32:20-8.; Delmondes et al., 2012Delmondes GMB, De Oliveira DC, Dos Santos PCP, Viana MT, Santos MSB, De Castro CMMB, et al. , Andrade MA. Efeito do treinamento físico moderado e intenso sobre os mecanismos de defesa de ratos adultos. Mot 2012;18(4):699-707.). Durante natação, o estímulo da fagocitose foi correlacionado com a carga corporal (Schöler et al., 2016Schöler CM, Marques CV, da Silva GS, Heck TG, de Oliveira Junior LP, et al. Modulation of rat monocyte/macrophage innate functions by increasing intensities of swimming exercise is associated with heat shock protein status. Mol CellBiochem 2016;421(1-2):111- 25.) e ao limiar de exaustão (Ferreira et al., 2010Ferreira CKO, Prestes J, Donatto F, Verlengia R, Navalta JW, Cavaglieri CR. Phagocytic responses of peritoneal macrophages and neutrophils are different in rats following prolonged exercise. Clin 2010;65(11):1167-73.); entretanto, exercício agudo também promoveu efeitos similares (Oliveira et al., 2013Oliveira AG, Araujo TG, Carvalho BM, Guadagnini D, Rocha GZ, Bagarolli RA, et al. Acute exercise induces a phenotypic switch in adipose tissue macrophage polarization in dietinduced obese rats. Obes (SilSpr) 2013;21(12):2545-56.). O exercício pode aumentar a citotoxicidade antitumoral de macrófagos, mesmo após uma única sessão de exercício (Schöler et al., 2016Schöler CM, Marques CV, da Silva GS, Heck TG, de Oliveira Junior LP, et al. Modulation of rat monocyte/macrophage innate functions by increasing intensities of swimming exercise is associated with heat shock protein status. Mol CellBiochem 2016;421(1-2):111- 25.). Essas controvérsias ocorrem devido a diferentes protocolos que induzem respostas distintas no aumento de hormônios de estresse e citocinas (Leandro et al., 2002Leandro CG, Nascimento E, Manhães-de-castro R, Duarte Já, De Castro CMMB. Exercício físico e sistema imunológico: mecanismos e integrações. RevPortCdo Des 2002;2(5):80-90.). Outro elo sugerido entre o exercício e a imunidade se daria por duas vias: metabólica (glutamina) e a neuroendócrina (imunomodulação) (Zila et al., 2017Zila D, Mokra J, Kopincova M, Kolomaznik M, Javorka M, Calkovska A. Vagal-Immune Interactions Involved in Cholinergic Anti-Inflammatory Pathway. Physiol 2017;66(Suppl. 2):S139-45, Res.; Leandro et al., 2002Leandro CG, Nascimento E, Manhães-de-castro R, Duarte Já, De Castro CMMB. Exercício físico e sistema imunológico: mecanismos e integrações. RevPortCdo Des 2002;2(5):80-90.).
Segundo Moriguchi et al. (1998)Moriguchi S, Kato M, Sakai K, Yamamoto S, Shimizu E. Decreased mitogen response of splenic lymphocytes in obese Zucker rats is associated with the decreased expression of glucose transporter 1 (GLUT-1). Am J of Clin Nut 1998;67(6):1124-9., elevada concentração de ácidos graxos pode inibir a proliferação dos linfócitos T, devido a sua diminuição na captação de glicose. Os linfócitos regulam a resposta imune através da produção de citocinas que ativam os macrófagos e sintetizam acetilcolina (Martelli et al., 2014Martelli D, Mckinley MJ, Mcallen RM. The cholinergic antiinflammatory pathway: a critical review. Auton Neurosci 2014;182:65-9.). Esses macrófagos têm receptores colinérgicos, como o acetilcolinérgico 7-nicotínico, que é ativado durante a estimulação do nervo vago e pode ser protetor contra o choque séptico (Abboud e Singh, 2017Abboud FM, Singh MV. Autonomic regulation of the immune system in cardiovascular diseases. Adv Physiol Educ 2017;41:578-93.). Essa neuroimunomodulação foi denominada de via anti-inflamatória colinérgica; propõe, assim, um circuito funcional entre o nervo vago e a resposta inflamatória (Zila et al., 2017Zila D, Mokra J, Kopincova M, Kolomaznik M, Javorka M, Calkovska A. Vagal-Immune Interactions Involved in Cholinergic Anti-Inflammatory Pathway. Physiol 2017;66(Suppl. 2):S139-45, Res.). No entanto, sugere-se também que os fatores neuroendócrinos seriam responsáveis pelo estresse induzido pelo exercício (Pedersen e Hoffman-goetz, 2000Pedersen KBE, Hoffman-goetz L. Exercise and the immune system: regulation, integration and adaptation. Phys Rev 2000;80(3):1055-81.), tais como a adrenalina, a noradrenalina e o cortisol (Ferreira et al., 2010Ferreira CKO, Prestes J, Donatto F, Verlengia R, Navalta JW, Cavaglieri CR. Phagocytic responses of peritoneal macrophages and neutrophils are different in rats following prolonged exercise. Clin 2010;65(11):1167-73.). As células imunes parecem ter receptores para diversos hormônios do estresse que atuam como quimioatrativos para macrófagos e neutrófilos e auxiliam a mobilização no sítio de inflamação (Ortega, 2003Ortega E. Neuroendocrine mediators in the modulation of phagocytosis by exercise: physiological implications. ExercImmunol Rev 2003;9:70-93.; Leandro et al., 2002Leandro CG, Nascimento E, Manhães-de-castro R, Duarte Já, De Castro CMMB. Exercício físico e sistema imunológico: mecanismos e integrações. RevPortCdo Des 2002;2(5):80-90.). A expressão de β-receptores fornece a base molecular para sua ação. Contudo, a densidade e a eficiência de receptores adrenérgicos diferem nas células imunes (Leandro et al., 2002Leandro CG, Nascimento E, Manhães-de-castro R, Duarte Já, De Castro CMMB. Exercício físico e sistema imunológico: mecanismos e integrações. RevPortCdo Des 2002;2(5):80-90.).
Neste trabalho, a produção de ON por macrófagos alveolares foi maior nos exercitados. Estudos revelam que o exercício estimula o ON (Schöler et al., 2016Schöler CM, Marques CV, da Silva GS, Heck TG, de Oliveira Junior LP, et al. Modulation of rat monocyte/macrophage innate functions by increasing intensities of swimming exercise is associated with heat shock protein status. Mol CellBiochem 2016;421(1-2):111- 25.; Zhao et al., 2016Zhao F, Pang W, Zhang Z, Zhao J, Wang X, Liu Y, et al. Pomegranate extract and exerciseprovide additive benefits on improvement of immune functionby inhibiting inflammation andoxidative stress in high-fat-diet-induced obesity in rats. JNutrBiochem 2016;32:20-8.). Animais submetidos ao exercício de esteira (oito semanas, três vezes/semana) aumentaram a produção de ON por macrófagos (Sugiurah et al., 2002Sugiurah H, Nishida H, Sugiura H, Mirbod SM. Immunomodulatory action of chronic exerciseon macrophage and lymphocyte cytokine production in mice. Ac PhysScand 2002;174:247-56.). Exercício moderado gerou maior aderência, taxa de metabolismo do nitrogênio e capacidade fagocítica dos macrófagos (Delmondes et al., 2012Delmondes GMB, De Oliveira DC, Dos Santos PCP, Viana MT, Santos MSB, De Castro CMMB, et al. , Andrade MA. Efeito do treinamento físico moderado e intenso sobre os mecanismos de defesa de ratos adultos. Mot 2012;18(4):699-707.). Contudo, exercício intenso também elevou a produção de ON (Schöler et al., 2016Schöler CM, Marques CV, da Silva GS, Heck TG, de Oliveira Junior LP, et al. Modulation of rat monocyte/macrophage innate functions by increasing intensities of swimming exercise is associated with heat shock protein status. Mol CellBiochem 2016;421(1-2):111- 25.; Delmondes et al., 2012Delmondes GMB, De Oliveira DC, Dos Santos PCP, Viana MT, Santos MSB, De Castro CMMB, et al. , Andrade MA. Efeito do treinamento físico moderado e intenso sobre os mecanismos de defesa de ratos adultos. Mot 2012;18(4):699-707.). Esse aumento pode estar ligado a uma elevação do metabolismo e do consumo de oxigênio, produzida por exercícios de alta intensidade (Elikov, 2016Elikov AV. Oxidative Balance in Rats during Adaptation to Swimming Load. Bull ExpBiol Med 2016;162(2):180-3.). Segundo Jungersten et al. (1997)Jungersten L, Ambring A, Wall B, Wennmalm A. Both physical fitness and acute exerciseregulate nitric oxide formation in healthy humans. J of Appl Phys 1997(3):760-4., uma única sessão de exercício induz elevação transitória de nitrato do plasma, possivelmente por aumento temporário endógeno do ON. O exercício tem potente efeito estimulador sobre o metabolismo de nitrogênio e reatividade de oxigênio (França et al., 2017França EE, Ribeiro LC, Lamenha GG, Magalhães IK, Figueiredo TG, Costa MJ, et al. Oxidative stress and immune system analysis after cycle ergometer use in critical patients. Clin 2017;72(3):143-9.; Woods et al., 2009Woods JA, Vieira VJ, Keylock KT. Exercise Inflammation, and Innate Immunity. Immun and All Clin> of N Am 2009;29:381-93.). Em humanos, o uso de cicloergômetro propiciou uma mudança positiva no estado redox das células e tecidos dos níveis basais, reduziu o dano oxidativo (França et al., 2017França EE, Ribeiro LC, Lamenha GG, Magalhães IK, Figueiredo TG, Costa MJ, et al. Oxidative stress and immune system analysis after cycle ergometer use in critical patients. Clin 2017;72(3):143-9.). O exercício combinado (aeróbio e resistido) também verificou maior biodisponibilidade de ON (Conti et al., 2015Conti FF, Brito JO, Bernardes N, Dias DS, et al. Positive effect of combined exercise training in a model of metabolic syndrome and menopause: autonomic, inflammatory, and oxidative stress evaluations. Am J Physiol Regul Integr Comp Physiol 2015;309:1532-9.).
Um possível mecanismo seria a redução da modulação simpática, que influenciaria a redução dos parâmetros pró-inflamatórios e de estresse oxidativo e biodisponibilidade de ON (Conti et al., 2015Conti FF, Brito JO, Bernardes N, Dias DS, et al. Positive effect of combined exercise training in a model of metabolic syndrome and menopause: autonomic, inflammatory, and oxidative stress evaluations. Am J Physiol Regul Integr Comp Physiol 2015;309:1532-9.). É válido salientar que, apesar dos benefícios do ON como molécula reguladora imune, em situações de estresse oxidativo e inflamação, o ON pode reagir diretamente ou associado a outros compostos e se tornar citotóxico (Dusse et al., 2003Dusse LSA, Vieira LM, Carvalho M, Das G. Revisão sobre óxido nítrico. J Br de Patol e MedLab 2003;39(4):343-50.). Aumento não significante foi obtido em ratas exercitadas no IA. Contudo, o estudo de Woods et al. (2009)Woods JA, Vieira VJ, Keylock KT. Exercise Inflammation, and Innate Immunity. Immun and All Clin> of N Am 2009;29:381-93. verificou aumento da aderência, atividade citotóxica e a capacidade fagocítica de macrófagos exercitados. O primeiro passo de um processo fagocítico é a aderência, essencial para a resposta inflamatória (Segura, 1998Segura JJ, Jiménez-Rubio A, Guerreiro JM, Calvo JR, Feito JJ. Efeito in vitro do Tifell (formocresol-eugenol) na adesão de macrófagos. IntEndod J 1998;31(2):112-6.).
CONCLUSÃO
Os dados deste estudo permitem concluir que a dieta hiperlipídica aumentou os estoques de gordura visceral nos animais e influenciou o sistema imune. Entretanto, o exercício físico atenuou esses efeitos. A natação reduziu a quantidade de adiposidade e proporcionou melhoria no mecanismo de defesa, com o estímulo na fagocitose dos macrófagos alveolares, aderência celular e produção de ON. No entanto, estudos futuros são necessários para evidenciar quais os principais mecanismos de alterações imunes relacionados a esse tipo de exercício na obesidade.
AGRADECIMENTOS
Fundação de Amparo à Ciência e Tecnologia do Estado de Pernambuco (Facepe), nº IBPG 0437-4.08/09, em parceria com o Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), pelo apoio financeiro a Patrícia dos Santos.
Referências
- Abboud FM, Singh MV. Autonomic regulation of the immune system in cardiovascular diseases. Adv Physiol Educ 2017;41:578-93.
- Akao N, Sugimoto N, Thu AM, Kondo K, Tsuda Y, Fujita K. A tetrazorium dye (MTT) assay for testing larval viability using second-stage Larvae of Toxocaracanis. JPar 1995;44:1-5.
- Bernardes D, Manzoni MSJ, Souza CP, Tenório N, Dâmaso AR. Efeitos da dieta hiperlipídica e do treinamento de natação sobre o metabolismo de recuperação ao exercício em ratos. RevBr Ed Fís e Esp 2004;18(2):191-200.
- Conti FF, Brito JO, Bernardes N, Dias DS, et al. Positive effect of combined exercise training in a model of metabolic syndrome and menopause: autonomic, inflammatory, and oxidative stress evaluations. Am J Physiol Regul Integr Comp Physiol 2015;309:1532-9.
- Dâmaso AR, Oller Do Nascimento CM. Efeitos do exercício realizado durante o ciclo reprodutivo sobre o metabolismo lipídico: análise de estudos utilizando animaisexperimentais. Rev Paul Ed Fís 1998;12:54-70.
- De Castro CMMB, De Castro RM, Andrade AD, Brandt CT. LPS bacteriano: um mediador de inflamação. An Fac Med Um Fed Pern 1997;42(2):78-83.
- De La Fuente M, Del Rio M, Ferrandez MD, Hernanz A. Modulation of phagocytic function in murine peritoneal macrophages by bombesin, gastrin-releasing peptide and neuromedin C. Imm 1991;73(2):205-11, 1991.
- Delmondes GMB, De Oliveira DC, Dos Santos PCP, Viana MT, Santos MSB, De Castro CMMB, et al. , Andrade MA. Efeito do treinamento físico moderado e intenso sobre os mecanismos de defesa de ratos adultos. Mot 2012;18(4):699-707.
- Delves PJ, Roitt EIM. The immune system First of two parts. The N Eng J of Med 2000;343(1):37-49.
- Ding AH, Nathan CF, Stuehr J. Release of nitrogen intermediates and reactive oxygen intermediates from mouse peritoneal macrophages. J of Imm 1988;141:2407-12.
- Dusse LSA, Vieira LM, Carvalho M, Das G. Revisão sobre óxido nítrico. J Br de Patol e MedLab 2003;39(4):343-50.
- Eguchi R, Cheik NC, Oyama LM, do Nascimento CMO, Mello MT, De Tufik S, et al. Efeitos do exercício crônico sobre a concentração circulante da leptina e grelina em ratos com obesidade induzida por dieta. Revista Brasileira de Medicina do Esporte 2008;14(3):182-7.
- Elikov AV. Oxidative Balance in Rats during Adaptation to Swimming Load. Bull ExpBiol Med 2016;162(2):180-3.
- Estadella D, Oyama lM, Damaso AR, Ribeiro EB, do Nascimento CMO. Effect of Palatable Hyperlipidic Diet on Lipid Metabolism of Sedentary and Exercised Rats. Bas Nut Inv 2004;20: 218-24.
- França EE, Ribeiro LC, Lamenha GG, Magalhães IK, Figueiredo TG, Costa MJ, et al. Oxidative stress and immune system analysis after cycle ergometer use in critical patients. Clin 2017;72(3):143-9.
- Fernandes CR, Kannen V, Mata KM, Frajacomo FT, Jordão Junior AA. High-Fat and Fat-Enriched Diets Impair the Benefits of Moderate Physical Training in the Aorta and the Heart in Rats. Front Nutr 2017;4:21.
- Ferreira CKO, Prestes J, Donatto F, Verlengia R, Navalta JW, Cavaglieri CR. Phagocytic responses of peritoneal macrophages and neutrophils are different in rats following prolonged exercise. Clin 2010;65(11):1167-73.
- Ganta CK, Lu N, Helwig BG, Blecha F, Ganta RR, Zheng L, et al. Central angiotensin II-enhanced splenic cytokine gene expression is mediated by the sympathetic nervous system. Am J Physiol Heart Circ Physiol 2005;289:1683-91.
- Jungersten L, Ambring A, Wall B, Wennmalm A. Both physical fitness and acute exerciseregulate nitric oxide formation in healthy humans. J of Appl Phys 1997(3):760-4.
- Lamas O, Martinez JA, Marti A. T helper lymphopenia and decreased mitogenic response in cafeteria diet-induced obese rats. Nut Res 2002;22:496-507.
- Leandro CG, Levada AC, Hirabara SM, et al. A program of mode- rate physycal training for Wistar rats based on maximal oxigen consumption. JlofStrandCond Res 2007;21(3):751-6.
- Leandro CG, Nascimento E, Manhães-de-castro R, Duarte Já, De Castro CMMB. Exercício físico e sistema imunológico: mecanismos e integrações. RevPortCdo Des 2002;2(5):80-90.
- Malagueno E, Albuquerque C, De Castro CMMB, Gadelha M, Inácio-irmão J, Santana JV. Effect of biomphalariastraminea plasma of biomphalariaglabratahemolymph cells. Mem InstOsw C 1998;93(1):301-2.
- Martelli D, Mckinley MJ, Mcallen RM. The cholinergic antiinflammatory pathway: a critical review. Auton Neurosci 2014;182:65-9.
- Moriguchi S, Kato M, Sakai K, Yamamoto S, Shimizu E. Decreased mitogen response of splenic lymphocytes in obese Zucker rats is associated with the decreased expression of glucose transporter 1 (GLUT-1). Am J of Clin Nut 1998;67(6):1124-9.
- Nascimento E, Cavalcante T, Pereira S, Palmeira A, Rocha MC, Viana MT. O exercício físico crônico altera o perfil leucocitário e a taxa de fagocitose de ratos estressados. RevPort C do Desp 2004;4(3):26-33.
- Nery CS, Pinheiro IL, Muniz GS, Vasconcelos DGA, França SP, Nascimento E. Medidas murinométricas e eficiência alimentar em ratos provenientes de ninhadas reduzidas na lactação e submetidos ou não ao exercício de natação. Rev Br Med Esp 2011;17(1):49-55.
- Nielsen HB, Pedersen BK. Lymphocyte proliferation in response to exercise. Eur J Appl Physiol 1997;75:375-9.
- Nieman DC, Pedersen BK. Exercise and Immune Function: Recent Dev Sports Med 1999;27(2):73-80.
- Novelli ELB, Diniz YS, Galhardi CM, Ebaid Rodrigues GMX, Mani F. Anthropometrical parameters and markers of obesity in rats. Lab An 2007;41:111-9.
- Oliveira AG, Araujo TG, Carvalho BM, Guadagnini D, Rocha GZ, Bagarolli RA, et al. Acute exercise induces a phenotypic switch in adipose tissue macrophage polarization in dietinduced obese rats. Obes (SilSpr) 2013;21(12):2545-56.
- Ortega E. Neuroendocrine mediators in the modulation of phagocytosis by exercise: physiological implications. ExercImmunol Rev 2003;9:70-93.
- Pedersen KBE, Hoffman-goetz L. Exercise and the immune system: regulation, integration and adaptation. Phys Rev 2000;80(3):1055-81.
- Sampey BP, Vanhose AM, Winfield HM, Freemerman AJ, Muehlbauer MJ, et al. Cafeteria Diet Is a Robust Model of Human Metabolic Syndrome With Liver and Adipose Inflammation: Comparison to High-Fat Diet. Obes 2011;19:1109-17.
- Schöler CM, Marques CV, da Silva GS, Heck TG, de Oliveira Junior LP, et al. Modulation of rat monocyte/macrophage innate functions by increasing intensities of swimming exercise is associated with heat shock protein status. Mol CellBiochem 2016;421(1-2):111- 25.
- Segura JJ, Jiménez-Rubio A, Guerreiro JM, Calvo JR, Feito JJ. Efeito in vitro do Tifell (formocresol-eugenol) na adesão de macrófagos. IntEndod J 1998;31(2):112-6.
- Sugiurah H, Nishida H, Sugiura H, Mirbod SM. Immunomodulatory action of chronic exerciseon macrophage and lymphocyte cytokine production in mice. Ac PhysScand 2002;174:247-56.
- Spielmann J, Hanke J, Knauf D, Ben-Eliyahu S, Jacobs R, Stangl GI, et al. Significantly enhanced lung metastasis and reduced organ NKcell functions in diet-induced obese rats. BMC Obes 2017;3(4):24.
- Verwaerde C, Delanoye A, Macia L, Tailleux A, Wolowczuk I. Influence of high-fat feeding on both naive and antigenexperienced T-cell immune response in DO10.11 mice. Scand J Immunol 2006;64(5):457-66.
- Zhao F, Pang W, Zhang Z, Zhao J, Wang X, Liu Y, et al. Pomegranate extract and exerciseprovide additive benefits on improvement of immune functionby inhibiting inflammation andoxidative stress in high-fat-diet-induced obesity in rats. JNutrBiochem 2016;32:20-8.
- Zila D, Mokra J, Kopincova M, Kolomaznik M, Javorka M, Calkovska A. Vagal-Immune Interactions Involved in Cholinergic Anti-Inflammatory Pathway. Physiol 2017;66(Suppl. 2):S139-45, Res.
- Wang YT, Chiang HH, Huang YS, Hsu CL, Yang PJ, Juan HF, et al. Alink betweenadipogenesis and innate immunity: RNase-L promotes 3T3-L1adipogenesis bydestabilizing Pref-1 mRNA. CellDeathDis 2016;7(11):e2458, 10.
- Woods JA, Vieira VJ, Keylock KT. Exercise Inflammation, and Innate Immunity. Immun and All Clin> of N Am 2009;29:381-93.
Datas de Publicação
-
Publicação nesta coleção
15 Maio 2020 -
Data do Fascículo
2020
Histórico
-
Recebido
13 Maio 2018 -
Aceito
22 Ago 2018


 Fonte: autor.
Fonte: autor.
 Fonte: autor.
Fonte: autor.