Resumos
OBJETIVOS: Em pacientes com primeiro episódio de esquizofrenia, estudos com ressonância magnética funcional (RMf) têm demonstrado disfunção pré-frontoparietal durante estimulação acústica e visual. O objetivo do presente estudo foi investigar a rede pré-frontoparietal em pacientes idosos com esquizofrenia utilizando o mesmo paradigma. Adicionalmente, foram presumidos efeitos favoráveis na ativação cerebral pelo antipsicótico atípico clozapina em comparação a neurolépticos típicos. MÉTODOS: Foram investigados 18 pacientes com esquizofrenia crônica e 21 controles saudáveis idosos. Nove pacientes com esquizofrenia haviam sido medicados com clozapina e nove haviam recebido neurolépticos típicos por décadas. Concomitantemente às avaliações com escalas psicopatológicas e neuropsicológicas foi utilizado um paradigma de estimulação auditiva e visual em um aparelho de ressonância magnética de 1,5 Tesla para investigar a resposta BOLD em diferentes áreas cerebrais. RESULTADOS: Comparados a controles saudáveis, os pacientes com esquizofrenia apresentaram diminuição na ativação cerebral nos córtices pré-frontal e parietal, assim como no giro do cíngulo anterior medial. Nessas regiões, os pacientes medicados com clozapina apresentaram resposta BOLD aumentada em comparação aos pacientes tratados com neurolépticos típicos. DISCUSSÃO: O presente estudo confirmou a presença de distúrbios na rede pré-frontoparietal em pacientes idosos com esquizofrenia, apontando assim para a preservação de déficits de ativação cerebrais e a influência de distúrbios do desenvolvimento neural em esquizofrenia crônica até a velhice. CONCLUSÃO: O antipsicótico atípico clozapina parece facilitar a ativação de áreas cerebrais mesmo em pacientes idosos com esquizofrenia crônica.
RMf; esquizofrenia; visual; acústica; medicação antipsicótica
OBJECTIVES: In first-episode schizophrenia patients, functional magnetic resonance imaging (fMRI) has shown prefronto-parietal dysfunction during acoustic and visual stimulation. The aim of this study was to investigate the prefronto-parietal network in elderly schizophrenia patients using the same paradigm. Additionally, we hypothesized favourable effects on brain activation by the atypical antipsychotic clozapine compared to typical neuroleptics. METHODS: We investigated 18 elderly, chronic schizophrenia patients and 21 elderly healthy controls. Nine schizophrenia patients had been medicated with clozapine and 9 had been receiving typical neuroleptics over decades. In addition to assessments with psychopathological and neuropsychological rating scales we used an acoustic and visual stimulation paradigm in a 1.5 Tesla MRI scanner to investigate BOLD-response in different brain areas. RESULTS: Compared to healthy controls schizophrenia patients showed decreased brain activation in the prefrontal and parietal cortex as well as medial anterior cingulate gyrus compared to healthy controls. In these regions, patients medicated with clozapine showed increased BOLD-response compared to patients treated with typical neuroleptics. DISCUSSION: Our study confirmed prefronto-parietal network disturbances in elderly schizophrenia patients thus pointing to the preservation of brain activation deficits and the influence of neurodevelopmental disturbances in chronic schizophrenia until old-age. CONCLUSION: The atypical antipsychotic clozapine seems to facilitate brain activation even in elderly, chronic schizophrenia patients.
fMRI; schizophrenia; visual; acoustic; antipsychotic medication
ARTIGO ORIGINAL
Disfunção pré-frontoparietal durante o processamento de informação visuoauditiva em pacientes idosos com esquizofrenia crônica e efeitos da medicação
Parieto-prefrontal dysfunction during visuo-auditory information processing in elderly, chronic schizophrenic patients and medication effects
Andrea SchmittI,II; Sylvia OttoII; Alexander JatzkoIII; Matthias RufII; Traute DemirakcaII; HeiKe TostII; Oliver GruberI; Eleni ParlapaniI; Peter FalkaiI; Dieter F. BrausIV
IDepartment of Psychiatry, University of Goettingen, D-37075 Goettingen, Germany
IICentral Institute of Mental Health, J5, D-68159 Mannheim, Germany
IIIDepartment of Psychosomatic, Kaiserslautern, Germany
IVClinic for Psychiatry and Psychotherapy, HSK Dr. Horst Schmidt Clinic, D-65201 Wiesbaden, Germany
Endereço para correspondência Endereço para correspondência: Andrea Schmitt Department of Psychiatry, University of Goettingen Von-Siebold-Str. 5 - 37075 Goettingen, Germany Phone: 0049-551-3910366. Fax: 0049-551-398952 E-mail: aschmit@gwdg.de
RESUMO
OBJETIVOS: Em pacientes com primeiro episódio de esquizofrenia, estudos com ressonância magnética funcional (RMf) têm demonstrado disfunção pré-frontoparietal durante estimulação acústica e visual. O objetivo do presente estudo foi investigar a rede pré-frontoparietal em pacientes idosos com esquizofrenia utilizando o mesmo paradigma. Adicionalmente, foram presumidos efeitos favoráveis na ativação cerebral pelo antipsicótico atípico clozapina em comparação a neurolépticos típicos.
MÉTODOS: Foram investigados 18 pacientes com esquizofrenia crônica e 21 controles saudáveis idosos. Nove pacientes com esquizofrenia haviam sido medicados com clozapina e nove haviam recebido neurolépticos típicos por décadas. Concomitantemente às avaliações com escalas psicopatológicas e neuropsicológicas foi utilizado um paradigma de estimulação auditiva e visual em um aparelho de ressonância magnética de 1,5 Tesla para investigar a resposta BOLD em diferentes áreas cerebrais.
RESULTADOS: Comparados a controles saudáveis, os pacientes com esquizofrenia apresentaram diminuição na ativação cerebral nos córtices pré-frontal e parietal, assim como no giro do cíngulo anterior medial. Nessas regiões, os pacientes medicados com clozapina apresentaram resposta BOLD aumentada em comparação aos pacientes tratados com neurolépticos típicos.
DISCUSSÃO: O presente estudo confirmou a presença de distúrbios na rede pré-frontoparietal em pacientes idosos com esquizofrenia, apontando assim para a preservação de déficits de ativação cerebrais e a influência de distúrbios do desenvolvimento neural em esquizofrenia crônica até a velhice.
CONCLUSÃO: O antipsicótico atípico clozapina parece facilitar a ativação de áreas cerebrais mesmo em pacientes idosos com esquizofrenia crônica.
Palavras-chave: RMf, esquizofrenia, visual, acústica, medicação antipsicótica.
ABSTRACT
OBJECTIVES: In first-episode schizophrenia patients, functional magnetic resonance imaging (fMRI) has shown prefronto-parietal dysfunction during acoustic and visual stimulation. The aim of this study was to investigate the prefronto-parietal network in elderly schizophrenia patients using the same paradigm. Additionally, we hypothesized favourable effects on brain activation by the atypical antipsychotic clozapine compared to typical neuroleptics.
METHODS: We investigated 18 elderly, chronic schizophrenia patients and 21 elderly healthy controls. Nine schizophrenia patients had been medicated with clozapine and 9 had been receiving typical neuroleptics over decades. In addition to assessments with psychopathological and neuropsychological rating scales we used an acoustic and visual stimulation paradigm in a 1.5 Tesla MRI scanner to investigate BOLD-response in different brain areas.
RESULTS: Compared to healthy controls schizophrenia patients showed decreased brain activation in the prefrontal and parietal cortex as well as medial anterior cingulate gyrus compared to healthy controls. In these regions, patients medicated with clozapine showed increased BOLD-response compared to patients treated with typical neuroleptics.
DISCUSSION: Our study confirmed prefronto-parietal network disturbances in elderly schizophrenia patients thus pointing to the preservation of brain activation deficits and the influence of neurodevelopmental disturbances in chronic schizophrenia until old-age.
CONCLUSION: The atypical antipsychotic clozapine seems to facilitate brain activation even in elderly, chronic schizophrenia patients.
Keywords: fMRI, schizophrenia, visual, acoustic, antipsychotic medication.
Introdução
A esquizofrenia é uma doença heterogênea com diferentes desfechos. Estudos com pacientes com esquizofrenia em estágios psicótico e clinicamente remissivo indicam que distúrbios do processamento de informação podem ser componentes críticos da vulnerabilidade neuropsicológica para a esquizofrenia1,2. Déficits no processamento da informação sensorial têm sido comumente investigados na esquizofrenia por meio de eletrofisiologia e tomografia por emissão de pósitrons (positron-emission tomography - PET), usando estímulos que ativam sistemas corticais e subcorticais3,4. Em um subgrupo de pacientes com pior prognóstico e sob tratamento institucional de longa duração, a disfunção do processamento sensorial tem sido relatada como grave se comparada a pacientes de primeiro episódio e pacientes ambulatoriais5.
Em nível sistêmico, acredita-se que pacientes com esquizofrenia apresentem distúrbios primários nos estágios iniciais do processamento de informação que ocorrem durante as primeiras centenas de milissegundos e podem levar a efeitos em cascata em funções corticais superiores, como déficits cognitivos. Distúrbios do processamento de informação têm sido apontados como marcador estável em pacientes com prognósticos bom e ruim6. Um estudo de ressonância magnética funcional (RMf) utilizando estímulos visuais e acústicos revelou disfunções talâmicas, assim como pré-frontoparietais em pacientes com primeiro episódio de esquizofrenia, sem uso de neurolépticos7.
A questão que permanece é se mesmo em pacientes idosos com esquizofrenia crônica, com hospitalização de longa duração, apresentando o pior prognóstico possível da doença, os distúrbios do processamento de informação sensorial poderiam representar marcador estável da doença e resultariam ativação alterada das vias visuais e auditivas. No entanto, estudos de RMf, utilizando tarefas de detecção de alvo visual e atenção visual, têm mostrado que a idade pode influenciar a ativação em muitas regiões cerebrais8,9. Adicionalmente, pacientes idosos com esquizofrenia têm predisposição a menor reserva cerebral levando a uma maior vulnerabilidade a processos neurodegenerativos relacionados à idade10. Além do mais, a resposta BOLD (blood oxygen level dependent) pode ser correlacionada a déficits psicopatológicos e neuropsicológicos. Para elucidar esse fenômeno, foram investigados pacientes idosos com esquizofrenia crônica, sob tratamento institucional, com sintomas negativos e positivos persistentes, assim como déficits neuropsicológicos, sob medicação antipsicótica estável utilizando o mesmo paradigma que foi previamente investigado em pacientes com episódio inicial de esquizofrenia em comparação aos resultados de controles saudáveis pareados por idade e sexo.
Postulou-se que pacientes idosos com esquizofrenia crônica mostram os mesmos déficits de ativação nos córtices pré-frontal e parietal11, bem como previamente investigado em pacientes com esquizofrenia jovens, e que antipsicóticos atípicos mostram efeitos favoráveis em comparação a neurolépticos típicos mesmo após tratamento de longa duração. Dado que o córtex préfrontal está sob controle do giro do cíngulo anterior12, em adição, decidiu-se investigar essa região.
Materiais e métodos
Indivíduos
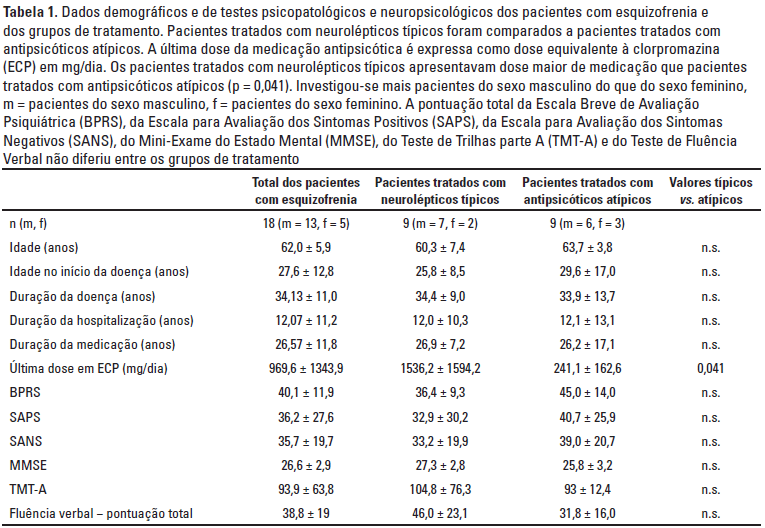
O presente estudo foi aprovado pelo Comitê de Ética local. Investigou-se 18 pacientes idosos com esquizofrenia crônica (cinco mulheres, 13 homens), idade média (62,0 ± 5,9 anos), vivendo em internatos em Mannheim ou no Centro Psiquiátrico de Nordbaden, em Wiesloch, Alemanha, que preencheram os critérios diagnósticos do DSM-IV para esquizofrenia crônica13 junto com 21 controles saudáveis pareados por idade e gênero (oito mulheres, 13 homens, idade média 64,1 ± 8,6 anos). Como determinado pelo histórico médico, exame clínico e exames de sangue de rotina (incluindo diferenciação de células brancas, parâmetros hepáticos, eletrólitos e taxa de sedimentação sanguínea) nem os pacientes com esquizofrenia nem os controles saudáveis faziam uso abusivo de álcool ou toxicodependência ou doenças neurológicas. Todos os pacientes e probandos passaram por exames neurológicos, sem demonstrar anormalidades clínicas. Todos os sujeitos eram destros, de acordo com o inventário de Edimburgh14. Os grupos de estudo não diferiram significativamente em relação à idade. Medidas psicopatológicas e neuropsicológicas nos pacientes com esquizofrenia (Tabela 1) revelaram que eles sofriam de sintomas moderados a graves da doença, assim como déficits de atenção, função executiva, sinais neurológicos leves e discinesia tardia.
A duração da doença, idade do início, duração da medicação antipsicótica e a dose equivalente à clorpromazina (ECP)15,16 nos pacientes com esquizofrenia estão listados na tabela 1. Entre os pacientes com esquizofrenia, nove foram medicados com haloperidol e neurolépticos típicos adicionais, como perazina, clorprotixeno, tioridazina e prometazina (grupo típico), enquanto nove receberam apenas clozapina (grupo atípico) (Tabela 1).
Avaliações psicopatológicas e neuropsicológicas
O estado psicopatológico dos pacientes com esquizofrenia foi avaliado por médico treinado utilizando a Escala para Avaliação dos Sintomas Positivos (SAPS)17, a Escala para Avaliação dos Sintomas Negativos (SANS)18 e a Escala Breve de Avaliação Psiquiátrica (BPRS)19. A bateria de testes neuropsicológicos incluindo o teste de fluência verbal (categorias: animais, mobília, supermercado e letras: F, A, S em um minuto cada)20,21 e o Teste de Trilhas parte A (TMT) para processamento de informação básica22. Em virtude da severidade dos sintomas, a maioria dos nossos pacientes não foi capaz de realizar o Teste de Trilhas parte B. O rastreamento cognitivo nos pacientes e controles saudáveis foi avaliado utilizando o Mini-Exame do Estado Mental (MMSE)23. A avaliação psicopatológica e neuropsicológica dos voluntários saudáveis foi realizada com uma entrevista estruturada e o MMSE. Em controles saudáveis, a demência foi excluída pela pontuação de 29,4 ± 0,6 no MMSE.
Procedimento de RMf e aquisição de imagens
Uma descrição detalhada do procedimento de RMf foi descrita previamente11. O paradigma de RMf do presente estudo incluía a apresentação simultânea de tabuleiro de damas cintilando a 6Hz e estímulo auditivo que consistia de rufos de tambores, com a instrução específica de olhar e ouvir. O estímulo visual foi gerado por um computador. Os sujeitos estavam em uma posição de supino observando a tela através de um espelho ajustável fixado à bobina principal. O estímulo acústico foi apresentado por um fone de ouvido personalizado. As duas condições experimentais (estimulação e fixação) foram adquiridas em cinco sequências de dez medidas em ordem alternada. As imagens foram adquiridas em um aparelho de ressonância magnética de 1,5 Tesla padrão clínico (Siemens AG, Erlangen, Alemanha). Para a RMf, foi utilizada sequência-padrão de EPI (echo planar imaging) (tamanho da matriz 64 x 64, resolução no plano 3,43 x 3,43 mm, espessura do corte 4 mm, 19 cortes). Os cortes de RMf foram orientados axialmente, paralelos à comissura anterior-comissura posterior, de acordo com Talairach e Tournoux24. Cada corte T2* foi adquirido 100 vezes em um período total de 310 segundos. Para referência anatômica, foi adquirida uma série de dados de imagem de eco-gradiente rápido preparada por magnetização tridimensional (MPR).
Análise de dados
Para análise de dados, foi usado modelo linear geral como empregado pelo software SPM99 (Wellcome Department of Cognitive Neurology, University College, London, UK)25. Os primeiros cinco volumes de cada série temporal funcional foram descartados por causa de efeitos T1. Todos os volumes foram realinhados ao primeiro volume remanescente como correção para movimentos entre as varreduras por meio de uma transformação de corpo rígido. A imagem MPR estrutural foi corregistrada com a primeira imagem T2*. A imagem estrutural foi normalizada espacialmente a um modelo padrão. Uma transformação não-linear foi aplicada ao dado T2*. Após o alisamento com filtro Gaussiano, o filtro passa-alta com um período de corte de 120 ms foi aplicado para remover os drifts dentro da sessão. Os dados individuais foram analisados modelando as diferentes condições (estimulação e fixação), como funções boxcar convolucionadas com a função de resposta hemodinâmica (limiar individual p < 0,001). Efeitos específicos foram testados aplicando-se contrastes lineares apropriados às estimativas dos parâmetros para cada condição levando à imagem de contraste para cada participante. Os dados foram analisados pela inclusão das imagens de contraste de todos os sujeitos de cada grupo (pacientes com primeiro episódio de esquizofrenia e controles jovens, pacientes com esquizofrenia crônica e controles idosos, grupos de tratamento de pacientes com esquizofrenia) em uma análise de grupo de segundo nível. Testes-t para uma amostra foram realizados para testar correspondências intragrupo e testes-t para duas amostras foram utilizados para identificar áreas que estão menos ativas em pacientes com esquizofrenia crônicos idosos comparados a controles idosos ou entre diferentes grupos de tratamento. As análises foram conduzidas com o nível de significância ajustados em p < 0,001 e com limite de extensão de 5 voxels. Baseado na hipótese, uma correção para volumes pequenos (CVP) foi usada adicionalmente para os resultados da comparação entre os grupos no córtex pré-frontal, giro do cíngulo anterior e córtex parietal (CVP p < 0,05).
Resultados
Em razão dos artefatos de movimento excedendo 1,5 mm nas direções x, y ou z, seis pacientes foram excluídos (dados demográficos e do teste não mostrados).
Análise de grupo dos controles saudáveis e pacientes com esquizofrenia (teste-t para uma amostra)
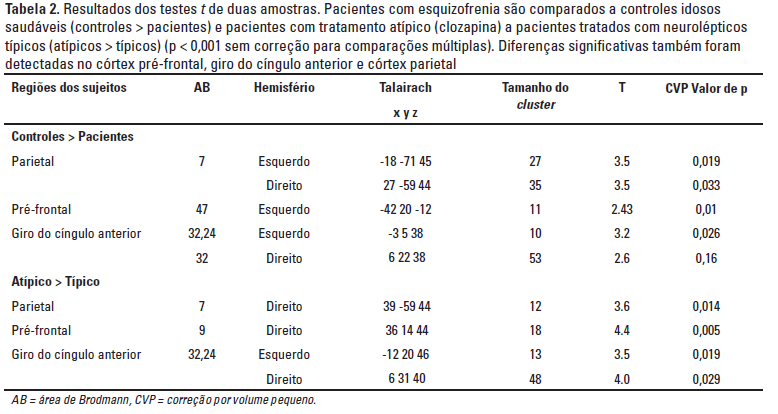
Como esperado a análise de grupo em controles idosos saudáveis mostrou ativação significante (p < 0,001, sem correção) dos córtices visuais primário (V1, área de Brodmann (AB) 17) e secundário (V2-V3, AB 18,19), assim como do córtex parietal posterior (V4-V5, AB 07, 40), como partes da via visual dorsal. Os núcleos geniculados lateral e medial (NGL e NGM) e o córtex temporal auditivo (A1 e A2, AB 41, 42, 22) também foram ativados bilateralmente. Uma resposta BOLD aumentada também foi observada no córtex pré-frontal dorsolateral (AB 09, 45, 46) com uma ativação pronunciada do lado direito, que também foi observada no córtex parietal. No córtex pré-frontal ventrolateral, (AB 47) ativação significante foi encontrada apenas no hemisfério direito (Tabela 2).
Em pacientes idosos com esquizofrenia crônica, ativação significante (p < 0,001,sem correção)foi observada nos córtices visual primário (V1), extraestriado (V2-5), temporal auditivo (A1 e A2) e núcleos talâmicos (NGL e NLM). O córtex pré-frontal dorsolateral foi ativado apenas levemente com lateralização para o lado direito (Tabela 2), enquanto o córtex pré-frontal ventrolateral não foi ativado.
Comparação entre os pacientes com esquizofrenia crônica e controles idosos e grupos de tratamento (teste-t para duas amostras)
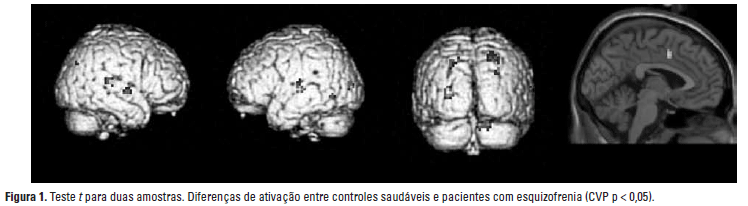
Usando o teste-t para duas amostras, detectou-se ativação reduzida no córtex parietal posterior (AB 07), giro temporal superior (AB 41, 22) e área V3 do córtex occipital (AB 19) em ambos os hemisférios de pacientes com esquizofrenia comparados a controles idosos saudáveis. Adicionalmente, pacientes com esquizofrenia mostraram menor ativação no córtex cingulado anterior (CCA) em ambos os hemisférios (Tabela 2, Figura 1).
No subgrupo tratado com neurolépticos típicos, foi mostrada ativação (p < 0,001, sem correção) bilateralmente no córtex visual primário e secundário (AB 17,18,19), assim como bilateralmente no giro temporal superior e tálamo (NGL e NGM). No córtex parietal posterior a resposta BOLD era pequena e o córtex pré-frontal dorsolateral mostrava apenas pequena área ativada no hemisfério direito (Tabela 2). Em contraste, pacientes tratados com antipsicóticos atípicos mostraram boa ativação bilateral do córtex parietal posterior e córtex pré-frontal (AB 9) com lateralização para o lado direito. Adicionalmente, nesse grupo, o córtex cingulado anterior (AB 32 e 24) também foi ativado (Tabela 2).
Discussão
Esse estudo mostra ativação reduzida em regiões do giro do cíngulo anterior, assim como do córtex pré-frontal e do córtex parietal posterior bilateral nos pacientes idosos com esquizofrenia crônica em comparação a controles idosos saudáveis pareados. Com isso, pode-se confirmar os resultados que mostravam ativação diminuída dos córtices pré-frontal e parietal em pacientes com primeiro episódio de esquizofrenia11, levando suporte adicional sobre o envolvimento dessas áreas na fisiopatologia da esquizofrenia26. Nessa doença, tem sido observado que a ativação talâmica direita e do córtex pré-frontal está diminuída durante o reconhecimento de um estímulo visual novo27. Esses resultados confirmam a disfunção da rede pré-frontotêmporo-límbica e a hipótese da hipofrontalidade da esquizofrenia28,29. Além do mais uma rede pré-fronto-parietal perturbada tem sido envolvida em déficits de memória de trabalho relacionados à esquizofrenia30,31. No presente estudo, o córtex cingulado anterior, que serve como modulador do córtex pré-frontal dorsolateral12,32, mostrou uma ativação reduzida. Também foi relatado que essa região exibe uma redução na utilização de glicose correlacionada com a magnitude dos sintomas positivos33. Em contraste, os sintomas negativos foram associados à diminuição na captação de glicose no córtex pré-frontal34,35.
O paradigma visuoacústico usado nesse estudo é simples e robusto demandando apenas esforço cognitivo e motivação mínimos. Portanto, esse é o mais apropriado para a aplicação em pacientes idosos com esquizofrenia crônicos com déficits cognitivos e sintomas negativos e positivos persistentes. Usando o mesmo paradigma, em pacientes com o primeiro episódio de esquizofrenia comparados a controles jovens saudáveis, déficits funcionais, como regiões cerebrais menos ativadas, têm sido mostrados no tálamo posterior direito, no córtex pré-frontal, assim como bilateralmente nos córtices occipital e parietal inferior. Isso pode estar relacionado aos distúrbios do processamento de informação na esquizofrenia11. Nosso grupo de pacientes idosos com esquizofrenia crônica apresentou resposta BOLD reduzida nas áreas pré-frontal e parietal. Postulou-se que apenas mudanças mínimas na ativação cerebral dessas regiões ocorreriam durante o envelhecimento no curso da esquizofrenia crônica. Assim, o paradigma usado mostra déficits robustos que podem estar relacionados a distúrbios do neurodesenvolvimento, ao invés dos processos neurodegenerativos presumidos adicionalmente na esquizofrenia crônica.
Os resultados do presente estudo em controles idosos saudáveis sem déficits cognitivos mostraram a ativação das mesmas áreas que em controles jovens11, revelando que a função cerebral é preservada até a velhice. No entanto, existem evidências de efeitos relacionados à idade no volume cerebral, como o estreitamento do córtex cerebral frontoparietal36 e a ativação reduzida do córtex orbitofrontal em sujeitos idosos comparados a jovens37. No córtex pré-frontal, um estudo por RMf também relatou diminuição relacionada à idade na responsividade do córtex pré-frontal e parietal em sujeitos idosos38. Em um estudo por TEP, a atividade do córtex cingulado anterior e do córtex préfrontal lateral era dependente da idade39. Portanto, no nosso estudo não podemos excluir efeitos relacionados à idade na função cerebral, que podem ser detectados apenas comparando sujeitos jovens a idosos.
Todos os pacientes do presente estudo passaram pelo tratamento de longa duração com medicação antipsicótica. Quando os pacientes tratados com neurolépticos típicos são comparados aos pacientes que receberam o neuroléptico (atípico) clozapina, observou-se que pacientes idosos tratados com clozapina apresentam maior ativação no córtex pré-frontal dorsolateral e córtex parietal posterior, assim como no córtex cingulado anterior em comparação com aqueles tratados com neurolépticos típicos. Isso confirma resultados de resposta BOLD aumentada nos córtices pré-frontal e parietal em pacientes jovens após tratamento com olanzapina pelo período de três semanas7 e melhora na ativação do córtex cingulado anterior após tratamento de curta duração com antipsicóticos atípicos40-42. Em relação ao córtex pré-frontal, esses efeitos restauradores da ativação cerebral não foram observados em associação a neurolépticos típicos após estimulação visuoacústica43. Utilizando tarefa de memória de trabalho, a ativação pré-frontal e parietal posterior foi aumentada após a mudança de neurolépticos típicos para a risperidona44. Adicionalmente, a ativação diminuída dessas regiões, bem como do giro do cíngulo anterior está envolvido em déficits atencionais na esquizofrenia45,46. Neurolépticos típicos como haloperidol são conhecidos por interferir com habilidades atencionais47 por modulação tônica antidopamina do receptor D2 nas funções cognitivas superiores, como mostrado por estudos em voluntários saudáveis e roedores48-50. Entre os pacientes deste estudo, no entanto, havia tendência a um melhor desempenho atencional do grupo clozapina no TMT-A, que não atingiu significância estatística, provavelmente por causa do pequeno tamanho da amostra.
Nossos resultados sugerem que o tratamento com clozapina melhora o metabolismo pré-frontal, parietal e cingulado anterior em pacientes com esquizofrenia. Em linha com esses achados, um estudo usando espectroscopia de prótons por ressonância magnética (1H-ERM) em pacientes jovens com esquizofrenia mostrou aumento de N-acetil-aspartato no córtex cingulado anterior de subgrupo tratado com clozapina e risperidona comparado a pacientes tratados com neurolépticos típicos51. O aumento de N-acetil-aspartato é marcador de viabilidade e função neuronais aumentadas52. Nesse contexto, a clozapina é conhecida por melhorar a neurotransmissão glutamatérgica no córtex, um achado que não é observado com haloperidol. Em estudos com animais, a clozapina tem sido relacionada a aumento na atividade do receptor N-metil-D-aspartato (NMDA) no córtex por diminuição na expressão de transportadores de glutamato, que regulam a captação de glutamato na sinapse53,54. Os níveis extracelulares de glutamato também podem ser elevados pela inibição de interneurônios gabaérgicos55-57. Desde que a hipofunção glutamatérgica tem sido proposta na fisiopatologia da esquizofrenia, uma transmissão glutamatérgica aumentada por antipsicóticos atípicos em áreas corticais pode melhorar a ativação cerebral, assim com melhora dos sintomas. Comparado a neurolépticos típicos, a clozapina é de fato conhecida por melhorar os sintomas negativos com a vantagem do tratamento dos sintomas positivos58,59, apesar de o presente estudo não revelar diferenças significativas na pontuação das escalas psicopatológicas entre pacientes tratados com antipsicóticos atípicos e neurolépticos típicos. Isso pode ser em virtude de regime terapêutico que favorece a clozapina em pacientes com sintomas mais severos.
Durante a avaliação dos resultados desse trabalho é necessário ter as limitações deste em mente. Por causa de aspectos éticos, por exemplo, não se pode investigar pacientes com esquizofrenia crônica não tratados, portanto apenas um estudo com indivíduos virgens de tratamento poderia determinar se os efeitos observados são resultados da medicação antipsicótica. No entanto, ele permite análise útil por comparar grupos tratados com neurolépticos típicos ou clozapina. O desenho é transversal, em contraste a estudo prospectivo de tratamento que tem a vantagem de comparar efeitos do tratamento de maneira mais confiável. Até o momento, no entanto, tal regime de estudo não é praticável para investigar pacientes com esquizofrenia crônica. Em adição aos efeitos favoráveis dos antipsicóticos atípicos na função cerebral, a ativação pré-frontal e a resposta da memória de trabalho à medicação atípica também pode também ser predita pela genotipagem da catecol-O-metiltransferase60,61, que deve ser investigado nesses pacientes. Em resumo, mostrou-se déficit cortical difundido em pacientes idosos com esquizofrenia crônica, que representam grupo de diagnóstico homogêneo. Além disso, distúrbios da ativação cerebral ocorrem apesar da idade e apontam para a influência dos distúrbios do neurodesenvolvimento na esquizofrenia também na velhice. Como um todo, os dados do presente estudo estão alinhados com os diferentes novos dados clínicos62-64, mostrando que o tratamento com antipsicóticos atípicos é vantajoso mesmo em pacientes idosos com esquizofrenia para restaurar a função cerebral.
- 1. Braff DL, Saccuzzo DP. Information processing dysfunction in paranoid schizophrenia: a two-factor deficit. Am J Psychiatry. 1981; 138(8):1051-6.
- 2. Nuechterlein KH, Dawson ME, Green MF. Information-processing abnormalities as neuropsychological vulnerability indicators for schizophrenia. Acta Psychiatr Scand. 1994;90(Suppl 384):71-9.
- 3. Javitt DC, Shelley AM, Silipo G, Lieberman JA. Deficits in auditory and visual context-dependent processing in schizophrenia: defining the pattern. Arch Gen Psychiatry. 2000;57(12):1131-7.
- 4. Weinberger DR, Berman KF, Suddath R, Torrey EF. Evidence of dysfunction of a prefrontal-limbic network in schizophrenia: a magnetic resonance imaging and regional cerebral blood flow study of discordant monozygotic twins. Am J Psychiatry. 1992;149(7):890-7.
- 5. Rabinowicz EF, Silipo G, Goldman R, Javit DC. Auditory sensory dysfunction in schizophrenia: imprecision or distractibility? Arch Gen Psychiatry. 2000;57(12):1149-55.
- 6. Saccuzzo DP, Braff DL. Early information processing deficit in schizophrenia. New findings using schizophrenic subgroups and manic control subjects. Arch Gen Psychiatry. 1981;38(2):175-9.
- 7. Braus DF, Brassen S. Functional magnetic resonance imaging and antipsychotics. Overview and own data. Radiologe. 2005;45(2):178-85.
- 8. Cabeza R, Daselaar SM, Dolcos F, Prince SE, Budde M, Nyberg L. Task-independent and task-specific age effects on brain activity during working memory, visual attention and episodic retrieval. Cereb Cortex. 2004;14(4):364-75.
- 9. Madden DJ, Whiting WL, Provenzale JM, Huettel SA. Age-related changes in neural activity during visual target detection measured by fMRI. Cereb Cortex. 2004;14(2):143-55.
- 10. Arnold SE. Contributions of neuropathology to understanding schizophrenia in late life. Harvard Review of Psychiatry. 2001;9(2):69-76.
- 11. Braus DF, Ende G, Weber-Fahr W, Demirakca T, Tost H, Henn FA. Functioning and neuronal viability of the anterior cingulate neurons following antipsychotic treatment: MR-spectroscopic imaging in chronic schizophrenia. Eur Neuropsychopharmacol. 2002;12(2):145-52.
- 12. Kerns JG, Cohen JD, MacDonald AW, Cho RY, Stenger VA, Carter CS. Anterior cingulate conflict monitoring and adjustments in control. Science. 2004;303(5660):1023-6.
- 13. Association AP. DSM IV: Diagnostic and Statistical Manual of Mental Disorders, fourth edition. Washington, DC: American Psychiatric Association; 1994.
- 14. Oldfield RC. The assessment and analysis of handedness: the Edinburgh inventory. Neuropsychologia. 1971;9(1):97-113.
- 15. Jahn T, Mussgay L. Die statistische Kontrolle möglicher Medikamenteneinflüsse in experimentalpsychologischen Schizophreniestudien: Ein Vorschlag zur Berechnung von Chlorpromazinäquivalenten. Z Klin Psychol. 1989;18:257-67.
- 16. Meltzer HY, Fatemi SH. Treatment of Schizophrenia. The American Psychiatric Press Text Book of Psychopharmacology. In: Schatzberg AF, Nemeroff CB, editores. 2a ed. Washington, DC: American Psychiatric Press; 1998. p. 747-74.
- 17. Andreasen N. Scale for the Assessment of Positive Symptoms (SAPS). Iowa City: University of Iowa; 1983.
- 18. Andreasen N. Scale for the Assessment of Negative Symptoms (SANS). Iowa City: University of Iowa; 1983.
- 19. Overall JE, Gorham DR. A brief psychiatric rating scale (BPRS). Psychol Rep. 1962;10:799-812.
- 20. Frith CD, Friston KJ, Herold S, Silbersweig D, Fletcher P, Cahill C, et al. Regional brain activity in chronic schizophrenic patients during the performance of a verbal fluency task. Br J Psychiatry. 1995;167(3):343-9.
- 21. Joyce EM, Collinson SL, Crichton P. Verbal fluency in schizophrenia: relationship with executive function, semantic memory and clinical alogia. Psychol Med. 1996;26(1):39-49.
- 22. Reitan R. Trail Making Test. Reitan Neuropsychology Laboratory. South Tucson; 1992.
- 23. Folstein MF, Folstein SE, McHugh PR. "Mini-mental state". A practical method for grading the cognitive state of patients for the clinician. J Psychiatr Res. 1975;12(3):189-98.
- 24. Talairach JPT. Co-Planar Stereotaxic Atlas of the Human Brain. Stuttgart: Thieme Verlag; 1988.
- 25. Friston KJ, Holmes AP, Poline JB, Grasby PJ, Williams SC, Frackowiak RS, et al. Analysis of fMRI time-series revisited. Neuroimage. 1995;2(1):45-53.
- 26. Pearlson GD, Petty RG, Ross CA, Tien AY. Schizophrenia: a disease of heteromodal association cortex? Neuropsychopharmacology. 1996; 14(1):1-17.
- 27. Heckers S, Curran T, Goff D, Rauch SL, Fischman AJ, Alpert NM, et al. Abnormalities in the thalamus and prefrontal cortex during episodic object recognition in schizophrenia. Biol Psychiatry. 2000;48(7):651-7.
- 28. Andreasen NC, Paradiso S, O'Leary DS. "Cognitive dysmetria" as an integrative theory of schizophrenia: a dysfunction in corticalsubcortical-cerebellar circuitry? Schizophr Bull. 1998;24(2):203-18.
- 29. Weinberger DR, Lipska BK. Cortical maldevelopment, anti-psychotic drugs, and schizophrenia: a search for common ground. Schizophr Res. 1995;16(2):87-110.
- 30. Schlosser RG, Nenadic I, Wagner G, Gullmar D, von Consbruch K, Kohler S, et al. White matter abnormalities and brain activation in schizophrenia: a combined DTI and fMRI study. Schizophr Res. 2007; 89(1-3):1-11.
- 31. Schneider F, Habel U, Reske M, Kellermann T, Stocker T, Shah NJ, et al. Neural correlates of working memory dysfunction in first-episode schizophrenia patients: an fMRI multi-center study. Schizophr Res. 2007;89(1-3):198-210.
- 32. Fincham JM, Anderson JR. Distinct roles of the anterior cingulate and prefrontal cortex in the acquisition and performance of a cognitive skill. Proc Natl Acad Sci U S A. 2006;103(34):12941-6.
- 33. Tamminga CA, Holcomb HH. Phenotype of schizophrenia: a review and formulation. Mol Psychiatry. 2005;10(1):27-39.
- 34. Corcoran R, Frith CD. Neuropsychology and neurophysiology in schizophrenia. Current Opinion in Psychiatry. 1993;6:74-9.
- 35. Schröder J, Buchsbaum MS, Siegel BV, Geider FJ, Lohr J, Tang C, et al. Cerebral metabolic activity correlates of subsyndromes in chronic schizophrenia. Schizophr Res. 1996;19(1):41-53.
- 36. Salat DH, Buckner RL, Snyder AZ, Greve DN Desikan RS, Busa E, et al. Thinning of the cerebral cortex in aging. Cereb Cortex. 2004;14(7): 721-30.
- 37. Lamar M, Yousem DM, Resnick SM. Age differences in orbitofrontal activation: an fMRI investigation of delayed match and nonmatch to sample. Neuroimage. 2004;21(4):1368-76.
- 38. Milham MP, Erickson KI, Banich MT, Kramer AF, Webb A, Wszalek T, et al. Attentional control in the aging brain: insights from an fMRI study of the stroop task. Brain and Cognition. 2002;49(3):277-96.
- 39. Sharp DJ, Scott SK, Mehta MA, Wise RJ. The neural correlates of declining performance with age: evidence for age-related changes in cognitive control. Cereb Cortex. 2006;16(12):1739-49
- 40. Davis CE, Jeste DV, Eyler LT. Review of longitudinal functional neuroimaging studies of drug treatments in patients with schizophrenia. Schizophrenia Research. 2005;78(1):45-60.
- 41. Jones HM, Brammer MJ, O'Toole M, Taylor T, Ohlsen RI, Brown RG, et al. Cortical effects of quetiapine in first-episode schizophrenia: a preliminary functional magnetic resonance imaging study. Biol Psychiatry. 2004;56(12): 938-42.
- 42. Snitz BE, MacDonald A, Cohen JD, Cho RY, Becker T, Carter CS. Lateral and medial hypofrontality in first-episode schizophrenia: functional activity in a medication-naive state and effects of short-term atypical antipsychotic treatment. Am J Psychiatry. 2005;162(12):2322-9.
- 43. Braus DF, Ende G, Hubrich-Ungureanu P, Henn FA. Cortical response to motor stimulation in neuroleptic-naive first episode schizophrenics. Psychiatry Res. 2000;98(3):145-54.
- 44. Honey GD, Bullmore ET, Soni W, Varatheesan M, Williams SC, Sharma T. Differences in frontal cortical activation by a working memory task after substitution of risperidone for typical antipsychotic drugs in patients with schizophrenia. Proc Natl Acad Sci U S A. 1999;96(23):13432-7.
- 45. Ojeda N, Ortuño F, Arbizu J, López P, Martí-Climent JM Peñuelas I, et al. Functional neuroanatomy of sustained attention in schizophrenia: contribution of parietal cortices. Hum Brain Mapp. 2002;17(2):116-30.
- 46. Weiss EM, Siedentopf C, Golaszewski S, Mottaghy FM, Hofer A, Kremser C, et al. Brain activation patterns during a selective attention test: a functional MRI study in healthy volunteers and unmedicated patients during an acute episode of schizophrenia. Psychiatry Res. 2007;154(1):31-40.
- 47. Tost H, Meyer-Lindenberg A, Ruf M, Demirakca T, Grimm O, Henn FA, et al. One decade of functional imaging in schizophrenia research. From visualisation of basic information processing steps to molecular-genetic oriented imaging. Radiologe. 2005;45(2):113-8, 120-13.
- 48. Floresco SB, Magyar O. Mesocortical dopamine modulation of executive functions: beyond working memory. Psychopharmacology (Berl). 2006;188(4):567-85.
- 49. Goto Y, Grace AA. Dopaminergic modulation of limbic and cortical drive of nucleus accumbens in goal-directed behavior. Nat Neurosci. 2005;8(6):805-12.
- 50. Mehta MA, Manes FF, Magnolfi G, Sahakian BJ, Robbins TW. Impaired set-shifting and dissociable effects on tests of spatial working memory following the dopamine D2 receptor antagonist sulpiride in human volunteers. Psychopharmacology (Berl). 2004;176(3-4):331-42.
- 51. Braus DF, Ende G, Weber-Fahr W, Demirakca T, Henn FA. Favorable effect on neuronal viability in the anterior cingulate gyrus due to long-term treatment with atypical antipsychotics: an MRSI study. Pharmacopsychiatry. 2001;34(6):251-3.
- 52. De Stefano N, Matthews PM, Antel JP, Preul M, Francis G, Arnold DL. Chemical pathology of acute demyelinating lesions and its correlation with disability. Ann Neurol. 1995;38(6):901-9.
- 53. Melone M, Bragina L, Conti F. Clozapine-induced reduction of glutamate transport in the frontal cortex is not mediated by GLAST and EAAC1. Mol Psychiatry. 2003;8(1):12-3.
- 54. Schmitt A, Zink M, Petroianu G, May B, Braus DF, Henn FA. Decreased gene expression of glial and neuronal glutamate transporters after chronic antipsychotic treatment in rat brain. Neurosci Lett. 2003;347(2):81-4.
- 55. Flores C, Coyle JT. Regulation of glutamate carboxypeptidase II function in corticolimbic regions of rat brain by phencyclidine, haloperidol, and clozapine. Neuropsychopharmacology. 2003;28(7):1227-34.
- 56. Michel FJ, Trudeau LE. Clozapine inhibits synaptic transmission at GABAergic synapses established by ventral tegmental area neurones in culture. Neuropharmacology. 2000;39(9):1536-3.
- 57. Zink M, Schmitt A, May B, Mueller B, Braus DF, Henn FA. Differential effects of long-term treatment with clozapine or haloperidol on GABA transporter expression. Pharmacopsychiatry. 2004;37(4):171-4.
- 58. Lieberman JA, Tollefson GD, Charles C, Zipursky R, Sharma T, Kahn RS, et al. Antipsychotic drug effects on brain morphology in first-episode psychosis. Arch Gen Psychiatry. 2005;62(4):361-70.
- 59. Potkin SG, Fleming K, Jin Y, Gulasekaram B. Clozapine enhances neurocognition and clinical symptomatology more than standard neuroleptics. J Clin Psychopharmacol. 2001;21(5):479-83.
- 60. Bertolino A, Caforio G, Blasi G, De Candia M, Latorre V, Petruzzella V, et al. Interaction of COMT (Val(108/158)Met) genotype and olanzapine treatment on prefrontal cortical function in patients with schizophrenia. Am J Psychiatry. 2004;161(10):1798-805.
- 61. Weickert TW, Goldberg TE, Mishara A, apud JA, Kolachana BS, Egan MF, et al. Catechol-O-methyltransferase val108/158met genotype predicts working memory response to antipsychotic medications. Biol Psychiatry. 2004;56(9):677-82.
- 62. Bartzokis G, Lu PH, Nuechterlein KH, Gitlin M, Doi C, Edwards N, et al. Differential effects of typical and atypical antipsychotics on brain myelination in schizophrenia. Schizophr Res. 2007;93(1-3):13-22.
- 63. van Haren NE, Hulshoff Pol HE, Schnack HG, Cahn W, Mandl RC, Collins DL, et al. Focal gray matter changes in schizophrenia across the course of the illness: a 5-year follow-up study. Neuropsychopharmacology. 2007;32(10):2057-66.
- 64. Woodward ND, Purdon SE, Meltzer HY, Zald DH. A meta-analysis of cognitive change with haloperidol in clinical trials of atypical antipsychotics: dose effects and comparison to practice effects. Schizophr Res. 2007;89(1-3):211-24.
Datas de Publicação
-
Publicação nesta coleção
28 Ago 2009 -
Data do Fascículo
2009