Resumos
Considerando que os roedores possuem diversas formas de locomoção, o presente estudo apresenta e discute variações na forma das pegadas anteriores e posteriores de sete espécies [Akodon cursor (Winge, 1887), Necromys lasiurus (Lund, 1840), Oecomys bicolor (Tomes, 1860), Oecomys concolor (Wagner, 1845), Oligoryzomys nigripes (Olfers, 1818), Hylaeamys megacephalus (Fischer, 1814) e Rhipidomys macrurus (Gervais, 1855)], utilizando técnicas de morfometria geométrica e análises discriminantes. As variáveis de forma das pegadas foram relacionadas com a topologia filogenética e os modos de locomoção das espécies para verificar a influência de fatores históricos e ecológicos na morfologia das pegadas. A forma das pegadas dos roedores arborícolas (curtas e largas) foi claramente distinta dos cursoriais (estreitas e alongadas). As reclassificações das pegadas anteriores (Kappa = 0,72) e posteriores (Kappa = 0,88) das espécies foram consideradas substanciais e quase perfeitas, respectivamente. As pegadas posteriores discriminaram melhor as espécies além de indicarem os níveis de atividade arborícola e cursorial dos roedores. Efeitos alométricos foram observados nas análises das pegadas anteriores (13%) e posteriores (3%). O modo de locomoção explicou 90,3% da variação na forma nas pegadas dos roedores (p = 0,02), indicando convergência nos padrões morfológicos nas pegadas das espécies de roedores arborícolas e cursoriais.
Cricetidae; forma; modo de locomoção; morfometria geométrica
Considering that species of rodents have different means of locomotion, this study presents and discusses variations on the anterior and posterior footprints shape of seven species [Akodon cursor (Winge, 1887), Necromys lasiurus (Lund, 1840), Oecomys bicolor (Tomes, 1860), Oecomys concolor (Wagner, 1845), Oligoryzomys nigripes (Olfers, 1818), Hylaeamys megacephalus (Fischer, 1814) and Rhipidomys macrurus (Gervais, 1855)], using geometric morphometrics and discriminant analyses. Shape variables were related to phylogenetic topology and means of locomotion of the species to verify the influence of historical or ecological factors on footprints morphology. Footprints shape of the arboreal rodents (short and wide) was clearly distinct of cursorial ones (narrow and elongated). The anterior (Kappa = 0,72) and posterior (Kappa = 0,88) footprint reclassification was considered substantial and almost perfect, respectively. The posterior footprints presented better results of species discrimination and set the levels of arboreal and cursorial activity of rodents. Allometric effects were observed in anterior (13%) and posterior (3%) footprint analysis. The means of locomotion explained 90.3% of footprint rodents shape variation (p = 0.02), indicating convergence on footprint morphological patterns of arboreal and cursorial rodents.
Cricetidae; geometric morphometrics; means of locomotion; shape
MORPHOLOGY AND PHYSIOLOGY
Nícholas F. de CamargoI; Rodrigo Gurgel-GonçalvesI; Alexandre R. T. PalmaII
ILaboratório de Zoologia, Curso de Ciências Biológicas, Universidade Católica de Brasília. QS 07 Lote 1 EPTC Bloco M, 72030-170 Águas Claras, Distrito Federal, Brasil. E-mail: camargonf@gmail.com; rgurgel@ucb.com
II Departamento de Sistemática e Ecologia, Centro de Ciências Exatas e da Natureza, Universidade Federal da Paraíba. Campus I, Cidade Universitária Castelo Branco, 58059-900 João Pessoa, Paraíba, Brasil. E-mail: artpalma@dse.ufpb.br
RESUMO
Considerando que os roedores possuem diversas formas de locomoção, o presente estudo apresenta e discute variações na forma das pegadas anteriores e posteriores de sete espécies [Akodon cursor (Winge, 1887), Necromys lasiurus (Lund, 1840), Oecomys bicolor (Tomes, 1860), Oecomys concolor (Wagner, 1845), Oligoryzomys nigripes (Olfers, 1818), Hylaeamys megacephalus (Fischer, 1814) e Rhipidomys macrurus (Gervais, 1855)], utilizando técnicas de morfometria geométrica e análises discriminantes. As variáveis de forma das pegadas foram relacionadas com a topologia filogenética e os modos de locomoção das espécies para verificar a influência de fatores históricos e ecológicos na morfologia das pegadas. A forma das pegadas dos roedores arborícolas (curtas e largas) foi claramente distinta dos cursoriais (estreitas e alongadas). As reclassificações das pegadas anteriores (Kappa = 0,72) e posteriores (Kappa = 0,88) das espécies foram consideradas substanciais e quase perfeitas, respectivamente. As pegadas posteriores discriminaram melhor as espécies além de indicarem os níveis de atividade arborícola e cursorial dos roedores. Efeitos alométricos foram observados nas análises das pegadas anteriores (13%) e posteriores (3%). O modo de locomoção explicou 90,3% da variação na forma nas pegadas dos roedores (p = 0,02), indicando convergência nos padrões morfológicos nas pegadas das espécies de roedores arborícolas e cursoriais.
Palavras-chave: Cricetidae; forma; modo de locomoção; morfometria geométrica.
ABSTRACT
Considering that species of rodents have different means of locomotion, this study presents and discusses variations on the anterior and posterior footprints shape of seven species [Akodon cursor (Winge, 1887), Necromys lasiurus (Lund, 1840), Oecomys bicolor (Tomes, 1860), Oecomys concolor (Wagner, 1845), Oligoryzomys nigripes (Olfers, 1818), Hylaeamys megacephalus (Fischer, 1814) and Rhipidomys macrurus (Gervais, 1855)], using geometric morphometrics and discriminant analyses. Shape variables were related to phylogenetic topology and means of locomotion of the species to verify the influence of historical or ecological factors on footprints morphology. Footprints shape of the arboreal rodents (short and wide) was clearly distinct of cursorial ones (narrow and elongated). The anterior (Kappa = 0,72) and posterior (Kappa = 0,88) footprint reclassification was considered substantial and almost perfect, respectively. The posterior footprints presented better results of species discrimination and set the levels of arboreal and cursorial activity of rodents. Allometric effects were observed in anterior (13%) and posterior (3%) footprint analysis. The means of locomotion explained 90.3% of footprint rodents shape variation (p = 0.02), indicating convergence on footprint morphological patterns of arboreal and cursorial rodents.
Key words: Cricetidae; geometric morphometrics; means of locomotion; shape.
Os roedores sigmodontíneos ocupam diferentes habitats e apresentam vários modos de vida (semi-aquáticos, fossoriais, semi-fossoriais, cursoriais, semi-arborícolas e arborícolas) (EMMONS & FEER 1997, FONSECA et al. 1996). A variação nos modos de vida é produto tanto das restrições impostas pela evolução morfológica quanto da adaptação a ambientes particulares.
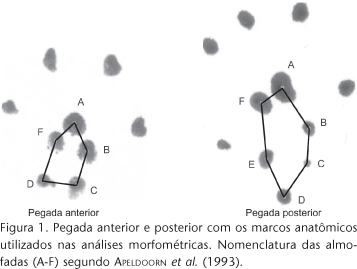
O bioma Cerrado inclui fitofisionomias florestais, savânicas e campestres (EITEN 1990) com diferentes graus de complexidade estrutural. Segundo ALHO (1981), a diversidade e complexidade dessas fitofisionomias devem influenciar na riqueza e variação morfológica de espécies do Cerrado. Uma das formas dos roedores explorarem essa complexidade é por meio da segregação vertical, apresentando diferentes graus de arborealidade (NITIKMAN & MARES 1987). Entre as especializações para exploração de nichos arbóreos e terrestres, estão as modificações nas patas, que podem ser avaliadas estudando as pegadas (PALMA & GURGEL-GONÇALVES 2007).
Vários estudos ecológicos de pequenos mamíferos não voadores foram realizados no bioma Cerrado nas últimas décadas (e.g. ALHO 1981, ALHO & PEREIRA 1985, ERNEST & MARES 1986, NITIKMAN & MARES 1987, HENRIQUES & ALHO 1991, VIEIRA & BAUMGARTEN 1995, BRIANI et al. 2004, RIBEIRO & MARINHO-FILHO 2005, ALHO 2005, BONVICINO et al. 2005). Entretanto, a relação entre características morfológicas e modos de locomoção de roedores foi menos estudada. O grau de arborealidade de mamíferos tem sido relacionado com a proporção entre falanges; JI et al. (2002) mostraram que a proporção entre as falanges medial e proximal difere entre didelfídeos terrestres, semi-arborícolas e arborícolas. A curvatura da garra, importante para indicar graus de arborealidade em aves (FEDUCCIA 1993), foi apontada por RIVAS & LINARES (2006) como uma especialização de roedores sigmodontíneos arborícolas na savana venezuelana.
O estudo das pegadas vem sendo feito nas últimas décadas e representa uma ferramenta importante para inventários e estudos ecológicos de populações de mamíferos de maneira menos invasiva (MARTEN 1972, TAYLOR & RAPHAEL 1988, BECKER & DALPONTE 1991, CAREY & WITT 1991, BOONSTRA et al. 1992, ALPEDOORN et al. 1993, RATZ 1997, PALMA & GURGEL-GONÇALVES 2007). Em alguns desses estudos, a discriminação de pegadas entre espécies foi feita usando a morfometria tradicional como ferramenta, ou seja, a medição e quantificação de distâncias e/ou ângulos (MONTEIRO & REIS 1999). Distâncias entre almofadas da sola e os dedos foram usadas para caracterizar pegadas de insetívoros e roedores, porém não permitiram mostrar diferenças claras entre as espécies de um mesmo grupo (ALPEDOORN et al. 1993). Posteriormente, RATZ (1997) analisou a relação entre comprimento e largura de pegadas de roedores, insetívoros e mustelídeos, mostrando diferenças de tamanho, porém indicando pouca diferença de forma entre as pegadas de roedores. Em uma análise morfométrica de pegadas de pequenos mamíferos do Cerrado, PALMA & GURGEL-GONÇALVES (2007) mostraram que é possível discriminar pegadas de roedores, incluindo espécies cogenéricas, usando morfometria tradicional e análises multivariadas.
Apesar desses estudos morfométricos indicarem diferenças importantes nas pegadas das espécies de roedores, a variação de forma entre as pegadas não foi detalhada nem visualizada. Uma maneira de se analisar as variações e covariações de forma é a partir de técnicas de morfometria geométrica, que permitem representar graficamente as regiões da pegada onde se concentram as diferenças interespecíficas ou variações associadas aos modos de locomoção das espécies.
A morfometria geométrica é um conjunto de técnicas de aquisição, processamento, análise e visualização que preservam a geometria do objeto. Baseia-se no uso de coordenadas cartesianas e métodos de superposição para analisar a variação de forma entre espécimes (ROHLF & MARCUS 1993, MONTEIRO & REIS 1999). A técnica permite apresentar de maneira gráfica e clara as diferenças na forma de uma determinada estrutura, além de indicar com maior precisão em quais regiões se concentra a sua variação. Alguns estudos de morfometria geométrica contribuíram muito para o entendimento de aspectos ecológicos e filogenéticos. A morfometria geométrica do crânio de roedores já foi utilizada com sucesso para estudar variações intra-específicas (MONTEIRO et al. 1999, HINGST-ZAHER et al. 2000) e interespecíficas (CORDEIRO-ESTRELA et al. 2006). A técnica também foi eficiente no estudo sobre modo de locomoção, complementação osteológica, postural e evolução de saurópodes usando pegadas icnofósseis (RODRIGUES & SANTOS 2003). Ainda, a partir do estudo de morfometria geométrica da articulação distal de úmero de carnívoros do velho mundo, ANDERSSON (2004) pôde inferir se duas espécies extintas apresentavam o comportamento de forrageamento do tipo senta e espera ou o de perseguição ativa. Finalmente, RIVAS & LINARES (2006) utilizaram a morfometria geométrica para verificar as diferenças morfológicas das patas posteriores de nove gêneros de roedores sigmodontíneos da savana venezuelana, relacionando modo de vida e habitat. Dessa forma, a morfometria geométrica pode fornecer informações importantes sobre o modo de vida e ecologia dos roedores.
Os objetivos desse estudo foram: 1) apresentar e discutir variações na forma das pegadas de sete espécies de roedores do Cerrado [Akodon cursor (Winge, 1887), Necromys lasiurus (Lund, 1840), Oecomys bicolor (Tomes, 1860), Oecomys concolor (Wagner, 1845), Oligoryzomys nigripes (Olfers, 1818), Hylaeamys megacephalus (Fischer, 1814) e Rhipidomys macrurus (Gervais, 1855)], utilizando técnicas de morfometria geométrica e análises discriminantes; e 2) estudar a variação morfológica das pegadas posteriores e anteriores indicando qual delas representa melhor as diferenças entre os modos de vida das espécies.
MATERIAL E MÉTODOS
Coleção de referência
As análises de morfometria geométrica foram realizadas utilizando a mesma coleção de referência de pegadas de pequenos mamíferos do Cerrado utilizada e identificada por PALMA & GURGEL-GONÇALVES (2007). Foram selecionadas as espécies de roedores com diferentes modos de locomoção e que apresentavam maior quantidade de pegadas para viabilizar a análise morfométrica (Tab. I). Os indivíduos juvenis foram desconsiderados da análise evitando assim possíveis variações ontogênicas que influenciassem na forma (MONTEIRO & REIS 1999).
Digitalização das pegadas
As pegadas foram digitalizadas usando um scanner de mesa com resolução de 600 dpi, cor preto e branco e utilizando como padrão de orientação a seguinte posição: patas anteriores e posteriores direitas. O tratamento digital e efeitos de espelho (na ausência de boas pegadas direitas) das imagens foram realizados com o programa Adobe Photoshop 6.0.
O centro das almofadas da sola deixadas por impressão das pegadas anteriores e posteriores foi considerado como marco anatômico ('Landmark'), de acordo com a figura 1. A digitalização desses marcos foi feita utilizando o programa TPSDIG versão 1.18 (ROHLF 1999a). A repetição de até quatro pegadas por indivíduo de cada espécie foi utilizada quando possível, para minimizar o erro dos pontos marcados.
Morfometria geométrica
Utilizando o programa TPSRELW versão 1.18 (ROHLF 1999b), as variáveis de forma foram obtidas a partir da sobreposição dos marcos anatômicos (Algoritmo de Procrustes), definidos nas imagens digitalizadas das pegadas de cada indivíduo. Este método envolve a translação, centralizando a configuração dos marcos anatômicos; rotação, minimizando as distâncias entre os marcos e escalamento, padronizando a configuração dos marcos anatômicos a partir do Tamanho do Centróide (TC) (BOOKSTEIN 1991, ROHLF 1999b). O TC foi calculado a partir da raiz quadrada da soma do quadrado das distâncias de cada um dos marcos antômicos ao centro de massa de cada configuração (centróide) (BOOKSTEIN 1991). Este estimador isométrico da variação de tamanho das pegadas também foi obtido a partir do TPSRELW.
Análises estatísticas
As variáveis de forma (deformações parciais e componentes uniformes) da análise de deformações obtidas pelo TPSRELW foram utilizadas em análises multivariadas (Análise de Fatores Discriminantes - AFD) para testar se existe diferença na forma das pegadas entre as espécies. Os mapas fatoriais foram usados para mostrar graficamente a distribuição das pegadas de cada espécie de roedor no espaço multivariado de forma definido pelos dois primeiros fatores discriminantes. Para uma melhor visualização do gráfico, polígonos convexos agrupando todas as pegadas de uma espécie foram desenhados utilizando os pontos extremos e removendo posteriormente os pontos relativos a cada pegada. A significância das AFDs foi testada usando a estatística Kappa (LANDIS & KOCH 1977). Os valores do tamanho do centróide das pegadas dos indivíduos de cada espécie extraídos nas análises foram padronizados transformando-os em x' = log [x]. Para analisar a variação de tamanho de pegadas anteriores e posteriores entre as espécies, foi aplicada uma análise de variância (ANOVA). Para verificar as diferenças estatísticas de forma entre as pegadas (anteriores e posteriores) das espécies foi feita uma MANOVA com as variáveis de forma. Uma MANOVA das variáveis de forma das pegadas utilizando os níveis de atividade arborícola como variável independente também foi aplicada. Por meio de regressões, as variáveis de forma e tamanho foram analisadas para verificar a presença de alometria. As análises foram computadas com os programas Statistica® e JMP® (SAS Institute Inc., Cary, NC, USA).
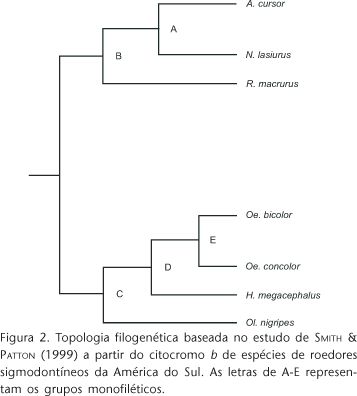
Utilizando uma Ordenação Filogenética Canônica (OFC) (GIANNINI 2003), parâmetros de história evolutiva e ecologia foram testados para verificar qual explica melhor a forma das pegadas dos roedores estudados. A OFC é uma modificação da Análise de Correspondência Canônica (ACC) (TER BRAAK 1986). Uma das matrizes (Y) da OFC continha as médias dos valores da variável canônica 1 (VC 1) correspondentes para cada espécie, explicando a forma das pegadas anteriores e posteriores dos roedores; a outra (X) continha todos os grupos monofiléticos codificados pelas letras de A a E (Fig. 2) e seus respectivos modos de locomoção descritos na tabela I. A análise que consistiu em encontrar o conjunto de dados de X que melhor explicavam a variação em Y foi realizada por meio de uma ACC juntamente com permutações de Monte Carlo. A OFC foi executada no programa CANOCO 4.5 para Windows, utilizando os parâmetros: symmetric scaling, biplot scaling, seleção manual de variáveis (VC 1) que representam a forma das pegadas, grupos monofiléticos e modo de locomoção. A significância foi testada usando 9,999 permutações e permutações irrestritas (MESQUITA et al. 2006).
RESULTADOS
Forma das pegadas
Foi observada a partir da MANOVA diferenças estatísticas na forma entre as pegadas anteriores (F = 30,71; p < 0,01) e principalmente posteriores (F = 37,98; p < 0,01) das espécies de roedores estudados. As pegadas anteriores e posteriores apresentaram formas diferentes associadas aos modos de vida arborícola e cursorial (Fig. 3). Para as pegadas anteriores, essas diferenças foram relacionadas com as posições relativas dos marcos anatômicos C-D e B-F, nos quais houve uma aproximação para roedores cursoriais e afastamento para roedores arborícolas, mostrando estreitamento e alargamento das pegadas. Para as posteriores, o mesmo padrão foi observado, porém, além da aproximação entre pontos B-C-E (estreitamento das pegadas associado ao modo de vida cursorial) foi observado, também, um afastamento entre os pontos A-F em relação aos pontos B-C-E, apresentando uma forma alongada e estreita para pegadas de roedores cursoriais. O mesmo padrão de modificação na forma aconteceu com as pegadas dos roedores arborícolas, porém de maneira inversa, revelando pegadas curtas e largas (Fig. 3).
A variável canônica 1 (VC1), cuja contribuição foi de 76% para as pegadas anteriores e 79% para as posteriores, mostrou de forma eficiente a separação dos grupos de roedores arborícolas e cursoriais. O mapa fatorial (Fig. 3) das pegadas posteriores mostrou esta separação de forma mais clara que as anteriores, bem como a separação em espécies e níveis de atividade arborícola e cursorial. A MANOVA das variáveis da forma utilizando a atividade arborícola como variável independente também foi significativa para pegadas anteriores (F = 45,14; p < 0,01) e principalmente posteriores (F = 71,10; p < 0,01). Somente em R. macrurus e Oe. bicolor houve sobreposição dos polígonos que os representam, tanto nas pegadas anteriores como nas posteriores, mostrando formas muito parecidas para as duas espécies analisando os dois primeiros eixos discriminantes. Ol. nigripes, a única espécie semi-arborícola utilizada no estudo, ficou posicionada entre os arborícolas e cursoriais a partir das pegadas posteriores. Da mesma forma, por meio da AFD das pegadas anteriores, Oe. concolor, roedor de hábito arborícola bem estabelecido, obteve a mesma posição. As configurações de consenso de cada espécie podem ser observadas nas figuras 4 e 5.
A variável canônica 2 também discriminou algumas espécies a partir da forma das pegadas posteriores, onde foi possível observar a separação de dois grupos relacionados a este eixo do gráfico: A. cursor, R. macrurus, Oe. bicolor e Ol. nigripes com menores valores e H. megacephalus, Oe. concolor e N. lasiurus com maiores valores. Para as pegadas anteriores a mudança na forma está relacionada à posição do ponto C em relação ao D (Fig. 6). Já para pegadas posteriores, apesar de existir uma discreta contribuição para pegadas largas ou estreitas, a maior variação se concentra na porção anterior e posterior das almofadas da sola das patas (Figs 6-9). Valores máximos positivos para esta variável conferem pegadas alongadas na porção anterior e curtas na posterior. O oposto ocorre a partir dos valores máximos negativos.
Na AFD considerando as espécies como grupos (Tabs II e III ), as reclassificações de pegadas posteriores (Kappa = 0,88), apresentaram resultados melhores que as anteriores (Kappa = 0,72). De acordo com LANDIS & KOCH (1977), valores entre os intervalos de 0,81 a 1,00 são considerados quase perfeitos e valores entre 0,61 a 0,80 substanciais. Adicionalmente, a percentagem total de classificações corretas das pegadas posteriores (90,14%) foi superior do que das anteriores (76,6%).

A OFC relacionando os modos de vida e a topologia filogenética dos roedores mostrou que a forma das pegadas é predominantemente explicada pelo modo de locomoção e não pelas características herdadas de cada grupo (Tab. IV).
Tamanho das pegadas
A partir do Tamanho do Centróide (TC) foi observada uma diferença significativa de tamanho das pegadas anteriores (F6,188 = 122,78; p < 0,01) e posteriores (F6,204 = 175,77; p < 0,01) entre as espécies de roedores analisadas. O TC das pegadas anteriores dos roedores arborícolas (TCA = 0,08 ± 0,05), em relação ao dos cursoriais (TCC = 0,02 ± 0,04), foi significativamente maior (t = -8,55; p < 0,01). Entretanto, o TC das pegadas posteriores dos roedores cursoriais (TCC = 0,25 ± 0,05) foi maior que o dos arborícolas (TCA = 0,22 ± 0,04), onde (t = 4,3; p < 0,01).
A partir das análises do tamanho do centróide das pegadas anteriores (Fig. 10), N. lasiurus foi a menor espécie, seguida de Ol. nigripes. De acordo com o teste de Tukey, A. cursor e H. megacephalus apresentaram tamanhos semelhantes em relação a Oe. bicolor. As maiores pegadas pertenceram a R. macrurus e Oe. concolor. Com relação às pegadas posteriores, Oe. bicolor e N. lasiurus apresentaram as menores pegadas, seguidas de R. macrurus e Ol. nigripes, A. cursor e Oe. concolor. A maior pegada foi atribuída à H. megacephalus. A regressão entre o TC e as variáveis da forma mostraram que os efeitos de alometria interferiram 13% nas pegadas anteriores e 3% nas posteriores dos roedores sendo significativa em ambos os casos (p < 0,01).
DISCUSSÃO
Forma das pegadas
As diferenças na forma das pegadas dos roedores arborícolas e cursoriais do Cerrado foram similares às observadas por RIVAS & LINARES (2006) estudando a morfologia das patas de roedores da savana venezuelana. Animais cursoriais tendem a apresentar membros delgados, patas compridas e estreitas, o que lhes permite maior sustentação, firmeza e manobrabilidade no chão por meio do impulso (LULL 1904, SCHUTZ & GURALNICK 2007, FOSTOWICZ-FRELIK 2007, HILDEBRAND 1995). Esta adaptação permitiria ainda corridas mais eficientes e descolamento por grandes distâncias (LULL 1904, ELISSAMBURU & VIZCAÍNO 2004). Metatarsos muito alongados são observados em roedores cursoriais 'sensu strictu' (e.g. ratos-cangurus e ratos do deserto), nos coelhos (Lagomorpha) e cangurus (Diprodontia) com modo de locomoção saltatorial (FOSTOWICZ-FRELIK 2007). Esta morfologia permite um 'efeito alavanca' para grandes impulsos durante o deslocamento cursorial. A forma das pegadas dos roedores arborícolas reflete patas mais largas e curtas, ou mais compactas. Segundo HAMRICK (1998), esta forma apresenta uma base larga, conferindo maior equilíbrio sobre suportes estreitos como os galhos de árvores e ramos de lianas.
A pegada posterior foi a que melhor ilustrou a forma de locomoção. Isso sugere algum nível de compromisso ('trade off') (FREEMAN & LEMEN 2007) entre locomoção e outras funções de manipulação e/ou biomecânica como amortecimento de impactos utilizando as patas anteriores. A morfologia da pata anterior poderia atender ambas as funções, e, portanto não apresenta o formato ideal para nenhuma delas. Isto explicaria o fato das patas posteriores terem uma relação mais forte com modo de locomoção, exibindo então convergências adaptativas. Além disso, as patas traseiras estão relacionadas com funções importantes como sustentação e arranque, sendo geralmente mais robustas (VIEIRA & MONTEIRO FILHO 2003, SCHUTZ & GURALNICK 2006, FOSTOWICZ-FRELIK 2007).
De acordo com o agrupamento dos taxa incluídos dentro dos sigmodontíneos (SMITH & PATTON 1999), existem diferentes categorias supragenéricas. Os roedores apresentados neste estudo pertencem a três diferentes tribos: Akodontini, representada por A. cursor e N. lasiurus; Oryzomyini represendada por H. megacephalus, Oe. bicolor, Oe. concolor e Ol. nigripes; e Thomasomyini representada por R. macrurus. A análise morfométrica das pegadas mostrou formas semelhantes em espécies pertencentes a tribos distintas: Oe. bicolor (Oryzomyini) apresentou pegadas semelhantes a R. macrurus (Thomasomyini) e não a roedores da mesma tribo como H. megacephalus e Ol. nigripes. Essa observação foi corroborada por meio da OFC, evidenciando que a forma das pegadas é uma característica predominantemente adaptativa devido à forte pressão de uma seleção direcional sobre a locomoção.
A análise morfométrica das pegadas posteriores refletiu precisamente os níveis de arborealidade e cursorialidade dos roedores descritos na literatura. De acordo com NITIKMAN & MARES (1987), estudos mostram atividades 100% cursoriais para A. cursor, 98% para N. lasiurus e 87% para H. megacephalus, o que está de acordo com a disposição destas espécies na VC1 do mapa fatorial. A comparação entre as pegadas de A. cursor e H. megacephalus por meio das configurações de consenso, mostra que na medida em que o aumento das eventuais atividades arborícolas façam parte do hábito de um animal primariamente cursorial, adaptações para essa variação na locomoção ficam mais evidentes na morfologia da pegada: H. megacephalus apresenta a pata mais larga proporcionalmente em relação a A. cursor (Fig. 5). O mesmo padrão é mantido para os outros roedores utilizados neste estudo, coincidindo sobre os modos de locomoção já conhecidos. Oligoryzomys nigripes ficou posicionado ao longo da VC1 entre os arborícolas e os cursoriais, apresentando formas para as patas adaptadas tanto para o hábito cursorial como arborícola. ALHO & VILLELA (1984), por meio de experimentos em laboratório, testaram o hábito semi-arborícola e a habilidade deste roedor de subir em árvores utilizando a cauda. Adicionalmente, as espécies reconhecidamente arborícolas R. macrurus, Oe. concolor e Oe. bicolor (VIEIRA & MONTEIRO-FILHO 2003, ALHO 2005) apresentaram convergência na forma das pegadas.
As pegadas posteriores, além de refletir as atividades arborícolas e cursoriais dos roedores, permitiram a identificação das espécies a partir da forma. As especificidades de cada pegada podem ser observadas a partir das configurações de consenso tanto da pegada anterior como da posterior (Fig. 5). As únicas espécies que apresentaram sobreposição dos polígonos que as representam, foram R. macrurus e Oe. bicolor tanto na pegada posterior como na anterior, porém, pode-se discriminar estas espécies pelo tamanho do centróide (Fig. 10): R. macrurus apresentou pegadas maiores em relação a Oe. bicolor.
Foram observadas diferenças na forma de pegadas entre espécies de roedores cogenéricas. Oecomys concolor apresentou formas distintas para as pegadas anteriores e posteriores em relação à Oe. bicolor. Esta diferença parece estar concentrada na região anterior das pegadas posteriores, apresentando-se mais alongada (Figs 6-9). ALHO (2005) menciona diferentes utilizações dos estratos de vegetação desses roedores. De acordo com o estudo, Oe. bicolor ocupa estratos mais altos próximos às copas das árvores, e Oe. concolor estratos mais baixos (sub-bosque). A utilização de diferentes microhabitats pode explicar as distinções morfológicas associadas à porção anterior da pata destes dois roedores, que estão representadas pela variável canônica 2. A adição de outros marcos anatômicos nas pegadas ou um estudo feito diretamente com as patas dos roedores estudados poderia exibir melhor estas diferenças morfológicas relacionadas a porção anterior mais alongada ou menos alongada, explicando a relação entre habitats e microhabitats. Os rastros de pegadas também apresentam marcas de dedos e, eventualmente, garras bem evidentes. Entretanto, esses marcos anatômicos seriam pouco confiáveis, pois a posição dos dedos pode apresentar grande variação, dependendo do modo que o animal pisa no substrato.
Tamanho das pegadas
Foi verificado que as pegadas anteriores dos roedores arborícolas são significativamente maiores em relação aos cursoriais. Entretanto, as pegadas posteriores dos roedores cursoriais apresentaram-se maiores em relação aos arborícolas. Tais diferenças entre as pegadas anteriores podem ser explicadas pelo fato de que os roedores arborícolas utilizados no estudo são os que possuem maior tamanho corporal. Utilizando medidas de cabeça-corpo e tamanho do centróide, foi constatada uma forte correlação entre essas duas variáveis (R2 = 0,83; p = 0,003) ou seja, o tamanho da pegada anterior é reflexo pelas medidas corporais do animal. As patas posteriores apresentaram fraca correlação entre as medidas corporais e os tamanhos das pegadas. Esse resultado sugere novamente uma maior especificidade da pata posterior em relação hábito dos roedores: as pegadas dos roedores cursoriais são mais alongadas em relação às pegadas dos roedores arborícolas, que são mais curtas e compactas.
AGRADECIMENTOS
A Daniel O. Mesquita pelo auxílio nas análises estatísticas e sugestões. A Amabílio Camargo, Diego A. de Moraes, Willian Camargo, Camila Martins e Ludmilla Aguiar pela revisão do manuscrito e sugestões.
LITERATURA CITADA
Submitted: 13.VI.2008; Accepted: 06.XII.2008.
Editorial responsibility: Marcio R. Pie
- ALHO, C.J.R. 1981. Small mammal populations of brazilian cerrado: the dependence of abundance and diversity on habitat complexity. Revista Brasileira de Biologia 41 (1): 223-230.
- ALHO, C.J.R. 2005. Intergradation of habitats of non-volant small mammals in patchy cerrado landscape. Arquivos do Museu Nacional 63 (1): 41-48.
- ALHO, C.J.R. & O.M.M. VILLELA. 1984. Scansorial ability in Oryzomys eliurus and O.subflavus (Rodentia: Cricetidae) from the Cerrado. Revista Brasileira de Biologia 44 (4): 403-408.
- ALHO, C.J.R. & L.A. PEREIRA. 1985. Population ecology of a cerrado rodent community in central Brazil. Revista Brasileira de Biologia 45 (4): 597-607.
- ANDERSSON, K.I. 2004. Elbow-joint morphology as a guide to forearm function and foraging behaviour in mammalian carnivores. Zoological Journal of the Linnean Society 142 (1): 91-104.
- APELDOORN, R.; M. EL DAEM; K. HAWLEY; M. KOZAKIEWCIZ; G. MERRIAM; W. NIEUWENHUIZEN & J. WEGNER. 1993. Footprints of small mammals: a field method of sampling data for different species. Mammalia 57 (3): 407-422.
- BECKER, M. & J.C. DALPONTE. 1999. Rastros de mamíferos silvestres brasileiros. Brasília, Editora Universidade de Brasília, 180p.
- BONVICINO, C.R.; B. LEMOS & M. WEKSLER. 2005. Small mammals of Chapada dos Veadeiros National Park (Cerrado of Central Brazil): ecologic, Karyologic and Taxonomic considerations. Brazilian Journal of Biology 65 (3): 395-406.
- BOOKSTEIN, F.L. 1991. Morphometric tools for landmark data: geometry and biology. Cambridge University Press, 435p.
- BOONSTRA, R.; M. KANTER & C.J. KREBS. 1992 A tracking technique to locate small mammals at low densities. Journal of mammalogy 73 (3): 683-685.
- BRIANI, D.C.; A.R.T. PALMA; E.M. VIEIRA & R.P.B. HENRIQUES. 2004. Post-fire succession of small mammals in the Cerrado of central Brazil. Biodiversity and Conservation 13 (5): 1023-1037.
- CAREY, A.B. & J.W.T. WITT. 1991. Track counts as indices to abundances of arboreal rodents. Journal of Mammalogy 72 (1): 192-194.
- CORDEIRO-ESTRELA, P.; M. BAYLAC; C. DENYS & J. MARINHO-FILHO. 2006. Interspecific patterns of skull variation between sympatric brazilian vesper mice: geometric morphometrics assessment. Journal of Mammalogy 87 (6): 1270-1279.
- EITEN, G. 1990. Vegetação do Cerrado, p. 9-65. In: M.N. PINTO (Ed.) Cerrado: caracterização, ocupação e perspectivas. Brasília, Editora Universidade de Brasília, 657p.
- ELISSAMBURU, A. & S.F. VIZCAÍNO. 2004. Limb proportions and adaptations in caviomorph rodents (Rodentia: Caviomorpha). Journal of Zoology 262 (2): 145-159.
- EMMONS, L.H. & F. FEER. 1997. Neotropical rainforest mammals: a field guide. Chicago, The University of Chicago Press, 2nd ed., 307p.
- ERNEST, K.A & M.A. MARES. 1986. Ecology of Nectomys squamipes, the neotropical water rat, in central Brazil: Home range, habitat selection, reproduction and behaviour. Journal of Zoology 210 (4): 599-612.
- FEDUCCIA, A. 1993. Evidence from claw geometry indicating arboreal habits of Archaeopteryx Science 259 (5096): 790-793.
- FONSECA, G.A.B.; G. HERRMANN; Y.L.R. LEITE; R.A. MITTERMEIER; A.B. RYLANDS & J.L. PATTON. 1996. Lista anotada dos mamíferos do Brasil. Occasional Papers in Conservation Biology 4: 1-38.
- FOSTOWICZ-FRELIK, L. 2007. The hind limb skeleton and cursorial adaptations of the Plio-Pleistocene rabbit Hypolagus beremendensis. Acta Palaeontologica Polonica 52 (3): 447-476.
- FREEMAN, P.W. & C.A. LEMEN. 2007. The trade-off between tooth strength and tooth penetration: predicting optimal shape of canine teeth. Journal of Zoology 273 (3): 273-280.
- GIANNINI, N.P. 2003. Canonical Phylogenetic Ordination. Systematic Biology 52 (5): 684-695.
- HAMRICK, M.W. 1998. Functional and adaptive significance of primate pads and claws: Evidence from New World anthropoids. American Journal of Physical Anthropology 106 (2):113-127.
- HENRIQUES, R.P.B. & C.J.R. ALHO. 1991.Microhabitat selection by two rodent species in the Cerrado of Central Brazil. Mammalia 55 (1): 49-56.
- HILDEBRAND, M. 1995. Análise da estrutura dos vertebrados. São Paulo, Atheneu, 700p.
- HINGST-ZAHER, E.; L. MARCUS & R. CERQUEIRA. 2000. Application of geometric morphometrics to the study of postnatal size and shape changes in the skull of Calomys expulsus Hystrix 11 (1): 99-113.
- JI, Q.; Z. LUO; C.-X. YUAN; J.R. WIBLE; J.-P. ZHANG & J.A. GEORGI. 2002. The earliest known eutherian mammal. Nature 416 (6883): 816-822.
- LANDIS, R.J. & G.G. KOCH. 1977. An Application of Hierarchical Kappa-type Statistics in the Assessment of Majority Agreement among Multiple Observers. Biometrics 33 (2): 363-374.
- LULL, R.S. 1904. Adaptations to Aquatic, Arboreal, Fossorial and Cursorial Habits in Mammals. IV. Cursorial Adaptations. The American Naturalist 38 (445): 1-11.
- MARTEN, G.G. 1972. Censusing mouse populations by means of tracking. Ecology 52 (5): 859-867.
- MESQUITA D.O.; G.R. COLLI; F.G.R. FRANÇA & L.J. VITT. 2006. Ecology of a Cerrado Lizard Assemblage in the Jalapão Region of Brazil. Copeia 2006 (3): 460-471.
- MONTEIRO, L.R. & S.F. REIS. 1999. Princípios de morfometria geométrica. São Paulo, Holos, IX+188p.
- MONTEIRO, L.R.; L.G. LESSA & A. S. ABE. 1999. Ontogenetic variation in skull shape of Thrichomys apereoides (Echimyidae: Rodentia). Journal of Mammalogy 80 (1): 102-111.
- NITIKMAN, L.Z. & M.A. MARES. 1987. Ecology of small mammals in a gallery forest of central Brazil. Annals of Carnegie Museum 56 (1-2): 75-95.
- PALMA, A.R.T. & R. GURGEL-GONÇALVES. 2007. Morphometric identification of small mammal footprints from ink tracking tunnels in the Brazilian Cerrado. Revista Brasileira de Zoologia 24 (2): 333-343.
- RATZ, H. 1997. Identification of footprints of some small mammals. Mammalia 61 (3): 431-441.
- RIBEIRO, R & J. MARINHO-FILHO. 2005. Community structure of small mammals (Mammalia, Rodentia) from Estação Ecológica de Águas Emendadas, Planaltina, Distrito Federal, Brazil. Revista Brasileira de Zoologia 22 (4): 898-907.
- RIVAS, B.A. & O.J. LINARES. 2006. Cambios en la forma de la pata posterior entre roedores Sigmodontinos según su locomoción y hábitat. Mastozoologia Neotropical 13 (2): 205-215.
- RODRIGUES, L.A. & V.F. SANTOS. 2003. Morfometria geométrica - aplicações em paleobiologia de Dinossáurios. Ciências da Terra (UNL) 5 (Especial): 141-145.
- ROHLF, F.J. & L.F. MARCUS. 1993. A revolution in morphometrics. Trends in Ecology and Evolution 8 (4): 129-132.
- ROHLF, F.J. 1999a. TPSDIG, version 1.18. Stony Brook, Department of Ecology and Evolution, State University of New York. Available online at: http://life.bio.sunysb.edu/morph [Accesed: 03.XI.2007]
- ROHLF, F.J. 1999b.TPSRELW, version 1.18. Stony Brook, Department of Ecology and Evolution, State University of New York. Available online at: http://life.bio.sunysb.edu/morph [Accesed: 03.XI.2007]
- SCHUTZ, H. & R. P. GURALNICK. 2007. Postcranial element shape and function: assessing locomotor mode in extant and extinct mustelid carnivorans. Zoological Journal of the Linnean Society 150 (4): 895-914.
- SMITH, F.M. & J.L. PATTON. 1999. Phylogenetic relationships and the radiation of Sigmodontine rodents in South America: evidence from cytochrome b Journal of mammalian evolution 6 (2): 89-128.
- TAYLOR, C.A. & M.G. RAPHAEL. 1988. Indentification of mammal tracks from sooted track stations in the pacific northwest. California Fish and Game 74 (1): 4-15.
- TER BRAAK, J.F. 1986. Canonical correspondence analysis: a new eigenvector technique for multivariate direct gradient analysis. Ecology 67 (5): 1167-1179.
- VIEIRA, E.M.; L.C. BAUMGARTEN. 1995. Daily Activity Patterns of Small Mammals in a Cerrado Area from Central Brazil. Journal of Tropical Ecology 11 (2): 255-262.
- VIEIRA E.M. & E.L.A. MONTEIRO-FILHO. 2003. Vertical stratification of small mammals in the atlantic rain forest of south-eastern Brazil. Journal of Tropical Ecology 19 (5): 501-507.
- WEKSLER, M.; A.R. PERCEQUILLO & R.S. VOSS. 2006. Ten new genera of Oryzomine rodents (Cricetidae: Zigmodontine). American Museum Novitates 3537: 1-29.
Variação morfológica de pegadas de roedores arborícolas e cursoriais do Cerrado
Datas de Publicação
-
Publicação nesta coleção
15 Jan 2009 -
Data do Fascículo
Dez 2008
Histórico
-
Aceito
06 Dez 2008 -
Recebido
13 Jun 2008