Resumos
Os ácidos graxos de cadeia curta (AGCC) representam o principal substrato energético para células da mucosa cólica. A derivação intestinal, reduzindo suprimento de AGCC, responsabiliza-se pela colite de exclusão (CE). Aplicação retal de butirato tem sido eficaz no tratamento da doença. Então, o objetivo deste estudo foi avaliar os níveis de lipoperoxidação na mucosa cólica, após aplicação de butirato, em modelo de CE. Vinte seis ratos Wistar foram submetidos à colostomia proximal e fístula mucosa distal. Os animais foram divididos em dois grupos segundo sacrifício ser realizado em duas ou quatro semanas. Cada grupo foi subdividido em dois subgrups segundo intervenção com soro fisiológico ou butirato. O diagnóstico de CE foi estabelecido por estudo histopatológico e os níveis de lipoperoxidação pelos níveis de malondialdeído (MDA). Utilizaram-se os testes de Mann-Whitney e Kruskal-Wallis (significantes quando p<0,05). Após duas semanas, os níveis de MDA foram menores nos segmentos sem trânsito nos animais irrigados com butirato (p=0,006); porém, após quatro semanas foram semelhantes (p=0,08). No cólon sem trânsito irrigado com butirato, os níveis de MDA aumentaram com o tempo de exclusão (p=0,02); enquanto no cólon com trânsito não se modificaram (p=0,86). O butirato reduz os níveis de MDA na mucosa cólica sem trânsito fecal, após duas semanas de derivação; entretanto, a irrigação isolada não é capaz de reduzir os níveis de lipoperoxidação das células mucosas com o progredir do tempo de exclusão intestinal.
colite; ácidos graxos de cadeia curta; peroxidação de lipídeos; malondialdeído; estresse oxidativo
The short-chain fatty acids (SCFA) are the main energy substrate for the cells of the colonic mucosa. Diversion of the fecal stream reducing the supply of SCFA is responsible for diversion colitis (DC). Rectal application of butyrate has been demonstrated effective in the treatment of the disease. So the aim of this study was to evaluate the levels of lipid peroxidation in the colon mucosa after application of butyrate in model of DC. Twenty-six rats were submitted to proximal colostomy and distal mucous fistula. The animals were divided into two groups according sacrifice carried out in two or four weeks. Each group was divided into two subgroups according to intervention with saline solution or butyrate. The diagnosis of colitis was established by histopathology and the levels of lipid peroxidation by tissue levels of malondialdehyde (MDA). We used the Mann-Whitney and Kruskal-Wallis, establishing a significance level of 5% (significant with p<0.05). After two weeks, the levels of MDA were lower in the segments without fecal stream of animals irrigated with butyrate (p=0.006), but after four weeks were similar (p=0.08). In the colon without fecal stream irrigated with butyrate, MDA levels increased with the time (p=0.02), while in segments with fecal stream MDA not changed. (p=0.86). Butyrate reduces the levels of MDA in the colonic mucosa without fecal stream, after two weeks of derivation. However, the irrigation with the substance is not able to reduce the lipid peroxidation of mucosal cells with increasing time of intestinal exclusion.
colitis; fatty acids, volatile; lipid peroxidation; malondialdehyde; oxidative stress
ARTIGO ORIGINAL
Efeitos do butirato nos níveis de peroxidação lipídica em células da mucosa cólica sem trânsito fecal: estudo experimental em ratos
Effects of butyrate on levels of lipid peroxidation in cells of the colonic mucosa without fecal stream: experimental study in rats
Thais Miguel do Monte LameiroI; Camila Morais Gonçalves da SilvaII; Letícia Helena Sousa MarquesI; Fernando Lorenzetti da CunhaIII; Marcos Gonçalves de AlmeidaIV; José Aires PereiraV; Carlos Augusto Real MartinezVI
IAcadêmica do Curso de Medicina da Universidade São Francisco (USF) - Bragança Paulista (SP),Brasil; Bolsista do Programa Institucional de Bolsas de Iniciação Científica (PIBIC/CNPq)
IIMestranda do Programa de Pós-Graduação em Ciências da Saúde da USF - Bragança Paulista (SP), Brasil
IIIAcadêmico do Curso de Medicina da USF - Bragança Paulista (SP),Brasil; Bolsista do Programa de Bolsa Auxílio à Iniciação Científica (PROBAIC/USF)
IVAcadêmico do Curso de Medicina da Universidade São Francisco - Bragança Paulista (SP), Brasil
VProfessor Assistente Mestre da Disciplina de Patologia do curso de Medicina da USF - Bragança Paulista (SP), Brasil
VIProfessor Livre-Docente do Departamento de Cirurgia da Faculdade de Medicina da Universidade de São Paulo (USP) - São Paulo (SP); Professor Adjunto Doutor do Programa de Pós-Graduação em Ciências da Saúde da USF - Bragança Paulista (SP), Brasil
Endereço para correspondência Endereço para correspondência: Carlos Augusto Real Martinez Rua Rui Barbosa, 255, apto. 32 CEP: 09190-370 - Santo André (SP), Brasil E-mail: caomartinez@uol.com.br
RESUMO
Os ácidos graxos de cadeia curta (AGCC) representam o principal substrato energético para células da mucosa cólica. A derivação intestinal, reduzindo suprimento de AGCC, responsabiliza-se pela colite de exclusão (CE). Aplicação retal de butirato tem sido eficaz no tratamento da doença. Então, o objetivo deste estudo foi avaliar os níveis de lipoperoxidação na mucosa cólica, após aplicação de butirato, em modelo de CE. Vinte seis ratos Wistar foram submetidos à colostomia proximal e fístula mucosa distal. Os animais foram divididos em dois grupos segundo sacrifício ser realizado em duas ou quatro semanas. Cada grupo foi subdividido em dois subgrups segundo intervenção com soro fisiológico ou butirato. O diagnóstico de CE foi estabelecido por estudo histopatológico e os níveis de lipoperoxidação pelos níveis de malondialdeído (MDA). Utilizaram-se os testes de Mann-Whitney e Kruskal-Wallis (significantes quando p<0,05). Após duas semanas, os níveis de MDA foram menores nos segmentos sem trânsito nos animais irrigados com butirato (p=0,006); porém, após quatro semanas foram semelhantes (p=0,08). No cólon sem trânsito irrigado com butirato, os níveis de MDA aumentaram com o tempo de exclusão (p=0,02); enquanto no cólon com trânsito não se modificaram (p=0,86). O butirato reduz os níveis de MDA na mucosa cólica sem trânsito fecal, após duas semanas de derivação; entretanto, a irrigação isolada não é capaz de reduzir os níveis de lipoperoxidação das células mucosas com o progredir do tempo de exclusão intestinal.
Palavras-chave: colite; ácidos graxos de cadeia curta; peroxidação de lipídeos; malondialdeído; estresse oxidativo.
ABSTRACT
The short-chain fatty acids (SCFA) are the main energy substrate for the cells of the colonic mucosa. Diversion of the fecal stream reducing the supply of SCFA is responsible for diversion colitis (DC). Rectal application of butyrate has been demonstrated effective in the treatment of the disease. So the aim of this study was to evaluate the levels of lipid peroxidation in the colon mucosa after application of butyrate in model of DC. Twenty-six rats were submitted to proximal colostomy and distal mucous fistula. The animals were divided into two groups according sacrifice carried out in two or four weeks. Each group was divided into two subgroups according to intervention with saline solution or butyrate. The diagnosis of colitis was established by histopathology and the levels of lipid peroxidation by tissue levels of malondialdehyde (MDA). We used the Mann-Whitney and Kruskal-Wallis, establishing a significance level of 5% (significant with p<0.05). After two weeks, the levels of MDA were lower in the segments without fecal stream of animals irrigated with butyrate (p=0.006), but after four weeks were similar (p=0.08). In the colon without fecal stream irrigated with butyrate, MDA levels increased with the time (p=0.02), while in segments with fecal stream MDA not changed. (p=0.86). Butyrate reduces the levels of MDA in the colonic mucosa without fecal stream, after two weeks of derivation. However, the irrigation with the substance is not able to reduce the lipid peroxidation of mucosal cells with increasing time of intestinal exclusion.
Keywords: colitis; fatty acids, volatile; lipid peroxidation; malondialdehyde; oxidative stress.
INTRODUÇÃO
A colite de exclusão (CE) caracteriza-se pela presença de processo inflamatório na mucosa de segmentos do intestino grosso exclusos de trânsito fecal1. Com o aumento da incidência do câncer colorretal, doenças inflamatórias intestinais, diverticulite do cólon sigmóide e dos traumatismos colorretais pela crescente violência urbana, a frequência da CE parece estar aumentando proporcionalmente à necessidade de operações de derivação do trânsito intestinal2.
A maioria dos autores atribui a CE à deficiência de ácidos graxos de cadeia curta (AGCC) na luz intestinal, ocasionada pela derivação do trânsito fecal3-9. Essa possibilidade é reforçada ao se constatar que a reconstituição do trânsito, ou a irrigação dos segmentos exclusos com soluções nutricionais ricas em AGCC, restabelecendo o substrato energético à mucosa cólica, são capazes de reverter as alterações clínicas e histopatológicas encontradas nos portadores de CE9-11. Os AGCC são formados a partir da fermentação de carboidratos não absorvidos pelo intestino delgado pela flora bacteriana do interior do cólon. A principal fonte de carboidratos para a formação dos AGCC são as fibras dietéticas, especialmente a parede celular polissacarídica dos vegetais não derivados do amido12. Os três principais AGCC formados no interior do cólon são o acetato (50-60%), o propionato (20-25%) e o butirato (15-20%). Não obstante todos os AGCC terem importância para o trofismo das células da mucosa cólica, o butirato é o principal, respondendo por cerca de 90% de todo o substrato metabolizável para a obtenção de energia6,13,14. Depois de formado, é rapidamente absorvido para que as células epiteliais da mucosa cólica, através de reações oxidativas, produzam a energia necessária para seu funcionamento normal6,15.
Estudos mostraram que a deficiência de AGCC na luz intestinal ocasiona maior produção de radicais livres de oxigênio (RLO), pelas próprias células epiteliais desprovidas de sua principal fonte de energia16-19. Há três décadas, demonstrou-se que células isoladas da mucosa cólica aumentam intensamente seu metabolismo oxidativo quando o butirato é acrescido ao meio, confirmando sua importância como combustível energético3,6. A deficiência no suprimento de butirato, aumentando a produção de RLO, ocasiona quebra dos mecanismos de defesa que formam a mucosa cólica, permitindo a infiltração de bactérias e antígenos nas camadas estéreis da parede intestinal, levando ao desenvolvimento da colite18. Estudos sugerem que os efeitos protetores dos AGCC, provavelmente, ocorrem pela capacidade de aumentarem o consumo tecidual de oxigênio, evitando o acúmulo de RLO16,20. Substâncias como o 2-bromo-octanoato sódico que inibem a oxidação dos AGCC provocam alterações histológicas características da colite, sugerindo que a oxidação de constituintes das células possa ser considerada etapa inicial da etiopatogenia da doença21.
A mucosa cólica sem trânsito fecal encontra-se submetida a maiores níveis de estresse oxidativo, levantando a possibilidade que esse mecanismo possa ser responsável pela lesão dos diferentes sistemas de defesa do epitélio, encontrada nos doentes com CE16,19,22. É possível que, a lesão epitelial da mucosa cólica na CE, possa estar relacionada à oxidação de fosfolipídeos presentes nas membranas citoplasmáticas das células da mucosa cólica, que representa um dos principais mecanismos de defesa. Talvez, a aplicação de clisteres com butirato no colón desprovido de trânsito fecal, restabelecendo o metabolismo celular normal, possa minimizar os efeitos da lipoperoxidação, melhorando a lesão epitelial. Entretanto, do melhor do nosso conhecimento, essa possibilidade ainda não foi avaliada experimentalmente em modelos de CE.
O objetivo do presente estudo foi verificar se a aplicação de clisteres contendo solução isotônica de butirato reduz os níveis de peroxidação lipídica na mucosa cólica desprovida de trânsito fecal.
MÉTODO
O estudo foi aprovado pelo Comitê de Ética no Uso de Animais em Pesquisa (CEUAP) da Universidade São Francisco e, todas as etapas experimentais, foram realizadas em conformidade com os princípios definidos pelo Colégio Brasileiro de Experimentação Animal (COBEA) e a lei 11.794 de outubro de 2008, que regulamenta o uso de animais em pesquisa.
Animais
Foram utilizados 26 ratos Wistar machos, pesando entre 300 e 350 g provenientes do Biotério Central da Universidade São Francisco. Os animais foram mantidos em gaiolas individuais, em ambiente climatizado, com controle de temperatura, luminosidade, umidade e ruídos. Na véspera da intervenção cirúrgica permaneceram em jejum durante 12 h, exceto para água. As gaiolas foram identificadas com o número, grupo e subgrupo experimental a que pertenciam e esses mesmos dados foram tatuados, com tinta da China, na cauda de cada animal. Os ratos foram alimentados sempre com a mesma ração, própria para roedores, (Nuvilab CR1®, Nuvital Nutrientes SA, São Paulo, Brasil) e pesados semanalmente.
Técnica cirúrgica
A derivação do trânsito intestinal em todos os animais, foi realizada sob anestesia geral pela administração intramuscular de 0,1 mL/100 g de solução de quetamina (50 mg/mL) e xilazina (20 mg/mL) 1:1 (v/v) na pata traseira esquerda. Depois de anestesiados e fixos à mesa cirúrgica, a cavidade abdominal foi aberta por incisão longitudinal mediana com três centímetros de extensão. Após identificar-se a placa de Peyer, com um paquímetro aferiu-se a distância entre a placa e o local escolhido para a secção do cólon esquerdo, quatro centímetros acima da extremidade superior da placa de Peyer. Após ligadura dos vasos da arcada marginal, seccionou-se o cólon no ponto escolhido exteriorizando-se o segmento proximal, como colostomia terminal no hipocôndrio esquerdo, fixando-se a colostomia à pele com pontos separados de fio absorvível monofilamentar 4-0 nos quatro pontos cardinais, e entre eles. Concluída a fixação da colostomia proximal, o segmento caudal do cólon esquerdo foi cateterizado e irrigado com 40 mL de solução fisiológica 0,9% (SF) a 37ºC, até que o efluente drenado pelo ânus não mais apresentasse resíduos fecais. Terminada a irrigação, o cateter foi removido e o cólon distal exteriorizado como colostomia (fístula mucosa distal) na face lateral inferior esquerda da parede abdominal. O estoma distal foi fixado com a mesma técnica utilizada no proximal. A síntese da parede abdominal foi realizada em dois planos de sutura: peritônio e aponeurose com pontos contínuos de fio de ácido poliglicólico 4-0, e a pele com pontos separados de nylon 4-0.
Grupos experimentais
Os 26 animais colostomizados foram randomizados em dois grupos experimentais composto de 13 animais, segundo o sacrifício ter sido realizado duas ou quatro semanas após a derivação do trânsito fecal. Cada grupo foi dividido por sua vez em dois subgrupos de acordo com a solução de intervenção aplicada no reto. No primeiro subgrupo, aplicaram-se clisteres retais, em dias alternados, contendo 20 mL de SF à 37ºC (grupo controle; n=4). No segundo subgrupo, os clisteres continham butirato de sódio (B5887- Sigma-Aldrich Corporation, St Louis, MO, USA) na dose de 100 mL/Kg na concentração de 80 mmol/L (grupo experimental; n=9).
Coleta das amostras
Duas ou quatro semanas após a intervenção com as substâncias propostas os animais foram anestesiados com a mesma técnica descrita anteriormente, a cavidade abdominal foi reaberta, removendo-se dois fragmentos com quatro centímetros cada, obtidos do cólon submetido ou não a irrigação com as soluções de intervenção propostas. Os espécimes retirados foram abertos longitudinalmente pela borda antimesentérica, lavados com SF e divididos em dois fragmentos, com dois centímetros de comprimento, destinados aos estudos histológicos e avaliação dos níveis de peroxidação lipídica pela quantificação tecidual do malondialdeído (MDA).
Análise histológica
Os fragmentos destinados a análise histológica foram imediatamente imersos em paraformaldeído a 4% em PBS, por 24 h e, logo após, desidratados em concentrações crescentes de etanol. Terminada esta fase, foram inclusos em blocos de parafina e, a partir destes, realizou-se cortes histológicos com 5 μm de espessura, que posteriormente foram montados sobre uma lâmina. Depois de montados, os cortes foram corados com hematoxilina-eosina (HE) para o diagnóstico de colite. As lâminas foram analisadas por patologista experiente no diagnóstico de doenças inflamatórias colorretais, que desconhecia a origem do material e os objetivos do estudo. Para o diagnóstico da colite considerou-se dois parâmetros principais: a infiltração de polimorfonucleares na mucosa cólica e a presença de erosões ou úlceras epiteliais.
Determinação dos níveis de MDA
A medida dos níveis de peroxidação lipídica foi avaliada pela dosagem das substâncias reativas ao ácido tiobarbitúrico (TBARS), tais como o MDA, segundo metodologia proposta anteriormente23. O MDA é um dos produtos secundários da lipoperoxidação, sendo considerado candidato potencial como um biomarcador geral de estresse oxidativo tecidual. Para a quantificação dos níveis tissulares de MDA, resumidamente, 1 g de cada fragmento cólico foi colocada em 5 mL de tampão fosfato e homogeneizada em vórtex e ultrassonicador por 30 s, repetindo-se o processo três vezes, alternadamente. A seguir, 250 µL do sobrenadante, obtido no processo de homogeneização, foram transferidos para tubo plástico contendo 25 µL de hidroxi-tolueno butilado (BHT) a 4% metanólico e, novamente, homogeneizados no vórtex. A seguir adicionou-se 1 mL de ácido tricloroacético a 12%, 1 mL de ácido tiobarbitúrico a 0,73% e 750 µL de tampão tris/HCl incubando-se em banho-maria, a 100ºC, por 60 min. Concluída essa etapa, os tubos foram imediatamente acondicionados em recipiente contendo gelo para bloquear a reação. A seguir acrescentou-se 1,5 mL de n-butanol homogeneizando-se, no vórtex, por mais 30 s. Posteriormente, os tubos foram centrifugados por 10 min a 5.000 rpm e, o sobrenadante, removido para a leitura da coloração em espectrofotômetro Lambda 45UV/VIS (Perkin-Elmer Inc., Massachussetts, USA), sempre em absorbância de 532 nm.
Análise estatística
Os valores teciduais de MDA, nos segmentos irrigados e não irrigados com as soluções de intervenção, foram expressos pelo valor médio com o respectivo desvio-padrão. Os resultados encontrados nos segmentos expostos e não expostos a SF e ao butiratoforam comparados pelo teste de Mann-Whitney. A variação nos níveis teciduais de MDA, nos diferentes tempos de irrigação, foi avaliada pelo teste de Kruskal-Wallis. Na análise estatística dos resultados encontrados, adotou-se nível de significância de 5% (p<0,05), utilizando-se o programa SPSS® (SPSS Inc., Chicago, USA) versão 13.0 para Windows.
RESULTADOS
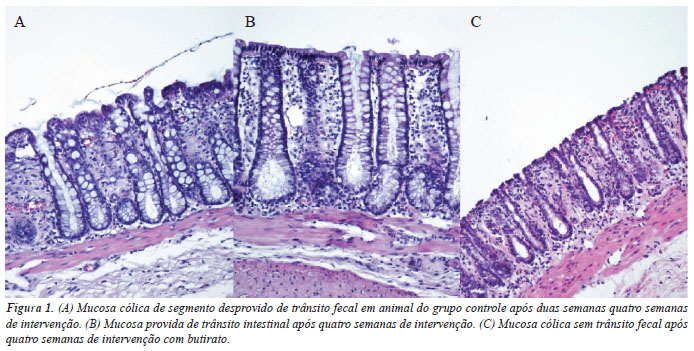
A Figura 1A mostra cortes histológicos da parede intestinal de segmento cólico irrigado com solução fisiológica. As Figuras 1B e 1C mostram segmentos provido e desprovido de trânsito, respectivamente, após quatro semanas de intervenção com butirato. No cólon irrigado com o AGCC, as criptas cólicas encontravam-se preservadas, menor infiltrado neutrofílico e edema, não se detectando ulcerações na mucosa cólica.
A Figura 2 mostra os níveis de MDA, nos segmentos com e sem trânsito intestinal, comparando-se os animais submetidos à intervenção com SF ou butirato, por duas semanas. Verificou-se que o cólon sem trânsito dos animais irrigados com butirato apresentava níveis de MDA menores, quando comparado aos submetidos à intervenção com SF (p=0,006).
A Figura 3 mostra os níveis de MDA, nos segmentos com e sem trânsito fecal, comparando-se os animais submetidos à intervenção com SF ou butirato, por quatro semanas. Constatou-se que no cólon sem trânsito os níveis de MDA, apesar de menores nos animais irrigados com butirato, não apresentaram significância estatística (p=0,08).
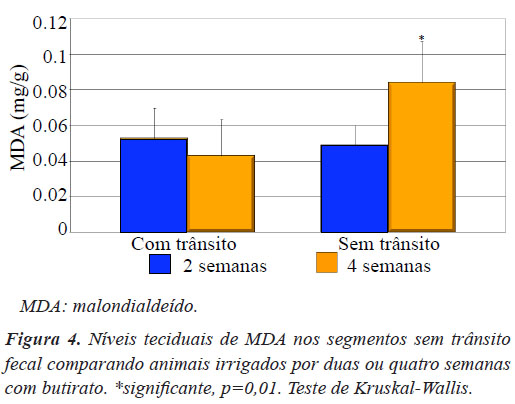
A Figura 4 mostra a variação dos níveis de MDA no cólon sem trânsito intestinal, após duas ou quatro semanas de irrigação com o butirato. Verificou-se que os níveis de MDA aumentaram com o decorrer do tempo (p=0,01).
DISCUSSÃO
O ácido butírico é formado a partir da degradação das fibras alimentares, sendo considerado a principal fonte de energia primária para células da mucosa cólica14. O butirato geralmente é produzido nas porções proximais do intestino grosso, pela maior presença de carboidratos nesse local23. Estima-se que a produção de AGCC no homem seja de aproximadamente 15 a 40 mM por dia, mas esses valores podem variar segundo o tipo de dieta. Os principais substratos para formação de ácido butírico são o amido resistente, oligossacarídeos e os farelos de trigo e aveia, e as principais bactérias responsáveis pela metabolização pertencem aos gêneros Clostridium, Eubacterium e Fusobacterium24,25. Depois de produzido, 95% de todo ácido butírico é rapidamente absorvido pelo epitélio cólico; porém, uma pequena concentração ainda pode ser recuperada no sangue portal, indicando que, depois de absorvido, o maior contingente da substância é utilizada com substrato energético, reforçando sua importância nos mecanismos de oxidação celular24. Na forma protonada (ácido butírico) é lipossolúvel e difunde-se rapidamente pelas membranas celulares. De outro modo, a forma iônica (butirato), como não é lipossolúvel, requer diferentes mecanismos de absorção pelas membranas celulares, sendo a absorção por troca aniônica, associada à de sódio e cloro e secreção de bicarbonato, um dos mais importantes14. Após a entrada na célula, o butirato é convertido no interior da mitocôndria em butiril-CoA, por ação da enzima butiril-CoA sintetase, e desta forma oxidado pelas reações de β-oxidação4,6. Assim sendo, a integridade das membranas das células epiteliais cólicas possui fundamental importância para a correta absorção do butirato. Condições que destruam as membranas celulares, tais como a peroxidação dos seus fosfolipídeos constituintes podem interferir na absorção do AGCC, alterando a integridade e o trofismo do epitélio intestinal.
Já se demonstrou que a deficiência de AGCC, em modelos experimentais de CE, leva a um aumento da produção de RLO e que o estresse oxidativo consequente encontra-se relacionado ao maior grau de lesão epitelial21. A irrigação intestinal com butirato e propionato de sódio diminuiu o processo inflamatório e favoreceu a epitelização da mucosa cólica, em ratos com colite induzida por ácido acético, quando comparado a aplicação de clisteres com soluções ricas em glicose ou solução salina10,26. De modo contrário, a exposição da mucosa cólica a substâncias oxidantes, tais como o H2O2, por aumentar a peroxidação dos fosfolipídeos das membranas celulares, aumenta o processo inflamatório local27.
Apesar da deficiência no suprimento de AGCC ao cólon excluso ser responsabilizada pela inflamação que caracteriza a CE, os mecanismos moleculares pelos quais se determina à agressão a mucosa, ainda não se encontram totalmente esclarecidos8,28,29. A infiltração leucocitária da mucosa intestinal nos doentes com CE é considerada evento secundário e mediado por diferentes células. Existem dúvidas em relação aos mecanismos iniciais pelos quais ocorre quebra da barreira epitelial, que possibilita a migração bacteriana e a consequente resposta inflamatória celular18. Nenhuma teoria explica, satisfatoriamente, o mecanismo inicial de ruptura dos sistemas de defesa do epitélio intestinal, possibilitando a migração das bactérias para o interior da submucosa estéril18. Com objetivo de elucidar esse mecanismo, estudo utilizando modelo experimental de CE sugere que a agressão inicial poderia estar relacionada ao estresse oxidativo decorrente do aumento de RLO, pelas próprias células epiteliais com alterações no seu metabolismo oxidativo21. Como são moléculas tóxicas, a produção exagerada de RLO pelas células da mucosa cólica desprovidas de AGCC, ocasionaria a ruptura das diferentes linhas de defesa que formam a barreira intestinal. A quebra da barreira funcional possibilitaria, então, a translocação de bactérias da luz intestinal para a camada submucosa estéril18,21. Na tentativa de combater a invasão bacteriana, leucócitos ativados migrariam para o estroma da parede intestinal, dando origem ao processo inflamatório que caracteriza a doença21,30,31. Nesse estudo, verificou-se que os maiores níveis de estresse oxidativo relacionavam-se às alterações histológicas e bioquímicas características da CE, e que aumentavam com o decorrer do tempo de exclusão21,32. A importância do estresse oxidativo na indução da CE foi reforçada, recentemente, ao verificar-se que a aplicação de clisteres contendo ácido 5-aminosalicílico (5-ASA), substância com notável ação antioxidante, não só reduz os níveis de estresse oxidativo à mucosa desprovida de trânsito, como melhora as alterações histológicas encontradas no cólon excluso33. A aplicação de substâncias antioxidantes neutralizaria a ação deletéria dos RLO sobre as diferentes linhas de defesa da mucosa cólica, impedindo a sua ruptura.
A barreira funcional da mucosa cólica é composta por diferentes linhas de defesa, que agindo em conjunto impedem a infiltração bacteriana21. Esses sistemas de defesa são formados pela camada de muco que recobre o epitélio, pelas membranas citoplasmáticas apical e basolateral dos colonócitos, pelos intrincados sistemas de junção intercelular compostos pelos desmossomos, hemidesmossomos, junções de oclusão, de comunicação e aderentes e, finalmente, pela lâmina basal18,21,34. A importância de todas essas linhas de defesa fica evidente quando se constata que a maioria dos modelos experimentais, que tentam reproduzir em animais as alterações histológicas encontradas nos doentes com colite ulcerativa, induz a penetração bacteriana da camada submucosa pela ruptura dessas linhas de defesa, pela exposição da mucosa a substâncias químicas tóxicas (ácido acético, ácido trinitrobenzeno sulfônico (TNBS) e sulfato sódico de dextrana (DSS)35. Nos modelos experimentais de CE essas linhas de defesa também se encontram comprometidas, apesar de não se expor a mucosa cólica a substâncias tóxicas, tornando-o o modelo experimental ideal para verificar se o estresse oxidativo encontra-se relacionado as etapas inicias de agressão epitelial21. É possível que a falta de suprimento de AGCC, levando a maior produção de RLO pelas células desprovidas de substrato energético, possa ser responsabilizada pela quebra de cada um desses sistemas.
Estudos demonstraram que a falta no suprimento de AGCC provoca alterações nesses mecanismos de defesa epitelial32,33,36,37. A deficiência de AGCC ocasiona atrofia das glândulas da mucosa cólica, modifica o conteúdo e padrão de expressão de diferentes tipos de mucinas, que recobrem o epitélio e que formam a primeira linha de defesa14,36,37. Pesquisa recente demonstrou que, no epitélio cólico desprovido de trânsito, existe redução no conteúdo e modificações do local de expressão das proteínas e-caderina e β-catenina, principais constituintes das junções aderentes intercelulares38. Todas essas alterações histológicas encontram-se relacionadas à maior produção de RLO15,27,31,32. Assim sendo, o estresse oxidativo na CE, além de atrofiar as criptas cólicas, pode romper duas importantes linhas de defesa epitelial: a barreira de muco e as junções aderentes.
As membranas apical e basolateral das células intestinais formam a terceira linha de defesa da mucosa cólica18,27. As membranas citoplasmáticas são formadas por uma dupla camada de fosfolípedes que, além de proteger as organelas celulares, mantém o meio intercelular separado do extracelular. Os RLO em contato com as membranas celulares são capazes de oxidar fosfolípedes, destruindo as membranas celulares e consequentemente induzindo a apoptose celular25. O MDA é um dos metabólitos resultantes da lipoperoxidação das membranas e a sua dosagem tecidual vem sendo utilizada como potencial marcador de estresse oxidativo, em modelos de colite quimicamente induzida39-41. Do melhor do nosso conhecimento, apenas um único estudo avaliou, em modelos de CE, os níveis de MDA na mucosa exclusa de trânsito exposta à H2O2, substância capaz de formar altos níveis de RLO27. Os resultados mostraram que os níveis de MDA aumentavam após a exposição ao H2O2, principalmente nas primeiras semanas de intervenção e relacionavam-se às alterações histológicas habitualmente encontradas na CE27. Esses mesmos achados já tinham sido descritos em seres humanos submetidos à aplicação retal de H2O2 que desenvolveram quadros graves de colite, até mesmo com evolução fatal42,43.
Quando se constata que a deficiência de AGCC é capaz de deflagrar a CE é lícito supor que a aplicação regular de AGCC no cólon excluso, restabelecendo o fornecimento de butirato, poderia restabelecer o equilíbrio do metabolismo celular, reduzindo a lipoperoxidação e, consequentemente, a lesão tecidual. Todavia, até a presente data essa possibilidade ainda não tinha sido testada. Os resultados do presente estudo mostraram que após duas semanas de aplicação de clisteres contendo butirato, houve redução significativa dos níveis de MDA no cólon sem trânsito. A queda dos níveis de MDA nas duas primeiras semanas ocorreu, justamente, no período onde a lipoperoxidação ocorre com maior intensidade27. Os menores níveis de peroxidação lipídica estavam relacionados à melhora histológica nos animais irrigados com butirato, que apresentavam criptas intestinais mais regulares e ausência de ulcerações epiteliais. Os resultados encontrados sugerem que o restabelecimento do fornecimento de butirato às células exclusas de trânsito normaliza o metabolismo celular, reduzindo a produção de RLO e melhorando o processo inflamatório.
Após quatro semanas de irrigação, verificou-se que os níveis de MDA nos segmentos sem trânsito fecal irrigados com butirato, apesar de menores do que os dos animais tratados com SF, não apresentavam diferenças significantes (p=0,08). Várias são as possíveis explicações para esses resultados. É possível que, nas primeiras semanas de exclusão do trânsito, o butirato seja o substrato energético preferencialmente utilizado e que, posteriormente, outros subtipos, como o propionato e o acetato, possam ter papel complementar. O pequeno número de animais estudados em cada grupo e o tempo de exclusão adotado também possa ser uma explicação plausível. Talvez, com a irrigação por um maior período, em um número maior de animais, fosse possível encontrar-se significância em quatro semanas. Atualmente, aumentamos o número de animais em cada grupo experimental e, paralelamente, idealizamos um terceiro grupo onde realizamos a irrigação por maior período. Da mesma forma, também estamos testando uma solução de irrigação composta pelos três principais subtipos de AGCC metabolizáveis pelo cólon, com intuito de verificar se a ação conjunta das três substâncias apresenta maior eficácia. Outra explicação para os maiores níveis de MDA após quatro semanas seja a idade mais avançada desses animais. Já se demonstrou que o processo de envelhecimento encontra-se relacionado à maior produção de RLO pelas mitocôndrias e, consequentemente, a maior lipoperoxidação tecidual44.
A possibilidade de que outras substâncias, além dos AGCC, sejam importantes para a prevenção da lipoperoxidação das membranas fica ainda mais evidente ao analisarmos a variação nos níveis de MDA, em relação ao tempo de intervenção. Verificou-se que no cólon com trânsito fecal preservado, tanto nos animais irrigados com SF quanto com butirato, onde todo substrato nutritivo ao cólon é mantido normal e que não sofre modificações da flora bacteriana, os níveis de MDA não se modificam com o decorrer do tempo do experimento (p=0,77 e p=0,14, respectivamente). De modo distinto, no cólon desprovido do trânsito fecal e, provavelmente, com modificações do conteúdo bacteriano luminal, os níveis de MDA aumentaram com o decorrer do tempo, em ambos os grupos. Esses achados sugerem que apenas o butirato não é capaz de reduzir a lipoperoxidação nas fases mais tardias da exclusão intestinal. O estudo histológico dos segmentos cólicos desprovidos de trânsito, após quatro semanas de irrigação, mostrou que os animais submetidos à intervenção com butirato apresentavam menor infiltração neutrofílica e congestão vascular, embora fosse possível identificar, ocasionalmente, presença de ulcerações epiteliais. No entanto, os irrigados com SF apresentavam infiltração neutrofílica mais intensa e maior número de úlceras epiteliais.
Os resultados encontrados no presente estudo sugerem que a aplicação de clisteres com butirato diminui os níveis de peroxidação lipídica das células do cólon excluso de trânsito que desenvolve CE. Apesar do potencial terapêutico, novas pesquisas utilizando soluções preparadas com todos os AGCC, associadas ou não a antioxidantes, aplicados por um maior período de tempo, ainda são necessárias para confirmar estes resultados. Caso a aplicação de clisteres com AGCC se mostre realmente eficaz em longo prazo, poderia se tornar estratégia útil para prevenir ou minimizar os sintomas da CE em indivíduos que já convivem com os percalços da presença de um estoma.
Recebido em: 27/05/2011
Aprovado em: 30/06/2011
Conflito de interesse: nada a declarar.
Fonte de financiamento: TMML e FLC agradecem ao Programa de Bolsa Auxílio à Iniciação Científica da Universidade São Francisco (PROBAIC/USF).
Trabalho realizado no Programa de Pós-Graduação em Ciências da Saúde da Universidade São Francisco, Bragança Paulista, São Paulo.
LHSM agradece ao CNPq pela Bolsa Auxílio à Iniciação Científica (PIBIC/CNPq). CMGS agradece a CAPES pela Bolsa de Mestrado.
- 1. Glotzer DJ, Glick ME, Goldman H. Proctitis and colitis following diversion of fecal stream. Gastroenterology 1981;80:438-41.
- 2. Curi A, Mascarenhas JCS, Moreira Junior H, Almeida AC, Moreira JPT, Azevedo IF, et al. Morbimortalidade associada à reconstrução do trânsito intestinal - Análise de 67 casos. Rev bras Coloproctol 2002;22:88-97.
- 3. Roediger WE, Truelove SC. Method of preparing isolated colonic epithelial cells (colonocytes) for metabolic studies. Gut 1979;20:484-8.
- 4. Roediger WE, Rae DA. Trophic effect of short chain fatty acids on mucosal handling of ions by the defunctioned colon. Br J Surg 1982;69:23-5.
- 5. Harig JM, Soergel KH, Komorowski RA, Wood CM. Treatment of diversion colitis with short-chain-fatty acid irrigation. N Engl J Med 1989;320:23-8.
- 6. Velazquez OC, Lederer HM, Rombeau JL. Butyrate and colonocyte. Production, absorption, metabolism and therapeutic implications. Adv Exp Med Biol 1997;427:123-34.
- 7. Oliveira-Neto JP, Aguilar-Nascimento JE. Intraluminal irrigations with fibers improve mucosal inflammation and atrophy in diversion colitis. Nutrition 2004;20:197-9.
- 8. Scheppach W, Weiler F. The butyrate story: old wine in new bottles? Curr Opin Clin Nutr Metab Care 2004;7:563-7.
- 9. Wong JM, de Souza R, Kendall CW, Emam A, Jenkins DJ. Colonic health: fermentation and short chain fatty acids. J Clin Gastroenterol 2006;40:235-43.
- 10. Nassri CGG, Nassri AB, Favero E, Rotta CM, Martinez CAR, Margarido NF. Influência da irrigação de soluções nutricionais no colo excluso de trânsito intestinal. Estudo experimental em ratos. Rev bras Coloproctol 2008;28:306-14.
- 11. Szczepkowski M, Kobus A, Borycka K. How to treat diversion colitis? Current state of medical knowledge, own research and experience. Acta Chir Iugosl 2008;55:77-81.
- 12. Assumpção IR, Rodrigues M, Barbieri D. Tratamento da retocolite ulcerativa inespecífica em criança com enemas contendo butirato. Arq Gastroenterol 1999;36:238-43.
- 13. Jørgensen JR, Clausen MR, Mortensen PB. Oxidation of short and medium chain C2-C8 fatty acids in Sprague-Dawley rat colonocytes. Gut 1997;40:400-5.
- 14. Campos FGCM, Habr-Gama A, Plopper C, Terra RM, Waitzberg DL. Ácidos graxos de cadeia curta e doenças colorretais. Rev bras Coloproctol1999;19:11-6
- 15. Sousa MV, Priolli DG, Portes AV, Cardinalli IA, Pereira JA, Martinez CAR. Evaluation by computerized morphometry of histopathological alterations of the colon wall in segments with and without intestinal transit in rats. Acta Cir Bras 2008;23:417-24.
- 16. Liu Q, Shimoyama T, Suzuki K, Umeda T, Nakaji S, Sugawara K. Effect of sodium butyrate on reactive oxygen species generation by human neutrophils. Scand J Gastroenterol 2001;36:744-50.
- 17. Roediger WE, Babidge WJ. Nitric oxide effect on colonocyte metabolism: co-action of sulfides and peroxide. Mol Cell Biochem 2000;206:159-67.
- 18. Pravda J. Radical induction theory of ulcerative colitis. World J Gastroenterol 2005;11:2371-84.
- 19. Rosignoli P, Fabiani R, De Bartolomeu A, Spinozzi F, Agea E, Pelli MA, et al. Protective activity of butyrate on hydrogen peroxide-induced DNA damage in isolated human colonocytes and HT29 tumour cells. Carcinogenesis 2001;22:1675-80.
- 20. Agarwal VP, Schimmel EM. Diversion colitis: a nutritional deficiency syndrome? Nutr Rev 1989;47:257-61.
- 21. Martinez CAR, Ribeiro ML, Gambero A, Miranda DDC, Pereira JA, Nadal SR. The importance of oxygen free radicals in the etiopathogenesis of diversion colitis in rats. Acta Cir Bras 2010; 25:387-95.
- 22.Ohkawa H, Ohishi N., Yagi K. Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction. Anal Biochem 1979;95:351-8.
- 23. MacFarlane S, MacFarlane GT. Session: Short-chain fatty acids. Regulation of short-chain fatty acids production. Proc Nutr Soc 2003;62:67-72.
- 24. Pryde SE, Duncan SH, Hold GL, Stewart CS, Flint HJ. The microbiology of butyrate formation in the human colon. FEMS Microbiological Lett 2002;217:133-9.
- 25. Delzenne NM. Oligosaccharides: state of the art. Proc Nut Soc 2003;62:177-82.
- 26. Aguilar-Nascimento JE, Silva LRF, Oliveira AF, Silva MHG. Enhanced mucosal re-epithelization induced by short-chain fatty acids in experimental colitis. Bras J Med Biol Res 1999;32:961-6.
- 27. Marques LHS, Silva CMG, Lameiro TMM, Almeida MG, Cunha FL, Pereira JA, Martinez CAR. Avaliação dos níveis de peroxidação lipídica em células da mucosa cólica após aplicação de enemas com peróxido de hidrogênio: estudo experimental em ratos. Rev Bras Coloproctol 2010;30:272-80.
- 28. Farrell RF, Peppercorn MA. Ulcerative colitis. Lancet 2002;359:331-40.
- 29. Hendrickson BA, Gokhale R, Cho JH. Clinical aspects and pathophysiology of inflammatory bowel disease. Clin Microbiol Rev 2002;15:79-94.
- 30. Millar AD, Rampton DS, Chander CL, Claxson AW, Blades S, Coumbe A, et al. Evaluating the antioxidant potential of new treatments for inflammatory bowel disease using a rat model of colitis. Gut 1996;39:407-15.
- 31. Sheridan AM, Fitzpatrick S, Wang C, Wheeler DC, Lieberthal W. Lipid peroxidation contributes to hydrogen peroxide induced cytotoxicity in renal epithelial cells. Kidney Int 1996;49:88-93.
- 32. Longatti TS, Acedo SC, de Oliveira CC, Miranda DD, Priolli DG, Ribeiro ML, et al. Inflammatory alterations in excluded colon in rats: a comparison with chemically induced colitis. Scand J Gastroenterol 2010;45:315-24.
- 33. Caltabiano C, Máximo FR, Spadari AP, da Conceição Miranda DD, Serra MM, Ribeiro ML, et al. 5-Aminosalicylic Acid (5-ASA) can reduce levels of oxidative DNA damage in cells of colonic mucosa with and without fecal stream. Dig Dis Sci 2011;56:1037-46.
- 34. Gaudier E, Hoebler C. Physiological role of mucins in the colonic barrier integrity. Gastroenterol Clin Biol 2006;30:965-74.
- 35. Hoffmann JC, Pawlowski NN, Kühl AA, Höhne W, Zeitz M. Animal models of inflammatory bowel disease: an overview. Pathobiology 2002-2003;70:121-30.
- 36. Martinez CAR, Nonose R, Spadari AP, Máximo FR, Priolli DG, Pereira JA, et al. Quantification by computerized morphometry of tissue levels of sulfomucins and sialomucins in diversion colitis in rats. Acta Cir Bras 2010;25:231-40.
- 37. Nonose R, Spadari APP, Priolli DG, Máximo FR, Pereira JA, Martinez CAR. Tissue quantification of neutral and acid mucins in the mucosa of the colon with and without fecal stream: Experimental study in rats. Acta Cir Bras 2009;24:267-75.
- 38. Martinez CAR. Avaliação dos níveis de estresse oxidativo e modificações no conteúdo e padrão de expressão das proteínas E-caderina e β-catenina em modelo de colite de exclusão: Estudo experimental em ratos [Tese Livre-Docência]. São Paulo: Faculdade de Medicina, Universidade de São Paulo; 2010.
- 39. Paiva LA, Gurgel LA, Silva RM, Tomé AR, Gramosa NV, Silveira ER, et al. Anti-inflammatory effect of kaurenoic acid, a diterpene from Copaifera langsdorffi on acetic acid-induced colitis in rats. Vascul Pharmacol 2002;39:303-7.
- 40. Liu XC, Mei Q, Xu JM, Hu J. Balsalazine decreases intestinal mucosal permeability of dextran sulfate sodium-induced colitis in mice. Acta Pharmacol Sin 2009;30:987-93.
- 41. Xu L, Yang ZL, Li P, Zhou YQ. Modulating effect of Hesperidin on experimental murine colitis induced by dextran sulfate sodium. Phytomedicine 2009;16:989-95.
- 42. Cammarota G, Cesaro P, Cazzato A, Fedeli P, Riccioni ME, Sparano L, et al. Hydrogen peroxide-related colitis (previously known as "pseudolipomatosis"): a series of cases occurring in an epidemic pattern. Endoscopy 2007;39:916-9.
- 43. Schwartz E, Dabezies MA, Krevsky B. Hydrogen peroxide injury to the colon. Dig Dis Sci1995;40:1290-1.
- 44. Pamplona R. Mitochondrial DNA damage and animal longevity: insights from comparative studies. J Aging Res 2011;807108.
Endereço para correspondência:
Datas de Publicação
-
Publicação nesta coleção
15 Set 2011 -
Data do Fascículo
Jun 2011
Histórico
-
Recebido
27 Maio 2011 -
Aceito
30 Jun 2011