Resumos
Duzentos camundongos suíços foram alojados em um biotério com instalações e condições de manejo adequadas para uma criação de animais convencionais sadios. Após 14 dias de alojamento, dois animais tiveram morte súbita, e em 74 animais (37%) foram observados sintomas clínicos como edema da face e das patas. Uma semana após foram observadas lesões generalizadas na pele ou somente no dorso, na face, no focinho e nas patas, nódulos na cauda, e em cinco animais conjuntivite. A necropsia de 10 camundongos indicou alterações como hepatomegalia, esplenomegalia e hiperplasia dos gânglios. Amostras do fígado, baço e de lesões da cauda foram inoculadas em membrana corioalantóide (MCA) de ovos embrionados de galinha. Após 72 horas foram detectadas lesões necróticas típicas denominadas "pocks". As MCAs foram maceradas e inoculadas em culturas de células Vero e detectado efeito citopático após 72 horas. O diagnóstico da varíola murina foi baseado nos sinais clínicos, lesões, cultivo e na identificação do vírus.
Camundongo; varíola murina; poxvírus; biotério
Two hundred Swiss mice were housed following the requirements to produce healthy laboratory animals. After 14 days two mice had an acute lethal infection and one week later 74 animals (37%) presented multiple skin lesions some of them associated with conjunctivitis. Necropsy of 10 mice with clinical signs (swelling of feet and facial area) revealed alterations in the spleen, liver and lymphonodes. Samples of hepatic and splenic tissues and of tail lesions were inoculated on chorioallantoic membrane (MCA) of embrionated chicken eggs and pocks lesions were detected. The MCAs were grinded and inoculated in Vero cell cultures and the cytophatic effect was detected after 72 hours. Diagnosis of mousepox was based on clinical signs, lesions and virus isolation and identification.
Mice; mousepox; poxvirus
a03v53n2
Surto de varíola murina em camundongos suíços em biotério Relato de caso
[An outbreak of mousepox in swiss mice in a laboratory animal facility Case report]
S. Diniz, G.S. Trindade, F.G., Fonseca, E.G. Kroon* * Autor para correspondência E-mail kroone@mono.icb.ufmg.br
Instituto de Ciências Biológicas da Universidade Federal de Minas Gerais
Av. Antônio Carlos, 6627
31270-901 - Belo Horizonte, MG
RESUMO
Duzentos camundongos suíços foram alojados em um biotério com instalações e condições de manejo adequadas para uma criação de animais convencionais sadios. Após 14 dias de alojamento, dois animais tiveram morte súbita, e em 74 animais (37%) foram observados sintomas clínicos como edema da face e das patas. Uma semana após foram observadas lesões generalizadas na pele ou somente no dorso, na face, no focinho e nas patas, nódulos na cauda, e em cinco animais conjuntivite. A necropsia de 10 camundongos indicou alterações como hepatomegalia, esplenomegalia e hiperplasia dos gânglios. Amostras do fígado, baço e de lesões da cauda foram inoculadas em membrana corioalantóide (MCA) de ovos embrionados de galinha. Após 72 horas foram detectadas lesões necróticas típicas denominadas "pocks". As MCAs foram maceradas e inoculadas em culturas de células Vero e detectado efeito citopático após 72 horas. O diagnóstico da varíola murina foi baseado nos sinais clínicos, lesões, cultivo e na identificação do vírus.
Palavras-chave: Camundongo, varíola murina, poxvírus, biotério
ABSTRACT
Two hundred Swiss mice were housed following the requirements to produce healthy laboratory animals. After 14 days two mice had an acute lethal infection and one week later 74 animals (37%) presented multiple skin lesions some of them associated with conjunctivitis. Necropsy of 10 mice with clinical signs (swelling of feet and facial area) revealed alterations in the spleen, liver and lymphonodes. Samples of hepatic and splenic tissues and of tail lesions were inoculated on chorioallantoic membrane (MCA) of embrionated chicken eggs and pocks lesions were detected. The MCAs were grinded and inoculated in Vero cell cultures and the cytophatic effect was detected after 72 hours. Diagnosis of mousepox was based on clinical signs, lesions and virus isolation and identification.
Keywords: Mice, mousepox, poxvirus
INTRODUÇÃO
O vírus ectromelia, pertencente à família Poxviridae, gênero Orthopoxvirus, é o agente da varíola murina, doença infecciosa e endêmica com distribuição mundial. Há relatos de sua ocorrência enzootica na Europa e epizootias nos Estados Unidos e na Ásia (Dixon, 1981; Faundez et al., 1990; Niemialtowski et al., 1994).
A transmissão do vírus ectromelia de uma criação de camundongos para outra ocorre por contato direto entre animais doentes ou portadores do vírus ou fômites e animais sadios. A infecção e a disseminação ocorrem pela penetração do vírus no trato respiratório, contato com lesões cutâneas, ingestão de fezes contaminadas, ectoparasitas e urina (Cepanzo, 1971; Harkness & Wagner, 1977; Fenner, 1982).
Segundo Fenner (1982), a infecção pelo vírus ectromelia pode ocorrer nas formas latente, aguda, subaguda ou crônica. Na forma latente o vírus pode estar presente no trato intestinal de camundongos adultos e desencadear a doença quando os animais forem submetidos a estresse. Na forma aguda o animal doente morre em poucas horas, apresentando necrose no fígado e no baço. A forma crônica é caracterizada por lesões ulcerativas nos pés, cauda e focinho. Há um estágio em que o vírus se multiplica sistemicamente tendo sido encontrado em títulos elevados no fígado e no baço. Nesse estágio alguns animais morrem, e os sobreviventes poderão desenvolver lesões ulcerativas não só nas extremidades com poucos pêlos mas em todo o corpo.
Em epizootias severas de varíola murina foram observados índices de até 90% de morbidade e de mais de 70% de mortalidade entre 4 e 20 dias após o aparecimento dos sintomas clínicos (Niemialtowski et al., 1994). Morbidade e mortalidade são influenciadas por vários fatores como amostra do vírus, genótipo, idade e estado imune dos camundongos (Dick et al., 1996).
Os camundongos heterogênicos suíços são os mais sensíveis ao vírus ectromelia. Várias linhagens isogênicas como A, A/I, BALB/C, DBA, C3H e AKH são sensíveis enquanto que C57BL/6 e C57BL/10 são resistentes ao efeito letal da infecção pelo vírus (Allen et al., 1981; Wallace et al., 1981; Werner et al., 1981; Bhatt et al., 1988; Brownstein et al., 1989; Niemialtowski et al., 1994).
Hoje o impacto dessa doença pode ser devastador pois o modelo murino vem sendo muito utilizado para o estudo da função dos genes, criando-se os modelos "knock-outs" (Lipman et al., 1999), o que reforça a necessidade de diagnosticar rapidamente a doença e fazer um controle em todos os insumos utilizados nos animais.
O estudo da biologia das amostras isoladas em cada país ou região com o propósito de diagnóstico, prevenção e controle da varíola murina é importante. Assim, o objetivo deste trabalho foi o de determinar a etiologia de um surto de varíola murina em uma criação de camundongos pelos aspectos clínicos, anatopatológicos, isolamento e identificação do vírus.
CASUÍSTICA
Duzentos camundongos suíços (100 machos e 100 fêmeas) adultos foram adquiridos de uma instituição de pesquisa para iniciar uma colônia piloto no Centro de Bioterismo da UFMG (CEBIO/UFMG). Todos os animais foram submetidos a um período de observação de sete dias. Após esse período, foram acasalados no sistema monogâmico intensivo e mantidos em condições de manejo adequadas para uma criação convencional. O setor a eles destinado não havia abrigado nenhuma outra criação anteriormente.
A necropsia de 10 animais que apresentavam sinais clínicos como lesões ulcerativas pelo corpo foi realizada coletando-se fragmentos de fígado, baço e tecido de lesões de pele, os quais foram macerados em gral com areia lavada e autoclavada em meio mínimo de Eagle (MEM) acrescido de penicilina, fungizona e gentamicina.
Ovos embrionados com nove dias de incubação foram inoculados com 50ml de suspensão de tecidos na membrana corioalantóide (MCA). A incubação dos ovos embrionados foi feita a 30oC durante 72 horas, segundo o protocolo de Andrews & Pereira (1972). Os ovos foram resfriados a 4oC e a MCA removida para observação da presença de lesões ("pocks"). As MCAs foram maceradas em gral com areia lavada e autoclavada e o sobrenadante obtido após centrifugação a 2500 rpm/10 minutos.
Cultivos celulares de linhagens contínuas de células Vero (células derivadas de rim de macaco verde) foram multiplicadas com MEM acrescido de 5% de soro fetal bovino (SFB), e as monocamadas infectadas com 10ml de suspensões de MCA. Após 72 horas de incubação a 37ºC foram feitas as observações microscópicas das monocamadas.
O teste de neutralização foi feito em células Vero conforme Schmidt (1979). O vírus isolado e o vírus vaccínia-WR foram diluídos em MEM sem SFB até a concentração de 103 partículas virais/ml e a diluição do soro foi feita a partir de 1/4 na razão de 2 até 1/1024. A mistura (soro + vírus) foi mantida sob agitação a 37ºC por uma hora e diluída em placas de seis câmaras contendo a monocamada de célula Vero. Em cada câmara da placa foram acrescentados 200ml da suspensão do vírus e 200ml da diluição do soro. As placas foram incubadas a 37ºC por uma hora para adsorção das partículas virais. Em seguida foi acrescentado MEM 1% SFB e as placas foram novamente incubadas até o aparecimento do ECP. Após o surgimento de placas de lise, o meio foi desprezado e as células fixadas por 30 minutos em formol 10% em solução salina tamponada contendo fosfato (PBS). A monocamada foi corada com solução de cristal violeta durante 5 a 15 minutos. Os ensaios foram feitos em triplicata para ambos os vírus e todos os experimentos foram realizados separadamente. Foram feitos também controles de células, de vírus e do soro.
DISCUSSÃO
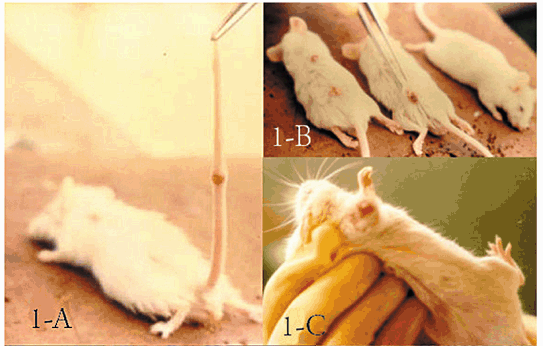
Quatorze dias após o transporte e sete dias após o acasalamento dois animais (1%) tiveram morte súbita e em 74 animais (37%) foram observados sinais clínicos como edema da face e das patas. Uma semana após, nesses animais foram observadas lesões generalizadas de pele ou somente no dorso, face, focinho e patas, nódulos na cauda, e em cinco animais, conjuntivite (3,5%) (Fig. 1).
À necropsia, realizada em 10 animais, foram encontrados hepatomegalia, esplenomegalia e hiperplasia dos gânglios, além de nódulos na cauda e extremidades. As lesões de varíola murina observadas foram semelhantes às descritas anteriormente em outros surtos (Allen et al., 1981; Dick et al., 1996).
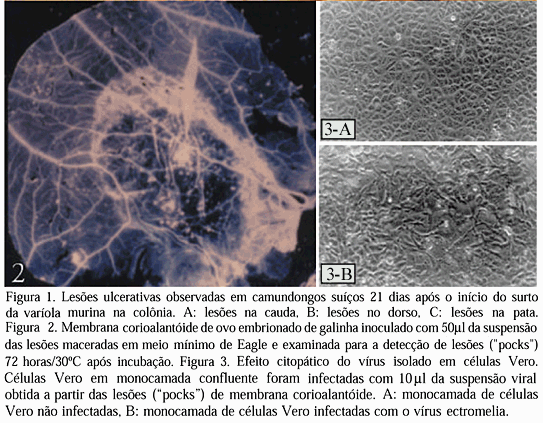
O vírus foi isolado de suspensões de fígado e lesões de pele em MCA de ovos embrionados de galinha. Em MCAs coletadas após 72 horas foram detectadas lesões necróticas típicas denominadas "pocks" (Fig.2). MCAs maceradas foram inoculadas em células Vero, observando-se o aparecimento de efeito citopático característico após 72 horas (Fig.3).
Para a identificação do vírus, amostras obtidas em células Vero foram testadas pelo teste de neutralização empregando soro antivaccínia produzido em coelhos por Lanna (comunicação pessoal). O título neutralizante do soro antivaccínia em células infectadas com o vírus Vaccínia WR (Western Reserve) e para células infectadas com o vírus isolado foi >1:1024. Embora o teste de neutralização não seja utilizado rotineiramente para diagnóstico de varíola murina e monitoramento das colônias, ele foi de grande utilidade, contribuindo para a classificação da amostra viral isolada como sendo um ortopoxvírus, uma vez que por meio dele foram demonstradas as relações antigênicas entre a amostra viral isolada e o vírus vaccínia. Collins et al. (1981) relatam que testes de soroneutralização baseados na inibição do efeito citopático em culturas de células L929 podem ser feitos para a detecção do vírus ectromelia, entretanto os vírus do gênero Orthopoxvirus são antigenicamente relacionados, o que torna a diferenciação da espécie por diagnóstico sorológico difícil. Isso tem levado ao desenvolvimento de técnicas como PCR (reação em cadeia da polimerase) para identificação de ortopoxvírus (Newbauer et al., 1997).
Confirmado o diagnóstico de varíola murina, medidas de controle foram adotadas de acordo com Dixon (1981). Os animais da colônia piloto foram sacrificados e incinerados assim como o material de cama e a ração. Foi realizada descontaminação das instalações e dos equipamentos para o início de uma nova colônia. O diagnóstico clínico associado à detecção do efeito citopático característico de poxvírus nos sistemas celulares e os testes sorológicos permitiram confirmar a infecção como varíola murina Gilioli et al. (1996), em estudo sobre a infecção da flora indígena de ratos e camundongos em 17 biotérios no Brasil, durante dois anos, não detectaram o vírus ectromelia. O fato de o vírus ectromelia não ter sido anteriormente detectado no país indica a necessidade de se implantar um sistema de fiscalização e controle dos biotérios brasileiros. Os resultados deste estudo reforçam essa necessidade, pois indicam a possível circulação da varíola murina no Brasil.
- ALLEN, A.M., CLARKE, G.L., GANAWAY, J.R. et al. Pathology and diagnosis of mousepox. Lab. Anim. Sci, v.31, p.599-608, 1981.
- ANDREWS, C., PEREIRA, H.G. Viruses of vertebrates 3.ed., Baltimore: Williams & Wilkins, 1972. p.373-387.
- BHATT, P.N., JACOBY, R.O., GRASS, L. Mousepox in inbred mice innately resistant or susceptible to lethal infection with Ectromelia virus. IV. Studies with the Moscow strain. Arch. virol., v.100, p.221-230, 1988.
- BROWSTEIN, D., BHATT, P.N., JACOBY, R.O. Mousepox in inbred mice innately resistant or susceptible to lethal infection with Ectromelia virus. V. Genetics of resistence to the Moscow strain. Arch. Virol., v.107, p.35-41, 1989.
- CEPANZO - Centro Panamericano de Zoonoses. Enfermedades infecciosas de los animales de laboratório, Buenos Aires: 1971, p.61-64. Série Monografias Científicas y Tecnicas.
- COLLINS, M.J.J., PETERS, R.L., PARKER, J.C. Serological detection of ectromelia virus antibody. Lab. Anim. Sci, v.31, p. 595-598, 1981.
- DICK, E.J.J., KITTELL, C.L., MEYER, H. et al. Mousepox outbreak in a laboratory mouse colony. Lab. Anim. Sci., v.46, p.602-611, 1996.
- DIXON, I.W. Control of mousepox epizootics in St. Louis and Chicago. Lab. Anim. Sci., v.31, p.585-589, 1981.
- FAUNDEZ, I.S., NIEMIALTOWSKI, M., MALICKA, E. et al. Electron microscopy, plaque assay and preliminary serological characterization of three ectromelia virus strains isolated in Poland in the period 1986-1988. Arch. Virol., v.114, p.285-291, 1990.
- FENNER, F. Mousepox. In: FOSTER, H.L., SMALL, J.D., FOX, J.G. The mouse in biomedical research New York: Academic Press, 1982. p.209-228.
- GILIOLI, R., SAKURADA, J.K., ANDRADE, L.A.G. et al. Vírus infection in rat and mouse colonies reared in brazilian animal facilities. Lab. Anim. Sci, v.46, p582-584, 1996.
- HARKNESS, J.E., WAGNER, J.E. The biology and medicine of rabbits and rodents. Philadelphia: Lea & Felbinger, 1977, p.85-86.
- LIPMAN, N.S., NGUYEN, H., PERKINS, S. Threat to U.S. Mouse Col. Sci., v.284. p.1123, 1999.
- NEWBAUER, H., PFEFFER, M., MEYER, H. Specific detection of mousepox virus by polymerase chain reaction. Lab. Anim. Sci., v.31, p.201-205, 1997.
- NIEMIALTOUWSKI, M.G., FAUNDEZ, I.S., GIERYNSKA, M. et al. The inflammatory and immune response to mousepox (infectious Ectromelia) virus. Acta Virol., v.38, p.299-309, 1994.
- SCHMIDT, N.J. Cell culture techniques for diagnostic virology. In: LENNETTE, E.H., SCHMIDT, N.J. Diagnostic procedures for viral, rickettsial and chlamydial infections 5.ed. Washington: American Public Health Association, 1979, p.65-134.
- WALLACE, G.D., WERNER, R.M., GOLWAT, P.L. et al. Epizootiology of an outbreak of mousepox at the National Institutes of Health. Lab. Anim. Sci., v.31, p.609-615, 1981.
- WERNER, R.M., ALLEN, A.M., SMALL, J.D. et al. Clinical manifestation of mousepox in a experimental animal holding room. Lab. Anim. Sci., v.31, p.590-594, 1981.
Datas de Publicação
-
Publicação nesta coleção
05 Jun 2002 -
Data do Fascículo
Abr 2001