Resumos
Noventa e seis pintos de corte foram mantidos em diferentes temperaturas ambientais (calor, 29ºC; neutro, 24ºC; frio, 15ºC) e oito aves de cada grupo de temperatura (tratamento) foram sacrificadas nos dias 1, 7, 14, 21, 28, 35 e 42, e suas bolsas cloacais (BC) coletadas e processadas segundo técnica de rotina para inclusão em parafina. Cortes de 4m m, corados em HE, foram submetidos à análise histométrica utilizando-se o programa Kontron KS300, V 2.0. De cada corte foram mensurados a porcentagem de parênquima e o índice apoptótico nas BC. As médias da porcentagem de parênquima nas BC das aves com cinco semanas foram significativamente menores quando mantidas em ambiente frio (53,0%), quando comparadas com as do ambiente neutro (78,5%). As médias do índice apoptótico foram significativamente maiores nas BC de aves mantidas no ambiente frio (0,26), em relação às do neutro (0,12). Conclui-se que o estresse térmico induz apoptose de linfócitos e, conseqüentemente, hipotrofia da bolsa cloacal, alterando sua maturação.
frango; bolsa cloacal; apoptose; estresse térmico; imunossupressão
Ninety six broiler chickens were kept in climatic chambers and submitted to three different environmental temperatures 24h/day: 29ºC (hot), 24ºC (neutral) and 15ºC (cold). Eight chickens of each temperature group were sacrificed at 1, 7, 14, 21, 28, 35 and 42 days, and the cloacal bursae (CB) were collected, processed and embedded in paraffin. Sections were stained with HE and histometric evaluation was carried out. From each section, parenchyma ratio (PR) and apoptotic index (AI) were measured. The CB of five week-old chickens kept in lower temperature showed PR lower than CB of chickens kept in neutral temperature. The CB of five week-old chickens kept in lower temperature showed an AI greater than CB of chickens submitted to neutral temperature. The present study shows that environmental temperature stress induces lymphocytes apoptosis, cloacal bursae atrophy and affects CB maturation.
broiler; bursa of Fabricius; apoptosis; stress; environmental temperature immunossupression
Porcentagem de parênquima e índice apoptótico da bolsa cloacal em frangos de corte em ambiente de conforto e estresse térmico
Parenchymal percentage and apoptotic index of cloacal bursa of broiler chickens maintained in thermal comfort or stress
E.B. GuimarãesI; A.C. VasconcelosII; N.R.S. MartinsIII; R.F.M. OliveiraIV; L. MoroII; J.E.S. NunesII; F.G.A. SantosV
IDepartamento de Medicina Veterinária da UFMS Caixa postal 649 79070-900 - Campo Grande, MS
IIInstituto de Ciências Biológicas da UFMG
IIIEscola de Veterinária da UFMG
IVDepartamento de Zootecnia do CCA da UFV
VDoutorando da Escola de Veterinária da UFMG
RESUMO
Noventa e seis pintos de corte foram mantidos em diferentes temperaturas ambientais (calor, 29ºC; neutro, 24ºC; frio, 15ºC) e oito aves de cada grupo de temperatura (tratamento) foram sacrificadas nos dias 1, 7, 14, 21, 28, 35 e 42, e suas bolsas cloacais (BC) coletadas e processadas segundo técnica de rotina para inclusão em parafina. Cortes de 4m m, corados em HE, foram submetidos à análise histométrica utilizando-se o programa Kontron KS300, V 2.0. De cada corte foram mensurados a porcentagem de parênquima e o índice apoptótico nas BC. As médias da porcentagem de parênquima nas BC das aves com cinco semanas foram significativamente menores quando mantidas em ambiente frio (53,0%), quando comparadas com as do ambiente neutro (78,5%). As médias do índice apoptótico foram significativamente maiores nas BC de aves mantidas no ambiente frio (0,26), em relação às do neutro (0,12). Conclui-se que o estresse térmico induz apoptose de linfócitos e, conseqüentemente, hipotrofia da bolsa cloacal, alterando sua maturação.
Palavras-chave: frango, bolsa cloacal, apoptose, estresse térmico, imunossupressão.
ABSTRACT
Ninety six broiler chickens were kept in climatic chambers and submitted to three different environmental temperatures 24h/day: 29ºC (hot), 24ºC (neutral) and 15ºC (cold). Eight chickens of each temperature group were sacrificed at 1, 7, 14, 21, 28, 35 and 42 days, and the cloacal bursae (CB) were collected, processed and embedded in paraffin. Sections were stained with HE and histometric evaluation was carried out. From each section, parenchyma ratio (PR) and apoptotic index (AI) were measured. The CB of five week-old chickens kept in lower temperature showed PR lower than CB of chickens kept in neutral temperature. The CB of five week-old chickens kept in lower temperature showed an AI greater than CB of chickens submitted to neutral temperature. The present study shows that environmental temperature stress induces lymphocytes apoptosis, cloacal bursae atrophy and affects CB maturation.
Keywords: broiler, bursa of Fabricius, apoptosis, stress, environmental temperature immunossupression
INTRODUÇÃO
Condições adversas de clima, principalmente oscilações bruscas de temperatura, causam estresse e imunodeficiência em resposta ao aumento de função da glândula adrenal (Cheville, 1978). Isso ocorre especialmente nas aves (Regnier, Lelley, 1980) devido à inibição da atividade dos linfócitos e plasmócitos e/ou bloqueio do desenvolvimento da bolsa cloacal em animais jovens (Compton et al., 1990).
A bolsa cloacal, ou Bursa Fabricii, é um órgão linfóide exclusivo de aves, localizado na face superior da cloaca, com a qual se comunica (Baumel et al., 1993). É indispensável ao desenvolvimento e funcionamento do tecido linfóide periférico e à competência para manutenção da imunidade humoral (Glick, 1960).
Por ocasião da eclosão este órgão está complemente formado e cresce rapidamente até em torno da quinta semana de vida, quando se inicia um processo de involução fisiológica que se completa com 23 semanas (Glick, 1960). É composto basicamente de folículos linfóides cujo ápice, voltado para o lume da bolsa, é recoberto por células epiteliais especializadas (Hodges, 1974) capazes de realizarem pinocitose, as quais transferem antígenos do lume da cloaca para a área medular dos folículos, apresentando-os aos linfócitos B (Tizzard, 1979).
Alguns fatores estressantes, infecciosos ou não, podem causar depleção de linfócitos imaturos, principalmente da bolsa cloacal, devido à intensificação da apoptose (Cifone et al., 1999) mediada por aumento da concentração de corticosteróides (Herenda, Franco, 1996).
A apoptose ou morte celular programada é um tipo de morte da célula geneticamente controlada, dependente de energia metabólica, de síntese de RNAm e de expressão de proteínas específicas (Raff, 1992). Geralmente é mais intensa em células e tecidos com atividade proliferativa elevada, nos quais aumenta acentuadamente após a exposição a agentes desencadeadores (Arends, Wyllie, 1991).
Em condições normais, a apoptose é indispensável ao desenvolvimento e manutenção da homeostasia dos tecidos e regulação do tamanho dos órgãos (Cohen, 1993; Wyllie, 1995), exercendo papel oposto ao da mitose (Motoyama et al., 1995; Vasconcelos et al., 1996). Em situação de anormalidade, a apoptose é responsável pela eliminação de células alteradas por agentes físicos (Arai et al., 1997), químicos, (Hickman, Boyle, 1997) e virais (Cotran et al., 2000; Hacker, 2000). Também pode ser desencadeada pelo excesso de alguns hormônios (Majno, Joris, 1995), destacando-se os glicocorticóides (Wyllie et al., 1984). Esses hormônios são importantes na deleção fisiológica de linfócitos excedentes ou imaturos (Garvy et al., 1993; Gruber et al., 1994) e de células linfóides malignas (Arends, Wyllie, 1991; Kerr et al., 1994). Também participam na regulação e funcionamento do sistema imunológico de animais sadios (Golstein et al., 1991), na destruição de clones de células T auto-reativas e na eliminação das células alvo dos linfócitos T (Hacker, 2000).
Morfologicamente, a célula apoptótica encolhe e aumenta de densidade. O núcleo apresenta-se retraído e com cromatina condensada disposta na periferia (Majno, Joris, 1995), ou divide-se em múltiplos corpos envolvidos pelo envelope nuclear (Haker, 2000).
A superfície celular emite brotos que se separam e se transformam em pacotes envolvidos por membrana plasmática denominados corpos apoptóticos. Essas estruturas mantêm o gradiente osmótico da célula de origem, não permitindo a liberação do conteúdo intracelular para o interstício, prevenindo, dessa forma, o desencadeamento de reação inflamatória (Cohen, 1993).
Microscopicamente observa-se que a célula, ao entrar em apoptose, apresenta hipercromasia nuclear (Kerr, 1993) e retração do citoplasma. Na fase avançada os corpos apoptóticos, quando presentes, são facilmente visualizados ao microscópio óptico (Arends, Wyllie, 1991), apresentando-se como uma massa ovalada ou arredondada menor que a célula de origem, os quais freqüentemente apresentam um ou mais fragmentos compactos de cromatina (Kerr, 1993). Como são rapidamente formados, fagocitados e digeridos, eles desaparecem em poucas horas. Isto, associado à presença de corpos apoptóticos demasiadamente pequenos, à ausência de reação inflamatória e à preservação da arquitetura dos tecidos e órgãos, fazem com que a apoptose, na maioria das vezes, passe despercebida ao exame histológico de rotina (Kerr, 1993).
No caso do estresse ambiental, o calor ou o frio estimula a secreção de hormônio adrenocorticotrófico (ACTH), aumentando a atividade do córtex da adrenal e da secreção de hormônios esteróides causadores de apoptose em tecidos linfóides (Distelhorst, 1997).
Na expectativa de melhor caracterizar os mecanismos celulares envolvidos na imunossupressão causada por estresse térmico nas aves e testar a hipótese da participação da apoptose na depleção do tecido imune, realizou-se o presente trabalho com o objetivo de avaliar e comparar as bolsas cloacais de frangos de corte, com idades entre 1 e 42 dias, submetidos a três temperaturas ambientais a partir do 21º dia de vida e quantificar a apoptose das células linfóides na bolsa cloacal, correlacionando-a com a exposição ao estresse térmico ambiental.
MATERIAL E MÉTODOS
O trabalho foi conduzido no Centro de Ciências Agrárias do Departamento de Zootecnia da Universidade Federal de Viçosa (CCA/DZ/UFV), em três etapas, cada uma considerada um tratamento, designados A (calor), B (neutro) e C (frio), cada tratamento dividido em duas fases. Na primeira, os animais com idades entre 1 e 21 dias foram mantidos em galpão e na segunda, entre 22 e 42 dias, em câmaras climatizadas equipadas com sistema automático de acondicionamento ambiental.
Foram utilizados 96 pintos de um dia da linhagem Avian Farms, machos, adquiridos em incubatório comercial e alimentados com rações produzidas no laboratório de rações do CCA, segundo Rostagno et al. (1996).
As bolsas cloacais destinadas às medições foram colhidas de oito aves retiradas ao acaso de cada grupo. Após examinadas, foram sacrificadas por eletrocussão e necropsiadas. As amostras foram processadas para inclusão em parafina e coloração pela hematoxilina e eosina (Prophet, 1992) e avaliadas em microscopia óptica. Para melhor avaliar a evolução do processo de apoptose, foram descritos primeiro os achados nas bolsas dos animais do tratamento B, seguido do tratamento A e do tratamento C.
Três lâminas de animais de cada tratamento foram medidas para determinação da porcentagem de parênquima bursal (Rachid, 2000; Guimarães, 2001). Secções coradas pela HE também foram submetidas à histometria para quantificação do índice apoptótico (Rachid, 2000; Guimarães, 2001). Os campos analisados corresponderam ao mínimo estatisticamente representativo para esse tipo de avaliação em bolsas cloacais (Rachid, 2000). Foram quantificadas as células com morfologia típica de apoptose e o índice apoptótico foi obtido dividindo-se o número de células em apoptose pelo número total de linfócitos no campo microscópico.
O delineamento experimental foi inteiramente ao acaso (Sampaio, 1998) e os valores médios submetidos a análise de variância pelo modelo linear geral (GLM) do programa Statistical Analysis System (SAS, 1985). A comparação entre as médias foi feita pelo teste Duncan (Sampaio, 1998).
RESULTADOS E DISCUSSÃO
Durante a fase de criação em galpão, entre 1 e 21 dias de idade, as aves do tratamento A manifestaram discretos sinais de desconforto pelo calor. Quando passaram para segunda fase, as médias da temperatura interna das câmaras climatizadas situaram-se entre 28,3 e 29,3oC. Houve intensificação dos sinais de desconforto mas, provavelmente, a temperatura teve pouco efeito sobre a maturação da bolsa cloacal, pois segundo Glick (1960) e Hodges (1974), nessa idade esse órgão já completou o desenvolvimento.
Com relação ao tratamento B, o monitoramento ambiental associado com o manejo adequado da fonte de calor possibilitaram a manutenção da temperatura média no galpão em níveis considerados como de conforto. Nas câmaras, as médias de temperatura situaram-se entre 23,4 e 24,7ºC e as aves não manifestaram sinais de desconforto.
As aves do tratamento C foram criadas em um período de temperaturas médias ambientais máxima de 24,5ºC e mínima de 11,5ºC. Durante todo o período de criação elas foram inferiores ao recomendado como ideal para a linhagem (Avian..., 2000). Os pintinhos manifestaram, desde o primeiro dia no alojamento, sinais de desconforto pelo frio. Na fase experimental do tratamento C, a temperatura manteve-se em torno de 15ºC, com agravamento do estresse pelo frio a que os animais já vinham sendo submetidos no galpão.
À necropsia das aves dos tratamentos A (calor) e B (neutro) não foram observadas, à inspeção macroscópica, alterações dignas de nota. As aves do tratamento C apresentaram, a partir da segunda semana, discreto retardamento no desenvolvimento corporal, empenamento pobre e palidez da pele das pernas. Ao exame interno, observou-se em vários animais desenvolvimento deficiente da musculatura peitoral. Os órgãos não apresentaram alterações dignas de nota, a não ser discreta palidez das vísceras e aumento de líquido transparente no interior das cavidades. Vários animais apresentaram bolsas cloacais menores que as dos tratamentos A e B, evidenciando flacidez e transparência da parede, e a partir da terceira semana, pregas mucosas delgadas e curtas. Os achados foram compatíveis com hipotrofia da bolsa cloacal em aves expostas ao estresse ou tratadas com glicocorticóide (Riddel, 1987).
Os aspectos microscópicos foram descritos tomando-se como base as aves com cinco semanas, época em que, segundo Glick (1960), a bolsa cloacal atinge o desenvolvimento pleno.
As bolsas cloacais das aves do tratamento B apresentaram folículos linfóides grandes e densamente povoados. A área cortical era separada da medular por uma membrana basal, visível na maioria dos cortes. Os septos interfoliculares apresentavam-se delgados e o epitélio estendido (Fig. 1B). A população celular predominantemente de células grandes, aparentemente normais, apresentavam poucas características morfológicas de apoptose (Fig.1b). Esse aspecto microscópico caracterizava, segundo Hodges (1974) e Riddell (1987), uma bolsa cloacal normal para frangos de corte dessa idade.
De modo semelhante ao tratamento B, as aves do tratamento A, sacrificadas com um dia e no final da primeira e segunda semanas de vida, apresentaram aspectos microscópicos compatíveis com um órgão normal de acordo com o descrito por Hodges (1974) e Riddell (1987). A partir daí, até a quarta semana, apesar de as porções medular e cortical apresentaram-se densamente povoadas, observou-se grande número de células com características morfológicas de apoptose (Kerr, 1993). As aves sacrificadas ao final da quinta semana apresentaram bolsas cloacais com parênquima rarefeito, amplos espaços vazios e delimitação entre as áreas cortical e medular pouco visível. A cortical mostrava-se estreita, o epitélio pregueado, sendo freqüente a presença de cistos, e o tecido conjuntivo subepitelial proeminente (Fig. 1A). A observação detalhada revelou células com citoplasma retraído, núcleos com cromatina condensada, disposta na periferia ou em forma de "meia lua". Observaram-se estruturas densas características de corpos apoptóticos (Fig. 1a). Essas alterações caracterizam um quadro de intensa apoptose (Kerr, 1993), com evidentes sinais de hipotrofia (Arai et al., 1997) e involução prematura do órgão, provavelmente devidos ao estresse induzido pelo calor que intensificou o processo de apoptose a partir da terceira semana, talvez mediada pelo aumento de glicocorticóides endógenos (Gruber et al., 1994).
A avaliação histológica das bolsas cloacais das aves do tratamento C evidenciou, já no final da primeira semana, septos interfoliculares mais espessos que os observados nos tratamentos A e B, sem distinção das áreas cortical e medular. Os folículos linfóides apresentavam-se pequenos com redução da densidade celular na região medular. Em lugar dos linfoblastos grandes, observaram-se células com núcleos condensados e/ou fragmentados, sendo comum a presença de corpos apoptóticos.
Essas alterações intensificaram-se nas aves sacrificadas no final da segunda semana de vida, que apresentaram folículos linfóides pequenos, com corticais estreitas e medulares rarefeitas, indicando pouca atividade. Com três semanas observou-se pregueamento do epitélio, que proporcionava um aspecto irregular à superfície da mucosa, com estruturas císticas. Os linfócitos eram escassos e a maioria das células remanescentes apresentavam núcleos condensados e hipercromáticos. Ao final da quinta semana, na fase experimental de estresse térmico, as alterações anteriores intensificaram-se. Os folículos mostravam-se retraídos e o epitélio intensamente pregueado, inclusive com presença de invaginações e cistos repletos de material protéico. Não foi possível a delimitação entre cortical e medular (Fig. 1C). A escassa população celular evidenciava amplos espaços vazios e as células remanescentes mostravam núcleos condensados, hipercromáticos, sendo comum a presença de corpos apoptóticos (Fig.1c). Em alguns cortes percebia-se que os linfócitos da região medular foram substituídos por células grandes, com citoplasma pouco definido e núcleos vesiculosos, alongados ou arredondondados e com nucléolos proeminentes.
A evolução das alterações histológicas observadas nas bolsas cloacais das aves com cinco semanas do tratamento C, submetidas ao frio desde o terceiro dia de vida, caracterizaram um quadro acentuado de hipotrofia bursal e imunossupressão (Arai et al., 1997). Esses autores afirmaram também que a hipotrofia das pregas bursais atribuida à retração folicular manifesta-se com o pregueamento do epitélio.
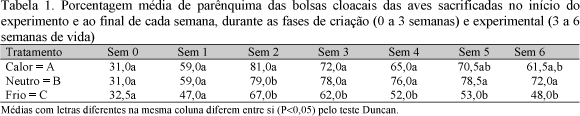
A histometria revelou que o parênquima das bolsas cloacais das aves do tratamento B ( Tab.1; Fig.2) apresentou crescimento rápido durante as duas primeiras semanas de vida, estabilizou-se entre a terceira e a quinta, quando então evidenciou-se tendência de declínio. Essas observações estão de acordo com as informações de Glick (1960), de que a bolsa cloacal de galinhas normais apresenta crescimento acelerado durante as três primeiras semanas de vida e inicia processo de regressão fisiológica a partir da sexta semana.
Quanto ao tratamento A, a evolução da porcentagem de parênquima nas bolsas cloacais foi semelhante ao observado nos órgãos das aves do tratamento B, até o final da segunda semana (Fig. 2).
Quanto ao tratamento C, a porcentagem de parênquima foi menor do que a encontrada nos demais já na primeira semana, acentuando-se a partir da segunda e permanecendo assim até o final do período experimental. Todas as observações anteriores caracterizaram a redução na quantidade de tecido linfóide da bolsa cloacal devido ao aumento do índice de apoptose (Tab.2; Fig.3).
A Fig. 2 ilustra a evolução da porcentagem do parênquima da bolsa cloacal nos três tratamentos. O frio retardou o desenvolvimento e o calor acelerou a involução. A involução fisiológica iniciou a partir da quinta semana.
No tratamento frio o IA foi maior que nos demais, já no final da primeira semana, apresentando comportamento inverso a partir da quarta semana de vida, provavelmente devido à depleção linfocitária. No calor o IA elevou-se após a terceira semana, intensificando-se a partir da quinta semana, devido ao início dos processos regressivos fisiológicos da bolsa cloacal.
O aumento do índice apoptótico foi conseqüência do estresse induzido pela temperatura ambiental (Thaxton et al., 1968).
Com base nesses achados, é possível afirmar que, apesar das temperaturas ambientais no galpão e nas câmaras climatizadas não terem sido excessivamente elevadas, elas foram suficientemente altas para causar estresse, com prejuízo para o desenvolvimento normal da bolsa cloacal. Isso causou redução da população de linfócitos e, conseqüentemente, da quantidade de parênquima, porém manifestou-se mais tardiamente e com menor intensidade que a ocasionada pelo frio (Tab. 1) Estes achados estão de acordo com as afirmações de Thaxton et al. (1968), que relatam a ocorrência de tal fenômeno quando aves jovens são expostas ao calor excessivo.
Quanto ao frio, o efeito prejudicial se fez sentir já na primeira semana de vida, agravando-se até a quarta. Observou-se que quanto menor a idade do animal, mais grave é o efeito negativo do estresse (Arai et al., 1997). Provavelmente, no tratamento A, caso as aves tivessem sido submetidas a uma temperatura ambiental mais elevada desde o primeiro dia, os efeitos teriam sido mais intensos conforme afirma Cheville (1978).
CONCLUSÕES
Com base nos resultados encontrados pode-se concluir que o estresse térmico ambiental afeta a maturação da bolsa cloacal, diminuindo o percentual de parênquima bursal. A hipotrofia da bolsa cloacal atribuída ao estresse térmico ambiental ocorre em função da intensificação da apoptose nas células linfóides.
Recebido para publicação em 11 de maio de 2002
Recebido para publicação, após modificações, em 28 de fevereiro de 2003
E-mail: ebg@nin.ufms.br
- ARAI, S.; KOWADA, T.; TAKEHAHANA, K. et al. Apoptosis in chicken bursa of Fabricius induced by X-irradiation. J. Vet. Med. Sci., v.58, p.1001-1006, 1997.
- ARENDS, M.J.; WYLLIE, H.A. Apoptosis: mechanisms and roles in pathology Int. Rev. Exp. Pathol., v.32, p.223-254, 1991.
- Avian Farms. Broiler Manual. 2000 Avian Farms, Georgia, http://www.avianfarms.com/
- BAUMEL, J.J.; KING, A.S.; BREAZILE, J.E. et al. Handbook of avian anatomy; nomina anatomica avium. 2.ed. Cambridge: Nuttal Ornithological Club, n.23, p.393-478, 1993.
- CHEVILLE, N.F. Environmental factors affecting the immune response of birds. (A Review). Avian Dis., v.23, p.308-314, 1978.
- CIFONE, M.G.; MIGLIORATI, G.; PARRONI, R. et al. Dexamethasone-induced thymocyte apoptosis: Apoptotic signal involves the sequential activation of phosphoisitide-specific phospholipase-C, acidic sphingomyelinase, and caspases. Blood, v.93, p.2282-2296, 1999.
- COHEN, J.J. Apoptosis. Immunol. Today, v.14, p.126-130, 1993.
- COLLINS, R.J.; HARMON, B.V.; COBÉ, G.C. et al. Intranucleosomal DNA cleavage should not be sole criterion for identifying apoptosis. Int. J. Rad. Biol.,v.61, p.451-453, 1992.
- COMPTON, M.M.; GIBBS, P.S.; JOHNSON, L.R. Glicocorticoid-mediated activation of DNA degradation in avian lymphocytes. Gen. Comp. Endocrinol., v.80, p.68-79, 1990.
- COTRAN, R.S. Patologia celular I: Lesão e morte da célula. In: COTRAN, R.S.; KUMAR, V.; COLLINS, T. Robbin´s, patologia estrutural e funcional 6.ed. Rio de Janeiro: Guanabara Koogan, 2000. p.1-26.
- DISTELHORST, C.W. Glicocorticoid-induced apoptosis. Adv. Pharmacol., v.41, p.247-270, 1997.
- GARVY, B.A.; KING, L.E.; TELFORD, W.G. et al. Chronic elevation of plasma corticosterone causes reductions in the number of cycling cells of the B lineage in murine bone marrow and induces apoptosis. Immunology, v.80, p.587-592, 1993.
- GLICK, B. Growth of the bursa of Fabricius and its relationship to the adrenal gland in White Pekin Duck, White Leghorn, outbred and inbred New Hampshire. Poult. Sci., v.39, p.30-139, 1960.
- GOLSTEIN, P.; OJCIUS, D.M.; YOUNG, D.E. Cell death mechanisms and the immune system. Immunol. Rev., v.121, p.29-65, 1991.
- GRUBER, J.; SGONE, R.; HU, Y.H. et al. Thymocyte apoptosis induced by elevated endogenous corticosterone levels. Europ. J. Immunol., v.24, p.1115-1121, 1994.
- GUIMARÃES, E.B. Histometria, índice apoptótico da bolsa cloacal e catabolismo de anticorpos em frangos de corte em ambiente de conforto e estresse térmico. 2001. 71f. Tese (Doutorado em Ciência Animal). Escola de Veterinária, Universidade Federal de Minas Gerais, Belo Horizonte, MG.
- HACKËR, G. The morphology of apoptosis. Cell Tissue Res., v.301, p.5-17, 2000.
- HERENDA, D.C.; FRANCO, D.A. Poultry disease and meat hygiene: a color atlas. Ames: Iowa State University, 1996. 337p.
- HIKCMAN, J.A.; BOYLE, C.C. Apoptosis and cytotoxins. Br. Med. Bull., v.52, p.632-643, 1997.
- HODGES, R.D. Histology of the bursa of Fabricius and the thymus. In: HODGES, R. D. The histology of the fowl. London: Academic Press, 1974. p.205-213.
- KERR, J.F.R.; WINTERFORD, C.M.; HARMON, B.V. Apoptosis. Its significance in cancer and cancer therapy. Cancer, v.73, p.2013-2026, 1994.
- KERR, J.F.R. Definition of apoptosis and overview of its incidence. In: LAVIN, M.; WATERS, D. Programmed cell death: the cellular and molecular biology of apoptosis. Chur: Harwood, 1993. p.1-18.
- MAJNO, G.; JORIS, I. Apoptosis, oncosis, and necrosis. An overview of cell death. Am. J. Pathol, v.146, p.3-15, 1995.
- MOTOYAMA, N.; WANG, F.; ROTH, K.A. et al. Massive cell death of immature hematopoietic cell and neurons in Bcl-x-deficient mice. Science, v.267, p.1506-1509, 1995.
- PROPHET, E.B.; MILLS, B.; ARRLINGTON, J.B. et al. (Ed.) Lab. Meth. Histotech. Armed Forces Institute of Pathology, Washington, D.C, 1992. p. 29-57.
- RACHID, M.A. Apoptose na depleção linfocitária induzida pela toxina t-2 na bolsa de Fabrico de frangos de corte. 2000. 30f. Dissertação (Mestrado). Escola de Veterinária, Universidade Federal de Minas Gerais, Belo Horizonte, MG.
- RAFF, M.C. Social controls on cell survival and cell death. Nature, v.356, p.397-400, 1992.
- REGNIER, J.A.; KELLEY, K.W. Acute thermal stressors and synthesis of antibodies in chickens. Poult. Sci., v.59, p. 985-990, 1980.
- RIDDELL, C. Avian histopathology. Pennsylvania: American Association of Avian Pathologists, 1987. p.8.
- ROSTAGNO, H.S.; BARBARINO Jr.; BARBOZA, W.A. Exigências nutricionais das aves determinadas no Brasil. In: SIMPÓSIO INTERNACIONAL SOBRE EXIGÊNCIAS NUTRICIONAIS DE AVES E SUÍNOS, Set., 1996, Viçosa. Anais... Viçosa, 1996.
- SAMPAIO, I.B.M. Estatística aplicada à experimentação animal. Belo Horizonte: Fundação de Ensino e Pesquisa em Medicina Veterinária e Zootecnia, 1998. 221p.
- SAS. STATISTICAL ANALYSIS SYSTEM. User´s guide statistics. 5.ed. Cary. SAS Institute Inc., 1985.
- THAXTON, P.; SADLER, C.R.; GLICK, B. Immune response of chickens following heat exposure or injections with ACTH. Poult. Sci., v.47, p.264-266, 1968.
- TIZZARD, I. Avian immune responses: a brief review. Avian Dis, v.23, p.290-298, 1979.
- VASCONCELOS, A.C.; MORO, L.; DA SILVA, P.M. Apoptose ou morte celular programada e sua importância em patologia veterinária. Rev. Port. Cienc. Vet., p.182-193, 1996.
- WYLLIE, A.H. The genetic regulation of apoptosis. Curr. Op. Gen. Develop., v.5, p.97-104, 1995.
- WYLLIE, A.H.; MORRIS, R.G.; SMITH, A.L. et al. Chromatin cleavage in apoptosis: association with condensed chromatin morphology and dependence on macromolecular synthesis. J. Pathol., v.142, p.67-77, 1984.
Datas de Publicação
-
Publicação nesta coleção
15 Jul 2003 -
Data do Fascículo
Abr 2003
Histórico
-
Recebido
11 Maio 2002 -
Aceito
28 Fev 2003