Resumos
Avaliaram-se os efeitos da vitrificação de ovócitos imaturos de bovinos utilizando o etilenoglicol (EG) associado à trehalose e à polivinilpirrolidona (PVP). Utilizaram-se ovócitos provenientes de ovários de vacas abatidas em matadouro, distribuídos aleatoriamente em três tratamentos (T). TI - ovócitos não desnudados e não congelados, TII - ovócitos vitrificados com cumulus oophorus e TIII - ovócitos desnudados vitrificados. A percentagem de ovócitos recuperados e ovócitos com morfologia normal após a vitrificação foi diferente entre TII e TIII (92,2 e 72,6%; 79,0 e 63,6%, respectivamente). Os ovócitos normais foram cultivados à 38,5ºC em atmosfera de 5% de CO2 por 24 horas. Após o cultivo, os ovócitos foram fecundados e os embriões cultivados in vitro por sete dias. Foram encontradas diferenças entre tratamentos quanto às taxas de maturação nuclear, fecundação e clivagem (83,9, 70,0 e 44,0%; 17,5, 23,7 e 5,1%; 0,0, 0,0 e 0,0% para os tratamentos I, II e III, respectivamente). Apenas no TI foram obtidas mórulas e blastocistos (21,4%). Os procedimentos de vitrificação, segundo os protocolos utilizados, não são indicados para a criopreservação de ovócitos imaturos de bovinos.
bovino; ovócito; vitrificação
This study aimed to evaluate the effects of vitrification procedure of immature bovine oocytes using ethylene glycol (EG) associated with trehalose and polivinylpyrrolidone on the percentage of recovered oocytes with normal morphology and nuclear maturation, fecundation and cleavage rates for in vitro cultivated embryos. Ovary oocytes of slaughtered cows were randomly allotted to three treatments (T): TI - oocytes neither undenuded nor vitrified, TII - vitrified oocytes with cumulus oophorus, TIII - undenuded vitrified oocytes. The percentage of recovered oocytes and oocytes with normal morphology after vitrification was different for TII and TIII (92.2 and 72.6%, 79.0 and 63.3% for TII and TIII, respectively). All normal oocytes were cultivated at 38.5ºC in atmosphere with 5% CO2 for 24 hours. After culture, the oocytes were fecundated and the embryos were cultivated in vitro for seven days. The nuclear maturation, fecundation and cleavage rates for TI, TII and TIII were different (83.9, 70.0 and 44.0%, 17.5, 23.7 and 5.1%, 0.0, 0.0 and 0.0% for TI, TII and TIII, respectively). Morulas and blastocysts were obtained only for TI (21.4%). These results indicate that the protocol used for vitrification procedure is not recommended for cryopreservation of immature bovine oocytes.
bovine; oocytes; vitrification
MEDICINA VETERINÁRIA
Vitrificação de ovócitos imaturos de bovinos utilizando etilenoglicol associado à trehalose e polivinilpirrolidona
Vitrification of immature bovine oocytes, by the ethylene glycol associated with trehalose and polivinylpyrrolidone
M.R. SouzaI; E.P. CostaII, * * Autor para correspondência E-mail: epcosta@ufv.br ; C.A.A. TorresIII; J.D. GuimarãesII; L.M. FagundesI
IEstudante de Mestrado - UFV
IIDepartamento de Veterinária da Universidade Federal de Viçosa Rua P.H. Rolfs, s/n 36571-000 - Viçosa, MG
IIIDepartamento de Zootecnia - UFV
RESUMO
Avaliaram-se os efeitos da vitrificação de ovócitos imaturos de bovinos utilizando o etilenoglicol (EG) associado à trehalose e à polivinilpirrolidona (PVP). Utilizaram-se ovócitos provenientes de ovários de vacas abatidas em matadouro, distribuídos aleatoriamente em três tratamentos (T). TI - ovócitos não desnudados e não congelados, TII - ovócitos vitrificados com cumulus oophorus e TIII - ovócitos desnudados vitrificados. A percentagem de ovócitos recuperados e ovócitos com morfologia normal após a vitrificação foi diferente entre TII e TIII (92,2 e 72,6%; 79,0 e 63,6%, respectivamente). Os ovócitos normais foram cultivados à 38,5ºC em atmosfera de 5% de CO2 por 24 horas. Após o cultivo, os ovócitos foram fecundados e os embriões cultivados in vitro por sete dias. Foram encontradas diferenças entre tratamentos quanto às taxas de maturação nuclear, fecundação e clivagem (83,9, 70,0 e 44,0%; 17,5, 23,7 e 5,1%; 0,0, 0,0 e 0,0% para os tratamentos I, II e III, respectivamente). Apenas no TI foram obtidas mórulas e blastocistos (21,4%). Os procedimentos de vitrificação, segundo os protocolos utilizados, não são indicados para a criopreservação de ovócitos imaturos de bovinos.
Palavras-chave: bovino, ovócito, vitrificação
ABSTRACT
This study aimed to evaluate the effects of vitrification procedure of immature bovine oocytes using ethylene glycol (EG) associated with trehalose and polivinylpyrrolidone on the percentage of recovered oocytes with normal morphology and nuclear maturation, fecundation and cleavage rates for in vitro cultivated embryos. Ovary oocytes of slaughtered cows were randomly allotted to three treatments (T): TI - oocytes neither undenuded nor vitrified, TII - vitrified oocytes with cumulus oophorus, TIII - undenuded vitrified oocytes. The percentage of recovered oocytes and oocytes with normal morphology after vitrification was different for TII and TIII (92.2 and 72.6%, 79.0 and 63.3% for TII and TIII, respectively). All normal oocytes were cultivated at 38.5ºC in atmosphere with 5% CO2 for 24 hours. After culture, the oocytes were fecundated and the embryos were cultivated in vitro for seven days. The nuclear maturation, fecundation and cleavage rates for TI, TII and TIII were different (83.9, 70.0 and 44.0%, 17.5, 23.7 and 5.1%, 0.0, 0.0 and 0.0% for TI, TII and TIII, respectively). Morulas and blastocysts were obtained only for TI (21.4%). These results indicate that the protocol used for vitrification procedure is not recommended for cryopreservation of immature bovine oocytes.
Keywords: bovine, oocytes, vitrification
INTRODUÇÃO
A produção de embriões de mamíferos domésticos é de grande importância para o melhoramento genético. As biotecnologias utilizadas com esse propósito incluem a maturação in vitro (MIV), fecundação in vitro (FIV) e o cultivo embrionário in vitro (CIV). Esses procedimentos podem gerar grande número de embriões, que seriam utilizados em clonagem, manipulação de genes e transferência de núcleos. A FIV destaca-se como instrumento para o aproveitamento do potencial reprodutivo de animais de alto valor genético, de fêmeas que não respondem aos tratamentos de superovulação e de fêmeas imaturas, idosas ou que apresentam infertilidade adquirida. O fator limitante à utilização da FIV é a necessidade de se ter um laboratório estruturado, próximo ao local de coleta dos ovócitos. Essa condição eleva os custos e dificulta sua aplicação.
O aproveitamento de gametas femininos pode ser otimizado pelo desenvolvimento de técnicas de criopreservação, as quais permitirão formar bancos de gametas femininos, que poderão ser utilizados a posteriori em pesquisas ou aplicações comerciais. A criopreservação de ovócitos também seria importante para a conservação de espécies raras ou em extinção.
Dentre os métodos de criopreservação de ovócitos, a vitrificação é a de uso mais recente. Esse método refere-se ao processo pelo qual uma solução concentrada de crioprotetores se solidifica durante o resfriamento, sem formar cristais (Rall et al., 1987). Sua grande vantagem é eliminar etapas laboriosas dos métodos convencionais.
Os melhores resultados da criopreservação têm sido obtidos com ovócitos previamente maturados (Wu et al., 1999). Entretanto, certas condições de resfriamento e exposição das células aos crioprotetores podem induzir à instabilidade dos fusos meióticos, provocando segregação anormal dos cromossomos na retomada da meiose com a fecundação, podendo causar anormalidades cromossômicas (Shaw et al., 2000). Vale ressaltar que a criopreservação de ovócitos imaturos é a que atinge plenamente os objetivos dessa técnica. A viabilidade desse procedimento no campo permite a congelação de ovócitos imaturos logo após a aspiração, evitando-se, assim, a manipulação e a maturação prévia em laboratório.
A presença ou não do cumulus oophorus durante a criopreservação de ovócitos tem sido bastante discutida. Alguns estudos demonstraram que a presença de células do cumulus oophorus reduziu o efeito tóxico do crioprotetor em ovócitos de camundongas (Johnson, Pickering, 1989), humanos (Fabbri et al., 1998) e bovinos (Im et al., 1997). Pellicer et al. (1988) relataram que, em camundongas, quanto mais camadas dessas células houver, maior a taxa de sobrevivência de ovócitos após a descongelação. Whittinghan (1977) não encontrou diferença na taxa de sobrevivência de ovócitos imaturos de hamster criopreservados com ou sem células do cumulus oophorus. Dhali et al. (2000a), Dhali et al. (2000b) e Vajta (2000) relataram que as camadas de células do cumulus oophorus poderiam reduzir a velocidade de passagem dos crioprotetores, acarretando inadequadas desidratação e reidratação.
Alguns autores (Fabbri et al., 1998; Otoi et al., 1998) desnudaram parcialmente os ovócitos antes da vitrificação para facilitar a passagem dos crioprotetores, ou para facilitar a avaliação do citoplasma (Chung et al., 2000). No entanto, Vajta (2000) comentou que é muito difícil realizar, uniformemente, a remoção parcial das células do cumulus oophorus em um grupo de ovócitos, podendo resultar em penetração desigual do crioprotetor. Além disso, o uso de enzimas para o desnudamento pode comprometer a viabilidade dos ovócitos (Costa, 1994).
Os objetivos deste trabalho foram avaliar os efeitos da vitrificação, utilizando-se como crioprotetores o etilenoglicol (EG) associado à trehalose e à polivinilpirrolidona (PVP), sobre a capacidade de desenvolvimento in vitro de ovócito imaturo de bovino, e verificar a interferência do cumulus oophorus na congelabilidade e subseqüente MIV e FIV de ovócitos e no desenvolvimento inicial do zigoto.
MATERIAL E MÉTODOS
Foram utilizados ovários de vacas abatidas em matadouro distante 60 quilômetros do laboratório de manipulação. Imediatamente após o abate e evisceração, os ovários removidos e imersos em solução fisiológica entre 35-37ºC, acrescida de penicilina e estreptomicina (Sirard, Bilodeau, 1990), foram transportados para o laboratório em tempo máximo de três horas e submetidos à aspiração, manipulação e classificação segundo Costa (1994). Selecionados os ovócitos que apresentaram cumulus oophorus compactos (COC), eles foram divididos aleatoriamente em três tratamentos.
O tratamento I (TI) constituiu-se de 505 ovócitos com COC não congelados (frescos) submetidos aos processos de MIV, FIV e CIV a serem descritos.
O tratamento II (TII) constituiu-se de 412 ovócitos criopreservados com as células do cumulus oophorus pelo método de vitrificação. A vitrificação foi realizada conforme protocolo utilizado em zigotos por Saha et al. (1996), utilizando-se três etapas (banhos) para a desidratação. As duas primeiras etapas tiveram duração de cinco minutos cada, com as soluções em temperatura ambiente, enquanto que a última etapa, que correspondia à solução de vitrificação (SV), durou apenas um minuto à temperatura de 4ºC. O pH de todas as soluções das referidas etapas foi ajustado para 7,30-7,35. Na primeira etapa foi utilizada uma solução contendo 10% de etilenoglicol (EG), na segunda 10% de EG + 0,3 mol L-1 de trehalose e na terceira 40% de EG + 0,3 mol L-1 de trehalose + 20% de polivinilpirrolidona (PVP). Antes de completar o tempo da terceira etapa, os COC foram envasados em grupos de 20 a 30 em palhetas de 0,25ml, as quais foram fechadas e mergulhadas em nitrogênio líquido mantido em caixa de isopor. O tempo decorrido entre a exposição à terceira solução e o mergulho em nitrogênio líquido foi de um minuto.
O tratamento III (TIII) constituiu-se de 404 ovócitos desnudados segundo Costa (1994) e posteriormente desidratados e vitrificados de maneira idêntica ao tratamento II.
Os ovócitos dos tratamentos II e III foram desvitrificados pela imersão da palheta em banho-maria à 30ºC por 20 segundos, e a reidratação em temperatura ambiente, em apenas um banho. A solução de reidratação foi composta de 20% EG mais 0,3 mol L-1 de trehalose e 10% e PVP, cujo pH foi previamente ajustado para 7,30-7,35. Os ovócitos aí permaneceram por seis minutos. Posteriormente, eles foram lavados quatro vezes em meio Talp-Hepes e avaliados morfologicamente. Após esses procedimentos, os ovócitos considerados normais foram submetidos a MIV, FIV e CIV.
Foram considerados normais os ovócitos que apresentaram forma esférica e simétrica sem degeneração aparente. Os considerados anormais foram aqueles que apresentaram perda de conteúdo celular, citoplasma vacuolizado, retraído e fragmentado.
A MIV foi feita em meio TCM segundo Costa (1994), em cultivo por 24 horas. Apenas os ovócitos do tratamento III (desnudados) foram maturados com células da granulosa em suspensão, na quantidade de dois milhões por mililitro.
A fecundação in vitro foi realizada segundo Costa (1994), utilizando sêmen bovino congelado em palhetas médias. Os meios de manipulação e incubação do sêmen e o de fecundação foram o Sp-Tl e Fert-Talp, respectivamente (Parrish et al., 1988, modificado segundo Costa, 1994).
Para avaliação da taxa de maturação e de fecundação os ovócitos foram submetidos aos procedimentos recomendados por Costa (1994). Foram considerados fecundados os ovócitos que apresentaram os dois pronúcleos, com presença ou não da cauda do espermatozóide.
Após a incubação com o sêmen, os ovócitos foram cultivados durante sete dias em gotas com 50µl de meio TCM 199 acrescido de 10% de soro de vaca em diestro. Apenas os ovócitos do tratamento III foram cultivados com células da granulosa em suspensão. O meio foi renovado a cada 48 horas. A taxa de clivagem foi avaliada no segundo dia de cultivo. As taxas de mórula e de blastocisto foram verificadas no sétimo dia de cultivo.
Os dados foram agrupados em tabelas de contingência e analisados pelo teste do qui-quadrado (?2) (Gomes, 1981).
RESULTADOS E DISCUSSÃO
Houve diferença (P<0,01) entre os tratamentos II e III quanto à percentagem de ovócitos recuperados, 92,2 e 79,0%, respectivamente.
A taxa de recuperação do TII foi semelhante à obtida por vários pesquisadores com ovócitos congelados de búfalas (Dhali et al., 2000a; Dhali et al., 2000b), de vacas (Lim et al., 1999) e de camundongas (Miyake et al., 1993).
Poucos estudos foram realizados com a criopreservação de ovócitos bovinos desnudados, e entre eles, poucos relataram a taxa de recuperação. Bem et al. (1993) obtiveram 94,1% de taxa de recuperação de ovócitos imaturos desnudados de bovino, valor superior ao obtido neste experimento. Esses autores usaram o método clássico, o qual provavelmente pode ter reduzido os danos causados nos ovócitos.
A taxa de recuperação dos ovócitos parece não ser afetada pelo tipo de crioprotetor, pela espécie animal e pelo método de criopreservação. As perdas dos ovócitos podem ser atribuídas à sua manipulação durante os procedimentos de desvitrificação e reidratação, sendo mais intensa no TIII devido à maior dificuldade de visualização dos ovócitos desnudados.
A percentagem de ovócitos com morfologia normal foi diferente (P<0,05) entre TII (72,6%) e TIII (63,6%), atribuindo-se ao etilenoglicol, de baixo peso molecular e alta permeabilidade, o efeito de diminuir a ocorrência de injúrias celulares. Segundo Lim et al. (1999), o tipo de crioprotetor pode afetar a morfologia dos ovócitos bovinos, ou seja, quanto mais permeável for melhor serão os resultados.
Neste experimento, a menor percentagem de ovócitos desnudados com morfologia normal pode ser atribuída aos banhos de desidratação. Eles foram submetidos às mesmas condições das etapas de desidratação do TII, porém com suas células do cumulus oophorus, as quais possibilitaram trânsito menos drástico do crioprotetor. Isto sugere que os ovócitos desnudados necessitam de tempo de desidratação diferenciado dos COC. Assim, o tipo de crioprotetor e o tempo de desidratação devem ser distintos quanto à presença ou não de células do cumulus oophorus. No presente estudo, essas células foram importantes para a manutenção da morfologia normal dos ovócitos, resultando em melhores resultados.
As anormalidades morfológicas encontradas nos ovócitos dos tratamentos de vitrificação são apresentadas na Tab. 1. O número de ovócitos com anormalidades morfológicas foi diferente (P<0,05) apenas em relação ao citoplasma vacuolizado.
Alguns trabalhos (Dias et al., 1999; Dhali et al., 2000a; Dhali et al., 2000b) relataram que a principal anormalidade que acomete os ovócitos criopreservados é o rompimento de zona pelúcida. Neste experimento, o rompimento de zona pelúcida estava associado aos ovócitos que apresentaram perda de material citoplasmático, visto que não é possível a perda de material sem o rompimento prévio da zona pelúcida. Nesse sentido, os resultados obtidos diferiram dos encontrados pelos autores citados. Alguns trabalhos (Dhali et al., 2000a; Dhali et al., 2000b) classificaram a perda de conteúdo celular e o rompimento de zona pelúcida como anormalidades distintas. O presente experimento indicou que elas não são distintas.
Poucos são os trabalhos que classificam as anormalidades morfológicas. A maioria dos pesquisadores tem enquadrado as anormalidades em um único grupo. Como observado neste estudo, a classificação das anormalidades pode ser de grande valia, por auxiliar na interpretação das possíveis causas de injúrias. Desse modo, o adequado critério de classificação torna-se imprescindível para as correções ou ajustes das possíveis causas do alto percentual de anormalidades encontradas na criopreservação de ovócitos bovinos.
Os números e a percentagem de ovócitos que alcançaram metáfase I e metáfase II, segundo os tratamentos, são apresentados na Tab. 2. A vitrificação provocou efeitos deletérios sobre os ovócitos, impedindo o desenvolvimento para metáfase I e metáfase II. Foi encontrada diferença (P<0,05) entre os tratamentos com ovócitos vitrificados e o tratamento-controle e entre os ovócitos dos dois tratamentos de vitrificação.
A taxa de MIV do tratamento-controle (configuração cromossômica em MII; Fig.1), foi 83,9%, semelhante à obtida por Dhali et al. (2000a), Dhali et al. (2000b) e Yang et al. (2000), os quais encontraram taxa de maturação de 67, 67 e 87%, respectivamente. As diferenças podem ser atribuídas, provavelmente, às particularidades dos meios de maturação ou à qualidade geral dos ovócitos obtidos em função da época de coleta (Farin et al., 2001). Assim, os resultados obtidos demonstram que os procedimentos e meios adotados para a MIV dos ovócitos foram adequados.
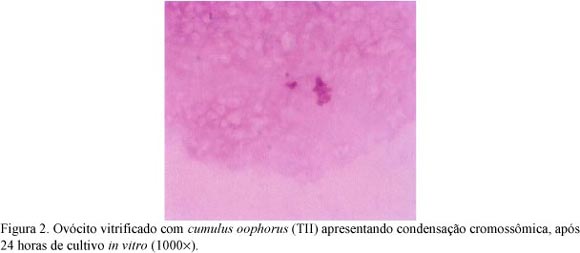
Nas lâminas de maturação referentes aos ovócitos vitrificados com cumulus oophorus foi observado que a maior parte que não evoluiu para as metáfases I (5,3%) ou II (17,5%) apresentou cromossomos organizados em forma de grumos, ou seja, condensados (Fig. 2 e 3). A condensação da cromatina pode ter ocorrido por duas causas prováveis. A primeira é a de que os ovócitos vitrificados (TII) podem ter reiniciado a maturação, que não se completou. Segundo Suss et al. (1988), a condensação aumenta com o tempo de cultivo, permanecendo até 13 horas. Kastrop et al. (1990) demonstraram que os eventos iniciais de condensação de cromatina e quebra da vesícula germinativa são precedidos pela fosforilação de proteínas, e qualquer fator que prejudique esses mecanismos pode alterar o processo de quebra da vesícula germinal e retomada da meiose. Wu et al. (1999) sugeriram que a criopreservação pode alterar de forma significativa a atividade dos fatores reguladores da meiose, inibindo totalmente ou parcialmente a maturação.
A segunda causa de condensação de cromatina, de acordo com Betts e King (2001) e Farin et al. (2001), caracteriza um dos primeiros eventos do processo de morte celular. Ele provavelmente ocorre também em ovócitos degenerados. Entretanto, não é possível definir com exatidão se a condensação da cromatina encontrada nos ovócitos do TII é devida ao reinício da meiose ou à degeneração antes mesmo da retomada da meiose, visto que as lâminas analisadas foram confeccionadas após 24 horas de maturação. Nesse tempo, alguns ovócitos podem ter reiniciado a meiose e se degenerado logo em seguida, enquanto que outros podem nem mesmo ter reiniciado a meiose, mas apresentaram condensação da cromatina.
Nenhum ovócito do TIII (0,0%) apresentou configuração cromossômica de metáfase I e II (Fig. 4). Ao contrário, Bem et al. (1993) e Im et al. (1997) criopreservaram ovócitos imaturos desnudados de bovinos pelo método clássico e obtiveram taxas de maturação de 53,0, 43,5 e 30,0%, respectivamente. Portanto, pode-se inferir que o método clássico é mais eficiente do que a vitrificação para ovócitos desnudados de bovinos. As elevadas diferenças osmóticas às quais os ovócitos foram submetidos podem ter acarretado desarranjo total do citoplasma, visto que nada foi observado na avaliação das lâminas de maturação.
A taxa de fecundação foi diferente (P<0,01) entre os tratamentos, sendo de 70,0, 23,7 e 0,0% para TI, TII e TIII, respectivamente. O resultado de TII foi inferior aos 38,3 e 47,5% encontrados por Hochi et al. (1998) e Le Gal e Massip (1999), respectivamente. Hochi et al. (1998) utilizaram concentrações de crioprotetores similares às do presente experimento e comentaram que a alta taxa de fecundação pode ser atribuída às etapas de exposição aos crioprotetores, pois utilizaram duas etapas de desidratação de 10 e um minuto, respectivamente, ambas em temperatura ambiente. No presente estudo a última etapa também durou um minuto, no entanto, a temperatura foi de 4ºC, o que pode ter comprometido a fecundação.
O número e a percentagem de ovócitos que clivaram e alcançaram estádio de mórula e blastocisto estão na Tab. 3. Os procedimentos de vitrificação provocaram efeitos adversos, evitando a clivagem e, conseqüentemente, o desenvolvimento até estádios de mórula e blastocisto. Houve diferença (P< 0,05) entre os tratamentos quanto à clivagem.
Os ovócitos não vitrificados desenvolveram-se até os estádios de mórula e blastocisto, em taxas satisfatórias (21,4% do total de clivados), demonstrando que os procedimentos e meios adotados para FIV e CIV foram adequados.
Apenas cinco ovócitos (5,1%) no TII clivaram. Este resultado sugere que, embora tenha ocorrido 17,5% de maturação nuclear, os procedimentos de vitrificação provocaram outras alterações que comprometeram, de alguma forma, a integridade celular, provavelmente interferindo na maturação citoplasmática. Acredita- se que essa alteração seja nos grânulos corticais, pois eles são de fundamental importância na fecundação normal. Dias et al. (1999) verificaram que a vitrificação provoca migração prematura dos grânulos corticais durante a MIV, caracterizando deficiência na maturação citoplasmática dos ovócitos. Essa migração prematura levaria ao endurecimento também prematuro da zona pelúcida (Vicent et al., 1990) e, conseqüentemente, redução da taxa de fecundação.
Martino et al. (1996) observaram que o menor tempo de exposição dos ovócitos à solução de vitrificação melhorou a taxa de clivagem e, conseqüentemente, a produção de blastocisto. No presente estudo os ovócitos foram expostos à solução de vitrificação durante um minuto, tempo talvez inadequado dada à elevada osmolaridade da solução.
Além do período de exposição de um minuto, o procedimento foi realizado à temperatura de 4ºC. Martino et al. (1995) relataram que ovócitos imaturos de bovinos foram prejudicados quando resfriados à 0ºC durante 30 segundos. Segundo esses pesquisadores, os ovócitos resfriados maturaram e foram fecundados, entretanto, seu subseqüente desenvolvimento foi totalmente comprometido. Dessa maneira, a temperatura da solução de vitrificação usada no presente experimento pode ter prejudicado o desenvolvimento após a fecundação.
CONCLUSÕES
A associação do etilenoglicol, trehalose e polivinilpirrolidona da maneira como foi adotada neste experimento não foi eficaz para a vitrificação de ovócitos bovinos imaturos com cumulus oophorus ou desnudados. Não existe relação entre a aparência morfológica do ovócito criopreservado e sua capacidade de maturar in vitro, indicando que a avaliação morfológica não pode ser utilizada como critério definitivo. Ovócitos vitrificados exibem expansão das células do cumulus oophorus sem maturação nuclear, evidenciando que essa característica não é uma boa indicação morfológica da maturação in vitro, tal como ocorre com ovócitos frescos.
Apoio financeiro da FAPEMIG
Recebido para publicação em 20 de fevereiro de 2002
Recebido para publicação, após modificações, em 14 de maio de 2003
- BAVISTER, B.D.; LEIBFRIED, M.L.; LIEBERMAN, G. Development of preimplantation embryos of the Golden hamster in a defined culture medium. Biol. Reprod., v.28, p.235-247, 1983.
- BEM, A.R.; FREITAS, V.C.; SOUSA, R.V. et al. Cryopreservation of immature of oocyte bovine using 1,2 propanediol and glycerol as cryoprotector. In: RÉUNION ASSOCIATION EUROPEENNE DE TRANSFERT EMBRYONNAIRE, 9, 1993, Lyon. Anais..., Lyon, 1993. p.184.
- BETTS, D.H.; KING, W.A. Genetic regulation of embryo death and senescence. Theriogenology, v.55, p.171-191, 2001.
- CHUNG, H.M.; HONG, S.W.; LIM, J.M. et al. In vitro blastocyst formation of human oocytes obtained from unstimulated and stimulated cycles after vitrification at various maturational stages. Fertil. Steril., v.73, p.545-551, 2000.
- COSTA, E.P. Aspectos morfológicos (citológicos e ultra-estruturais) e desenvolvimento de ovócitos de bovinos in vitro. 1994. 155p. Tese (Doutorado em Ciência Animal). Escola de Veterinária, Universidade Federal de Minas Gerais, Belo Horizonte, MG.
- DHALI, A.; MANIK, R.S.; DAS, S.K. et al. Post-vitrification survival and in vitro maturation rate of buffalo (Bubalus bubalis) oocytes: effect of ethylene glycol concentration and exposure time. Anim. Reprod. Sci., v.63, p.159-165, 2000b.
- DHALI, A.; MANIK, R.S.; DAS, S.K. et al. Vitrification of buffalo (Bubalus bubalis) oocytes. Theriogenology, v.53, p.1295-1303, 2000a.
- DIAS, A.J.B.; BENCHIMOL, M.; FONTES, R.S. Avaliação ultraestrutural de ovócitos bovinos vitrificados. Rev. Bras. Reprod. Anim., v.23, p.259-261, 1999.
- FABBRI, R.; PORCUS, E.; MARSELLA, T. et al. Oocyte cryopreservation. Hum. Reprod., v.13, p.98-108, 1998.
- FARIN, P.W.; CROSIRE, A.E.; FARIN, C.E. Influence of in vitro systems on embryo survival and fetal development in cattle. Theriogenology, v.55, p.151-170, 2001.
- GOMES, F.P. Curso de estatística experimental 9.ed. Piracicaba: ESALQ-USP, 1981. 430p.
- HOCHI, S.; ITO, K.; HIRABAYASHI, M. et al. Effect of nuclear stages during ivm on the survival of vitrified-warmed bovine oocytes. Theriogenology, v.49, p.787-796, 1998.
- IM, K.S.; KANG, J.K.; KIM, H.S. Effects of cumulus cells, different cryoprotectants, various maturation stages and preincubation before insemination on developmental capacity of frozen-thawed bovine oocytes. Theriogenology, v.47, p.881-891, 1997.
- JOHNSON, M.H.; PICKERING, S.J. The effect of dimethyl sulfoxide on the microtubular system of the mouse oocytes. Development, v.100, p.313-324, 1989.
- KASTROP, P.M.; BEVERS, M.M.; DESTREE, O.H.J. Changes in protein synthesis and phosphorylation patterns during bovine oocyte maturation. J. Reprod. Fertil., v.90, p.305-310, 1990.
- LIM, J.M.; KO, J.J.; HWANG, W.S.; CHUNG, H.M. et al. Development of in vitro matured bovine oocytes after cryopreservation with different cryoprotectants. Theriogenology, v.51, p.1303-1310, 1999.
- MARTINO, A.; POLLARD, J.W.; NAKAGATA, A. et al. The kinetics of chilling sensitivity of bovine oocytes cooled to non-physiological temperatures. Theriogenology, v.43, p.272, 1995.
- MARTINO, A.; SONGSASEN, N.; LEIBO, S.P. Development into blastocysts of bovine oocytes cryopreserved by ultra-rapid cooling. Biol. Reprod., v.54, p.1059-1069, 1996.
- MIYAKE, T.; KASAI, M.; ZHU, S.E. et al. Vitrification of mouse oocytes and embryos at various stages of development in an ethylene glycol-based solution by a simple method. Theriogenology, v.40, p.121-134, 1993.
- NAKAGATA, N. High survival rate of unfertilized mouse oocytes after vitrification. J. Reprod. Fertil., v.87, p.479-483, 1989.
- OTOI, T.; YAMAMOTO, K.; KOYAMA, N. et al. Cryopreservation of mature bovine oocytes by vitrification in straws. Cryobiology, v.37, p.77-85, 1998.
- PARRISH, J.J.; SUSKO-PARRISH, J.; WINER, M.A. et al. Capacitation on bovine sperm by heparin. Biol. Reprod., v.38, p.1171-1180, 1988.
- PELLICER, A.; LIGHTMAN, A.; PARMER, A. et al. Morphologic and function studies of immature rat oocyte-cumulus complexes after cryopreservation. Fertil. Steril., v.50, p.805-810, 1988.
- RAFFETY, K.A. Methods in experimental embryology of the mouse Baltimore: Johns Hopkins, 1980.
- RALL, W.F.; WOOD, M.G.; KIRBY, C. et al. Development of mouse embryos cryopreserved by vitrification. J. Reprod. Fertil., v.80, p.499-504, 1987.
- SAHA, S.; RAJAMAHENDRAN, R.; BOEDIONO, A. et al. Viability of bovine blastocysts obtained after 7, 8, or 9 days of culture in vitro following vitrification and one-step rehydratation. Theriogenology, v.46, p.331-343, 1996.
- SHAW, J.M.; ORANRATNACHAI, A.; TROUNSON, A.O. Fundamental cryobiology of mammalian oocytes and ovarian tissue. Theriogenology, v.53, p.59-72, 2000.
- SIRARD, M.A.; BILODEAU, S. Granulosa cells inhibit the resumption of meiosis in bovine oocytes in vitro Biol. Reprod., v.43, p.777-783, 1990.
- SUSS, U.; WUTHRICH, K.; STRANZINGER, G. Chromosome configurations and time sequence of the first meiotic division in bovine oocytes matured in vitro Biol. Reprod., v.38, p.871-880, 1988.
- VAJTA, G. Criopreservação de ovócitos e embriões produzidos in vitro Arq. Fac. Vet. UFRS, v.25, p.85-93, 2000.
- VICENT, C.; PICKERING, S.J.; JOHNSON, M.H. The hardening effect of dimethyl sulphoxide on the mouse zona pellucida requires the presence of an oocyte and in associated with a reduction in the number of cortical granules present. J. Reprod. Fertil., v.89, p.253-259, 1990.
- WHITTINGHAN, D.G. Fertilization in vitro and development to term of unfertilized mouse oocytes previously stored at -196ºC. J. Reprod. Fertil., v.49, p.89-94, 1977.
- WU, B.; IGNOTZ, G.; CURRIE, W.B. Effects of cooling germinal vesicle-stage bovine oocytes on meiotic spindle formation following in vitro maturation. Mol. Reprod. Develop., v.54, p.388-395, 1999.
- YANG, B.C.; YANG, B.S.; SEONG, H.H. et al. Effects of vitrification methods and polyvinylpyrrolidone supplementation on the viability of immature bovine oocytes. Theriogenology, v.53, p.266, 2000.
Datas de Publicação
-
Publicação nesta coleção
13 Jan 2004 -
Data do Fascículo
Out 2003
Histórico
-
Revisado
14 Maio 2003 -
Recebido
20 Fev 2002