Resumos
Avaliaram-se as alterações cardiorrespiratórias e a analgesia da administração epidural de clonidina ou romifidina em cães submetidos à cirurgia coxofemural. Foram utilizados 14 cães distribuídos em dois grupos: o grupo Cloni recebeu 150µg de clonidina e o grupo Romi, 20µg/kg de romifidina. A indução anestésica foi realizada com propofol e a anestesia cirúrgica mantida com halotano e O2 em respiração espontânea. A punção do espaço epidural foi feita logo após a indução. Antes da indução e a cada 10 minutos foram avaliadas as freqüências cardíaca e respiratória, a pressão arterial sistólica, a saturação de oxigênio da hemoglobina e a concentração de halotano. Após indução e ao término do procedimento cirúrgico coletou-se sangue arterial para avaliação gasométrica de pH, PaCO2, PaO2, SaO2, BE e HCO3-. Foi realizada avaliação pós-operatória do grau de analgesia (intensa, pouco intensa e inadequada) nas primeiras duas horas após término da cirurgia. Os animais do grupo Romi apresentaram bradicardia, bradiarritmias e hipertensão. A freqüência cardíaca e a pressão arterial sistólica no grupo Cloni mantiveram-se dentro da faixa de variação fisiológica para a espécie. A analgesia trans-operatória foi considerada intensa nos dois grupos. A administração epidural de clonidina ou romifidina produziu intensa analgesia transcirúrgica sem depressão respiratória e pouco intensa analgesia pós-operatória por duas horas
cão; epidural; clonidina; romifidina
Cardiovascular alterations and analgesia in 14 dogs submitted to epidural administration of clonidine or romifidine to enable coxofemoral surgery were evaluated. Dogs were separated in two groups: Cloni group received 150µg of clonidine and Romi group, 20µg/kg of romifidine. Anesthetic induction was performed using propofol (8mg/kg) and maintenance using halothane and O2 in spontaneous breathing. The puncture of epidural space was performed just after anesthetic induction. Heart rate and respiratory rate, systolic arterial rate, hemoglobin oxygen saturation and halothane concentration were assessed before anesthetic induction, and at each 10 minutes until the end of the surgery. Samples of arterial blood were collected after anesthesic induction and at the end of the surgical procedure in order to assess pH, PaCO2, PaO2, SaO2, BE and HCO3- levels. The analgesia degree (intense, middle or inadequated) was evaluated for two postoperative hours. Numerical data were analysed with ANOVA and Bonferroni's test (P< 0.05). Dogs of Romi group had bradycardia, bradyarrhrytmia, and hypertension. The heart rate and systolic arterial pressure in the Cloni group were within the physiologic variation parameter to dogs. In conclusion epidural administration of clonidine or romifidine produce intense intraoperative analgesia, with no respiratory depression, and middle analgesia for two postoperative hours. Bradycardia and hypotension were not observed with epidural clonidine, however, bradyarrhytmia and hypertension ocurred with epidural romifidine.
dog; epidural; clonidine; romifidine
MEDICINA VETERINÁRIA
Analgesia epidural com clonidina ou romifidina em cães submetidos à cirurgia coxofemoral
Epidural analgesia with clonidine or romifidine in dogs submitted to coxofemoral surgery
J.T. BrondaniI* * Endereço para correspondência Rua Sólon Enéas Flores, 05 Bairro Nossa Senhora de Lourdes 97060-530 Santa Maria, RS E-mail: jtbrondani@yaho.com ; C.C. NataliniII; A.G. RaiserI; A. MazzantiI; L. PratiIII
IUniversidade Federal de Santa Maria Santa Maria, RS
IILouisiana State University
IIIUniversidade da Região da Campanha Campus Alegrete Alegrete, RS
RESUMO
Avaliaram-se as alterações cardiorrespiratórias e a analgesia da administração epidural de clonidina ou romifidina em cães submetidos à cirurgia coxofemural. Foram utilizados 14 cães distribuídos em dois grupos: o grupo Cloni recebeu 150µg de clonidina e o grupo Romi, 20µg/kg de romifidina. A indução anestésica foi realizada com propofol e a anestesia cirúrgica mantida com halotano e O2 em respiração espontânea. A punção do espaço epidural foi feita logo após a indução. Antes da indução e a cada 10 minutos foram avaliadas as freqüências cardíaca e respiratória, a pressão arterial sistólica, a saturação de oxigênio da hemoglobina e a concentração de halotano. Após indução e ao término do procedimento cirúrgico coletou-se sangue arterial para avaliação gasométrica de pH, PaCO2, PaO2, SaO2, BE e HCO3-. Foi realizada avaliação pós-operatória do grau de analgesia (intensa, pouco intensa e inadequada) nas primeiras duas horas após término da cirurgia. Os animais do grupo Romi apresentaram bradicardia, bradiarritmias e hipertensão. A freqüência cardíaca e a pressão arterial sistólica no grupo Cloni mantiveram-se dentro da faixa de variação fisiológica para a espécie. A analgesia trans-operatória foi considerada intensa nos dois grupos. A administração epidural de clonidina ou romifidina produziu intensa analgesia transcirúrgica sem depressão respiratória e pouco intensa analgesia pós-operatória por duas horas
Palavraschave: cão, epidural, clonidina, romifidina
ABSTRACT
Cardiovascular alterations and analgesia in 14 dogs submitted to epidural administration of clonidine or romifidine to enable coxofemoral surgery were evaluated. Dogs were separated in two groups: Cloni group received 150µg of clonidine and Romi group, 20µg/kg of romifidine. Anesthetic induction was performed using propofol (8mg/kg) and maintenance using halothane and O2 in spontaneous breathing. The puncture of epidural space was performed just after anesthetic induction. Heart rate and respiratory rate, systolic arterial rate, hemoglobin oxygen saturation and halothane concentration were assessed before anesthetic induction, and at each 10 minutes until the end of the surgery. Samples of arterial blood were collected after anesthesic induction and at the end of the surgical procedure in order to assess pH, PaCO2, PaO2, SaO2, BE and HCO3- levels. The analgesia degree (intense, middle or inadequated) was evaluated for two postoperative hours. Numerical data were analysed with ANOVA and Bonferroni's test (P< 0.05). Dogs of Romi group had bradycardia, bradyarrhrytmia, and hypertension. The heart rate and systolic arterial pressure in the Cloni group were within the physiologic variation parameter to dogs. In conclusion epidural administration of clonidine or romifidine produce intense intraoperative analgesia, with no respiratory depression, and middle analgesia for two postoperative hours. Bradycardia and hypotension were not observed with epidural clonidine, however, bradyarrhytmia and hypertension ocurred with epidural romifidine.
Keywords: dog, epidural, clonidine, romifidine
INTRODUÇÃO
Os agonistas a2 adrenérgicos, por apresentarem propriedade analgésica, são alternativas ao uso dos opióides, via epidural. Eles estão sendo utilizados na clínica humana, principalmente em casos de dor neuropática e em pacientes com dores resistentes aos opióides. Ausência de depressão respiratória, prurido, vômito e dependência são outras vantagens que apresentam em relação aos opióides (Eisenach et al., 1995).
A clonidina é um agonista a2 parcial adrenérgico de alta seletividade para interação com receptores a2:a1 de 300:1 (Tong, Eisenach, 1994). A ação analgésica da clonidina pela via epidural vem sendo comprovada em humanos. Bonnet et al. (1989) e Eisenach et al. (1993) observaram que a clonidina produz analgesia mediante ação em um sítio espinhal, sem induzir depressão respiratória, náusea ou vômito, contudo, produz hipotensão e bradicardia.
Segundo Eisenach et al. (1987), a administração epidural de clonidina em ovelhas produz intensa analgesia, atribuída a um mecanismo de ação local, não produzindo hipotensão ou bradicardia e alteração na análise de gases sangüíneos. Em cães, Ghignone et al. (1987) utilizaram clonidina pela via epidural e observaram analgesia com alterações hemodinâmicas mínimas.
A romifidina é um agonista a2 desenvolvido a partir da clonidina (England et al., 1996). Utilizada na clínica e na anestesia de eqüinos (Pypendop, Verstegen, 2001), apresenta seletividade para receptores a2:a1 de 200:1 (Muir, 2000). A romifidina tem sido estudada para uso em pequenos animais, pelas vias intravenosa e intramuscular (England et al., 1996; Pypendop, Verstegen , 2001). A literatura consultada não relata o uso de romifidina em cães, pela via epidural.
Este estudo visou comparar as alterações cardiorrespiratórias e a analgesia trans e pós-operatória após a administração epidural de clonidina ou romifidina em cães.
MATERIAL E MÉTODOS
Foram utilizados 14 cães adultos, sete fêmeas e sete machos, sem raça definida, com peso médio de 11,6±4,55kg, provenientes do Biotério Central da UFSM e considerados hígidos após exame clínico. Os animais foram submetidos a jejum alimentar nas 12 horas que antecederam à anestesia e ao procedimento cirúrgico.
Os cães foram distribuídos aleatoriamente em dois grupos de sete animais. Os do grupo Cloni receberam 150µg de clonidina1 1 Clonidin Cloridrato de Clonidina Solução injetável (150mcg/ml) Cristália Produtos Químicos Farmacêuticos Ltda. Itapira, SP. e os do grupo Romi, romifidina2 2 Sedivet Romifidina Frasco/ampola (10mg/ml) Boehringer De Angeli Química e Farmacêutica Ltda. Divisão Vetmédica Itapecerica da Serra, SP. , na dose de 20µg/kg , ambos pela via epidural.
A veia cefálica foi canulada com cateter nº20 para a administração dos agentes anestésicos em solução fisiológica 0,9% (10ml/kg/h) e ampicilina sódica3 3 Ampicilina Sódica Frasco/ampola (1g) Instituto Biochimico Ltda. Rio de Janeiro, RJ. (20mg/kg). A indução anestésica foi realizada com propofol4 4 Propovan Propofol Frasco/ampola (10mg/ml) Cristália Produtos Químicos Farmacêuticos Ltda. - Itapira, SP. (8mg/kg) pela injeção intravenosa, em "bolus". Após perda do reflexo laringo-traqueal os animais foram intubados e mantidos sob anestesia geral com halotano, em sistema semi-fechado.
Aproximadamente 10 minutos após a indução, eles foram posicionados em decúbito lateral ou esternal, com os membros posteriores tracionados cranialmente, para a realização da antissepsia da região lombo-sacra com povidine degermante e álcool. Após a localização do espaço epidural com agulha espinhal (22G/1,5), administrou-se romifidina na dose de 20µg/kg em solução fisiológica 0,9%, correspondente a 1ml/5kg, ou clonidina na dose única de 150µg em solução fisiológica 0,9%, correspondente a 1ml/5kg. Para comprovar a presença da agulha no espaço epidural usou-se o teste da perda da resistência.
O procedimento cirúrgico iniciou-se, aproximadamente, 15 minutos após administração epidural do fármaco analgésico. Todos os animais foram submetidos à cirurgia de redução de luxação coxofemoral.
Foram avaliadas as freqüências cardíaca (FC-oxímetro de pulso5 5 Pulse Oximeter Nellcor Model M-200-13 - USA e/ou auscultação esofágica) e respiratória (FR-auscultação esofágica e movimento do balão reservatório), pressão arterial sistólica não invasiva (PAS) com Doppler ultra-sônico6 6 Pocket Doppler Model 841 A Parks Medical Electronics , saturação de oxigênio da hemoglobina (oxímetro de pulso) e concentração de halotano7 7 Vaporizador Calibrado Halothane HB 4.2 . Durante o procedimento os animais foram monitorados com eletrocardiograma8 8 Monitor Multiparamétrico Configurado TEB MPC 10. . As variáveis foram mensuradas 10 minutos antes da indução (valores iniciais) e a cada 10 minutos após punção epidural até o final do procedimento cirúrgico.
Imediatamente após a indução anestésica e ao término do procedimento cirúrgico a artéria femoral foi puncionada com agulha hipodérmica 13´4 em seringa de insulina heparinizada para a coleta de sangue arterial para análise gasométrica do pH sangüíneo, pressão arterial de dióxido de carbono (PaCO2), pressão arterial de oxigênio (PaO2), saturação da hemoglobina no sangue arterial (SaO2), excesso ou déficit de base (BE) e bicarbonato (HCO3-). As amostras, mantidas sob refrigeração entre 4 e 6°C por até três horas, foram encaminhadas ao laboratório de análises clínicas do Hospital Universitário de Santa Maria.
Quando necessário foram administrados fentanil9 9 Fentanil Citrato de Fentanila Solução injetável (0,05 mg/ml) Cristália Produtos Químicos Farmacêuticos Ltda. Itapira, SP. (0,002mg/kg IV) para controle da dor transcirúrgica, e propofol (na dose efetiva) no caso de superficialização de plano anestésico. Para administração de doses de fentanil observaram-se os seguintes parâmetros: aumento no tono mandibular, aumento de 10 a 20% da FC e da PAS e perda do relaxamento muscular na área operatória (informada pelo cirurgião). Quando essas alterações eram acompanhadas de aumento de reflexo palpebral e movimentos voluntários, administrava-se fentanil e propofol a efeito. Atropina10 10 Sulfato de atropina (0,5 mg/ml) Santisa Laboratório Farmacêutico Bauru, SP. (0,022mg/kg IV) foi administrada quando a FC apresentava-se reduzida a valores iguais ou inferiores a 60 bpm.
Durante o período trans e nas duas horas de pós-operatório os animais foram mantidos em colchão térmico. Nesse período, a temperatura retal foi acompanhada e mantida na faixa de variação fisiológica para cães.
Nas duas horas seguintes ao término do procedimento cirúrgico, os animais foram avaliados em relação ao grau de analgesia (intensa, pouco intensa e inadequada), usando-se as variáveis objetivas FC, FR e PAS e as variáveis subjetivas perfusão de mucosas (tempo de perfusão capilar), vocalização, grau de consciência e reação à palpação da articulação coxofemoral. As variáveis foram mensuradas uma e duas horas após a cirurgia. Foram atribuídos valores de 0 a 3 para cada item, dentro de cada variável, de modo que no final foi obtido um valor absoluto máximo de 19 pontos. Quanto mais baixo fosse o valor absoluto obtido, melhor seria o grau de analgesia.
Nas variáveis FC, FR e PAS atribuiu-se valor zero para até 10% de aumento em relação ao valor inicial, valor 1 para aumentos de 10 a 30% acima do inicial, valor 2 para aumentos de 30 a 50% acima do inicial e valor 3 para aumentos maiores que 50%. Na variável perfusão de mucosas atribuiu-se valor zero se o tempo de perfusão capilar fosse menor que dois segundos, valor 1 se maior que dois segundos e valor 2 se a mucosa estivesse isquêmica. Na vocalização atribuiu-se valor zero se estivesse ausente, valor 1 se presente e controlada sem medicação e valor 2 se presente e não controlada. No grau de consciência, valor zero se o animal estivesse alerta, valor l se levantasse apenas quando estimulado, valor 2 se reagisse a estímulos mas permanecesse em decúbito e valor 3 se não reagisse aos estímulos. Em relação à palpação da articulação coxofemoral, se não demonstrasse sinais de dor atribuiu-se valor zero, se apresentasse leve desconforto, valor 1, se reagisse à manipulação com movimentação, valor 2, e se apresentasse ganido e/ou retirada forte do membro, valor 3.
Em virtude da subjetividade das variavéis essa avaliação pós-operatória foi feita sempre pela mesma pessoa. Após o seu término e por mais dois dias consecutivos os animais receberam flunixin meglumine11 11 Banamine Frasco/ampola (50 mg/ml) Indústria Química e Farmacêutica Schering-Plough Veterinária Rio de Janeiro, RJ. na dose de 1,0mg/kg via intramuscular.
Fez-se análise de variância e as médias foram comparadas usando-se o teste de Bonferroni (P<0,05).
RESULTADOS
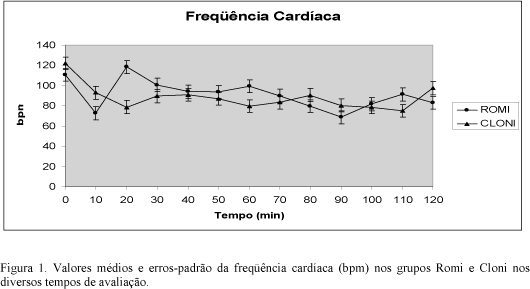
Não houve diferença significativa entre os grupos em relação à FC. No grupo Romi ela foi significativamente menor em relação ao valor inicial nos tempos de 10 e 90 minutos, e no grupo Cloni, nos tempos de 20, 50, 60, 70, 90, 100 e 110 minutos. Apenas no grupo Romi foram necessárias doses de atropina nos tempos de 10, 20, 50, 90 e 100 minutos, para sua manutenção acima de 60 bpm (Fig. 1).
Durante a observação do eletrocardiograma, os animais do grupo Romi apresentaram arritmias como bloqueio átrio ventricular de primeiro e segundo graus e depressão de segmento S-T, principalmente nos primeiros 30 minutos após a administração epidural do fármaco.
A pressão arterial sistólica diferiu entre os grupos nos tempos de 10 a 60 e aos 90 minutos. Nesses tempos, os animais do grupo Romi apresentaram valores maiores (acima de 170mmHg) em relação aos do grupo Cloni (que se mantiveram em torno de 100mmHg). Nos tempos de 10 a 60 minutos, os valores da pressão arterial foram maiores em relação ao inicial (Fig. 2).
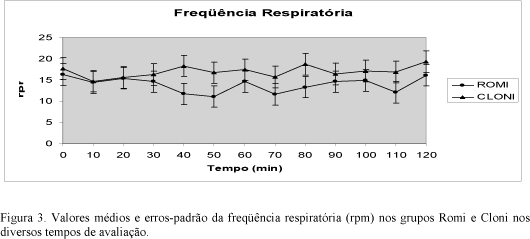
A freqüência respiratória não diferiu entre os grupos, nem entre o valor inicial e os intermediários e final. A saturação de oxigênio na hemoglobina permaneceu ao redor de 99% em todo o procedimento anestésico-cirúrgico (Fig. 3).
A concentração de halotano não diferiu entre os grupos nem entre o valor inicial e os valores intermediários e final. No grupo Romi observaram-se as seguintes concentrações: de T10 a T40, 0,8%; de T50 a T80, 0,9%; em T90, 0,7%; em T100 e T110, 0,6%; e em T120, 0,3%. No grupo Cloni as concentrações de halotano foram: de T10 a T90, 1,0%; em T100 e T110, 0,6%; e em T120, 0,3%.
Em um animal de cada grupo foi necessário administrar fentanil/propofol no trans-cirúrgico, devido a superficialização de plano anestésico.
As variáveis hemogasométricas mantiveram-se dentro da faixa de variação fisiológica para a espécie canina (Tab. 1).
Em relação à avaliação pós-operatória não houve diferença significativa entre os grupos. Uma hora após o fim do procedimento cirúrgico os animais do grupo Romi apresentaram pontuação média de 4,1 e os do grupo Cloni, 3,8. Na segunda avaliação, o grupo Romi atingiu pontuação de 5,7 e o grupo Cloni 4,2. Os dois grupos apresentaram pontuação média semelhante, aproximadamente um quarto da pontuação total.
DISCUSSÃO
A diminuição da freqüência cardíaca em relação aos valores iniciais, observada nos dois grupos, é causada pela ação nos receptores a 2 pré-sinápticos mediando a inibição da liberação de norepinefrina na junção neuroefetora, e pelo efeito vagomimético (Maze, Tranquili, 1991). A ação da romifidina foi mais intensa e produziu bradicardia, que exigiu o uso de atropina para manter a freqüência cardíaca. Embora tenha ocorrido diminuição da freqüência cardíaca, o grupo clonidina não apresentou bradicardia (bpm < 60) e dispensou a atropina.
A dose de 20µg/kg de romifidina pela via epidural foi considerada alta, em face do aparecimento de bradiarritmias. Os agonistas alfa2 em altas doses deprimem a condução no nódulo atrioventricular (Maze, Tranquili, 1991). England et al. (1996) e England e Hammond (1997), quando utilizaram altas doses de romifidina intravenosa (120µg/kg e 80µg/kg, respectivamente), também observaram bloqueio átrio ventricular de primeiro e segundo graus.
A hipertensão com o uso da romifidina foi atribuída à elevada dose administrada pela via epidural e à conseqüente estimulação de receptores pós-sinápticos, resultando em vasoconstrição periférica. A administração de altas dose de agonistas a2 pelas vias intravenosa e epidural em "bolus" produz vasoconstrição suficiente para levar a grandes períodos de hipertensão (Tong, Eisenach, 1994).
A ação dos agonistas a2 sobre a pressão arterial é bastante complexa e dependente da dose administrada. No cérebro, a ativação de receptores a2 pós-sinápticos reduz a atividade simpática. Na periferia e na medula espinhal a ativação de receptores a2 pré-sinápticos reduz a liberação de norepinefrina dos terminais nervosos (Eisenach et al., 1996). Esses efeitos periférico e central são contra-balanceados por uma ação direta dos agonistas a2 sobre receptores pós-sinápticos localizados na musculatura lisa vascular, induzindo vasoconstrição periférica ( Pypendop, Verstegen, 2001).
A dose de 150µg de clonidina produziu alterações míninas na pressão arterial, também verificadas por Ghignone et al. (1987), que compararam diferentes doses de clonidina pela via epidural em cães.
Não foram observadas alterações na FR, pH, PaCO2, PaO2 e SaO2, não caracterizando, desse modo, depressão respiratória nos dois grupos. Os agonistas a2 adrenérgicos não induzem depressão respiratória profunda, mesmo em doses elevadas (Eisenach et al., 1996). Entretanto, podem produzir depressão respiratória suave uma vez que causam sedação e analgesia e, conseqüentemente, podem diminuir a FR devido ao controle da ansiedade e da dor (Tong, Eisenach, 1994).
A baixa concentração de halotano nos dois grupos e a não utilização do fentanil/propofol no período transcirúrgico sugerem que a analgesia produzida pelos agonistas a2 adrenérgicos via epidural é eficiente em cães. Os agonistas a2 adrenérgicos causam analgesia, em parte, por ativação colinérgica espinhal. Após a administração epidural, os agonistas a2 aumentam a concentração de acetilcolina no liqüido cefalorraquidiano (Eisenach et al., 1996).
Levando em consideração o período transcirúrgico (120 minutos) mais duas horas de pós-operatório, verifica-se que tanto a clonidina quanto a romifidina produziram aproximadamente quatro horas de analgesia. Esse período também foi verificado por Eisenach et al. (1996), os quais observaram duração média de três a cinco horas após a administração de dose única de clonidina epidural em humanos.
A clonidina é rapidamente absorvida a partir do canal espinhal para o líquido cefalorraquidiano depois da administração epidural, atingindo adequada concentração de ação de 30 a 60 minutos após a injeção, o que coincide com a máxima analgesia (Eisenach et al., 1996). A clonidina produz analgesia breve quando administrada pela via epidural sob a forma de "bolus". Quando se deseja analgesia sustentada é necessária a infusão contínua (Huntoon et al., 1992; De Kock et al., 1993).
Os efeitos adversos iniciaram-se aproximadamente 10 a 15 minutos após a administração epidural do fármaco e foi possível, inclusive, visualizar, pelo ECG, as bradiarritmias no grupo romifidina. Esse rápido início de ação dos efeitos adversos também foi descrito por Bonnet et al. (1989), isto é, 15 a 20 minutos após a injeção epidural única de clonidina em humanos foram observados efeitos adversos oriundos da absorção da clonidina do espaço epidural, ao invés da migração cefálica através do fluido cerebroespinhal.
CONCLUSÕES
A administração epidural de clonidina ou romifidina em solução fisiológica 0,9% (1m/5kg) produz analgesia intensa durante o período transcirúrgico sem depressão respiratória e analgesia pouco intensa no pós-operatório imediato. Bradicardia e hipotensão não são observadas com o uso de clonidina epidural, entretanto, bradiarritmias e hipertensão são produzidas com romifidina pela via epidural.
Recebido para publicação em 4 de outubro de 2002
Recebido para publicação, após modificações, em 5 de junho de 2003
- BONNET, F.; BOICO, O.; ROSTAING, M. et al. Postoperative analgesia with extradural clonidine. Br. J. Anaesth, v.63, p.465 469, 1989.
- DE KOCK, M.; CROCHET, B.; MORIMONT, M.D. et al. Intravenous or epidural clonidine for intra and postoperative analgesia. Anesthesiology, v.79, p.525 531, 1993.
- EISENACH, J.C.; DETWEILER, D.; HOOD, D. Hemodynamic and analgesic actions of epidurally administered clonidine. Anesthesiology, v.78, p.277 287, 1993.
- EISENACH, J.C.; DEWAN, D.M.; ROSE J.C. et al. Epidural clonidine produces antinociception, but not hypotension, in sheep. Anesthesiology, v.66, p.496 501, 1987.
- EISENACH, J.C.; DUPEN, S.; DUBOIS, M. et al. Epidural clonidine analgesia for intractable cancer pain. Pain, v.61 p.391 399, 1995.
- EISENACH, J.C.; KOCK, M.D.; KLIMSCHA, W. a2 adrenergic agonistic for regional anesthesia. Anesthesiology, v.85, p.655 674, 1996.
- ENGLAND, G.C.W.; FLACK, T.E.; HOLLINGWORTH, E. et al. Sedative effects of romifidine in the dog. J. Small Anim. Pract., v.37, p.19 25, 1996.
- ENGLAND, G.C.W.; HAMMOND, R. Dose-sparing effects of romifidine premedication for thiopentone and halothane anaesthesia in the dog. J. Small Anim. Pract., v.38, p.141 146, 1997.
- GHIGNONE, M.; CALVILLO, O.; QUINTIN, L. et al. Haemodynamic effects of clonidine injected epidurally in halothane anaesthetized dogs. Can. J. Anaesth., v.34, p.46 50, 1987.
- HUNTOON, M.; EISENACH, J.C.; BOESE P. Epidural clonidine after cesarean section. Anesthesiology, v.76, p.187 193, 1992.
- MAZE, M.; TRANQUILI, W. Alpha-2 adrenoceptor agonists: defining the role in clinical anesthesia. Anesthesiology, v.74, p.581 605, 1991.
- MUIR W.W. Drugs used for preanesthetic medication. In: Handbook of veterinary anesthesia 3.ed. Missouri: Mosby, 2000. Cap.3: p.19 40.
- PYPENDOP, B.H.; VERSTEGEN, J.P. Cardiovascular effects of romifidine in dogs. Am. J. Vet. Res., v.62, p.490 495, 2001.
- TONG, C.; EISENACH, J.C. a2 adrenergic agonists. Anesth. Clin. North Am., v.12, p.49 63, 1994.
Datas de Publicação
-
Publicação nesta coleção
17 Jun 2004 -
Data do Fascículo
Abr 2004
Histórico
-
Recebido
04 Out 2002