Resumos
Avaliou-se o papel da gonadotrofina coriônica humana (hCG) e da testosterona na produção de progesterona (P4) e 17beta -estradiol (E2) pelas células da granulosa cultivadas in vitro de folículo antral de égua. Os tratamentos usados foram: 1- controle (nenhum hormônio adicionado), 2- 1UI hCG (0,3mig/ml) e 3- 10UI hCG (3,0mig/ml). O tratamento com hCG foi realizado na presença ou não de testosterona (144ng/ml). O meio foi coletado e substituído com 0,25, 3, 6, 12, 24 e 144h de cultivo. As concentrações de P4 e E2 foram mensuradas por radioimunoensaio. Não se observou diferença entre os tratamentos 1 e 3 quanto à produção de P4 e E2; o tratamento 1 resultou em aumento da concentração de progesterona após 24h de cultura (P<0,01), mas somente em presença de testosterona. A concentração de estradiol aumentou em presença de testosterona, alcançando concentração máxima com 6h de cultura (P<0,01), e diminuiu gradativamente, até atingir a concentração observada com 0,25h de cultura. A adição de hCG não influenciou a síntese do estradiol. A testosterona desempenhou importante efeito estimulador na síntese/secreção doe E2 pelas células da granulosa e modulou a ação do hormônio luteinizante na diferenciação e luteinização das células da granulosa de folículo antral presumidamente pré-ovulatório de égua in vitro.
égua hormônio luteinizante; testosterona; esteroidogênese; células da granulosa
The role of the human chorionic gonadotropin (hCG) and testosterone was evaluated in the progesterone (P4) and estradiol-17beta (E2) production by granulosa cells of antral follicles from mare cultivated in vitro. The treatment (groups) with gonadotropin consisted of: 1- control (no added hormone); 2- 1 IU hCG (0.3mg/ml) and 3- 10 IU hCG (3.0mg/ml). The treatment with hCG was carried out in the presence or not of testosterone (144ng/ml). The culture medium was collected and replaced at 0.25, 3, 6, 12, 24 and 144h of culture. The concentrations of P4 and E2 were measured by radioimunoassay. Analyses of variance were used for P4 and E2, and mean of the factors were compared by the Tukey test at 5% of probability. No difference was observed between 1 and 2 groups. Treatment with 1 IU of hCG increased progesterone concentration after 24h of culture (P<0.01), only in the presence of testosterone. The concentration of estradiol increased in the presence of testosterone, reaching maximum concentration with 6h of culture (P<0.01), and reduced gradually until the observed concentration at 0.25h of culture. The addition of hCG had no effect in the synthesis of this steroid. The testosterone modulates the action of the luteinizing hormone in the differentiation and luteinization of the granulosa cells and plays important estimulator effect in the synthesis/secretion of E2 by granulosa cells in vitro of presumptive pre-ovulatory antral follicle in mare.
mare; luteinizing hormone; testosterone; steroidogenesis; granulosa cell
MEDICINA VETERINÁRIA
Testosterona e gonadotrofina coriônica humana estimulam a esteroidogênese em células da granulosa de folículo pré-ovulatório de égua?
Do testosterone and human chorionic gonadotropin stimulate steroidogenesis in granulosa cells of preovulatory follicle in mare?
M.C. Caldas-BussiereI; J.M. GarciaII; J.C. BarbosaII; A.A.M. Rosa e SilvaIII
ICentro de Ciências e Tecnologias Agropecuárias - Universidade Estadual do Norte Fluminense Darcy Ribeiro - Av. Alberto Lamego, 2000 - Parque Califórnia - 28013-602 - Campos dos Goytacazes, RJ
IIFaculdade de Ciências Agrárias e Veterinárias UNESP - Jaboticabal, SP
IIIInstituto de Ciências Fisiológicas UNB - Brasília, DF
RESUMO
Avaliou-se o papel da gonadotrofina coriônica humana (hCG) e da testosterona na produção de progesterona (P4) e 17b -estradiol (E2) pelas células da granulosa cultivadas in vitro de folículo antral de égua. Os tratamentos usados foram: 1- controle (nenhum hormônio adicionado), 2- 1UI hCG (0,3mg/ml) e 3- 10UI hCG (3,0mg/ml). O tratamento com hCG foi realizado na presença ou não de testosterona (144ng/ml). O meio foi coletado e substituído com 0,25, 3, 6, 12, 24 e 144h de cultivo. As concentrações de P4 e E2 foram mensuradas por radioimunoensaio. Não se observou diferença entre os tratamentos 1 e 3 quanto à produção de P4 e E2; o tratamento 1 resultou em aumento da concentração de progesterona após 24h de cultura (P<0,01), mas somente em presença de testosterona. A concentração de estradiol aumentou em presença de testosterona, alcançando concentração máxima com 6h de cultura (P<0,01), e diminuiu gradativamente, até atingir a concentração observada com 0,25h de cultura. A adição de hCG não influenciou a síntese do estradiol. A testosterona desempenhou importante efeito estimulador na síntese/secreção doe E2 pelas células da granulosa e modulou a ação do hormônio luteinizante na diferenciação e luteinização das células da granulosa de folículo antral presumidamente pré-ovulatório de égua in vitro.
Palavras-chave: égua hormônio luteinizante, testosterona, esteroidogênese, células da granulosa
ABSTRACT
The role of the human chorionic gonadotropin (hCG) and testosterone was evaluated in the progesterone (P4) and estradiol-17b (E2) production by granulosa cells of antral follicles from mare cultivated in vitro. The treatment (groups) with gonadotropin consisted of: 1- control (no added hormone); 2- 1 IU hCG (0.3mg/ml) and 3- 10 IU hCG (3.0mg/ml). The treatment with hCG was carried out in the presence or not of testosterone (144ng/ml). The culture medium was collected and replaced at 0.25, 3, 6, 12, 24 and 144h of culture. The concentrations of P4 and E2 were measured by radioimunoassay. Analyses of variance were used for P4 and E2, and mean of the factors were compared by the Tukey test at 5% of probability. No difference was observed between 1 and 2 groups. Treatment with 1 IU of hCG increased progesterone concentration after 24h of culture (P<0.01), only in the presence of testosterone. The concentration of estradiol increased in the presence of testosterone, reaching maximum concentration with 6h of culture (P<0.01), and reduced gradually until the observed concentration at 0.25h of culture. The addition of hCG had no effect in the synthesis of this steroid. The testosterone modulates the action of the luteinizing hormone in the differentiation and luteinization of the granulosa cells and plays important estimulator effect in the synthesis/secretion of E2 by granulosa cells in vitro of presumptive pre-ovulatory antral follicle in mare.
Keywords: mare, luteinizing hormone, testosterone, steroidogenesis, granulosa cell
INTRODUÇÃO
As células da granulosa (CG) e as células da teca (CT) interagem para permitir a síntese de E2 (Falk, 1959). O modelo 2 células/2 hormônios para a produção de E2 em folículos antrais pré-ovulatórios de suínos (Stoklosowa et al., 1982), bovinos (Fortune, 1986) e eqüinos (Sirois et al., 1991) demonstra que as CT interna são estimuladas pelo hormônio luteinizante (LH) e produzem andrógenos, enquanto que o hormônio folículo estimulante (FSH) (e LH em folículos maturados) estimula as CG para aromatizarem os andrógenos sintetizados pelas CT.
A testosterona (T) estimula a síntese/liberação de progesterona (P4) pelas CG em presença de LH em fêmeas de ratos (Liu e Hseuh, 1986), bovinos (Fortune, 1986) e suínos (Stoklosowa et al., 1982), contudo nenhum efeito da T na síntese de P4 ou E2 foi descrito em eqüinos.
O objetivo da presente investigação foi estudar o papel da testosterona e da gonadotrofina coriônica humana (hCG) na síntese de P4 e E2 pelas CG de folículo antral presumivelmente pré-ovulatório de eqüino.
MATERIAL E MÉTODOS
Ovários de éguas cíclicas vazias foram obtidos do Frigorífico Pomar, Araguari, MG, e imediatamente colocados em frascos estéries contendo PBS, gentamicina (50mg/ml) e anfotericina B1 1 Bristol-Myers Squibb, New York, NY, USA (1mg/ml) na temperatura ambiente e transportados até o laboratório.
Um folículo ovariano contendo 55ml de fluido folicular foi selecionado de acordo com as características morfológicas (tamanho, coloração e intensidade de vascularização) após a dissecção do tecido ovariano no fluxo laminar com a ajuda de pinças e tesouras esterilizadas. Após a coleta do fluido folicular, o folículo foi seccionado, invertido e colocado em placa de Petri contendo PBS. As CG foram obtidas raspando-se delicadamente a face interna do folículo com uma pinça. Posteriormente, foram centrifugadas (200g/10 min) duas vezes em PBS e ressuspendidas em 3ml de meio de cultura, homogeinizadas com repetidas aspirações com pipeta Pasteur e contadas em câmara de Newbauer. A viabilidade das CG foi determinada utilizando-se a coloração vital "triplan-blue", sendo consideradas como vivas as células não coradas.
As CG foram cultivadas (200.000 células vivas/ml meio) em placas de 24 poços2 2 Corning, Corning, NY, USA em meio de cultivo de tecidos (TCM)1993 3 Sigma-Aldrich, St Louis, MO, USA suplementado com cortisol3 (40ng/ml), insulina3 (1mg/ml), transferrina3 (5mg/ml) e 10% de soro fetal bovino4 4 Gibco BRL, Grand Island, NY, USA , de acordo com Sirois et al. (1990). Visto que o hCG em CG de éguas apresenta atividade biológica semelhante ao LH (Kelly et al., 1988), ele foi utilizado neste experimento para se avaliar o efeito do LH na esteroidogênese ovariana. O tratamento com hCG3 constou de: 1- controle (nenhum hormônio adicionado); 2- 1UI hCG (0,3mg/ml) e 3- 10UI hCG (3mg/ml). Cada tratamento com hCG foi realizado em triplicata com ou sem T3 (0.5mM; 144ng/ml). O meio foi coletado após 0,25, 3, 6, 12, 24, 48 e 144h de cultura e estocado a -20º C até o dia do ensaio hormonal de P4 e E2. As culturas foram incubadas a 37º C em estufa com atmosfera umidificada com 95% de ar e 5% de CO2.
Utilizou-se um esquema fatorial 3×2×7, três concentrações de hCG (zero, 1 e 10UI), com e sem T, e sete tempos de cultura, em delineamento inteiramente ao acaso, com três repetições. Os resultados referentes à produção de P4 e E2 pelas CG cultivadas in vitro foram submetidos à análise de variância e as médias comparadas pelo teste de Tukey ao nível de 5% de probabilidade (Gomes, 1987).
As concentrações de P4 (Rosa e Silva et al., 1993) e E2 no meio de cultura (Bélanger et al., 1980) foram determinadas por radioimunoensaio. O coeficiente de variação (CV) inter e intra-ensaio para P4 foi de 10,3% e 5,0%, respectivamente, e a dose mínima detectável foi de 6,25 pg/tubo. O CV inter e intra-ensaio para E2 foi de 5,8% e 3,1%, respectivamente, e a dose mínima detectável foi de 1,3 pg/tubo.
RESULTADOS
A síntese de P4 pelas CG in vitro não foi afetada pela adição de 1 UI ou 10 UI de hCG no meio de cultura em ausência de T (Fig. 1). A T na ausência do hCG (controle) não alterou as concentrações de P4 no meio de cultura. Quando o meio de cultura foi suplementado com T (144 ng/ml) e 1UI de hCG, observou-se aumento de oito vezes (40 para 430ng/ml) na concentração de P4 no meio de cultura (P<0,01). Não houve efeito da T quando 10 UI de hCG foram adicionadas (Fig. 1).
Concentração basal de E2 foi observada no meio de cultura (2,98ng/ml) na ausência de T (Fig. 2). A adição de T (144ng/ml) ao meio de cultura aumentou 506 vezes a concentração de E2 (P<0,01). O tratamento com hCG não alterou o acúmulo de E2 na cultura na presença ou ausência de T (Fig. 2).
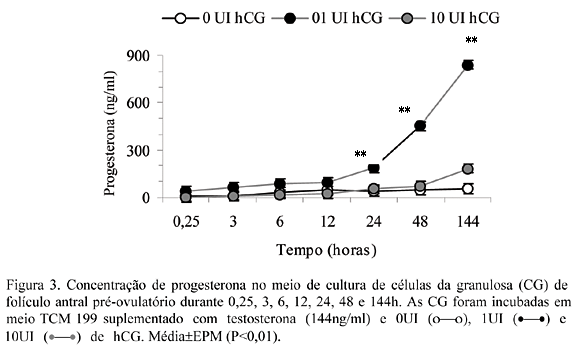
A concentração de P4 no meio de cultura na presença de T e 1UI de hCG aumentou significativamente (P<0,01) com 24h de cultura, atingindo concentração máxima após 144h (Fig. 3). Concentração basal foi observada quando 0 e 10UI de hCG foram adicionados ao meio de cultura. Já a concentração de E2 no meio de cultura na presença de T foi máxima após 6h de cultura (P<0,01), diminuindo gradativamente após esse período. A adição de hCG ao meio de cultura não alterou a síntese/secreção de E2 pelas CG durante o período de cultura (Fig. 4). Relação temporal inversa foi observada entre a concentração de P4 e de E2 no meio de cultura ao longo das 144h quando foi adicionado 1UI de hCG em presença da T (Fig. 3 e 4).
DISCUSSÃO
A síntese de novo do colesterol é uma das maiores atividades biossintéticas das CG em folículos antrais (Gore-Langton e Armstrong, 1994) e ocorre, inicialmente, em resposta ao estímulo pelo FSH e, posteriormente, em resposta ao LH (Hsueh et al., 1984). Visto que o precursor da P4 é derivado da síntese de novo e também de estoques endógenos de lipídios (Simpson et al., 1980), torna-se possível a síntese de P4 pelas CG cultivadas in vitro sem a adição suplementar de seu precursor.
O hCG estimulou o acúmulo de P4 pelas CG de folículo antral, presumivelmente pré-ovulatório, de égua na concentração de 1UI de hCG/ml na presença de T. Estes resultados são semelhantes aos descritos por outros autores, que observaram aumento marcante na habilidade das CG em secretar P4in vitro, na transição da fase folicular inicial para a fase folicular tardia (Sirois et al., 1991), em razão da exposição à concentração crescente de LH in vivo (Whitmore et al., 1973; Alexander e Irvine, 1982).
Alta concentração de hCG (10UI) não promoveu efeito estimulador na síntese de P4. A dessensibilização das células ovarianas às gonadotrofinas tem sido descrita em éguas (Jonassen e Richards, 1980; Jonassen et al., 1982) e em outras espécies como um mecanismo para prevenir a superestimulação das gônadas (Amsterdam et al., 2002). O processo de dessensibilização crônico é, em parte, atribuído ao acúmulo e internalização do complexo hormônio-receptor; o agudo pode ocorrer como resultado da fosforilação dos resíduos serina e treonina do receptor, impedindo que ele ative a formação do AMPc (Keren-Tal et al., 1996).
O hCG (1UI) estimulou o acúmulo de P4 no meio de cultura das CG, porém esse aumento só foi observado na presença de testosterona. O resultado deste estudo inclui as CG de éguas no grupo das CG de outras espécies animais nas quais a regulação da síntese de P4 no folículo envolve a ação de andrógenos. Contudo, Tucker et al. (1991) observaram, em éguas, inefetividade da T em estimular a síntese/secreção de P4 in vitro, o que difere do efeito estimulador da T sobre o acúmulo de P4 em cultura de CG de eqüinos observado neste trabalho e por outros autores em suínos (Stoklosowa et al., 1982), bovinos (Fortune, 1986) e ratos (Lui e Hsueh, 1986). Em ratos, o efeito dos andrógenos é um fenômeno receptor mediado pelo LH (Liu e Hsueh, 1986) e adicionalmente estimulado pela presença de E2 (Hillier et al., 1977). Na produção de P4, a combinação da gonadotrofina com andrógenos atua não somente estimulando a síntese, mas também bloqueando a sua degradação (Moon et al., 1984).
O hCG não estimulou significativamente a secreção de E2 pelas CG acima das concentrações observadas em meio de cultura suplementado com T sem hCG, ou seja, não aumentou a atividade da P450aromatase (P450arom). Resultados semelhantes também foram observados por outros pesquisadores, ao utilizarem CG de éguas tratadas com FSH e/ou LH (Sirois et al., 1990; Tucker et al., 1991). Em CG de folículos pré-ovulatórios de bovinos in vivo foi demonstrado que o RNAm das enzimas-chave da via sintética dos esteróides nas CG, como a P450 clivagem da cadeia lateral do colesterol (P450scc) e 3b -hidroxi-esteróide dehidrogenase/D 5-D 4-isomerase (3b -HSD), aumenta significativamente quando a fase folicular progride, porém esse aumento não ocorre com o RNAm da P450arom (Tian et al., 1995).
A T adicionada ao meio de cultura de CG de folículo antral presumivelmente pré-ovulatório de égua estimulou o acúmulo de E2 no meio de cultura, não apenas desempenhando papel de precursor do E2, mas de potente estimulador da atividade da P450arom, pois a quantidade de T adicionada ao meio de cultura (144ng/ml) foi bem menor do que a produção de E2 obtida com 6h de cultura (1119,74ng/ml), ou seja, 10,5 vezes maior. Sirois et al. (1991) observaram aumento na concentração de androstenediona no meio de cultura de CG de eqüinos durante três dias consecutivos. Contudo, quando não se adicionou T ao meio, a concentração de E2 foi muito baixa, alcançando 17ng/ml às 144h de cultura. Mais estudos são necessários para averiguar se esse andrógeno, utilizado como precursor para a síntese de E2, seria oriundo da síntese pelas CG ou liberação intracelular adicional. O efeito da T como precursor da síntese de E2 pelas CG foi relatado em eqüinos (Channing, 1969; Sirois et al., 1991) e em outras espécies animais (Dorrington et al., 1975; Erickson e Hsueh, 1978). Andrógenos também participam do mecanismo pelo qual o FSH aumenta a atividade da P450arom (Daniel e Armstrong, 1984). Porém, essa é a primeira vez que se demonstra em eqüinos o efeito da T como potente estimulador da síntese de E2, além de seu papel como precursor.
O fato do LH/hCG não estimular a atividade da P450arom e a T apresentar efeito estimulador marcante na síntese de E2 sugere que, pelo menos durante a fase folicular tardia, a disponibilidade de substrato aromatizável seja limitante para que ocorra a síntese de E2 pelas CG. Essa hipótese é sustentada por relatos que demonstram que CG de folículos pré-ovulatórios de ovinos (Evans et al., 1981) e suínos (Tsang et al., 1985), cultivadas in vitro e coletadas durante diferentes tempos após o tratamento com gonadotrofina coriônica eqüina, apresentam atividade da P450arom constante. Tian et al. (1995) demonstraram, em bovinos, que a concentração do RNAm da P450arom se mantém sem alteração durante 24h após a luteólise, e que o aumento marcante na síntese de E2, observado nesse período, foi devido ao aumento da concentração das enzimas-chave da via biossintética de andrógenos localizadas nas CT (P450scc, 3bHSD e P450-17a ) e CG (P450scc, 3bHSD), após elevação da freqüência de secreção do LH, aumentando a disponibilidade de substrato aromatizável. Outra evidência de que a disponibilidade de substrato aromatizável limita a síntese de E2 é que, após o pico pré-ovulatório de LH, a produção de E2 é inibida devido à diminuição da síntese de andrógenos pelas CT e células intersticiais (Lieberman et al., 1975; Katz e Armstrong, 1976).
Neste estudo foi observada relação temporal inversa entre concentrações de E2 e P4 no meio de cultura. Tem sido demonstrado que estrógenos diminuem a síntese/secreção de P4 pelas CG de suínos (Haney e Schomberg, 1978), bovinos (Fortune e Hansel, 1979), ratos (Hillier et al., 1977) e humanos (Bieszczad et al., 1982). A ação inibitória do E2 nas CG de suínos é dependente do tempo de cultura e da concentração adicionada ao meio, mas não é dependente do grau de maturação folicular (Veldhuis, 1985). Estes dados sugerem que, após a diminuição das concentrações de E2 no meio de cultura, as CG se luteinizaram, aumentando a produção de P4 em resposta ao hCG e T, 24h após o início da cultura.
Os resultados permitem concluir que a testosterona modula a ação do LH na diferenciação e luteinização das células da granulosa e desempenha importante efeito estimulador na síntese/secreção do E2 pelas células da granulosa de folículo antral presumidamente pré-ovulatório de égua in vitro.
AGRADECIMENTOS
Os autores agradecem a Rogério Rosário de Azevedo, Roberta Vantini e Ivo Luiz de Almeida Júnior pela assistência técnica. Este projeto foi financiado pela FAPESP e CNPq.
Recebido para publicação em 14 de julho de 2003
Recebido para publicação, após modificações, em 16 de abril de 2004
E-mail: claracal@uenf.br
- ALEXANDER, S.; IRVINE, C.H.G. Radioimmunoasay and in-vitro bioassay of serum LH throughout the equine oestrous cycle. J. Reprod. Fertil., v.32 (Suppl), p.253-260, 1982.
- AMSTERDAM, A; HANOCH, T.; DANTES, A et al. Mechanisms of gonadotropin desensitization. Mol. Cell Endocrinol, v.187, p.69-74, 2002.
- BÉLANGER, A.; CARON, S.; PICARD, V. Simultaneous radioimmunoassay of progestins, androgens and estrogens in rat testis. J. Steroid Biochem, v.13, p.185-190, 1980.
- BIESZCZAD, R.R.; McCLINTOCK, J.S.; PEPE, G.J. et al. Progesterone secretion by granulosa cells from different sized follicles of human ovaries after short term incubation. J. Clin. Endocrinol. Metab, v.55, p.181-184, 1982.
- CHANNING, C.P. Studies on tissue culture of equine ovarian cell types: Pathways of steroidogenesis. J. Endocrinol, v.43, p.403-413, 1969.
- DANIEL, S.A.J.; ARMSTRONG, D.T. Site of action of androgens on follicle-stimulating hormone-induced aromatase activity in cultured rat granulosa cells. Endocrinology, v.114, p.1975-1982, 1984.
- DORRINGTON, J.H.; MOON, Y.S.; ARMSTRONG, D.T. Estradiol-17b biosynthesis in cultured granulosa cells from hypophysectomized immature rats; stimulation by follicle stimulating hormone. Endocrinology, v.97, p.1328-1331, 1975.
- ERICKSON, G.F.; HSUEH, A.J.W. Stimulation of aromatase activity by follicle-stimulating hormone in rat granulosa cells in vivo and in vitro. Endocrinology, v.102, p.1275-1282, 1978.
- EVANS, G.; DOBIAS, M.; KING, G.L. et al. Estrogen, androgen, and progesterone biosynthesis by theca and granulosa of preovulatory follicles in the pig. Biol. Reprod, v.25, p.673-682, 1981.
- FALK, B. Site of production of oestrogens in rat ovary as studied by microtransplants. Acta Physiol. Scand, v.47 (Suppl. 163), p.1-101, 1959.
- FORTUNE, J.E. Bovine theca and granulosa cells interact to promote androgen production. Biol. Reprod, v.35, p.292-299, 1986.
- FORTUNE, J.E.; HANSEL W. The effects of 17b -estradiol on progesterone secretion by bovine theca and granulosa cells. Endocrinology, v.104, p.1834-1838, 1979.
- GOMES F.P. Curso de estatística experimental. Piracicaba: Livraria Nobel, 1987. 467p.
- GORE-LENGTON, R.E.; ARMSTRONG, D.T. Follicular steroidogenesis and its control. In: KNOBIL, E.; NEIL, J.D. (Eds.). The Physiology of reproduction 2.ed. New York: Raven, 1994. V.1, p.571-627.
- HANEY, AF.; SCHOMBERG, D.W. Steroidal modulation of progesterone secretion by granulosa cells from large porcine follicles: a role for androgens and estrogens in controlling steroidogenesis. Biol. Reprod, v.19, p.242-248, 1978.
- HILLIER, S.G.; KNAZEK, R.A.; ROSS, E.T. Androgenic stimulation of progesterone production by granulosa cells from preantral ovarian follicles: further in vitro studies using replicate cell cultures. Endocrinology, v.100, p.1539-1549, 1977.
- HSUEH, A.J.W.; ADASHI, E.Y.P.; JONES, P.C.B. et al. Hormonal regulation of the differentiation of cultured ovarian granulosa cells. Endocr. Rev, v.5, p.76-127, 1984.
- JONASSEN, J.A.; BOSE, K.; RICHARDS, J.S. Enhancement and desensitization of hormone-responsive adenylate cyclase in granulosa cells of preantral and antral ovarian follicles: effects of estradiol and follicle-stimulating hormone. Endocrinology, v.111, p.74-79, 1982.
- JONASSEN, J.A.; RICHARDS, J.S. Granulosa cell desensitization: effects of gonadotropins on antral and preantral follicles. Endocrinology, v.106, p.1786-1794, 1980.
- KATZ, Y.; ARMSTRONG, D.T. Inhibition of ovarian estradiol-17b secretion by luteinizing hormone in prepubertal, pregnant mare serum-treated rats. Endocrinology, v.99, p.1442-1447, 1976.
- KELLY, C.M.; HOYER, P.B.; WISE, M.E. In-vitro and in-vivo responsiveness of the corpus luteum of the mare to gonadotrophin stimulation. J. Reprod. Fertil,v.84, p.593-600, 1988.
- KEREN-TAL, I.; DANTES, A.; AMSTERDAN, A. Activation of FSH-responsive adenylate cyclase by staurosporine: Role for protein phosphorylation in gonadotropin receptor desensitization. Mol. Cell. Endocrinol, v.116, p.39-48, 1996.
- LIEBERMAN, M.E.; BARNEA, A.; BAUMINGER, S. et al. LH effect on the pattern of steroidogenesis in cultured Graafian follicles of the rat: dependence on macromolecular synthesis. Endocrinology, v.96, p.1533-1542, 1975.
- LIU, Y.; HSUEH, A.J.W. Synergism between granulosa and theca-intersticial cells in estrogen biosynthesis by gonadotrophin-treated rat ovaries: Studies on the two-cell, two-gonadotrofin hypothesis using steroid antisera. Biol. Reprod, v.35, p.27-36, 1986.
- MOON, Y.S.; DULEBA, A.J.; TAKAHASHI, H. Differential actions of FSH and androgens on progesterone catabolism by rat granulosa cells. Bioch. Bioph. Res. Commun, v.199, p.694-699, 1984.
- ROSA E SILVA, A.A.M.; CALDAS, M.C.S.; CAMPOS, L.M. et al. Setting-up and validation of two radioimmunoassay methods for determination of plasma progesterone concentration in mares, cows and rats. Ars Vet., v.9, p.1-9, 1993.
- SIMPSON, E.R.; ROCHELLE, D.B.; CARR, B.R. et al. Plasma lipoproteins in follicular fluid of human ovaries. J. Clin. Endocrinol. Metab, v.51, p.1469-1471, 1980.
- SIROIS, J.; KIMMICH, T.L.; FORTUNE, J.E. Developmental changes in steroidogenesis by equine preovulatory follicles: effects of equine luteinizing hormone, follicle-stimulating hormone, and chorionic gonadotropin. Endocrinology, v.127, p.2424-2430, 1990.
- SIROIS, J.; KIMMICH, T.L.; FORTUNE, J.E. Steroidogenesis by equine preovulatory follicles: relative roles of theca interna and granulosa cells. Endocrinology, v.128, p.1159-1166, 1991.
- STOKLOSOWA, S.; GREGORASZCUK, E.; CHANNING, C.P. Estrogen and progesterone secretion by isolated cultured porcine thecal and granulosa cells. Biol. Reprod, v.26, p.943-952, 1982.
- TIAN, X.C.; BERNDTSON, A.K.; FORTUNE, J.E. Differentiation of bovine preovulatory follicles during the follicular phase is associated with increases in messenger ribonucleic acid for cytochrome P450 side-chain cleavage, 3b -hydroxysteroid dehydrogenase, and P450 17a -hidroxylase, but not P450 aromatase. Endocrinology, v.136, p.5102-5110, 1995.
- TSANG, B.K.; AINSWORTH, L.; DOWNEY, B.R. et al. Differential production of steroids by dispersed granulosa and theca interna cells from developing preovulatory follicles of pigs. J. Reprod. Fertil, v.74, p.459-471, 1985.
- TUCKER, K.E.; HENDERSON, K.A.; DUBY, R.T. In vitro steroidogenesis by granulosa cells from equine pre-ovulatory follicles. J. Reprod. Fertil, v.44 (Suppl), p.45-55, 1991.
- VELDHUIS, J.D. Bipotential actions of estrogens on progesterone biosynthesis by ovarian cells. II. Relation of estradiols stimulatory actions to cholesterol and progestin metabolism in cultured swine granulosa cells. Endocrinology, v.117, p.1076-1083, 1985.
- WHITMORE, H.L.; WENTWORTH, B.C.; GINTHER, O.J. Circulating concentrations of luteinizing hormone during estrous cycle of mares as determined by radioimmunoassay. Am. J. Vet. Res, v.34, p.631-636, 1973.
Datas de Publicação
-
Publicação nesta coleção
28 Jun 2005 -
Data do Fascículo
Fev 2005
Histórico
-
Aceito
16 Abr 2004 -
Recebido
14 Jul 2003