Resumo
This study reports the occurrence of Tachinaephagus zealandicus (Ashmead) (Hymenoptera: Encyrtidae) parasitizing pupae of Chrysomya megacephala (Fabricius) (Diptera: Calliphoridae) associated with a decomposing rat carcass in a secondary wood area in Campinas, SP. The parasitism rate was 91.8%.
fly; Tachinaephagus zealandicus; Chrysomya megacephala; rat carcass; Campinas
fly; Tachinaephagus zealandicus; Chrysomya megacephala; rat carcass; Campinas
mosca; Tachinaephagus zealandicus; Chrysomya megacephala; carcaça de rato; Campinas
COMUNICAÇÃO
Encontro do parasitóide Tachinaephagus zealandicus (Ashmead) (Hymenoptera: Encyrtidae) em pupas de Chrysomya megacephala (Fabricius) (Diptera: Calliphoridae) em carcaça de rato
Occurrence of the parasitoid Tachinaephagus zealandicus (Ashmead) (Hymenoptera: Encyrtidae) in pupae of Chrysomya megacephala (Fabricius) (Diptera: Calliphoridae) in rat carcass
T.C. Moretti; O.B. Ribeiro
Instituto de Biologia UNICAMP Caixa Postal 6109 13083-970 - Campinas, SP
Palavras-chave: mosca, Tachinaephagus zealandicus, Chrysomya megacephala, carcaça de rato, Campinas
ABSTRACT
This study reports the occurrence of Tachinaephagus zealandicus (Ashmead) (Hymenoptera: Encyrtidae) parasitizing pupae of Chrysomya megacephala (Fabricius) (Diptera: Calliphoridae) associated with a decomposing rat carcass in a secondary wood area in Campinas, SP. The parasitism rate was 91.8%.
Keywords: fly, Tachinaephagus zealandicus, Chrysomya megacephala, rat carcass, Campinas
Chrysomya megacephala (Fabricius, 1794) foi pela primeira vez observada no Brasil na década de 70 e dispersou-se rapidamente, atingindo todo o território nacional (Guimarães et al., 1978; Guimarães et al., 1979). Tem considerável importância médica e veterinária por atuar como vetor mecânico de patógenos, entre os quais protozoários (Greenberg, 1973), bactérias entéricas, como Shigella sp. e Salmonella sp. (La Paz, 1938) e helmintos, como Ascaris sp., Toxocara sp., Trichuris sp., Capillaria sp., oxiurídeos e tricostrongilídeos (Monzon et al., 1991; Oliveira et al., 2002), além de ser responsável por causar miíase secundária ( Leger e Couput, 1924).
Os adultos dessa mosca são atraídos por alimentos, fezes de origem humana e animal, depósitos de lixo, aterros sanitários e carcaça de animais. Além dos hábitos alimentares promíscuos, o grande tamanho e a grande quantidade de cerdas em seu corpo também constituem importantes fatores para a incriminação de C. megacephala como vetora mecânica de patógenos (Oliveira et al., 2002).
Atualmente, é considerada espécie eusinantrópica e cria-se com mais facilidade na área urbana, características que dificultam o controle químico, o qual pode representar perigo de contaminação ao homem, animais e ambiente. Nesse contexto, insere-se a possibilidade de utilização de microhimenópteros parasitóides no controle biológico de C. megacephala, por ser um método fácil, seguro e barato (Carvalho et al., 2003).
Tachinaephagus zealandicus (Ashmead, 1904) é uma espécie endoparasita gregária de larvas de dípteros superiores das famílias Calliphoridae, Sarcophagidae e Muscidae, comumente encontrada no hemisfério sul (Silveira et al., 1989). Johnston e Tiegs (1921) conduziram as primeiras investigações quanto à biologia desse microhimenóptero, envolvendo larvas de Calliphoridae provenientes de carcaças. Olton e Legner (1974) indicaram que as fêmeas de T. zealandicus são atraídas por material vegetal ou animal em decomposição.
O presente estudo relata a ocorrência do parasitóide T. zealandicus em pupas de C. megacephala associadas à carcaça de rato em área de formação vegetal secundária de 3.500m2, no município de Campinas, SP (22º49'15"S, 47º04'08"W). Objetiva-se disponibilizar tal informação para uso em controle biológico.
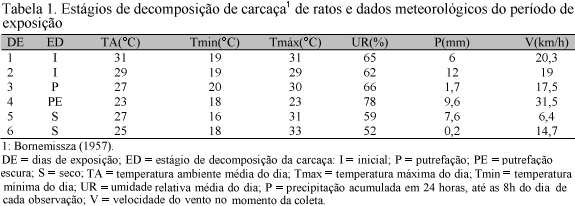
Expôs-se uma carcaça de rato (Rattus norvegicus, linhagem Wistar) de 251,75g em local parcialmente ensolarado, dentro da área de estudo. A carcaça foi acondicionada em embalagem plástica (15×10×10cm), cuja base foi retirada e substituída por uma tela de arame com malha reduzida entre nós, a qual permite fluxo de água, porém não permite a saída de imaturos de dípteros. Entre a tela de arame e a carcaça, foi colocada uma camada de 4cm de vermiculita, material adequado para absorver a umidade proveniente da água da chuva. Uma armação de ferro (30×30×30cm) revestida por tela de arame com malha de uma polegada entre nós foi fixada sobre a embalagem plástica, por meio de quatro ganchos de ferro, um em cada lado da base da gaiola, permitindo acesso de artrópodes, mas impedindo o acesso de animais carniceiros de grande porte. Durante o período de exposição da carcaça, parâmetros físicos foram medidos diariamente, sempre entre as 10 e 13 horas (Tab. 1). Após a decomposição total da carcaça, larvas e pupas foram retiradas da embalagem plástica exposta no ambiente e acondicionadas em pote plástico contendo vermiculita, substrato para pupariação das larvas. Esses potes foram mantidos no laboratório de entomologia sob temperatura de 25±1ºC e umidade relativa de 60±10%, para acompanhamento da emergência dos adultos.
A carcaça se decompôs totalmente em seis dias, entre os dias seis e 11 de dezembro de 2003. Ao longo do período de 25 dias da retirada da carcaça do campo, houve emergência de espécimes representantes das famílias Calliphoridae, Sarcophagidae, Muscidae e Fanniidae. Após esse período, restaram 73 pupas nas quais não houve emergência de dípteros. Tais pupas foram transferidas para um pequeno recipiente de vidro para observação.
Cinco dias após a transferência, notou-se a emergência de 43 fêmeas e 24 machos do microhimenóptero identificado como T. zealandicus. O dimorfismo sexual foi evidente, principalmente pelas características da antena. Baseando-se no formato e volume dos tubérculos na região posterior do pupário e na distância entre peritremas (Amorim e Ribeiro, 2001), constatou-se que os 73 pupários eram da espécie C. megacephala. A taxa de parasitismo para esse hospedeiro foi 91,8%. Foi possível notar que T. zealandicus é de comportamento gregário, mas não foi possível quantificar o número exato de parasitóides que emergiu de cada pupa.
Levantamentos realizados por Silveira et al. (1989) e Carvalho et al. (2003) relataram a ocorrência de T. zealandicus em pupas de Cochliomyia hominivorax (Coquerel) (Calliphoridae), C. megacephala e Syntesiomyia nudiseta (Wulp) (Muscidae).
Quanto ao segundo estudo, que trata especificamente de parasitóides do califorídeo C. megacephala, não há dados relativos à taxa de parasitismo, ou seja, houve apenas descrição de ocorrência. Pode-se afirmar que ainda faltam dados suficientes para concluir se T. zealandicus é ou não promissor alvo de programas de controle para moscas sinantrópicas. A duração dos ciclos de vida de T. zealandicus (±27 dias) e C. megacephala (±8 ½ dias) foi importante para que não se descartassem as pupas logo após o período referente ao ciclo de vida da mosca.
Segundo Marchiori et al. (1998), as áreas de matas são importantes locais de origem de parasitóides inimigos naturais de dípteros. É interessante notar que o presente estudo foi realizado em área de mata, porém com características secundárias e localizada dentro do perímetro urbano do distrito de Barão Geraldo, Campinas, São Paulo.
Uma questão importante no estudo de inimigos naturais de moscas sinantrópicas é o reconhecimento de quais fases do ciclo de vida do díptero estudado são vulneráveis a determinado parasitóide. Segundo Newman e Andrewartha (1930), T. zealandicus tem preferência por ovipor em larvas de moscas de terceiro instar. Isso permite inferir que o parasitismo no presente estudo deve ter ocorrido no campo, já que as larvas ficaram expostas no meio ambiente e só foram encaminhadas ao laboratório por ocasião da decomposição total da carcaça, quando a maioria das larvas já havia se transformado em pupas. Saber o local onde ocorreu o parasitismo é importante, por exemplo, quando se mantêm criações de moscas em laboratório.
Pode-se concluir que se fazem necessários estudos mais específicos quanto à biologia e ecologia local de T. zealandicus, com o intuito de incrementar programas de controle biológico de moscas sinantrópicas, tendo em vista a importância médico-veterinária de algumas espécies, e também a dificuldade de implementação de controle químico em certas regiões urbanas.
Recebido em 12 de julho de 2004
Aceito em 21 de setembro de 2005
E-mail: tmoretti@unicamp.br
- AMORIM, J.A.; RIBEIRO, O.B. Distinction among the puparia of three Blowfly species (Diptera: Calliphoridae) frequently found on unburied corpses. Mem. Inst. Oswaldo Cruz, v.96, p.781-784, 2001.
- BORNEMMISSZA, G.F. An analysis of arthropod sucession in carrion and the effect of its decomposition on the soil fauna. Austr. J. Zool, v.5, p.1-2, 1957.
- CARVALHO, A.R.; MELLO, R.P.; D´ALMEIDA, J.M. Microhimenópteros parasitóides de Chrysomya megacephala Rev. Saúde Pública, v.37, p.810-812, 2003.
- DE LA PAZ, G.C. The bacterial flora of flies caught in foodstores in the city of Manila. Mon. Bull. Bureau Health, v.18, p.1-20, 1938.
- GREENBERG, B. Flies and disease: biology and disease transmission. New Jersey: Princeton University, 1973. v.II, 447p.
- GUIMARÃES, J.H.; PRADO A.P.; BURALLI, G.M. Dispersal and distribution of three newly introduced species of Chrysomya Robineau-Desvoid in Brazil (Diptera: Calliphoridae). Rev. Bras. Entomol, v.23, p.245-255, 1979.
- GUIMARÃES, J.H.; PRADO A.P.; LINHARES, A.X. Three newly introduced blowflies species in southern Brazil (Diptera: Calliphoridae). Rev. Bras. Entomol., v.22, p.53-60, 1978.
- JOHNSTON, T.H.; TIEGS, O.W. On the biology and economic significance of the chalcid parasites of Australian sheep-maggot flies. Proc. R. Soc. Queensl., v.33, p.99-128,1921.
- LEGER, a.; COUPUT, A. Nasomyiase à Chrysomya dux. Esch. Bull. Soc. Pathol. Exot., v.17, p.375, 1924.
- MARCHIORI, C.H.; OLIVEIRA, A.T.; SCATOLINI, D. Ocorrência de espécies de Alysiinae (Hymenoptera: Braconidae) em áreas de mata nativa da região de Itumbiara, GO. Arq. Inst. Biol., v.65, p.43, 1998.
- MONZON, R.B.; SANCHEZ, A.R.; TADIAMAN, B.M. et al. A comparison of the role of Musca domestica (Linnaeus) and Chrysomya megacephala (Fabricius) as mechanical vectors of helminthic parasites in a typical slum area of metropolitan manila. Southeast Asian J. Trop. Med. Public Health, v.22, p.222-228, 1991.
- NEWMAN, L.J.; ANDREWARTHA, H.G. Blowfly parasite. The red- legged chalcid, Stenoterys fulvoventralis (Dodd). J. Dep. Agric. West. Aust, v.2, p. 89-95, 1930.
- OLIVEIRA, V.C.; MELLO, R.P.; D´ALMEIDA, J.M. Dípteros muscóides como vetores mecânicos de ovos de helmintos em jardim zoológico, Brasil. Rev. Saúde Pública, v.36, p.614-620, 2002.
- OLTON, G.S.; LEGNER, E.F. Biology of Tachinaephagus zealandicus (Hymenoptera: Encyrtidae), parasitoid of synanthropic diptera. Can. Entomol., v.106, p.785-800, 1974.
- SILVEIRA, G.A.R.; MADEIRA, N.G.; AZEREDO-ESPIN, A.M.L. et al. Levantamento de microhimenópteros parasitóides de dípteros de importância médico-veterinária no Brasil. Mem. Inst. Oswaldo Cruz, v.84, supl. IV, p.505-510, 1989.
Datas de Publicação
-
Publicação nesta coleção
19 Abr 2006 -
Data do Fascículo
Fev 2006
Histórico
-
Recebido
12 Jul 2004 -
Aceito
21 Set 2005