Resumos
Avaliaram-se, por meio da análise clínica, histopatologia e imunoistoquímica, os efeitos da aplicação da membrana amniótica xenógena fresca e conservada em glicerina, sobre os mecanismos imunológicos da superfície ocular. Para tal, utilizaram-se 40 coelhos, distribuídos em dois grupos experimentais, os quais foram avaliados por 21 dias. A avaliação clínica revelou que a membrana amniótica xenógena conservada em glicerina estimulou uma resposta inflamatória aguda maior que a membrana aplicada fresca. A análise histopatológica indicou que ambas se comportaram de forma semelhante a partir da primeira semana de pós-operatório, apresentando as alterações clássicas da resposta inflamatória da córnea, com o predomínio de infiltrado do tipo polimorfonuclear. A análise imunoistoquímica indicou que, ainda aos 21 dias, a resposta imune local é inespecífica, permitindo concluir que a resposta imune específica na córnea é tardia e que a córnea é um sítio privilegiado para aplicação de enxertos com características imunológicas diferentes, visto que não houve o estímulo para o desenvolvimento de uma resposta mais específica nos grupos avaliados durante toda a execução do experimento.
coelho; córnea; membrana amniótica; ceratoplastia
The dynamics of the inflammatory response and the mechanism involved in the healing process of cornea treated by keratoplasty, applying fresh and glycerin preserved xenogenous amniotic membranes as method to cover experimental ulcers were studied using 40 rabbits. The animals were allotted into two groups and evaluated during 21 days. The eyes were evaluated by histopathological study and immunohistochemical reaction. The clinical evaluation showed that the xenogenous amniotic membrane preserved in glycerin stimulated a greater acute inflammatory response than the one caused by fresh membrane. The histopathological analysis indicated that both membranes reacted in a very similar way from the first week post-surgery, presenting the classical alterations of the inflammatory response on the cornea. The immunohistochemical technique indicated that in no moment of the observation, the local immunologic response was specific. It was concluded that the specific immunologic response on the cornea took place later and that is a privileged site to use grafts with different immunological characteristics, once there was not a stimulus to the development of a more specific response in none of the evaluated groups throughout the experiment.
rabbit; cornea; amniotic membrane; keratoplasty
MEDICINA VETERINÁRIA
Aspectos clínicos e imunopatológicos da ceratoplastia com membrana amniótica xenógena fresca e conservada em glicerina. Estudo experimental em coelhos
Clinical and immunopathological aspects of keratoplasty with fresh and preserved in glycerin xenogenous amniotic membrane. Experimental study in rabbits
R.L. SampaioI; J.J.T. RanzaniII; V. Rodrigues JúniorIII; M.S. StacciariniIV; E.M. BragaV; C. BorrezziV
ICurso de Medicina Veterinária UNIUBE Av. do Tutuna, 720, Campus da FAZU 38061-500 Uberaba, MG
IIFaculdade de Medicina Veterinária e Zootecnia UNESP Botucatu, SP
IIIFaculdade de Medicina do Triângulo Mineiro Uberaba, MG
IVAluno de pós-graduação FCAV-UNESP Jaboticabal, SP
VResidente Hospital Veterinário de Uberaba - UNIUBE
RESUMO
Avaliaram-se, por meio da análise clínica, histopatologia e imunoistoquímica, os efeitos da aplicação da membrana amniótica xenógena fresca e conservada em glicerina, sobre os mecanismos imunológicos da superfície ocular. Para tal, utilizaram-se 40 coelhos, distribuídos em dois grupos experimentais, os quais foram avaliados por 21 dias. A avaliação clínica revelou que a membrana amniótica xenógena conservada em glicerina estimulou uma resposta inflamatória aguda maior que a membrana aplicada fresca. A análise histopatológica indicou que ambas se comportaram de forma semelhante a partir da primeira semana de pós-operatório, apresentando as alterações clássicas da resposta inflamatória da córnea, com o predomínio de infiltrado do tipo polimorfonuclear. A análise imunoistoquímica indicou que, ainda aos 21 dias, a resposta imune local é inespecífica, permitindo concluir que a resposta imune específica na córnea é tardia e que a córnea é um sítio privilegiado para aplicação de enxertos com características imunológicas diferentes, visto que não houve o estímulo para o desenvolvimento de uma resposta mais específica nos grupos avaliados durante toda a execução do experimento.
Palavras-chave: coelho, córnea, membrana amniótica, ceratoplastia
ABSTRACT
The dynamics of the inflammatory response and the mechanism involved in the healing process of cornea treated by keratoplasty, applying fresh and glycerin preserved xenogenous amniotic membranes as method to cover experimental ulcers were studied using 40 rabbits. The animals were allotted into two groups and evaluated during 21 days. The eyes were evaluated by histopathological study and immunohistochemical reaction. The clinical evaluation showed that the xenogenous amniotic membrane preserved in glycerin stimulated a greater acute inflammatory response than the one caused by fresh membrane. The histopathological analysis indicated that both membranes reacted in a very similar way from the first week post-surgery, presenting the classical alterations of the inflammatory response on the cornea. The immunohistochemical technique indicated that in no moment of the observation, the local immunologic response was specific. It was concluded that the specific immunologic response on the cornea took place later and that is a privileged site to use grafts with different immunological characteristics, once there was not a stimulus to the development of a more specific response in none of the evaluated groups throughout the experiment.
Keywords: rabbit, cornea, amniotic membrane, keratoplasty
INTRODUÇÃO
A transparência da córnea é um atributo fundamental para a perfeita formação da imagem pelo aparelho visual. Esta qualidade está relacionada a algumas características que diferenciam a córnea de outros tecidos. Dentre as mais peculiares destacam-se a ausência de vasos sangüíneos e linfáticos, ausência de pigmentos, disposição ortogonal das fibras de colágeno, presença de fibras nervosas amielínicas, epitélio não queratinizado e baixo índice de hidratação, que mantém o arranjo perfeito de suas camadas. Porém, várias enfermidades podem comprometer estas características, interferindo na transparência da córnea e, assim, limitando a capacidade da visão (Scroggs e Klintworth, 1992; Barros et al., 1998; Gelatt, 1999; Chen et al., 2000; Ti e Tseng, 2002).
Dessa forma, conhecendo-se as conseqüências das lesões da córnea sobre a acuidade visual, e com base nos seus mecanismos de reparação diante dos diversos processos mórbidos, torna-se necessária a rápida instituição de medidas terapêuticas eficazes. O tratamento das lesões corneanas abrange procedimentos clínicos e condutas cirúrgicas, sendo que a instituição de um ou de outro depende do diagnóstico correto da causa primária, bem como da identificação dos agentes secundários envolvidos e da criteriosa avaliação dos danos causados à córnea (Monteiro et al., 2000; Sridhar et al., 2000; Anderson et al., 2001; Kjaergaard et al., 2001).
Vários métodos de reparação cirúrgica das lesões corneanas têm sido estudados ao longo de mais de 200 anos de pesquisas. Já no século XVIII, Quengsy, em 1789, citado por Guimarães (1979), propôs a utilização de placas de vidro em substituição às córneas lesadas. A partir dessa época, vários estudos envolvendo técnicas de ceratoplastia foram desenvolvidos, com ênfase, nos últimos anos, para a utilização de membranas fetais (Matthews et al., 1982; Wang et al., 2001; Woo et al., 2001).
O transplante de membrana amniótica tem sido indicado como método coadjuvante no tratamento de inúmeras doenças oculares relacionadas à superfície do olho, como a reconstrução de defeitos primários da córnea e o tratamento das moléstias epiteliais recorrentes ou refratárias a outros tipos de tratamento, associadas ou não à deficiência de células limbais. Existem também relatos da utilização da membrana amniótica no tratamento do pterígio e da síndrome de Stevens-Johnson em humanos, do seqüestro corneano dos felinos, na correção de cicatrizes corneanas secundárias a outras enfermidades inflamatórias crônicas da superfície ocular e na reconstrução de defeitos secundários à ressecção de tumores (Honavar et al., 2000; Ma et al., 2000; Espana et al., 2002; Ti e Tseng, 2002; Barabino e Rolando, 2003; Espana et al., 2003; Kavinski et al., 2004).
Apesar do grande avanço nas pesquisas que envolvem a utilização de membranas biológicas no tratamento das doenças que atingem a córnea, pouco tem sido feito com o objetivo de se estudar como a superfície ocular reage ao contato de material biológico estranho (Matthews et al., 1982; Choi e Tseng, 2001; Anderson et al., 2001; Dekaris et al., 2001; Espana et al., 2003).
Os objetivos deste trabalho foram avaliar, por métodos macroscópicos e microscópicos, a cinética da resposta inflamatória da superfície ocular, quando sensibilizada pela presença de biomaterial imunogenicamente estranho ao receptor, e padronizar a técnica de imunoistoquímica em tecidos criopreservados para o estudo dos mecanismos imunológicos da superfície ocular.
MATERIAL E MÉTODOS
Foram utilizados 40 coelhos da raça Nova Zelândia, distribuídos aleatoriamente em dois grupos experimentais com 20 animais cada. No grupo 1 (G1), foi realizada ceratoplastia com membrana amniótica xenógena conservada em glicerina e no grupo 2 (G2), ceratoplastia com membrana amniótica xenógena a fresco. Após a distribuição dos animais de acordo com o tratamento proposto, cada grupo foi dividido aleatoriamente em quatro subgrupos de cinco animais cada. Determinou-se, para cada subgrupo, um período pós-operatório para avaliação da evolução clínica e colheita do material necessário à avaliação da metodologia proposta como segue: subgrupo 1 (T1), 72 horas; subgrupo 2 (T2), 7 dias; e subgrupo 3 (T3), 14 dias; subgrupo 4 (T4), 21 dias.
A membrana amniótica foi obtida de bovinos no momento do abate e preparada conforme metodologia descrita por Kim e Tseng (1995). A membrana utilizada no G1 foi cortada e colocada sobre discos de nitrocelulose de 10 cm de diâmetro, com a porção epitelial voltada para cima e a porção representada pela membrana basal em contato com o papel. Os discos contendo a membrana foram mantidos em solução de glicerina a 100% a 40C, por um período de 30 dias. A membrana amniótica xenógena a fresco utilizada na ceratoplastia do G2 foi obtida de forma semelhante e utilizada imediatamente após a colheita.
Os animais foram anestesiados pela via intramuscular com uma mistura de quetamina (30mg/kg) e cloridrato de xilazina (5mg/kg), após pré-medicação com acepromazina (0,2mg/kg), seguidos da aplicação de colírio anestésico imediatamente antes do ato operatório. Para permitir a manobra cirúrgica foi realizado o afastamento das pálpebras, com o auxílio do blefarostato Barraquer infantil, e fixação mecânica do bulbo do olho. O olho a ser operado foi escolhido de forma aleatória e preparado para a cirurgia fazendo-se antissepsia com solução de povidine a 0,2%. Após a remoção do epitélio corneano, por meio de haste flexível com algodão embebido em n-hepatnol, aplicou-se o enxerto de membrana amniótica sobre o estroma corneano, com a porção epitelial voltada para baixo, e procedeu-se à sua sutura na região perilimbal, com pontos simples separados, utilizando-se fio monofilamentado sintético 7-0.
A avaliação clínica consistiu na observação dos fenômenos relacionados com a evolução clínico-cirúrgica dos pacientes, tais como dor, representada pelos sinais de fotofobia e blefarospasmo, secreção ocular, edema da córnea e da conjuntiva, neovascularização corneana e grau de transparência da córnea. Observou-se, ainda, o tempo de permanência da membrana sobre a córnea e o intervalo de tempo necessário para a total epitelização da área de ceratectomia. Todas as alterações foram qualificadas e posteriormente quantificadas de forma subjetiva em: ausente (0), leve (1), moderada (2) e intensa (3).
Pesquisaram-se, mediante microscopia, os eventos relacionados com a resposta inflamatória e os mecanismos de reparação do defeito corneano. Para a colheita do material de cada subgrupo, os coelhos foram novamente anestesiados, utilizando-se a mesma técnica empregada para a realização da ceratoplastia. Foram retirados fragmentos da córnea, os quais foram fixados em formalina tamponada a 10%, incluídos em parafina, cortados em micrótomo convencional com espessura de 5µm e corados com hematoxilina e eosina. Observou-se, no exame microscópico, o tipo e a intensidade do infiltrado inflamatório e a epitelização da córnea.
Realizou-se, também, a pesquisa da resposta imune específica da superfície ocular por imunoistoqímica, por meio da identificação de linfócitos T CD4 e linfócitos T CD8 no tecido corneano. Para isso, fragmentos da córnea foram criopreservados em nitrogênio líquido, à temperatura de -196ºC e, posteriormente, incluídos em meio OCT1 1 Tissue-tek ®: OCT compound (embedding medium for frozen tissue specimens to ensure optimal cutting temperatures). Sakura finetek U.S.A., Inc. Torrance, CA 90051, USA. , sendo então cortados a uma espessura de 5µm, em criostato2 2 Cryocut 1800 ®: Reichert-Jung . O material obtido dos cortes foi montado em lâminas de vidro3 3 Dako ® Silanized Slides: Dako Corporation, Carpinteria, CA 93013, USA. e submetido à técnica de imunoistoquímica, cuja padronização foi realizada em cortes de linfonodos mesentéricos dos animais em estudo, o que permitiu atestar a eficácia da técnica e definir a melhor diluição para a reação imunoenzimática, visto que, nesse tecido, naturalmente residem populações dos linfócitos aqui pesquisados. Os cortes dos linfonodos foram obtidos no mesmo momento da colheita dos fragmentos da córnea, por meio de laparotomia pela linha média ventral. Após as etapas de colheita do material, os animais foram submetidos à eutanásia com a aplicação de pentobarbital sódico a 3% pela via intraperitoneal.
RESULTADOS E DISCUSSÃO
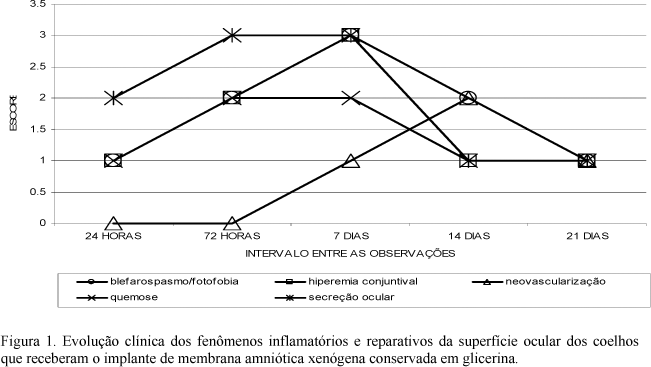
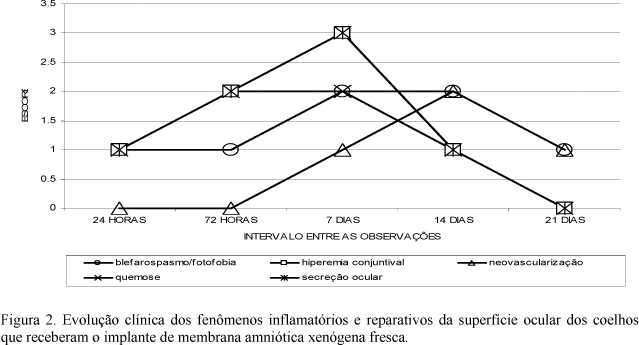
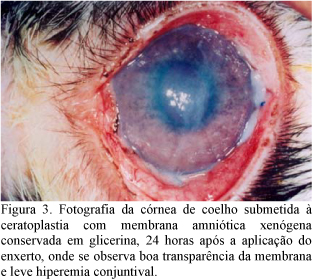
A avaliação clínica demonstrou que no G1 os fenômenos relacionados à dor e inflamação se mostraram com índices maiores em todos os intervalos de observação; porém, a cinética da resposta inflamatória foi semelhante entre os animais de G1 e G2 (Fig. 1 e 2). Isso permitiu inferir que a inflamação inicial se deu a partir da agressão cirúrgica, o que ocasionou a liberação dos fatores pró-inflamatórios originados a partir da conversão dos fosfolipídios da membrana das células destruídas em ácido araquidônico. Como ilustrado nas Fig. 3 e 4, esses fatores agiram aumentando o fluxo sangüíneo local por meio da vasodilatação, caracterizada por hiperemia conjuntival e, posteriormente, aumentaram a permeabilidade vascular no local, o que se manifestou na forma de edema (Kim e Tseng, 1995; Barros et al., 1998; Adds et al., 2001).
A permeabilidade vascular aumentada e a presença de substâncias quimiotáticas contribuíram para a marginação leucocitária e diapedese, aumentando a capacidade de recrutamento de células de defesa, representadas, nesse momento, pelos polimorfonucleares. Semelhante ao que foi descrito por Anderson et al. (2001), foi possível também observar que a reparação do defeito criado na córnea de ambos os grupos aconteceu de forma mais lenta, porém, progressiva, o que pode ser explicado tanto pela tendência à cronicidade do processo inflamatório, estimulado pela presença de fragmentos da membrana, quanto pela ausência das células tronco do limbo destruídas durante a aplicação do n-heptanol. Isso confirma que a córnea possui mecanismos próprios para a recuperação da sua funcionalidade e que a proximidade com a conjuntiva lhe confere subsídios tróficos e defesa necessária para a sua plena reparação (Barros et al., 1998; Choi e Tseng, 2001; Espana et al., 2003; Marinho et al., 2003).
Neste experimento, observou-se que o enxerto permaneceu, por mais tempo, nos olhos que receberam a membrana conservada em glicerina, mantendo-se aplicada sobre a córnea por um período médio de sete dias. No grupo que recebeu a membrana fresca, o implante permaneceu firmemente aderido sobre a superfície ocular por um período médio de seis dias. Observou-se, por meio de analise clínica, que a intensidade dos fenômenos inflamatórios diminuiu a partir da total liberação da membrana, permitindo, então, a conclusão dos fenômenos reparativos (Fig. 5 e 6). Nos animais submetidos à ceratoplastia com membrana conservada em glicerina, a total cicatrização aconteceu após 12 dias, e nos animais tratados com o enxerto fresco, aos 10 dias de pós-operatório. A revisão da literatura revela que o tempo de permanência do enxerto sobre a área de ceratectomia varia de acordo com a origem da membrana e as características da superfície ocular, sendo que a mesma é absorvida mais cedo nos olhos que já apresentavam inflamação local, como demonstrado por diversos autores (Chen et al., 2000; Kim et al., 2000; Monteiro et al., 2000; Dekaris et al., 2001).
À microscopia, observou-se, aos três dias de pós-operatório, a presença de infiltrado inflamatório intenso em ambos os grupos, localizado principalmente nas camadas superficiais da periferia do estroma, enquanto a região central apresentou quantidade moderada de células polimorfonucleares. Ainda nesse período, a proliferação vascular mostrou-se mais intensa na periferia, tendo sido observado que alguns vasos ocasionalmente apresentaram-se mais longos, invadindo o estroma em direção ao centro da córnea. A intensidade dessa resposta também pode ser explicada pela lesão provocada na superfície ocular pelo n-heptanol, o que também foi encontrado por outros autores que experimentaram a utilização da membrana amniótica sobre córneas recentemente traumatizadas (Chen et al., 2000; Sridhar et al., 2000; Anderson et al., 2001; Duchesne et al., 2001; Gris et al., 2002).
Aos sete dias, observou-se proliferação epitelial em ambos os grupos, com destaque para os animais tratados com a membrana fresca. Nestes, o infiltrado inflamatório da córnea apresentou-se moderado na periferia e na região subepitelial central e leve na porção inferior do estroma. A proliferação vascular mostrou-se também menos intensa nessa fase, demonstrando que o enxerto fresco apresentou menor atividade imunogênica e angiogênica. Nessa fase, foi possível observar maior quantidade de células inflamatórias nos animais do G1, nos quais a proliferação vascular também se mostrou mais intensa, tendo sido observada a presença de vasos sangüíneos nas camadas mais profundas e centrais da córnea. Não foi possível confirmar a ação inibitória da membrana amniótica sobre a formação vascular, visto que, após o rompimento da membrana, o fragmento do enxerto permaneceu agredindo a superfície da córnea, estimulando a resposta inflamatória local (Shimmura et al., 2001; Stoiber et al., 2002).
No 14º dia de pós-operatório, verificou-se que o epitélio já se encontrava completamente formado em todos os coelhos de ambos os grupos. Além disso, a partir desse dia, houve redução no número de células inflamatórias, representadas exclusivamente por polimorfonucleares. Também se observou o aumento no número e diâmetro dos vasos sangüíneos, os quais passaram a invadir a porção central da córnea, principalmente no interior do estroma. Os resultados apresentados demonstram que existe intensa quimiotaxia durante a fase aguda da resposta inflamatória e que esta permanece durante todo o processo de reparação, indicando que, mesmo com o início da cicatrização, quando já se observa clinicamente diminuição da resposta inflamatória local, o sistema de defesa celular permanece ativo, aguardando uma possível complicação do processo de cicatrização (Fig. 7). Semelhante ao que foi encontrado neste experimento, Sotozono (2000) sugeriu que a inflamação da córnea, comum em várias doenças, freqüentemente leva à destruição tecidual, podendo contribuir para o desenvolvimento de úlceras e de perfurações, mesmo quando o processo inflamatório inicial não se caracteriza pela perda de substância.
Ao se comparar os resultados de G1 e G2, observou-se que a evolução clínica dos olhos que receberam a aplicação da membrana fresca foi mais favorável, o que, em parte, pode ser explicado pelo fato de o enxerto ter sido eliminado mais cedo. Porém, a presença do fragmento da membrana que permaneceu preso pela sutura passou a agredir a córnea, contribuindo para perpetuar a resposta inflamatória e retardar a cicatrização. Esse fato pode ser comprovado pela intensidade da formação vascular na intimidade do tecido corneano, o que sugere um aspecto de cronicidade, caracterizando que houve a perpetuação da agressão. Nos animais que receberam a membrana conservada em glicerina, observou-se maior intensidade dos fenômenos relacionados à inflamação, principalmente após a primeira semana de pós-operatório, podendo esse fato, mais uma vez, ser explicado pela permanência da membrana por um período longo sobre a superfície ocular. Outros estudos também comprovaram grande atividade quimiotática da córnea durante aplicação de biomateriais imunogenicamente estranhos, mostrando que, apesar de sua aparente anergia em condições normais, a córnea utiliza plenamente os mecanismos de defesa presentes na superfície ocular quando é agredida (Choi e Tseng, 2001; Gris et al., 2002; Ueta et al., 2002; Espana et al., 2003; Barabino e Rolando, 2003; Marinho et al., 2003).
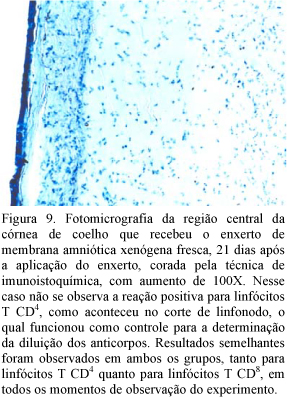
Os resultados obtidos pela análise imunoistoquímica demonstraram que a resposta inflamatória apresentada pelo modelo experimental proposto foi inespecífica para ambos os grupos, visto que não foi identificada a presença de linfócitos T CD4+ e linfócitos T CD8+ em qualquer momento da observação. A imunoistoquímica complementou os achados obtidos mediante a avaliação histológica, que permitiu identificar a presença de infiltrado inflamatório do tipo polimorfonuclear, com predominância de neutrófilos, confirmando que não houve uma resposta imune específica para o reconhecimento do material utilizado como enxerto (Fig. 8 e 9). Em outros experimentos, a análise histológica revelou que o infiltrado inflamatório predominante nos primeiros dias de pós-operatório é do tipo polimorfonuclear, não confirmando a existência de outros tipos celulares por métodos imunoistoquímicos, como verificado nesta pesquisa (Kim e Tseng, 1995; Barros et al., 1998; Chen et al., 2000; Honavar et al., 2000; Anderson et al., 2001; Shimmura et al., 2001; Ueta et al., 2002).
CONCLUSÕES
A metodologia proposta foi exeqüível como modelo experimental para o estudo da inflamação e reparação da superfície ocular, demonstrando que tem uma pequena capacidade de assimilar antígenos provenientes de membranas biológicas utilizadas como enxerto, visto que a resposta imune, aos 21 dias, ainda se mostrava inespecífica. Observou-se que a conjuntiva também reagiu tardiamente aos estímulos antigênicos, concluindo-se que o processamento local dos antígenos provenientes da membrana amniótica e a sua rápida eliminação pela superfície ocular evitaram a assimilação destes pelas células apresentadoras de antígeno e a provável deflagração de uma resposta específica, tanto celular quanto humoral. As avaliações clínica, histológica e imunoistoquímica confirmaram que existe um antagonismo entre a cinética da resposta inflamatória e a consolidação dos fenômenos reparativos dos tecidos que compõem a superfície ocular, demonstrando que, enquanto persiste a fase mais aguda da inflamação, a cicatrização apresenta-se lenta. A capacidade de resposta local demonstrada pela grande população de células do tipo polimorfonuclear, presentes após a lesão, sugeriram que a superfície ocular possui ampla e eficiente capacidade de resposta à agressão. A tolerância imunológica observada pela superfície ocular, nesse modelo experimental, demonstrou a viabilidade da utilização da membrana amniótica xenógena fresca e conservada em glicerina, no tratamento das lesões da superfície ocular; porém, a utilização das membranas deve ser vista como fator coadjuvante de todo o processo de reparação, tendo o momento certo de ser aplicada e retirada, não devendo concorrer com os mecanismos intrínsecos de inflamação e reparação.
Recebido em 25 de julho de 2005
Aceito em 18 de julho de 2006
E-mail: relisampa@aol.com
- ADDS, P.J.; HUNT, C.J.; DART, J.K. Amniotic membrane grafts, fresh or frozen? A clinical and in vitro comparison. Br. J. Ophthalmol, v.85, p.905-907, 2001.
- ANDERSON, D.F.; ELLIES, P.; PIRES, R.T. et al. Amniotic membrane transplantation for partial limbal stem cell deficiency. Br. J. Ophthalmol, v.85, p.567-575, 2001.
- BARABINO, S.; ROLANDO, M. Amniotic membrane transplantation elicits goblet cell repopulation after conjunctival reconstruction in a case of severe ocular cicatricial pemphigoid. Acta Ophthalmol. Scand, v.81, p.68-71, 2003.
- BARROS, P.S.M.; GARCIA, J.A.; LAUS, J.L. et al. The use of xenologous amniotic membrane to repair canine corneal perforation created by penetrating keratectomy. Vet Ophthalmol., v.1, p.119-123, 1998.
- CHEN, H.J.; PIRES, R.T.F.; TSENG, S.C.G. Amniotic membrane transplantation for severe neurotrophic corneal ulcers. Br. J. Ophthalmol, v.84, p.826-833, 2000.
- CHOI, T.H.; TSENG, S.C. In vivo and in vitro demonstration of epithelial cell-induced myofibroblast differentiation of keratocytes and an inhibitory effect by amniotic membrane. Cornea, v.20, p.197-204, 2001.
- DEKARIS, I.; GABRIC, N.; MRAVICIC, I. et al. Multilayer vs. monolayer amniotic membrane transplantation for deep corneal ulcer treatment. Coll. Antropol, v.25, p.23-28, 2001.
- DUCHESNE, B.; TAHI, H.; GALAND, A. Use of human fibrin glue and amniotic membrane transplant in corneal perforation (case report). Cornea, v.20, p.230-232, 2001.
- ESPANA, E.M.; GRUETERICH, M.; SENG, E.T. et al. Phenotypic study of a case receiving a keratolimbal allograft and amniotic membrane for total limbal stem cell deficiency. Ophthalmology, v.110, p.481-486, 2003.
- ESPANA, E.M.; PRABHASAWAT, P.; GRUETERICH, M. et al. Amniotic membrane transplantation for reconstruction after excision of large ocular surface neoplasias. Br. J Ophthalmol, v.86, p.640-645, 2002.
- GELATT, K.N. Veterinary ophthalmology 3.ed. Baltimore: Lippincott Williams & Wilkins, 1999. 1544p.
- GRIS, O.; WOLLEY-DOD, C.; GÜELL, J.L. et al. Histologic findings after amniotic membrane graft in the human cornea. Ophthalmology, v.109, p.508-512, 2002.
- GUIMARÃES, R. Q. Ceratoplastia interlamelar xenógena de galinha em coelho, utilizando córneas conservadas em cloreto de sódio por três dias, um mês e 14 anos. Estudo biomicroscópico e histopatológico 1979. 233f. Tese (Doutorado em Oftalmologia) Faculdade de Medicina, Universidade Federal de Minas Gerais, Belo Horizonte.
- HONAVAR, S.G.; BANSAL, A.K.; SANGWAN, V.S. et al. Amniotic membrane transplantation for ocular surface reconstruction in Stevens-Johnson Syndrome. Ophthalmology, v.107, p.975-579, 2000.
- KAVINSKI, L.C.; TEIXEIRA, R.B.; PRESOTTO, E.J. Transplante de membrana amniótica para reconstrução da superfície corneal pós-ceratectomia em gatos com seqüestro corneal. Santa Catarina: CRMV-SC, 2002. Disponível em: <http:www.crmvsc.org.br/>. Acessado em: 29 mar. 2004
- KIM, J.C.; TSENG, S.C. Transplantation of preserved human amniotic membrane for surface reconstruction in severely damaged rabbit corneas. Cornea, v.14, p.473-84, 1995.
- KIM, J.S.; KIM, J.C.; NA, B.K. et al. Amniotic membrane patching promotes healing and inhibits proteinase activity on wound healing following acute corneal alkali burn. Exp. Eye Res, v.70, p.329-337, 2000.
- KJAERGAARD, N.; HEIN, M.; HYTTEL, L. et al. Antibacterial properties of human amnion and chorion in vitro. Eur. J. Obstet. Gynecol. Reprod. Biol, v.94, p.221-229, 2001.
- MA, D.H.K.; SEE, L.C.; LIAU, S.B. et al. Amniotic membrane graft for primary pterygium: comparison with conjunctival autograft and topical mitomycin C treatment. Br. J. Ophthalmol, v.84, p.973-978, 2000.
- MARINHO, D.; HÖFLING-LIMA, A.L.; KWITKO, S. et al. Does amniotic membrane transplantation improve the outcome of autologous limbal transplantation? Cornea, v.22, p.338-342, 2003.
- MATTHEWS, R.N.; FAULK, W.P.; BENNETT, J.P. A review of the role of amniotic membranes in surgical practice. Obstet. Gynecol. Annu, n.11, p.31-58, 1982.
- MONTEIRO, E.C.L.; SCHELLINI, S.A.; MARQUES, M.E.A. et al. Tratamento da úlcera corneana experimental com membrana amniótica. Arq. Bras. Oftalmol, v.63, p.33-37, 2000.
- SCROGGS, M.W.; KLINTWORTH, G.K. Normal eye and adanexa. In:___. Histology for pathologists New York: Raven Press, 1992. p.903-10.
- SHIMMURA, S.; SHIMAZAKI, J.; OHASHI, Y. et al. Antiinflammatory effects of amniotic membrane transplantation in ocular surface disorders. Cornea, v.20, p.408-413, 2001.
- SOTOZONO, C. Second injury in the cornea: the role of inflammatory cytokines in corneal damage and repair. Cornea, v.19, p.155-159, 2000.
- SRIDHAR, M.S.; BANSAL, A. K.; SANGWAN, V.S. et al. Amniotic membrane transplantation in acute chemical and thermal injury. Am. J. Ophthalmol, v.130, p.134-137, 2000.
- STOIBER, J.; MUSS, W.H.; POHLA-GUBO, G. et al. Histopathology of human corneas after amniotic membrane and limbal stem cell transplantation for severe chemical burn. Cornea, v.21, p.482-489, 2002.
- TI, S.; TSENG, S.C. management of primary and recurrent pterygium using amniotic membrane transplantation. Curr. Opin. Ophthalmol, v.13, p.204-212, 2002.
- UETA, M.; KWEON, M.N.; SANO, Y. et al. Immunosuppressive properties of human amniotic membrane for mixed lymphocyte reaction. Clin. Exp. Immunol, v.129, p.464-470, 2002.
- WANG, M.X.; GRAY, T.B.; PARK, W.C. et al. Reduction in corneal haze and apoptosis by amniotic membrane matrix in excimer laser photoablation in rabbits. Cataract. Refract. Surg, v.27, p.310-319, 2001.
- WOO, H.M.; KIM, M.S.; KWEON, O.K. et al. Effects of amniotic membrane on epithelial wound healing and stromal remodeling after excimer laser keratectomy in rabbit cornea. Br. J. Ophthalmol, v.85, p.345-349, 2001.
Datas de Publicação
-
Publicação nesta coleção
14 Mar 2007 -
Data do Fascículo
Dez 2006
Histórico
-
Aceito
18 Jul 2006 -
Recebido
25 Jul 2005