Resumos
Utilizaram-se marcadores microssatélites para estimar a diversidade genética de grupos de pacu (Piaractus mesopotamicus) coletados nas escadas de transposição das hidroelétricas de Canoas I (CI) e Canoas II (CII), no Rio Paranapanema, e de um estoque e uma progênie utilizados em programas de repovoamento nesse rio. Os loci microssatélites produziram 16 alelos e heterozigosidade observada média similar entre os indivíduos do rio nos dois tempos de coleta (CI14 = 0,7356; CI28 = 0,7361; CII14 = 0,7442; e CII28 = 0,7507), do estoque e da progênie (0,7261 e 0,7287, respectivamente). Foram observados desvios no equilíbrio de Hardy-Weinberg, e valores negativos do índice de fixação com excesso de heterozigotos que indicaram ausência de endogamia. As análises de diversidade genética (distância e identidade genética, índice de Shannon, F ST e AMOVA) foram indicativas de baixa diferenciação genética e conduziram ao agrupamento dos indivíduos do rio, sugerindo que essa espécie está geneticamente estruturada como uma única população. Foram verificados baixa diferenciação genética e altos valores do número de migrantes entre os indivíduos do rio, do estoque e da progênie, o que presume a origem comum derivada dos constantes repovoamentos realizados nesse rio a partir dessas populações estocadas.
peixe; pacu; conservação genética; diversidade genética; escadas de transposição
This study used microsatellites markers to determine the genetic diversity of pacu (Piaractus mesopotamicus) groups collected at passage ladders of the hydroelectric plants (HEP) Canoas I (CI) and Canoas II (CII) - Paranapanema River - and of a broodstock and a progeny in stock enhancement programs in that river. The microsatellite loci produced 16 alleles and a similar heterozygosity between the individuals of the river at both times of collection (CI14 = 0.7356, CI28 = 0.7361, CII14 = 0.7442, and CII28 = 0.7507), as well of the broodstock and the progeny (0.7261 and 0.7287, respectively). Deviations were observed in Hardy-Weinberg equilibrium and negative values of fixation index with excess of heterozygosity indicated endogamy absence. The genetic diversity analyses (distance and genetic identity, Shannon index, F ST, and AMOVA) were signs of low genetic differentiation, and they led to the clustering of river individuals, suggesting that the species is genetically structured as a single population. Low genetic differentiation and high values of numbers of migrates among the river, the stock, and the progeny individuals were verified, suggesting a common origin derived from the constant stocks enhancement programs accomplished in that river with those stock populations.
fish; genetic conservation; genetic diversity; passage ladders
ZOOTECNIA E TECNOLOGIA E INSPEÇÃO DE PRODUTOS DE ORIGEM ANIMAL
Avaliação genética de populações naturais e de estoques de um programa de repovoamento de pacu (Piaractus mesopotamicus) utilizando marcadores microssatélite
Genetic evaluation of pacu (Piaractus mesopotamicus) natural populations and from the broodstocks of a stock enhancement program using microsatellite markers
N.M. Lopera-BarreroI; R.P. RibeiroII; J.A. PovhI; R.N. SirolIII; C.A. MangolinIV
IInstituto de Ciências Agrárias e Tecnológicas - UFMT - Rondonópolis, MT
IIDepartamento de Zootecnia - UEM - Maringá, PR
IIICPFL Geração - São Paulo, SP
IVDepartamento de Biologia Celular e Genética - UEM - Maringá, PR
RESUMO
Utilizaram-se marcadores microssatélites para estimar a diversidade genética de grupos de pacu (Piaractus mesopotamicus) coletados nas escadas de transposição das hidroelétricas de Canoas I (CI) e Canoas II (CII), no Rio Paranapanema, e de um estoque e uma progênie utilizados em programas de repovoamento nesse rio. Os loci microssatélites produziram 16 alelos e heterozigosidade observada média similar entre os indivíduos do rio nos dois tempos de coleta (CI14 = 0,7356; CI28 = 0,7361; CII14 = 0,7442; e CII28 = 0,7507), do estoque e da progênie (0,7261 e 0,7287, respectivamente). Foram observados desvios no equilíbrio de Hardy-Weinberg, e valores negativos do índice de fixação com excesso de heterozigotos que indicaram ausência de endogamia. As análises de diversidade genética (distância e identidade genética, índice de Shannon, FST e AMOVA) foram indicativas de baixa diferenciação genética e conduziram ao agrupamento dos indivíduos do rio, sugerindo que essa espécie está geneticamente estruturada como uma única população. Foram verificados baixa diferenciação genética e altos valores do número de migrantes entre os indivíduos do rio, do estoque e da progênie, o que presume a origem comum derivada dos constantes repovoamentos realizados nesse rio a partir dessas populações estocadas.
Palavras-chave: peixe, pacu, conservação genética, diversidade genética, escadas de transposição
ABSTRACT
This study used microsatellites markers to determine the genetic diversity of pacu (Piaractus mesopotamicus) groups collected at passage ladders of the hydroelectric plants (HEP) Canoas I (CI) and Canoas II (CII) - Paranapanema River - and of a broodstock and a progeny in stock enhancement programs in that river. The microsatellite loci produced 16 alleles and a similar heterozygosity between the individuals of the river at both times of collection (CI14 = 0.7356, CI28 = 0.7361, CII14 = 0.7442, and CII28 = 0.7507), as well of the broodstock and the progeny (0.7261 and 0.7287, respectively). Deviations were observed in Hardy-Weinberg equilibrium and negative values of fixation index with excess of heterozygosity indicated endogamy absence. The genetic diversity analyses (distance and genetic identity, Shannon index, FST, and AMOVA) were signs of low genetic differentiation, and they led to the clustering of river individuals, suggesting that the species is genetically structured as a single population. Low genetic differentiation and high values of numbers of migrates among the river, the stock, and the progeny individuals were verified, suggesting a common origin derived from the constant stocks enhancement programs accomplished in that river with those stock populations.
Keywords: fish, genetic conservation, genetic diversity, passage ladders
INTRODUÇÃO
Apesar da grande importância que os peixes representam para os ecossistemas aquáticos e para o homem como fonte de alimentação, mudanças ambientais e principalmente interferências antrópicas têm reduzido drasticamente a população natural de diversas espécies migradoras neotropicais. Entre essas espécies, destaca-se o pacu, Piaractus mesopotamicus, segundo peixe nativo mais cultivado no Brasil, que, embora apresente excelentes características de adaptação ao cativeiro, vem apresentando redução progressiva de sua população natural (Lopera-Barrero et al., 2008a).
Como tentativa de minimizar o impacto negativo da construção de barragens hidroelétricas, algumas ações de conservação vêm sendo utilizadas, como, por exemplo, a construção de escadas de transposição de peixes (Sirol e Britto, 2006) e a utilização de programas de repovoamento (Lopera-Barrero et al., 2007).
As escadas de transposição são mecanismos que visam principalmente ao acesso dos peixes migradores a montante ou a jusante da barragem durante o período reprodutivo. Limitações na sua eficácia advindas do processo de recrutamento e subtração dos peixes da jusante (Levin e Schiewe, 2001), atraso da migração e da desova (Agostinho et al., 2002) e impedimento da conclusão do processo reprodutivo (Paula, 2006) podem ocasionar diminuição da variabilidade genética dessas populações pela pressão de seleção.
Os programas de repovoamento são estratégias de conservação da biodiversidade aquática, que consiste em restabelecer populações naturais a partir da liberação de alevinos obtidos de estações de piscicultura (Lopera-Barrero et al., 2007). O manejo reprodutivo realizado nessas estações, quando feito de forma inadequada (poucos reprodutores durante o acasalamento, por exemplo), pode diminuir a variabilidade genética das progênies que serão liberadas no rio e a capacidade de adaptação às diferentes condições ambientais (Povh et al., 2008a). Por esses motivos, é primordial o monitoramento genético dos programas de repovoamento (Lopera-Barrero et al., 2008b) e da efetividade das escadas de transposição na preservação de populações de peixes migradores (Paula, 2006). Para isso, análises genéticas de populações naturais e de estoques mantidos em cativeiro são fundamentais para a conservação das espécies de peixes (Povh et al., 2008a) e do ecossistema.
O objetivo deste estudo foi estimar a diversidade genética de grupos de pacu coletados nas escadas de transposição das hidroelétricas de Canoas I e Canoas II em dois tempos diferentes, durante o período reprodutivo, e de um estoque e uma progênie utilizados em programas de repovoamento do Rio Paranapanema, usando os marcadores microssatélites.
MATERIAL E MÉTODOS
Amostras de nadadeira caudal de P. mesopotamicus foram coletadas nas escadas utilizadas para a transposição dos peixes nas barragens da usina hidroelétrica Duke Energy International (Geração Paranapanema), localizadas nos reservatórios Canoas I (22º 56'S; 50º 31'W) e Canoas II (22º 56'S; 50º 15'W), nos municípios de Cândido Mota, SP, e Palmital, SP, respectivamente. Foram realizadas duas coletas durante o período de piracema da espécie (14/02/09 = 30 amostras e 28/02/09 = 26 amostras). Quinze amostras do estoque de reprodutores de P. mesopotamicus e 69 larvas destinadas a programas de repovoamento no Rio Paranapanema (geradas a partir do cruzamento de indivíduos procedentes desse estoque de reprodutores) foram coletadas para análise da diversidade genética. O estoque de reprodutores, pertencente à Estação de Aquicultura e Hidrologia da usina hidroelétrica Duke Energy, localizada às margens do Rio Paranapanema (22° 54' S; 50° 00' W), em Salto Grande, SP, foi formado a partir de coletas realizadas no Rio Paraná.
Para extração de DNA, foi utilizado o protocolo de extração com NaCl, descrito por Lopera-Barrero et al. (2008c), quantificado em espectrofotômetro Shimadzu com absorvância de 260nm. As amostras foram diluídas para as concentrações de 10ng/μL (reprodutores) e 5ng/μL (larvas). Para conferir a qualidade do DNA, foi realizada eletroforese em gel de agarose 1%, conduzida em tampão TBE 1X (500mM Tris-HC1, 60mM ácido bórico e 83mM EDTA) por uma hora a 70V. O gel foi visualizado sob radiação UV, depois da sua exposição com brometo de etídio (0,5μg/mL) por uma hora. Posteriormente, a imagem foi fotografada utilizando-se o programa Kodak EDAS (Kodak 1D Image Analysis 3.5).
O DNA foi amplificado para o volume final de reação de 15μL, e utilizaram-se 1X do tampão Tris-KCl, 2,0mM de MgCl2, 0,8μM de cada primer (Forward e Reverse), 0,4mM de cada dNTP, uma unidade de Platinum Taq DNA polimerase, 10ng de DNA para larvas e 20ng de DNA para os reprodutores. Inicialmente o DNA foi desnaturado a 94ºC por quatro minutos, e, em seguida, realizaram-se 30 ciclos, cada um consistindo de: 30 segundos de desnaturação a 94ºC, 30 segundos de anelamento, em temperatura variável para cada primer (Tab. 1), e um minuto de extensão a 72ºC, e extensão final a 72ºC por 10 minutos. Foram amplificados quatro loci descritos por Calcagnotto et al. (2001) - Pme2-AF362445; Pme14-AF362448; Pme28-AF362451 e Pme32-AF362452. As reações foram realizadas em termociclador "Eppendorf Mastercycler® Gradient".
As amostras amplificadas foram submetidas à eletroforese em gel de poliacrilamida 10% (acrilamida:bisacrilamida - 29:1) desnaturante (6M de ureia), e conduzidas em tampão TBE 1X (90mM de Tris-Borato e 2mM de EDTA) com 320V e 250mA por sete horas. Para a visualização dos alelos microssatélites, foi utilizada a coloração com nitrato de prata pelo método descrito por Bassam et al. (1991) modificado. O gel foi submetido a uma solução de fixação (10% de etanol e 0,5% de ácido acético) por 20 minutos, corado (6mM de nitrato de prata) por 10 minutos e, posteriormente, visualizado (0,75M de NaOH e 0,22% de formol-40%) e fotografado com câmera Nikon CoolPix 5200.
O tamanho dos alelos foi calculado pelo programa Kodak EDAS-290, utilizando-se DNA ladder (Invitrogen) de 10, 50 e 100pb. O tipo (A, B, C, D e E) e o tamanho dos alelos observados nas populações de pacu (194 - 247pb) utilizando os loci microssatélites organizaram-se em matrizes de dados submetidas aos programas computacionais que calcularam vários parâmetros que permitiram a determinação da diversidade genética intra e interpopulacional. O número de alelos, as heterozigoses observada e esperada, o teste do equilíbrio de Hardy-Weinberg, o número de migrantes (Nm) e o índice de fixação (Fis) de Wright (1978) foram calculados para cada locus usando-se o programa Genepop 1.2 (Raymond e Rousset, 1995). Esse programa também foi utilizado para avaliar a deficiência ou o excesso de heterozigotos, calculados pelo método de cadeia de Markov. A frequência alélica, a distância e identidade genética, o índice de Shannon e o dendrograma baseado na distância genética de Nei (Nei, 1972) foram calculados utilizando-se o programa PopGene 1.31 (Yeh et al., 1999). Os valores de diferenciação genética FST (Weir e Cockerham, 1984), o desequilíbrio de ligação e a análise de variância molecular - AMOVA (Excoffier et al., 1992) foram estimados pelo programa Arlequim 3.1 (Excoffier et al., 2005). Nestas duas últimas análises e na estimativa do índice de Shannon, as populações foram analisadas formando cinco agrupamentos: Canoas I 14/02/09 x Canoas I 28/02/09; Canoas II14/02/09 x Canoas II 28/02/09; Canoas I (CI14 + CI28) x Canoas II (CI14 + CI28); Estoque x Progênie e Canoas (CI14 + CI28 + CII14 + CII28) x Estoque + Progênie. Como método de diferenciação dos valores de FST foi utilizada a definição de Wright (1978), em que valores entre 0,00 e 0,05; 0,05 e 0,15; 0,15 e 0,25 e >0,25 indicam pequena, moderada, alta e elevada diferenciação genética, respectivamente.
RESULTADOS E DISCUSSÃO
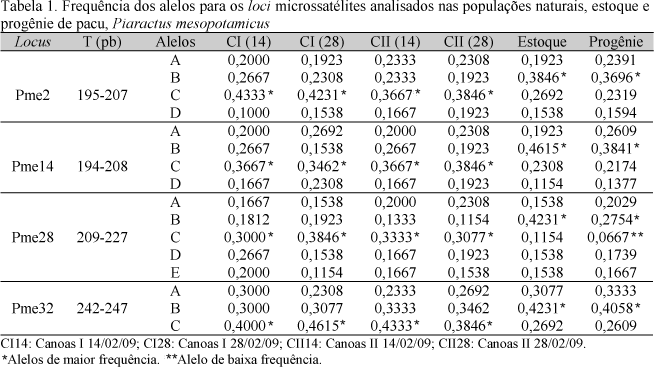
Os quatro loci produziram 16 alelos com variação de três a cinco alelos por locus. O tamanho dos alelos variou de 194pb (locus Pme14) a 247pb (locus Pme32). Nenhum alelo foi eliminado no estoque ou na progênie quando comparado com as populações naturais. Contudo, houve alteração no alelo de maior frequência nas populações naturais (alelo C), no estoque e na progênie (alelo B). Não foram observados alelos exclusivos (Tab. 1).
A presença dos mesmos alelos nos indivíduos do rio, no estoque e na progênie e a sua frequência similar - com exceção dos alelos B e C - sugerem que existe similaridade genética entre as populações e que a variabilidade genética foi preservada no estoque e na progênie. Segundo Innes e Elliott (2006), a perda no número de alelos é usualmente o primeiro sinal da redução de diversidade genética numa população.
De forma geral, foram observados alelos de alta frequência nas populações naturais e nos estoques, porém um alelo de baixa frequência (menor que 0,1000 - 10%) foi observado no locus Pme28 da progênie (alelo C). A presença desse alelo nessa população pode indicar que existe um processo de perda de alelos possivelmente devido ao efeito de deriva genética (Bengtsson et al., 1995), que implica alteração da composição genética que pode ser responsável pela diminuição das taxas de reprodução e de sobrevivência (Povh et al., 2008a).
A heterozigosidade média observada na população de Canoas I não revelou diferenças genéticas entre os indivíduos analisados em diferentes tempos nesse ponto de coleta (CI14 = 0,7356 e CI28 = 0,7361), o que evidencia similaridade genética entre os seus indivíduos. A mesma situação foi observada entre os indivíduos da população de Canoas II (CII14 = 0,7442 e CII28 = 0,7507) e entre o estoque e a progênie (0,7261 e 0,7287, respectivamente). Considerando todos os loci, a maior heterozigosidade observada foi encontrada no grupo CII28 (0,8092) (Tab. 2).
Os dados de heterozigosidade também refletem alta variabilidade genética intrapopulacional nos indivíduos coletados no rio, semelhante aos resultados encontrados por Povh et al. (2008b), ao analisarem uma população do Rio Paranapanema, utilizando o marcador RAPD, onde foram observados altos valores de índice de Shannon e porcentagem de fragmentos polimórficos (0,345 e 61,17%, respectivamente). Essa alta variabilidade genética intrapopulacional demonstra que, apesar dos constantes repovoamentos realizados nesse rio, a diversidade genética da população natural ainda exibe altos valores, o que pode significar maior adaptação dessa espécie às condições ambientais desse ecossistema. Quanto ao estoque e à progênie, também foram encontrados altos valores de heterozigosidade observada, o que, segundo Povh et al. (2008a), demonstra que essas populações apresentam uma base genética suficientemente ampla para serem utilizadas em programas de repovoamento, na formação de novos estoques ou na sua liberação no meio ambiente sem ocasionar riscos genéticos na população natural. Este resultado implicou a formação de estoques com grande número de reprodutores (Aho et al., 2006) que apresentem alta variabilidade genética (Melo et al., 2006). Contudo, os valores de Ho apresentaram desvio significativo dos valores de He, o que, segundo Romana-Eguia et al. (2004), é sempre esperado em populações mantidas em cativeiro, pois os desvios na frequência provocada eventualmente pela deriva genética têm tendência de ampliar-se com o passar das gerações.
Os valores de Fis, que representam a medida de desvio da frequência genotípica em relação à frequência panmítica, expressas em termos de deficiência ou excesso de heterozigotos, e que também podem ser interpretados como coeficientes de endogamia (Moreira et al., 2007), apresentaram valores médios negativos em todos os loci, com excesso de heterozigotos, indicando ausência de endogamia. Os maiores valores médios de Fis foram encontrados em CI28 (-0,385) e no estoque (-0,402). Foram observados desvios no equilíbrio de Hardy-Weinberg nos loci Pme32 de CI28 e CII14, Pme2 e Pme28 no estoque e no Pme14 na progênie. Estes resultados mostram que as populações podem estar sendo influenciadas pelas mudanças fortuitas nas frequências alélicas (Rengmark et al., 2006) e pelo efeito de boca de garrafa (Tab. 2).
O desequilíbrio de ligação, que é a associação não aleatória de alelos em dois ou mais loci (Caujapé-Castells, 2006), foi observado em seis diferentes pares nos cinco agrupamentos analisados (Pme2 x Pme32, Pme14 x Pme32, Pme28 x Pme32, Pme2 x Pme14, Pme2 x Pme32 e Pme2 x Pm28). No entanto, ocorreu diferente padrão de desequilíbrio dentro de cada combinação. Isto, segundo Povh (2007), sugere que estes não estejam ligados fisicamente.
Para Innes e Elliott (2006), populações que experimentam o efeito boca de garrafa podem mostrar incremento no nível do desequilíbrio de ligação. Por isso, ao se analisar o desvio no equilíbrio de Hardy-Weinberg e o desequilíbrio de ligação encontrados neste trabalho, é possível afirmar que as populações do rio, o estoque e a progênie podem estar sendo influenciados pelo efeito boca de garrafa (variação aleatória das frequências alélicas a qual se produz na redução do tamanho populacional), e que ainda não foi observada drástica diminuição da variabilidade genética.
O índice de Shannon foi similar entre todos os agrupamentos, indicando que existe baixa diferenciação genética entre eles. O maior valor foi apresentado pelo agrupamento Canoas x Estoque/Progênie (1,350). Por outro lado, o valor de FST, que, segundo Caujapé-Castells (2006), quantifica a consanguinidade e mede a redução da heterozigosidade, mostrou que, entre a população natural, o estoque e a progênie (nos diferentes agrupamentos), existe alta consanguinidade e, conforme a classificação de Wright (1978), sugere pequena diferenciação genética entre as populações estudadas. Em reforço a essa hipótese, o valor de Nm calculado foi elevado em todos os agrupamentos, o que pode ser considerado evidência de fluxo gênico. O maior valor de Nm foi encontrado em Canoas I e Canoas II, com 180,14 indivíduos por geração (Tab. 3).
Segundo a AMOVA, a maior parte da variação observada nos agrupamentos está dentro de grupo e não entre grupos. Isso demonstra que os indivíduos coletados em Canoas I e II nos diferentes tempos de coleta podem ser considerados como um grupo geneticamente estruturado numa única população. Da mesma forma, esse componente de variação dentro de cada grupo indica que o tamanho amostral utilizado capturou uma grande proporção de variabilidade genética contida no complexo Canoas, o que, segundo Paula (2006), é de grande importância para estudos de manejo e conservação (Tab. 4).
Pelo fato de as amostragens no complexo de Canoas terem sido realizadas em dois pontos diferentes de coleta e em épocas reprodutivas diferentes, é esperado que, entre as populações das duas escadas, haja diferenciação genética. Os resultados indicaram, de forma contraditória, que existe baixa diferenciação, fato que poderia ser atribuído ao pequeno número de amostras coletado em cada escada. Porém, resultados similares foram observados em outras pesquisas realizadas no mesmo complexo com outras espécies migradoras, demonstrando a integridade e a confiabilidade dos dados encontrados neste trabalho.
Nesse sentido, Ramos (2007), ao analisar a diversidade genética de populações de Leporinus elongatus no complexo de Canoas em três anos consecutivos de período reprodutivo, concluiu que existe baixa diferenciação genética entre as populações, sendo estruturadas como uma única população. Paula (2006), ao estudar a estrutura populacional de Prochilodus lineatus durante todo o período reprodutivo, encontrou igualmente baixa diferenciação genética, que evidencia a existência de uma única população dessa espécie. Lopes et al. (2007), após analisarem populações de Salminus brasiliensis capturados em Canoas I e II, também encontraram maior variância molecular dentro de cada grupo (98,2%) e baixa diferenciação genética (FST = 0,018), e concluíram que os grupos formam uma única população.
Os resultados obtidos de distância e identidade genética (Tab. 4) e do dendrograma (Fig. 1) mostram que existe maior relacionamento genético entre Canoas I x Canoas II e Estoque x Progênie, sendo observada a formação de dois agrupamentos: um formado pelas quatro coletas realizadas no complexo de Canoas e o outro pelas populações estocadas. Apesar disso, pelos resultados de diversidade genética analisados anteriormente, é evidente a similaridade genética entre a população natural, o estoque e a progênie, a qual pode ser decorrente do contínuo repovoamento realizado no Paranapanema a partir dessa população estocada (Duke Energy, 2009).
Resultados similares foram observados por Povh et al. (2008b) ao analisarem, com o marcador RAPD, um grupo de pacu coletado em Canoas I e II. Esses autores recomendaram uma análise com marcadores microssatélites para inferir a verdadeira procedência desses indivíduos e corroborar os dados obtidos pelo RAPD. Os resultados do presente trabalho são importantes, pertinentes e conclusivos sobre a real influência dos programas de repovoamento na composição genética da população natural no médio Rio Paranapanema.
De modo geral, para os grupos de pacu das duas escadas de transposição, foi verificado alto grau de variabilidade genética, o que para populações naturais é de grande importância, pois a presença de variações herdáveis as tornam hábeis em responder à seleção (Ramos, 2007) e mais aptas à sobrevivência e reprodução, quando se exercerem pressões seletivas e evolutivas (Lowe et al., 2004). Apesar disso, foi verificado que a quantidade de indivíduos coletados nas escadas durante os dois períodos diminuiu (coleta 14/02/09 = 15 indivíduos x coleta 28/02/09 = 13 indivíduos), inclusive quando comparado com outros estudos na mesma espécie realizados em diferentes anos de coleta (Povh et al., 2008). Esse resultado de diminuição populacional durante o período reprodutivo pode ser atribuído a dois efeitos: o físico das barragens e o da depleção na população a jusante do complexo.
O efeito das barragens fundamenta-se na interrupção das rotas migratórias, o que impede o correto amadurecimento do sistema reprodutivo dos peixes e evita a realização do ciclo completo de reprodução, afetando, dessa forma, a abundância de peixes migradores aptos para a reprodução e provocando baixo desenvolvimento e alta depredação de ovos e larvas (Agostinho et al., 2002). As condições observadas nos reservatórios de Canoas I e II - águas lénticas, com escassa vegetação ciliar e ausência de lagoas larginais - (Dias, 2003), permitem pensar na possibilidade da pouca contribuição dos peixes migrantes na formação de novos grupos de indivíduos na montante. O efeito da depleção na população a jusante do complexo fundamenta-se no fato de que, depois de realizar a migração a montante, não ocorre o retorno desses indivíduos. Esse efeito já foi comprovado para outras espécies, como o L. elongatus (Ramos, 2007) e P. Lineatus (Paula, 2006), o que, segundo Britto e Sirol (2006), pode ser devido à amortização do fluxo hidráulico descendente. Por esse motivo, são necessários maiores estudos que verifiquem a real eficiência das escadas de transposição e seus efeitos genéticos na população natural.
Devido à diminuição populacional, a variabilidade genética nas populações naturais pode diminuir, levando ao efeito de boca de garrafa. Como demonstrado com os resultados da frequência alélica, o equilíbrio de Hardy-Weinberg e o desequilíbrio de ligação, esse efeito pode estar acontecendo nas populações de pacu, o que, a longo prazo, pode comprometer a sustentabilidade da população, diminuir a prevalência da espécie no complexo Canoas e aumentar o risco de extinção (Hatanaka e Galetti Jr., 2003).
Ao analisar as populações estocadas, foi possível verificar a existência de alta variabilidade genética intrapopulacional, o que, segundo Lopera-Barrero et al. (2008a), indica que o estoque foi formado com suficiente variabilidade genética (efeito fundador), que se utilizaram de sistemas reprodutivos e cruzamentos eficientes (Povh, 2007) e permitiram manter o pool genético na progênie (Ho = 0,7261 e 0,7287, respectivamente). Essa alta variabilidade genética do estoque/progênie, somada à similaridade genética similar a população natural do complexo Canoas (apesar das primeiras serem oriundas do Rio Paraná), permite concluir que o pool de genes é semelhante, fato relevante quando se realizam programas de repovoamento, pois um pool diferente entre eles poderia significar baixa viabilidade do uso do estoque (Povh et al., 2008b) e provocar perda de genes importantes de adaptação ao ambiente na população natural (Sønstebø et al., 2007) e baixa sobrevivência das progênies repovoadas (Frost et al., 2006).
Recebido em 3 de abril de 2009
Aceito em 16 de julho de 2010
E-mail: nelson.peixegen@gmail.com
- AHO, T.; RÖNN, J.; PIIRONEN, J. et al. Impacts of effective population size on genetic diversity in hatchery reared Brown trout (Salmo trutta L.) populations. Aquaculture, v.253, p.244-248, 2006.
- AGOSTINHO, A.A.; GOMES, L.C.; FERNANDEZ, D.R. et al. Efficiency of fish ladders for a neotropical ichthyofauna. River Res. Appl, v.18, p.299-306, 2002.
- BASSAM, B.J.; CAETANO-ANOLLÉS, G.; GRESSHOFF, P.M. Fast and sensitive silver staining of DNA in polyacrylamide gels. Anal. Biochem, v.196, p.80-83, 1991.
- BENGTSSON, B.O.; WEIBULL, P.; GHATNEKAR, L. The loss of alleles by sampling: a study of the common outbreeding grass Festuca ovina over three geografical scales. Hereditas, v.122, p.221-238, 1995.
- BRITTO, S.G.; SIROL, R.N. Transposição de peixes como forma de manejo: as escadas do complexo Canoas, médio rio Paranapanema, bacia do Alto Paraná. In: NOGUEIRA, M.G.; HENRY, R.; JORCIN, A. (Eds). Ecologia de reservatórios: impactos potenciais, ações de manejo e sistemas em cascata. São Carlos: RiMA, 2006. p.285-304.
- CAUJAPÉ-CASTELLS, J. Brújula para botánicos desorientados en la genética de poblaciones. Las Palmas de Gran Canária: Exegen Ediciones. 2006. 133p.
- CALCAGNOTTO, D., RUSSELLO, M.; DESALLE, R. Isolation and characterization of microsatellite loci in Piaractus mesopotamicus and their applicability in other Serrasalminae fish. Mol. Ecol. Notes, v.1, p.245-247, 2001.
- DIAS, J.H.P. Distribuição espacial e temporal da ictiofauna do trecho médio do rio Paranapanema e suas relações com as características morfométricas e limnológicas dos compartimentos da bacia 2003. 103f. Tese (Doutorado) - Universidade Federal de São Carlos, São Carlos.
- DUKE ENERGY. Meio ambiente. Disponível em: <http://www.duke-energy.com.br/PT/Meioambiente>. Acessado em: 15 abr. 2009.
- EXCOFFIER, L.; SMOUSE, P.E.; QUATTRO, J.M. Analysis of molecular variance inferred from metric distances among DNA haplotypes: application to human mitochondrial DNA restriction data. Genetics, v.131, p.479-491, 1992.
- EXCOFFIER, L.; LAVAL, G.; SCHNEIDER, S. Arlequin Ver. 3.1: an integrated software package for population genetics data analysis. Evol. Bioinform. Online., v.1, p.47-50, 2005.
- FROST, L.A.; EVANS, B.S.; JERRY, D.R. Loss of genetic diversity due to hatchery culture practices in barramundi (Lates calcarifer). Aquaculture, v.261, p.1056-1064, 2006.
- HATANAKA, T.; GALETTI Jr., P.M. RAPD markers indicate the occurrence of structured populations in a migratory freshwater fish species. Genet. Mol. Biol, v.26, p.19-25, 2003.
- INNES, B.H.; ELLIOTT, N.G. Genetic diversity in a Tasmanian hatchery population of Atlantic salmon (Salmo salar L.) compared with its Canadian progenitor population. Aquac. Res, v.37, p.563-569, 2006.
- LEVIN, P.S.; SCHIEWE, M.H. Preserving salmon biodiversity. Am. Sci, v.89, p.220-227, 2001.
- LOPERA-BARRERO, N.M.; RIBEIRO, R.P.; POVH, J.A. et al. Caracterización genética de lotes de peces usados en programas de repoblamiento y su importancia en la conservación genética en la piscicultura. Zootecnia Trop, v.26, p.515-522, 2008a.
- LOPERA-BARRERO, N.M.; RIBEIRO, R.P.; VARGAS, L. et al. Caracterização genética de estoques de Prochilodus lineatus (Valenciennes, 1836) (Characiformes: Prochilodontidae), utilizados em programas de repovoamento: importância para a conservação da ictiofauna e do ecossistema. Biosci. J, v.24, p.86-93, 2008b.
- LOPERA-BARRERO, N.M.; POVH, J.A.; RIBEIRO, R.P. et al. Comparación de protocolos de extracción de ADN con muestras de aleta y larva de peces: extracción modificada con sal (NaCl). Cien. Inv. Agr, v.35, p.15-24, 2008c.
- LOPERA-BARRERO, N.M.; RIBEIRO, R.P.; POVH, J.A. O repovoamento de peixes: uma estratégia multidisciplinar? Aquic. Pesca, v.30, p.71-74, 2007.
- LOPES, C.M.; ALMEIDA, F.S.; ORSI, M.L. et al. Fish passage ladders from Canoas Complex - Paranapanema River: evaluation of genetic structure maintenance of Salminus brasiliensis (Teleostei: Characiformes). Neotrop. Ichthyol, v.5, p.131-138, 2007.
- LOWE, A.; HARRIS, S.; ASHTON, P. Ecological genetics: Desing, analysis and application. Malden: Blackwell, 2004. 326p.
- MELO, D.C.; OLIVEIRA, D.A.A.; RIBEIRO, L.P. et al. Caracterização genética de seis plantéis comerciais de tilápia (Oreochromis) utilizando marcadores microssatélites. Arq. Bras. Med. Vet. Zootec, v.58, p.87-93, 2006.
- MOREIRA, A.A.; HILSDORF, A.W.S.; SILVA, J.V. et al. Variabilidade genética de duas variedades de tilápia nilótica por meio de marcadores microssatélites. Pesq. Agropec. Bras, v.42, p.521-526, 2007.
- NEI, M. Genetic distance between populations. Am. Nat, v.106, p.283-292, 1972.
- PAULA, F.M. Diversidade genética de Prochilodus lineatus (Pisces Characiformes) das escadas de transposição de peixes das usinas hidroelétricas do complexo Canoas - Rio Paranapanema. 2006. 138f. Dissertação (Mestrado) - Universidade Estadual de Londrina, Londrina.
- POVH, J.A. Avaliação da diversidade genética e do manejo reprodutivo do pacu, Piaractus mesopotamicus. 2007. 75f. Tese (Doutorado) - Universidade Estadual de Maringá, Maringá
- POVH, J.A.; LOPERA BARRERO, N.M.; RIBEIRO, R.P. et al. Importancia del monitoreo genético de programas de repoblamiento de peces mediante marcadores moleculares. Cien. Inv. Agr, v.35, p.25-35, 2008a.
- POVH, J.A.; RIBEIRO, R.P.; SIROL, R.N. et al. Diversidade genética de pacu do Rio Paranapanema e do estoque de um programa de repovoamento. Pesq. Agropec. Bras, v.43, p.201-206, 2008b.
- RAYMOND, M.; ROUSSET, F. Genepop (version 1.2): population genetics software for exact tests and ecumenicism. J. Heredity, v.86, p.248-249, 1995.
- RAMOS, J.V.B. Estudo da estrutura genética de Leporinus elongatus (Pisces, Characiformes) no complexo Canoas - Rio Paranapanema. 2007. 85f. Dissertação (Mestrado) - Universidade Estadual de Londrina, Londrina.
- RENGMARK, A.H.; SLETTAN, A.; SKAALA, Ø. et al. Genetic variability in wild and farmed Atlantic salmon (Salmo salar) strains estimated by SNP and microsatellites. Aquaculture, v.253, p.29-237, 2006.
- ROMANA-EGUIA, M.R.R.; IKEDA, M.; BASIAO, Z.U. et al. Genetic diversity in farmed Asian and red hybrid tilapia stocks evaluated from microsatellite and mitochondrial DNA analysis. Aquaculture, v.236, p.131-150, 2004.
- SIROL, R.N.; BRITTO, S.G. Conservação e manejo da ictiofauna: repovoamento. In: NOGUEIRA, M.G.; HENRY, R.; JORCIN, A. (Ed). Ecologia de reservatórios: impactos potenciais, ações de manejo e sistemas em cascata São Carlos: RiMA, 2006. p.275-284.
- SØNSTEBØ, J.H.; BORGSTRØM, R.; HEUN, M. Genetic structure of brown trout (Salmo trutta L.) from the Hardangervidda mountain plateau (Norway) analyzed by microsatellite DNA: a basis for conservation guidelines. Conserv. Genet, v.8, p.33-44, 2007.
- WEIR, B.S.; COCKERHAM, C.C. Estimating F-statistics for the analysis of population structure. Evolution, v.38, p.1358-1370, 1984.
- WRIGHT, S. Evolution and Genetics of Populations Chicago: University of Chicago, 1978. 511p.
- YEH, F.C.; BOYLE, T.Y.Z.; XIYAN, J.M. PopGene Version 131: Microsoft Window-based freeware for population genetic analysis Alberta: University of Alberta and Center for International Forestry Research, 1999. 29p.
Datas de Publicação
-
Publicação nesta coleção
02 Fev 2011 -
Data do Fascículo
Ago 2010
Histórico
-
Recebido
03 Abr 2009 -
Aceito
16 Jul 2010