Resumos
Utilizou-se a citologia vaginal por meio de diferentes métodos de coloração para detecção de cio em jaguatirica, Leopardus pardalis, pela estimulação hormonal exógena e pela avaliação das estruturas ovarianas por videolaparoscopia. Cinco fêmeas foram tratadas com eCG/hCG e FSH/LH a cada quatro meses pelo período de dois anos. Videolaparoscopia foi realizada após cada tratamento utilizando-se cetamina-xilazina e isoflurano. Esfregaços vaginais foram obtidos 15 dias antes e após a videolaparoscopia. As lâminas foram analisadas ao microscópio de luz quanto aos tipos celulares predominantes. Todos os animais apresentaram folículos maduros (>2mm) e corpos lúteos recentes em todas as intervenções. Não houve diferença significativa entre os resultados obtidos na mesma coloração de acordo com os tratamentos utilizados. Todas as técnicas mostraram-se eficientes na detecção de células superficiais queratinizadas anucleadas e nucleadas, intermediárias, parabasais e basais. Foi possível determinar a fase de estro em Leopardus pardalis por meio da citologia vaginal
jaguatirica; estro; citologia vaginal; reprodução
Vaginal cytology was evaluated for estrus detection using different stains after hormonal stimulation with exogenous gonadotrophin (eCG/hCG, FSH/LH) and videolaparoscopy for ovarian structure evaluation. Five L. pardalis were treated four times during two years. After each treatment, videolaparoscopy was performed using Ketamine-Xylazine and Isoflurane. Vaginal cytology was made 15 days before and after videolaparoscopy. Three stains were used: Diff Quick, Papanicolaou, and Shorr. The slides were analyzed for the typical cell predominance. All the animals showed mature follicles (>2mm) and recent corpus luteum in all procedures. No significative difference was observed between the results in the same stain according to the treatment eCG/hCG and FSH/LH. All stains were efficient in detection of nucleated and anuclear superficial keratinized cells; intermediated, parabasal, and basal cells. Vaginal cytology can be used for estrus detection in Leopardus pardalis
Leopardus pardalis; estrus; vaginal cytology; reproduction
MEDICINA VETERINÁRIA
Detecção de estro em jaguatirica (Leopardus pardalis) utilizando citologia vaginal
Vaginal cytology for estrus detection in ocelot (Leopardus pardalis)
R.C.R. PazI; C.H. AdaniaII; V.H. BarnabeIII; R.C. BarnabeIII
IFaculdade de Agronomia e Medicina Veterinária - UFMT Av. Fernando Correa da Costa, s/n 78060-600 - Cuiabá, MT
IIAssociação Mata Ciliar - Jundiaí, SP
IIIFaculdade de Medicina Veterinária e Zootecnia - São Paulo, SP
RESUMO
Utilizou-se a citologia vaginal por meio de diferentes métodos de coloração para detecção de cio em jaguatirica, Leopardus pardalis, pela estimulação hormonal exógena e pela avaliação das estruturas ovarianas por videolaparoscopia. Cinco fêmeas foram tratadas com eCG/hCG e FSH/LH a cada quatro meses pelo período de dois anos. Videolaparoscopia foi realizada após cada tratamento utilizando-se cetamina-xilazina e isoflurano. Esfregaços vaginais foram obtidos 15 dias antes e após a videolaparoscopia. As lâminas foram analisadas ao microscópio de luz quanto aos tipos celulares predominantes. Todos os animais apresentaram folículos maduros (>2mm) e corpos lúteos recentes em todas as intervenções. Não houve diferença significativa entre os resultados obtidos na mesma coloração de acordo com os tratamentos utilizados. Todas as técnicas mostraram-se eficientes na detecção de células superficiais queratinizadas anucleadas e nucleadas, intermediárias, parabasais e basais. Foi possível determinar a fase de estro em Leopardus pardalis por meio da citologia vaginal.
Palavras-chave: jaguatirica, estro, citologia vaginal, reprodução
ABSTRACT
Vaginal cytology was evaluated for estrus detection using different stains after hormonal stimulation with exogenous gonadotrophin (eCG/hCG, FSH/LH) and videolaparoscopy for ovarian structure evaluation. Five L. pardalis were treated four times during two years. After each treatment, videolaparoscopy was performed using Ketamine-Xylazine and Isoflurane. Vaginal cytology was made 15 days before and after videolaparoscopy. Three stains were used: Diff Quick, Papanicolaou, and Shorr. The slides were analyzed for the typical cell predominance. All the animals showed mature follicles (>2mm) and recent corpus luteum in all procedures. No significative difference was observed between the results in the same stain according to the treatment eCG/hCG and FSH/LH. All stains were efficient in detection of nucleated and anuclear superficial keratinized cells; intermediated, parabasal, and basal cells. Vaginal cytology can be used for estrus detection in Leopardus pardalis.
Keywords:Leopardus pardalis, estrus, vaginal cytology, reproduction
INTRODUÇÃO
No Brasil, ocorrem seis espécies de pequenos felinos: gato mourisco (Herpailurus yagouarondi), gato palheiro (Oncifelis colocolo), gato-do-mato-pequeno (Leopardus tigrinus), gato-maracajá (Leopardus wiedii), gato-do-mato-grande (Oncifelis geoffroyi) e jaguatirica (Leopardus pardalis) (Oliveira e Cassaro, 1997). Todas as espécies pertencem ao gênero Leopardus e estão listadas no Apêndice I do Acordo Internacional para Conservação de Espécies da Flora e Fauna Silvestres Ameaçadas de Extinção (Conservation..., 2009).
A principal ameaça de extinção para essas espécies é a perda constante e a fragmentação de ambientes, determinando o desaparecimento local e o isolamento de populações. A formação de ilhas de mata impede a troca de informações genéticas e pode resultar em diminuição da variabilidade genética das populações envolvidas. Métodos alternativos de manejo têm sido estudados no sentido de minimizar a diminuição da variabilidade genética das populações, no entanto a reprodução natural de animais silvestres em cativeiro encontra inúmeras dificuldades.
Vários fatores interferem na reprodução natural desses animais em cativeiro. Dentre eles, destacam-se: recintos inadequados, estresse, doenças infecciosas e/ou parasitárias, deficiências nutricionais e alterações genéticas e comportamentais (Mellen, 1991). A manutenção da diversidade genética depende da reprodução. Nesse caso, as biotecnologias da reprodução surgem como importantes ferramentas na preservação de espécies ameaçadas de extinção, frente à necessidade de se desenvolver métodos que aumentem a fertilidade desses animais, bem como técnicas que visem à reprodução por meio de métodos naturais ou artificiais (Howard, 1993).
Considerando-se que felídeos neotropicais na natureza são solitários, machos e fêmeas deveriam ser alojados isoladamente em recintos separados e apresentados um ao outro apenas para cruzamento. No entanto, diante da frequente inabilidade em identificar com confiança quando as fêmeas estão em cio para escolher o momento oportuno para a formação de casais, muitas vezes os animais são mantidos juntos ou agrupados no momento errado, o que pode gerar brigas e até morte de animais. A determinação do período adequado para formação de casais em cativeiro, pela detecção do estro por citologia vaginal, apresenta-se como um recurso importante no manejo reprodutivo desses animais visando à monta natural, uma vez que é um método fácil, rápido e barato, que vem sendo utilizado rotineiramente na reprodução de cães (Vannucchi et al., 1997).
Nesse sentido, o objetivo deste trabalho foi avaliar a viabilidade da citologia vaginal, utilizando-se os métodos de coloração, para detecção de cio em jaguatirica mediante estimulação hormonal exógena e avaliação das estruturas ovarianas - folículos e corpos lúteos - por videolaparoscopia.
MATERIAL E MÉTODOS
Foram utilizadas cinco fêmeas de jaguatirica (Studbook número: 240, 254, 285, 289, 290), alojadas na Associação Mata Ciliar, localizada em Jundiaí, SP. Durante o período experimental, duas fêmeas - as de números 254 e 285 - ficaram prenhes, o que impossibilitou a realização do protocolo de estimulação ovariana.
Os animais foram distribuídos em dois grupos, sendo a estimulação ovariana, a citologia vaginal e a videolaparosocopia realizadas a cada quatro meses pelo período de dois anos, perfazendo um total de seis intervenções. Todos os animais passaram por todos os tratamentos, sendo que cada animal foi estimulado por três vezes com o mesmo protocolo alternadamente, assim descritos:
Protocolo 1: 225UI de hCG (gonadotropina coriônica humana - Vetecor, Carlier, Barcelona, Espanha), intramuscular (IM), 80h após administração de 500UI de eCG (gonadotropina coriônica equina - Novormon, Syntex, Argentina); IM, a videolaparoscopia foi realizada após 24-28h da administração do hCG (Moraes et al., 1997; Morato et al., 2000; Paz et al., 2005; Paz et al., 2006);
Protocolo 2: 50UI de FSH suíno (hormônio folículo estimulante - Folltropin, Bioniche Animal Health, Belleville, Ontario, Canada), IM, administrados gradativamente, em três dias consecutivos (dia 1: 20UI e 15UI aplicadas com intervalo de 14h; dia 2: 10UI; dia 3: 5UI, aplicados com intervalo de 24h). No dia quatro, 18h após a administração da última dose de FSH, foi aplicada uma dose de 20UI de LH suíno (hormônio luteinizante - Lutropin, Bioniche Animal Health); IM, a videolaparoscopia foi realizada 24-28h após a administração do LH (Morato et al., 2000; Paz et al., 2005; Paz et al., 2006);
Para avaliação das estruturas ovarianas, os animais foram contidos quimicamente com a associação cloridrato de cetamina, 12mg/kg (Ketamin S(+) 50mg/mL, Cristália SA) e cloridrato de xilazina, 1mg/kg (Anasedan 2%, Agribrands do Brasil), entubados e mantidos durante todo o procedimento em anestesia inalatória utilizando-se isoflurano (Isoflurine, Cristália SA).
Para videolaparoscopia, utilizou-se fibra óptica rígida 7mm, fonte de luz, insulflador e microcâmera (Karl Storz/H., Strattner & Cia. Ltda.) acoplado à televisão (Sony 24"). A atividade ovariana foi avaliada, e os corpos lúteos recentes, bem como os folículos maiores (<2mm) foram contados.
Cada animal recebeu uma dose de Pentabiótico Veterinário Pequeno Porte (Fort Dodge), 24.000UI/kg, e uma dose de Tramal (Cloridrato de Tramadol, 50mg/mL, Carlo Erba SA) 1mg/kg, após cada intervenção cirúrgica.
Quinze dias antes e imediatamente após o procedimento cirúrgico, esfregaços vaginais foram obtidos por meio de escovas ginecológicas humanas (Kolpast Ltda.) inseridas no vestíbulo vaginal a cerca de 1,0 a 1,5cm de profundidade, inicialmente direcionadas em sentido horizontal e aprofundadas na direção cranial. Após esse procedimento, a escova ginecológica foi rolada em três lâminas de vidro em ato contínuo as quais foram coradas pelos métodos:
1. Panótico rápido (Instant Prov, Newprov Produtos para Laboratório Ltda.), que consistiu na imersão, por 10 segundos, em solução alcoólica de ciclohexadienos 0,1% e em solução aquosa de azobenzenosulfônico 0,1%; e na imersão, por 20 segundos, em solução alcoólica de fenotiazinas 0,1%, lavagem em água corrente e secagem em temperatura ambiente;
2. Papanicolau, que consistiu na fixação em álcool 95% e éter (1:1) por 15 minutos, lavagem em álcool 70%, 50% e em água destilada; na fixação em hematoxilina (Merck do Brasil), por 10 minutos, lavagem em água destilada, imersão 4x em solução aquosa 0,5% ácido clorídrico, lavagem em água destilada, imersão 10x em álcool 50%, 70%, 80% e 95%; na fixação em Orange G (Merck do Brasil) por um minuto, imersão 10x em álcool 95%; e na fração em solução EA 31 (Merck do Brasil) por dois minutos, imersão 10x em álcool 95%, lavagem em álcool absoluto e em xilol;
3. Shorr, que consistiu na fixação em álcool 95% e éter (1:1) por dois minutos, na fixação em solução Shorr (Merck do Brasil) por um minuto, imersão 10x em álcool 70%, 95% e álcool absoluto, imersão 1x em xilol.
Posteriormente as lâminas foram analisadas quanto aos tipos celulares predominantes: células superficiais queratinizadas anucleadas - CSQA, células superficiais queratinizadas nucleadas - CSQN, células intermediárias - CI, células parabasais - CP, células basais (CB), células espumosas - CE e células do metaestro - CM, com auxílio de microscopia de luz (Herron, 1977; Davidson e Feldman, 2004). Foram contadas 100 células por lâmina.
Wilcoxon Test/1995 (Stat Soft - Tulsa, EUA) foi utilizado para avaliar as diferenças entre os resultados obtidos em cada coloração antes e após cada tratamento e entre as técnicas com relação à porcentagem de células analisadas antes e após a estimulação ovariana. Para descrição dos resultados, foram empregadas as médias e os desvios-padrão das médias para a citologia vaginal e as médias e os erros-padrão das médias para as estruturas ovarianas.
RESULTADOS
Foi possível observar as estruturas ovarianas - folículos e corpos lúteos - de todos os animais em todos os tratamentos, e todos os animais apresentaram folículos maduros (>2mm) e corpos lúteos recentes em todas as intervenções (Tab. 1).
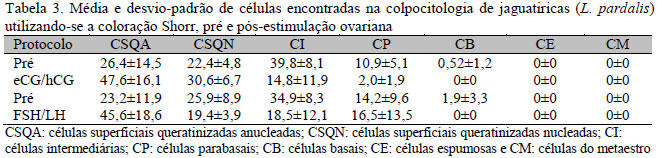
Nas Tab. 2 a 4, mostram-se os resultados obtidos nas análises de cada coloração de acordo com o tratamento utilizado, indicando o momento antes e após a estimulação ovariana. Não houve diferença significativa entre os resultados obtidos na mesma coloração de acordo com os tratamentos utilizados.
As três técnicas empregadas mostraram-se eficientes na detecção de CSQA, CSQN, CI, CP e CB. A técnica Papanicolau foi eficiente também na detecção de CE, e somente a técnica Panótico Rápido foi eficiente na detecção de CE e CM.
DISCUSSÃO
As alterações do epitélio durante as diversas fases do ciclo estral podem ser acompanhadas pelo exame citológico vaginal (Feldman e Nelson, 1996). O aumento das concentrações séricas de estrógeno, produzido pelos folículos ovarianos durante as fases de proestro e estro, causam proliferação das camadas de células do epitélio vaginal (Shille et al., 1984). Pequenas células saudáveis, próximas ao suporte sanguíneo, tornam-se maiores e mais irregulares à medida que se afastam da lâmina basal em direção ao lúmen e o núcleo diminui progressivamente, até se desintegrar (Herron, 1977).
Células provenientes de citologia vaginal realizada em gatas domésticas determinaram a presença de três tipos celulares característicos: parabasais, intermediárias e superficiais (Herron, 1977). Nas jaguatiricas, foi possível identificar células superficiais queratinizadas nucleadas e anucleadas, intermediárias, parabasais e basais nas três colorações utilizadas.
Alguns autores descreveram ser comum a presença de leucócitos, principalmente durante as fases de metaestro e anestro da gata (Toniollo et al., 1995), embora outros tenham afirmado ser raro tal fato (Shille et al., 1984). A ocorrência de hemácias não é normal em nenhuma das fases do ciclo (Herron, 1977; Toniollo et al., 1995). Neste experimento, foi possível verificar a presença de leucócitos em algumas lâminas pré-estimulação ovariana, mas sua presença não foi constante.
Schmidt et al. (1979) observaram que esfregaços vaginais de leoas (Panthera leo) apresentavam alto índice de células superficiais queratinizadas após o aumento nas concentrações séricas de estrógenos. Contudo, não encontraram nenhum outro padrão para as demais fases do ciclo reprodutivo na espécie. Bonney et al. (1981) relataram aumento significativo na proporção de células superficiais queratinizadas durante o estro em pumas (Puma concolor) e predomínio de células parabasais intermediárias nas demais fases, e Asa et al. (1992) descreveram o ciclo ovariano pela análise da citologia vaginal, em guepardos (Acinonyx jubatus), em que o estro se mostrou bastante característico, apresentando grande porcentagem de células queratinizadas. Tebet (1999) caracterizou o ciclo estral de jaguatiricas (Leopardus pardalis), mantidas em zoológicos brasileiros, por meio da análise das concentrações séricas de progesterona e estradiol e citologia vaginal durante diferentes fases do ciclo estral, e concluíram que os animais apresentavam duas fases distintas no ciclo estral: estro e interestro. Durante ambas as fases, as concentrações de progesterona permaneceram basais, confirmando a espécie como ovulatória reflexa. Os picos de estradiol foram acompanhados pela prevalência de células superficiais no esfregaço vaginal e algumas vezes por comportamento sexual característico de estro. A duração do estro foi de quatro e 15 dias, e o interestro entre oito e 22 dias. As fases não estrogênicas foram marcadas pelo domínio de células intermediárias e presença maciça de leucócitos e debris celulares.
Neste experimento, foi possível detectar grande quantidade de células queratinizadas nucleadas e anucleadas nos momentos subsequentes à estimulação ovariana em todos os animais, indicando período de proestro/estro, o que foi confirmado pela videolaparoscopia, em que todos os animais apresentaram folículos maduros (<2mm) e corpos lúteos recentes.
O método Shorr apresentou maior porcentagem de células queratinizadas nucleadas e anucleadas (71,6%) em relação ao Panótico Rápido (57,3%) e ao Papanicolau (59,1%), nos momentos subsequentes à estimulação ovariana, indicando ser a melhor técnica a ser utilizada na detecção do cio nesta espécie, no entanto, com esta técnica, não foi possível identificar células basais, espumosas e do metaestro. Os resultados deste trabalho estão de acordo com os encontrados por Tebet (1999), em que o estro foi marcado pela presença de células superficiais queratinizadas, no entanto, no momento pré-estimulação ovariana, não foi possível determinar a fase do ciclo estral em que o animal se encontrava, havendo em todos os casos predomínio de células intermediárias e parabasais.
CONCLUSÕES
É possível determinar o estro nesta espécie de felino selvagem por meio da citologia vaginal, pela presença de maior porcentagem de células superficiais queratinizadas encontradas nos momentos pós-estimulação ovariana, em que todos os animais apresentaram folículos maduros e corpos lúteos recentes.
Recebido em 15 de junho de 2009
Aceito em 15 de outubro de 2010
Apoio financeiro: FAPESP
E-mail: reginacrpaz@gmail.com
- ASA, C.S.; JUNGE, R.E.; BIRCHER, J.S. et al. Assessing reproductive cycles and pregnancy in cheetahs (Acinonyx jubatus) by vaginal cytology. Zoo Biol, v.11, p.139-151, 1992.
- BONNEY, R.C.; MOORE, H.D.M.; JONES, D.M. Plasma concentrations of oestradiol-17β and progesterone, and laparoscopic observations of the ovary in the puma (Felis concolor) during oestrus, pseudopregnancy and pregnancy. J. Reprod. Fertil, v.63, p.523-532, 1981.
- CONSERVATION international trade in endangered species of wild flora and fauna. Disponível em: <http://www.cites.org/eng/app/appendices.shtml>. Acessado em: 03 jun. 2009.
- DAVIDSON A.P.; FELDMAN, E.C. Alterações ovarianas e do ciclo estral. In: ETTINGER, S.; FELDMAN, E. Tratado de medicina interna veterinária 5.ed. v.2. Rio de Janeiro: Guanabara Koogan, 2004. p.1602-1609.
- FELDMAN, E.C.; NELSON, R.W. Canine and feline endocrinology and reproduction. 2.ed. Philadelphia: W.B. Saunders, 1996. 559p.
- HERRON, M.A. Feline vaginal cytologic examination. Feline Pract., v.7, p.36-39, 1977.
- HOWARD, J.G. Semen collection and analysis in carnivores. In: FOLWER, M.E. Zoo & Wild Animal Medicine Current Therapy 3.ed. Philadelphia: Saunders, 1993. p.390-399.
- MELLEN, J.D. Factors influencing reproductive sucess in small captive exotic felids (Felis spp): a multiple regression analysis. Zoo Biol, v.10, p.95-110, 1991.
- MORAES, W.; MORAIS, R.; MOREIRA, N. et al. Successful artificial insemination after exogenous gonadotropin treatment in the ocelot (Leopardus pardalis) and tigrina (Leopardus tigrinus). In: AMERICAN ASSOCIATIAN OF ZOO VETERINARIANS ANNUAL MEETINGS, 1997, Houston. Proceedings.. Houston, Texas: AAZV, 1997. p.334-335. (Abstract).
- MORATO, R.G.; CRICHTON, E.G.; PAZ, R.C.R. et al. Ovarian stimulation and successful in vitro fertilization in the jaguar (Panthera onca). Theriogenology, v.53, p.334, 2000.
- OLIVEIRA, T. G.; CASSARO, K. Guia de identificação dos felinos brasileiros São Paulo: Fundação Parque Zoológico de São Paulo, 1997. 60p.
- PAZ, R.C.R.; DIAS, E.A.; ADANIA, C.H. et al. Ovarian response to repeated administration of alternating exogenous gonadotropin regimens in the ocelot (Leopardus pardalis) and tigrinus (Leopardus tigrinus). Theriogenology, v.66, p.1787-1789, 2006.
- PAZ, R.C.R.; SWANSON, W.F.; DIAS, E.A. et al. Ovarian and immunological responses to alternating exogenous gonadotropin regimens in the ocelots (Leopardus pardalis) and tigrina (Leopardus tigrinus). Zoo Biol, v.24, p.247-260, 2005.
- SCHMIDT, A.M.; NADAL, L.A.; SCHMITH, M.J. et al. Serum concentrations of oestradiol and progesterone during the normal oestrus cycle and early pregancy in the lion (Panthera leo). J. Reprod. Fertil, v.57, p.267-272, 1979.
- SHILLE, V.M.; WING, A.E.; LASLEY, B.L. et al. Excretion of radiolabeled estradiol in the cat (Felis catus, L): a preliminary report. Zoo Biol, v.3, p.201-209, 1984.
- TEBET, J.M. Aspectos clínicos e fisiológicos do ciclo estral da jaguatirica (Leopardus pardalis, L. 1758). 1999. 101f. Dissertação (Mestrado) - Faculdade de Medicina Veterinária e Zootecnia, Universidade Estadual Paulista, Botucatu, SP.
- TONIOLLO, G.H.; CURY, S.R.; VICENTE, W.R.R. et al. Colpocitologia do ciclo estral em gatas. Braz. J. Vet. Res. Anim. Sci., v.32, p.125-129, 1995.
- VANNUCCHI, C.I.; SATZINGER, S.; SANTOS, S.E.C. Técnica de citologia vaginal como método de diagnóstico da fase do ciclo estral em cadelas. Rev. Clin. Vet, v.2, p.14-19, 1997.
Datas de Publicação
-
Publicação nesta coleção
23 Fev 2011 -
Data do Fascículo
Dez 2010
Histórico
-
Recebido
15 Jun 2009 -
Aceito
15 Out 2010