Resumos
Desenvolveu-se uma PCR multiplex (mPCR) para diagnóstico diferencial de encefalite bovina causada por herpesvírus suíno 1 (SuHV-1), herpesvírus bovino 1 (BoHV-1), herpesvírus bovino 5 (BoHV-5) e herpesvírus ovino 2 (OvHV-2). Os iniciadores foram projetados após alinhamento de sequências disponíveis no banco de genomas (GenBank) e a reação foi padronizada levando-se em consideração a concentração dos reagentes e os tipos diferentes de DNA polimerase. Após determinação da especificidade e sensibilidade, 65 amostras de encéfalo de bovinos com síndrome neurológica foram submetidas à análise. A sensibilidade analítica para detecção de BoHV-1, BoHV-5 e SuHV-1 foi, respectivamente, 10(1,2) TCID50/50µL, 10(1,0) TCID50/50µL, 10(1,3) TCID50/50µL na reação multiplex. Das 65 amostras analisadas, 10 foram positivas para BoHV-5, uma para BoHV-1 e cinco para OvHV-2. A mPCR descrita neste trabalho mostrou-se uma técnica útil para o diagnóstico diferencial de enfermidades relacionadas ao sistema nervoso central de bovinos.
PCR; encefalite; herpesvírus
The aim of this study was to develop a multiplex PCR (mPCR) for the differential diagnosis of bovine encephalitis caused by the suid herpesvirus 1 (SuHV-1), bovine herpesvirus 1 (BoHV-1), bovine herpesvirus 5 (BoHV-5) and ovine herpesvirus 2 (OvHV -2). The primers were designed after alignment of sequences available in GenBank and the reaction was developed by taking into account the concentration of reagents and different types of DNA polymerase. After determining the specificity and sensitivity to PCR, 65 brain samples from cattle with neurological syndrome were submitted to the reaction. The analytical sensitivity for detection of BoHV-1, BoHV-5 and SuHV-1 was, respectively, 10(1,2) TCID50/50µL, 10(1,0) TCID50/50µL, 10(1,3) TCID50/50µL. Ten samples were positive for BoHV-5, one for BoHV-1, one for SuHV-1 and five for OvHV-2. The mPCR described here is a useful technique for the differential diagnosis of diseases related to the central nervous system of cattle.
PCR; encephalitis; herpesvirus
MEDICINA VETERINÁRIA
A.A. Fonseca Jr.I; E.A. CostaII; T.S. OliveiraII, III, E.B. SalesI; M.L. SalesI; R.C. LeiteII; M. B. HeneimannII; J.K.P. ReisII
ILaboratório de Biologia Molecular - LANAGRO/MG - Pedro Leopoldo, MG
IIEscola de Veterinária - Universidade Federal de Minas Gerais - Belo Horizonte, MG
IIIInstituto Mineiro de Agropecuária - Belo Horizonte, MG
RESUMO
Desenvolveu-se uma PCR multiplex (mPCR) para diagnóstico diferencial de encefalite bovina causada por herpesvírus suíno 1 (SuHV-1), herpesvírus bovino 1 (BoHV-1), herpesvírus bovino 5 (BoHV-5) e herpesvírus ovino 2 (OvHV-2). Os iniciadores foram projetados após alinhamento de sequências disponíveis no banco de genomas (GenBank) e a reação foi padronizada levando-se em consideração a concentração dos reagentes e os tipos diferentes de DNA polimerase. Após determinação da especificidade e sensibilidade, 65 amostras de encéfalo de bovinos com síndrome neurológica foram submetidas à análise. A sensibilidade analítica para detecção de BoHV-1, BoHV-5 e SuHV-1 foi, respectivamente, 101,2 TCID50/50µL, 101,0 TCID50/50µL, 101,3 TCID50/50µL na reação multiplex. Das 65 amostras analisadas, 10 foram positivas para BoHV-5, uma para BoHV-1 e cinco para OvHV-2. A mPCR descrita neste trabalho mostrou-se uma técnica útil para o diagnóstico diferencial de enfermidades relacionadas ao sistema nervoso central de bovinos.
Palavras-chave: PCR, encefalite, herpesvírus
ABSTRACT
The aim of this study was to develop a multiplex PCR (mPCR) for the differential diagnosis of bovine encephalitis caused by the suid herpesvirus 1 (SuHV-1), bovine herpesvirus 1 (BoHV-1), bovine herpesvirus 5 (BoHV-5) and ovine herpesvirus 2 (OvHV -2). The primers were designed after alignment of sequences available in GenBank and the reaction was developed by taking into account the concentration of reagents and different types of DNA polymerase. After determining the specificity and sensitivity to PCR, 65 brain samples from cattle with neurological syndrome were submitted to the reaction. The analytical sensitivity for detection of BoHV-1, BoHV-5 and SuHV-1 was, respectively, 101,2 TCID50/50µL, 101,0 TCID50/50µL, 101,3 TCID50/50µL. Ten samples were positive for BoHV-5, one for BoHV-1, one for SuHV-1 and five for OvHV-2. The mPCR described here is a useful technique for the differential diagnosis of diseases related to the central nervous system of cattle.
Keywords: PCR, encephalitis, herpesvirus
INTRODUÇÃO
As doenças do sistema nervoso central dos bovinos podem ser provocadas por diversos agentes, alguns deles associados a zoonoses como o vírus da raiva e o agente da encefalopatia espongiforme bovina e outros com impacto exclusivo na saúde animal como os vírus da família Herpesviridae: herpesvírus bovino 1 (BoHV-1), herpesvírus bovino 5 (BoHV-5), herpesvírus ovino 2 (OvHV-2) e herpesvírus suídeo 1 (SuHV-1), capazes de causar sinais neurológicos que podem confundir o diagnóstico clínico (Claus et al., 2002). A partir das amostras de encéfalo, é possível realizar o diagnóstico diferencial destes agentes que afetam o sistema nervoso dos bovinos, além dos analisados no Programa Nacional de Controle da Raiva dos Herbívoros e Outras Encefalopatias do Ministério da Agricultura, Pecuária e Abastecimento (MAPA).
O BoHV-5 e o BoHV-1 são herpesvírus pertencentes à mesma subfamília Alphaherpesvirinae, gênero Varicellovírus (Davison et al., 2009). Esses dois vírus possuem identidade proteica de até 82%, o que dificulta diferenciá-los tanto por métodos moleculares quanto sorológicos (Thiry et al., 2006). O BoHV-5 é agente etiológico da meningoencefalite bovina, uma enfermidade de curso rápido e geralmente fatal. Animais mais novos são mais suscetíveis, enquanto nos bovinos adultos, a gravidade da infecção depende muito da cepa viral e do status imunológico do hospedeiro (Rissi et al., 2007). Mundialmente, as ocorrências de infecção por BoHV-5 são mais comuns na América do Sul (Del Médico et al., 2010), sendo um dos principais agentes de encefalopatias bovinas no Brasil (Rissi et al., 2010).
O BoHV-1 é agente da rinotraqueíte infecciosa bovina, vulvovaginite e balanopostite pustular infecciosa, além de mortalidade neonatal devido à infecção sistêmica ou abortos, principalmente quando a infecção ocorre em vacas soronegativas (Muylkens et al., 2007). O BoHV-1 pode causar danos neurológicos, ainda que esse não seja um fenômeno comum (Brower et al., 2008; Rissi et al., 2008). Essa ocorrência rara foi demonstrada em dois estudos que trabalharam com diagnóstico molecular por PCR. O primeiro, realizado com amostras parafinadas coletadas ao longo de 10 anos no centro oeste brasileiro, não detectou o BoHV-1 em nenhum dos tecidos analisados (Arruda et al., 2010). O segundo estudo, realizado por Batista et al. (2010), diagnosticou apenas duas amostras positivas para BoHV-1 em sua forma infecciosa após análise de setenta amostras de encéfalos bovinos coletados no Rio Grande do Sul.
O SuHV-1, vírus pertencente à mesma subfamília e gênero dos vírus BoHV-5 e BoHV-1, é o agente etiológico da pseudorraiva ou doença de Aujeszky (Braga et al., 2005). Os suínos são os principais hospedeiros do SuHV-1. Este causa danos neurológicos em animais mais jovens e sinais respiratórios em indivíduos adultos. Espécies como cães, gatos e bovinos também são suscetíveis à infecção e apresentam uma encefalite de curso agudo fatal que pode ser confundida com os sinais causados pela infecção com o vírus da raiva (Pomeranz et al., 2005).
A febre catarral maligna (FCM) é uma enfermidade de bovinos e outros ungulados, como suínos, búfalos, bisões e cervos, caracterizada por sinais neurológicos, inapetência, febre e corrimento nasal (Garmatz et al., 2004; Costa et al., 2009). Os principais herpesvírus associados à enfermidade pertencem ao gênero Gammaherpesvírus, sendo considerados membros do grupo de vírus associados à FCM (Li et al., 2005). Dentre esses, o OvHV-2 é o principal causador da FCM em bovinos no Brasil, principalmente quando ocorre criação concomitante com ovinos (Riet-Correa et al., 1998). A enfermidade já foi diagnosticada na Europa, Oriente Médio, África e América do Sul (Russell et al., 2009).
Os quatro agentes citados podem ser diagnosticados por uma variedade de métodos, incluindo técnicas moleculares como a reação em cadeia pela polimerase (PCR). A PCR é um método rápido e sensível já utilizado para diagnóstico de várias enfermidades virais. A utilização de uma metodologia multiplex agiliza o processo de identificação desses agentes infecciosos por realizar o diagnóstico completo com apenas uma reação, além de ser menos onerosa (Yeh et al., 2009).
O objetivo deste trabalho foi desenvolver uma PCR multiplex (mPCR) para diagnóstico diferencial das encefalopatias dos bovinos.
MATERIAL E MÉTODOS
A padronização da PCR foi realizada com a amostra padrão Shope de SuHV-1 (ATCC VR-135), amostra-padrão Colorado-1 de BoHV-1 (ATCC VR-864) e isolado EVI88/95 de BoHV-5 (Esteves et al., 2008). Devido à dificuldade de isolar o OvHV-2 (Gailbreath et al., 2008), o DNA extraído de leucócitos de uma ovelha naturalmente infectada pelo OvHV-2 foi utilizado como padrão nessa etapa do trabalho (Costa et al., 2009).
Foram utilizadas 65 amostras de encéfalo de bovinos com sinais neurológicos e negativas para raiva por meio de técnicas de imunofluorescência direta (IFD) e inoculação intracerebral em camundongos (ICC), oriundas de várias regiões do estado de Minas Gerais, Brasil. As amostras foram cedidas pelo Instituto Mineiro de Agropecuária (IMA) após extração do DNA. A viabilidade do DNA foi avaliada por PCR para detecção do gene da β-actina bovina antes do envio para o Laboratório Nacional Agropecuário de Minas Gerais.
Além das amostras de tecido bovino, tecido animal proveniente de outras espécies suscetíveis a alguns vírus estudados nesse trabalho foi submetido à mPCR. Trinta e cinco amostras de encéfalo suíno caracterizadas em outro trabalho (Fonseca Jr. et al., 2010a) foram selecionadas. Vinte e cinco delas foram diagnosticadas como positivas para SuHV-1 por isolamento viral e PCR, e as 10 restantes tiveram resultados negativos nos mesmos testes. Da mesma forma, amostras de tecido ovino caracterizadas por PCR por Costa et al. (2007) também foram adicionadas neste trabalho. Quatro dessas provinham de encéfalo ovino, sendo três positivas e uma negativa para OvHV-2. Dez amostras provinham de sêmen ovino, sendo sete positivas e três negativas para OvHV-2.
O DNA das amostras foi extraído por métodos diferentes de acordo com a origem. As amostras derivadas de bovinos e ovinos, incluindo encéfalos e sêmen, foram extraídas pelo método da sílica previamente descrito por Boom et al. (1990). As amostras de encéfalo de suíno foram submetidas à extração de DNA conforme Fonseca Jr. (2010b).
Os iniciadores para a mPCR foram construídos no programa Primer3 Plus (http://www.bioinformatics.nl/cgi-bin/primer3plus/primer3plus.cgi) após alinhamento no programa Bioedit das seguintes sequências disponíveis no banco de genomas GenBank (Hall, 1999; Untergasser et al., 2007). Os iniciadores foram submetidos a análises in silico de especificidade e formação de dímeros individualmente, em pares e em conjunto nos programas Blast (Altschul et al., 1990), PrimerBlast e OligoCalc (Kibbe, 2007). Os critérios de seleção foram temperaturas de fusão semelhantes, alta especificidade e número mínimo de interações. Três pares de iniciadores (Tab. 1) foram selecionados, sendo o iniciador BoHV 191 capaz de detectar o DNA de ambos BoHV-1 e BoHV-5.
A opção de diferenciar BoHV-1 de BoHV-5 por restrição enzimática deve-se ao fato de o BoHV-1 também causar danos neurológicos (Rissi et al., 2008). Como a presença de um par extra de iniciadores poderia diminuir a eficiência da PCR, optou-se por diferenciar os dois herpesvírus bovinos por restrição enzimática. A análise in silico de restrição enzimática foi realizada no programa pDraw 32 (Tipman, 2004).
A PCR foi otimizada variando-se a concentração dos reagentes e o tipo de DNA polimerase. Foram testadas uma DNA polimerase convencional (GoTaq® DNA Polymerase, Promega, EUA) e duas DNA polimerase do tipo hotstart (Platinum® Taq DNA Polymerase- Invitrogen, EUA e JumpStart® Taq DNA Polymerase- Sigma, EUA). A concentração do DNA nas reações variou de 20 a 150ng/µL.
A reação foi padronizada com as seguintes concentrações dos reagentes, para um volume final de reação de 25µL: 10 pmol dos iniciadores OvHV2-102, 20pmol dos iniciadores BoHV-191 e, 5pmol dos iniciadores SuHV1-499 (IDT, EUA), 2mM de MgCl2, 3% DMSO, 200mM de DNTP, 2 U DNA polimerase (Platinum® Taq DNA Polymerase, Invitrogen, EUA), Tampão 5x GoTaq® Green (Promega, EUA). O termociclador foi programado com: um ciclo de desnaturação a 95°C por 4min, 35 ciclos a 95°C por 40s, 62°C por 40s, 72°C por 40s e um ciclo final de extensão de 72°C por 5min. As amostras de referência mencionadas anteriormente foram utilizadas como controles positivos para todas as reações realizadas. Além delas, foi utilizado como controle negativo tecido encefálico bovino e, como controle branco, água destilada. Os resultados foram visualizados em gel de agarose a 2,5%, corado com brometo de etídeo sob luz ultravioleta, após eletroforese.
Cada par de iniciadores foi testado individualmente com os quatro vírus para se verificar a presença de amplificações inespecíficas. A especificidade da reação também foi testada em sete isolados brasileiros de SuHV-1 previamente caracterizados (Fonseca Jr. et al., 2010a), cinco isolados de BoHV-1, Streptococcus suis, Listeria monocytogenes. O DNA de todas essas amostras foi extraído segundo Fonseca Jr. et al. (2010b).
O teste de sensibilidade analítica foi realizado apenas para BoHV-1, BoHV-5 e SuHV-1, uma vez que o OHV-2 não é cultivado em linhagem celular. Isolados desses vírus foram titulados em célula de linhagem MDBK (rins de bovino). A solução estoque desses vírus foi diluída sucessivamente em base 10 e submetida à extração de DNA. O DNA foi estocado a -20ºC até o momento do uso. A sensibilidade foi testada com os iniciadores separados (PCR) e em conjunto na mPCR. A segunda etapa dos testes de sensibilidade foi realizada por meio da infecção de amostras do encéfalo de bovinos negativos para os três vírus e sem sinais clínicos de encefalite. Vírus titulado e novamente diluído na base dez foi adicionado ao tecido animal antes da extração do DNA.
Um sistema semelhante foi utilizado para a determinação da sensibilidade analítica do OvHV-2, porém com a utilização de produtos de PCR com concentrações estimadas em um equipamento Nanovue® (GE Healthcare, Estados Unidos).
RESULTADOS
A mPCR apresentou bandas específicas para cada agente pesquisado (Fig. 1). Os fragmentos amplificados para os herpesvírus bovinos puderam ser diferenciados por restrição enzimática (Fig. 2). Após análise in silico, a enzima BtgI foi escolhida para diferenciação dos resultados por clivar o amplicom de BoHV-5 em dois fragmentos (139pb e 52pb) e não clivar o amplicom de BoHV-1. A reação foi realizada segundo recomendação do fabricante (New England Biolabs®).
Os iniciadores amplificaram especificamente todos os isolados de SuHV-1 e BoHV-1, sem apresentarem bandas inespecíficas quando o DNA S. suis ou L. monocytogenes foi adicionado. Não houve amplificação inespecífica na PCR com os iniciadores isolados (dado não mostrado).
A sensibilidade analítica para detecção de BoHV-1, BoHV-5 e SuHV-1 foi, respectivamente, 101,2 TCID50/mL, 101,0 TCID50/mL, 101,3 TCID50/mL na reação multiplex. Os resultados foram semelhantes para a PCR realizada com os primers separadamente e com tecido bovino contaminado com o vírus titulado. Na detecção de OvHV-2, a reação apresentou sensibilidade de 300 cópias/µL com o DNA puro do agente, porém houve redução para 3000/µL cópias ao se utilizar o material contaminado (Fig. 3).
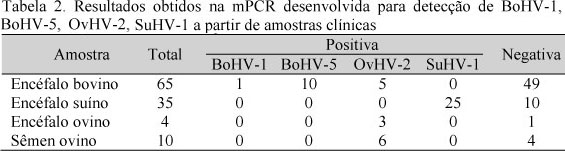
Os resultados da mPCR aplicada às amostras clínicas testadas nesse trabalho estão especificados na Tab. 2.
DISCUSSÃO
A mPCR padronizada neste trabalho foi capaz de detectar e diferenciar quatro tipos de vírus causadores de encefalite em bovinos e de sinais neurológicos em outras espécies, como ovinos e suínos. Todos esses agentes são listados no Manual da OIE (Manual..., 2008), sendo considerados, portanto, de elevada importância na pecuária internacional. Sua importância se estende em diversas áreas, sendo que pelo menos dois deles, OvHV-2 e SuHV-1, podem infectar diversas espécies.
O diagnóstico diferencial é importante para determinar as medidas sanitárias a serem tomadas. A encefalite causada por SuHV-1, por exemplo, é sinal de que existem suínos infectados na área, pois esses são os principais reservatórios deste vírus (Fonseca Jr. et al., 2010c). A pseudorraiva, doença causada pelo SuHV-1, é uma enfermidade de notificação obrigatória e de grande impacto na cadeia produtiva de suínos.
A mPCR descrita neste trabalho foi padronizada analisando-se variáveis como concentração de magnésio, DNA polimerase, iniciadores, além da temperatura de anelamento. As reações em multiplex são muito mais sensíveis às variações do que aquelas realizadas com apenas um par de iniciadores. É preciso considerar diversas variáveis, pois até mesmo iniciadores idênticos podem ter desempenho diferente em diferentes laboratórios (Bastien et al., 2008). O tipo e o fabricante da enzima DNA polimerase utilizada geraram variações na sensibilidade e especificidade da reação, sendo a mais eficiente a enzima do tipo hotstart. Essa enzima só é ativada após o primeira etapa de desnaturação, o que diminui o número de interação inespecífica e formação de dímeros dos iniciadores. Dentre outros reagentes testados, a utilização de um tampão diferente do normalmente usado para a Platinum® Taq DNA Polymerase e de DMSO foi relevante, sendo esse último importante para evitar a inibição da atividade de polimerização devido às estruturas secundárias, algo muito comum em genomas com alto índice de guanina e citosina como o da família Herpesviridae (Hengen, 1997).
Cerca de 15% das amostras analisadas nesse trabalho foram positivas para BoHV-5. Outros artigos relatam entre 11% (Rissi et al., 2010) e 27% (Pinto et al., 2003). Esses dados indicam que a incidência desse herpesvírus pode ser bastante variável conforme a região analisada. Existe a possibilidade de que os resultados positivos para BoHV-5 e BoHV-1 em encéfalo bovino sejam provenientes de vírus latentes, como alertado por Campos et al. (2009). Como não foi realizado o isolamento do vírus, foi possível comprovar apenas a presença do DNA viral nessas amostras.
Os resultados para a presença de OvHV-2 em encéfalo bovino são semelhantes aos descritos por Rissi et al. (2010), cujos trabalhos encontraram cerca de 4,2% de amostras positivas. Cerca de 7,6% dos tecidos submetidos à mPCR nesse trabalho foram positivos para OvHV-2. A incidência de latência desse vírus em bovinos é baixa. Geralmente a enfermidade tem curso fatal, o que indica que os sinais nervosos dos animais positivos na PCR ocorreram devido à infecção pelo OvHV-2.
Todas as amostras de encéfalo bovino utilizadas neste trabalho provinham de animais com sinais nervosos, no entanto a maior parte delas foi negativa para os três herpesvírus. É preciso salientar que diversos outros microrganismos causam encefalite com sinais semelhantes aos da raiva, como a leucose enzoótica bovina, listeriose, enterotoxemia e a forma cerebral da babesiose, assim como intoxicação por plantas tóxicas ou chumbo (Riet-Correa et al., 1998; Claus et al., 2002). Os sinais neurológicos manifestados pelos animais dos quais as amostras negativas eram provenientes podem, portanto, ser decorrentes da presença de outros agentes ou de outras alterações no sistema nervoso central desses animais.
Gunson et al. (2008) relataram a importância das reações de PCR multiplex na rotina do laboratório. Uma reação bem padronizada aumenta a velocidade do trabalho e otimiza a utilização dos termocicladores e o preparo das reações de PCR. O método pode ser utilizado até mesmo quando apenas dois dos agentes são suspeitos de provocar a doença, como no caso do SuHV-1 e do OvHV-2, que podem causar sinais neurológicos em suínos (Albini et al., 2003).
CONCLUSÕES
Os estudos permitiram desenvolver uma PCR multiplex capaz de detectar quatro agentes infecciosos relacionados a encefalites bovinas. Além da praticidade de seu uso no diagnóstico diferencial de doenças do sistema nervoso bovino, essa técnica pode ser utilizada na para detecção desses mesmos agentes em tecidos suínos e ovinos.
AGRADECIMENTOS
Esse trabalho teve o apoio financeiro do INCT de Informação Genético-sanitária da Pecuária Brasileira (CNPq 573899/2008-8) e do Ministério da Agricultura, Pecuária e Abastecimento. Os autores agradecem ao professor Paulo Roehe, pela doação do isolado de BoHV-5.
Recebido em 16 de julho de 2010
Aceito em 12 de agosto de 2011
E-mail: augustofj@yahoo.com.br
- ALBINI, S.; ZIMMERMANN, W.; NEFF, F. et al Porcine malignant catarrhal fever: diagnostic findings and first detection of the pathogenic agent in diseased swine in Switzerland. Schweiz. Arch. Tierheilkd., v.145, p.61-68, 2003.
- ALTSCHUL, S.F; GISH. W.; MILLER, W. et al Basic local alignment search tool. J. Mol Biol, v.215, p.403-410, 1990.
- ARRUDA, L.P.; NAKAZATO, L.; DUTRA, V. et al Detecção molecular de herpesvírus bovino 1 e 5 em amostras de encéfalo conservadas em formol e emblocadas em parafina provenientes de bovinos com doença neurológica. Pesqui. Vet. Bras, v.30, p.646-650, 2010.
- BASTIEN, P.; PROCOP, G.W.; REISCHL, U. Quantitative real-time PCR is not more sensitive than "conventional" PCR. J. Clin. Microbiol, v.46, p.1897-1900, 2008.
- BATISTA, H.B.C.R.; SCHMIDT, E.; SPILKI, F.R. et al Herpesvírus bovinos (BoHV-1.1 e BoHV-1.2b) em forma infecciosa em encéfalos de bovinos submetidos ao diagnóstico de raiva no estado do Rio Grande do Sul. Arq. Bras. Med. Vet. Zootec, v.62, p.1023-1028, 2010
- BRAGA, A.C.; ROSA, J.C.; ROEHE, P.M. et al Diagnóstico da doença de Aujeszky em suínos no estado do Rio Grande do Sul. Vet. Foco, v.2, p.177-182, 2005.
- BOOM, R.; SOL, C.J.A.; SALIMANS, M.M.M. et al Rapid and simple method for purification of nucleic acids. J. Clin. Micol., v.28, p.495-503, 1990.
- BROWER, A.; HOMB, K.M.; BOCHSLER, P. et al Encephalitis in aborted bovine fetuses associated with Bovine herpesvirus 1 infection. J. Vet. Diagn. Invest, v.20, p.297-303, 2008.
- CAMPOS, F.S.; FRANCO, A.C.; HÜBNER, S.O. et al High prevalence of co-infections with bovine herpesvirus 1 and 5 found in cattle in southern Brazil. Vet. Microbiol, v.139, p.67-73, 2009.
- CLAUS, M.P.; ALFIERI, A.F.; ALFIERI, A.A. Herpesvírus bovino tipo 5 e meningoencefalite herpética bovina 1 Meningoencephalitis by Herpesvirus Type 5. Semina: Cienc. Agrar., v.23, p.131-141, 2002.
- COSTA, E.A. Diagnóstico das encefalites herpéticas em bovinos 2007. 57f. Tese (Doutorado em Ciência Animal) - Escola de Veterinária, Universidade Federal de Minas Gerais, Belo Horizonte, MG.
- COSTA, E.A.; BOMFIM, M.R.; DA FONSECA, F.G. et al Ovine herpesvirus 2 infection in foal, Brazil. Emerg. Infect. Dis, v.15, p.844-845, 2009.
- DAVISON, A.J.; EBERLE, R.; EHLERS, B. et al The order herpesvirales. Arch. Virol., v.154, p.171-177, 2009.
- DEL MÉDICO, M.P.; LADELFA, M.F.; KOTSIAS, F. et al Biology of bovine herpesvirus 5. Vet. J., v.184, p.138-145, 2010.
- ESTEVES, P.A.; DELLAGOSTIN, O.A.; PINTO, L.S. et al Phylogenetic comparison of the carboxy-terminal region of glycoprotein C (gC) of bovine herpesviruses (BoHV) 1.1, 1.2 and 5 from South America (SA). Virus Res., v.131, p.16-22, 2008.
- FONSECA Jr., A.A.; CAMARGOS, M.F.; CIACCI-ZANELLA, J.R. et al Diagnóstico e genotipagem do vírus da pseudorraiva por nested-PCR e análise de restrição enzimática. Cienc. Rural, v.40, p.921-927, 2010a.
- FONSECA Jr., A.A.; CAMARGOS, M.F.; DE OLIVEIRA, A.M. et al Molecular epidemiology of Brazilian pseudorabies viral isolates. Vet. Microbiol, v.141, p.238-245, 2010b.
- FONSECA Jr., A.A.; LEITE, R.C.; HEINEMANN, M.B.; REIS, J.K.P. A comparative analysis of envelope and tegument proteins of suid herpesvirus 1, bovine herpesvirus 1 and bovine herpesvirus 5. Arch. Virol., v.155, p. 1687-1692, 2010c.
- GAILBREATH, K.L.; TAUS, N.S.; CUNHA, C.W. et al Experimental infection of rabbits with ovine herpesvirus 2 from sheep nasal secretions. Vet. Microbiol., v.132, p.65-73, 2008.
- GARMATZ, S.L.; IRIGOYEN, L.F.; RECH, R.R. et al Febre catarral em bovinos no Rio Grande do Sul: transmissão experimental para bovinos e caracterização do agente etiológico. Pesq. Vet. Bras., v.24, p.93-106, 2004.
- GUNSON, R.N.; BENNETT, S.; MacLEAN, A.; CARMAN, W.F. Using multiplex real time PCR in order to streamline a routine diagnostic service. J. Clin. Virol, v.43, p.372-375, 2008.
- HENGEN, P.N. Optimizing multiplex and LA-PCR with betaine. Trends Biochem. Sci., v.22, p.225-226, 1997.
- HALL, T.A. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT. Nucl. Acids. Symp. Ser., v.41, p.95-98, 1999.
- KIBBE, W.A. OligoCalc: an online oligonucleotide properties calculator. Nucleic Acids Res, v.35, W43-46, 2007.
- LI, H.; GAILBREATH, K.; FLACH, E.J. et al A novel subgroup of rhadinoviruses in ruminants. J. Gen. Virol, v.86, p.3021-3026, 2005.
- MANUAL of diagnostic tests and vaccines for terrestrial animals. Paris: OIE, 2008. 1343p.
- MUYLKENS, B.; THIRY, J.; KIRTEN, P.; et al. Bovine herpesvirus 1 infection and infectious bovine rhinotracheitis. Vet. Res., v.38, p.181-209, 2007.
- PINTO, A.M.V.; ROMIJN, P.C.; SILVA, R.C.F. et al Geographic distribution of BHV-5 in Rio de Janeiro state. In: NATIONAL MEETING OF VIROLOGY, 14., 2003, Florianópolis. Anais... São Paulo, SP: Sociedade Brasileira de Virologia, 2003. p.141.
- POMERANZ, L.E.; REYNOLDS, A.E.; HENGARTNER, C.J. Molecular biology of pseudorabies virus: impact on neurovirology and veterinary medicine. Microbiol. Mol. Biol. Rev., v.69, p.462-500, 2005.
- RIET-CORREA, F.; SCHILD, A.L.; FERNANDES, C.G. Enfermidades do sistema nervoso dos ruminantes no sul do Rio Grande do Sul. Cienc. Rural, v.28, p.341-348, 1998.
- RISSI, D.R.; RECH, R..R.; FLORES, E.F. et al Meningoencefalite por herpesvírus bovino-5. Pesq. Vet. Bras., v.27, p.251-260, 2007.
- RISSI, D.R.; PIEREZAN, F.E.; SILVA, M.S. et al Neurological disease in cattle in southern Brazil associated with Bovine herpesvirus infection. J. Vet. Diagn. Invest, v.20, p.346-349, 2008.
- RISSI, D. R.; PIEREZAN, F.; OLIVEIRA-FILHO, J.C. et al Abordagem diagnóstica das principais doenças do sistema nervoso de ruminantes e equinos no Brasil. Pesq. Vet. Bras. v.30, p.958-967, 2010.
- RUSSELL, G.C.; STEWART, J.P.; HAIG, D.M. Malignant catarrhal fever: a review. Vet. J, v.179, p.324-335, 2009.
- THIRY, J.; KEUSER, V.; MUYLKENS, B. et al Ruminant alphaherpesviruses related to bovine herpesvirus 1. Vet. Res v.37, p.169-190, 2006.
- TIPPMANN, H.F. Analysis for free: comparing programs for sequence analysis. Brief Bioinform., v.5, p.82-87, 2004.
- UNTERGASSER, A.; NIJVEEN, H.; RAO, X. et al Primer3Plus, an enhanced web interface to Primer3. Nucleic Acids Res, v.35, W71-W74, 2007.
- YEH, H.Y.; YATES, M.V.; CHEN, W. et al Real-time molecular methods to detect infectious viruses. Semin. Cell Dev. Biol., v.20, p.49-54, 2009.
PCR Multiplex para detecção dos principais herpesvírus neurológicos de ruminantes
Datas de Publicação
-
Publicação nesta coleção
19 Dez 2011 -
Data do Fascículo
Dez 2011
Histórico
-
Recebido
16 Jul 2010 -
Aceito
12 Ago 2011