Resumos
Avaliou-se o perfil bioquímico de cinco éguas hígidas tratadas com polietilenoglicol 3350 (PEG); ou com polietilenoglicol 3350+Ringer lactato (PEG+RL); ou com solução isotônica poliônica enteral (SIPE); ou com solução isotônica poliônica enteral associada ao Ringer lactato intravenoso (SIPE+RL); ou com solução de cloreto de sódio a 0,9% (NaCl 0,9%). Os parâmetros avaliados foram: sódio, cloreto, potássio, cálcio ionizado, fósforo, magnésio total, proteínas totais, albumina, creatinina, ureia e osmolaridade calculada no soro de sangue venoso. O tratamento PEG não alterou os parâmetros bioquímicos. O PEG+RL diminuiu o fósforo. O SIPE diminuiu o fósforo e aumentou o cloreto. O SIPE+RL aumentou o sódio, e o NaCl 0,9% ocasionou o aumento do cloreto e a redução da osmolaridade sérica. Concluiu-se que o tratamento PEG associado ao Ringer lactato pode provocar o aparecimento de hipofosfatemia, o SIPE ocasiona hipercloremia, o NaCl 0,9% diminui a osmolaridade sérica e o SIPE+RL provoca hipernatremia.
equino; bioquímica; polietilenoglicol; soluções
The biochemical profile of five healthy mares treated with polyethylene glycol 3350 (PEG); or polyethylene glycol 3350+Ringer lactate intravenous (PEG+RL); or enteral polionic isotonic solution (EPIS); or enteral polionic isotonic solution associated with Ringer lactate intravenous (EPIS+RL); or chloride sodium solution 0.9% (NaCl 0.9%) was evaluated. The parameters evaluated were: sodium, chloride, potassium, ionized calcium, phosphorus, total magnesium, total protein, albumin, creatinine, urea, and calculated serum osmolality of venous blood. PEG treatment did not alter biochemical parameters. PEG+RL decreased phosphorus. SIPE decreased phosphorus and increased chloride. The EPIS+RL caused an increase of sodium and NaCl 0.9% caused an increase of chloride and a reduction of serum osmolarity. It is concluded that PEG treatment associated with Ringer lactate solution can cause the appearance of hypophosphatemia, EPIS causes hyperchloremia, NaCl 0.9% decreases the serum osmolality and EPIS+RL causes hypernatremia.
equine; biochemistry; polyethylene glycol; solutions
MEDICINA VETERINÁRIA
Efeitos do polietilenoglicol 3350 e de soluções acidificantes e alcalinizantes sobre o perfil bioquímico de éguas hígidas
Effects of polyethylene glycol 3350 and alkalizing and acidifying solutions on the biochemical profile of healthy mares
C.L.N. GomesI; J.D. Ribeiro FilhoII; J.D. GuimarãesII; R.M. MenesesII
IUniversidade Estadual do Maranhão - São Luís, MA
IIUniversidade Federal de Viçosa - Viçosa, MG
RESUMO
Avaliou-se o perfil bioquímico de cinco éguas hígidas tratadas com polietilenoglicol 3350 (PEG); ou com polietilenoglicol 3350+Ringer lactato (PEG+RL); ou com solução isotônica poliônica enteral (SIPE); ou com solução isotônica poliônica enteral associada ao Ringer lactato intravenoso (SIPE+RL); ou com solução de cloreto de sódio a 0,9% (NaCl 0,9%). Os parâmetros avaliados foram: sódio, cloreto, potássio, cálcio ionizado, fósforo, magnésio total, proteínas totais, albumina, creatinina, ureia e osmolaridade calculada no soro de sangue venoso. O tratamento PEG não alterou os parâmetros bioquímicos. O PEG+RL diminuiu o fósforo. O SIPE diminuiu o fósforo e aumentou o cloreto. O SIPE+RL aumentou o sódio, e o NaCl 0,9% ocasionou o aumento do cloreto e a redução da osmolaridade sérica. Concluiu-se que o tratamento PEG associado ao Ringer lactato pode provocar o aparecimento de hipofosfatemia, o SIPE ocasiona hipercloremia, o NaCl 0,9% diminui a osmolaridade sérica e o SIPE+RL provoca hipernatremia.
Palavras-chaves: equino, bioquímica, polietilenoglicol, soluções
ABSTRACT
The biochemical profile of five healthy mares treated with polyethylene glycol 3350 (PEG); or polyethylene glycol 3350+Ringer lactate intravenous (PEG+RL); or enteral polionic isotonic solution (EPIS); or enteral polionic isotonic solution associated with Ringer lactate intravenous (EPIS+RL); or chloride sodium solution 0.9% (NaCl 0.9%) was evaluated. The parameters evaluated were: sodium, chloride, potassium, ionized calcium, phosphorus, total magnesium, total protein, albumin, creatinine, urea, and calculated serum osmolality of venous blood. PEG treatment did not alter biochemical parameters. PEG+RL decreased phosphorus. SIPE decreased phosphorus and increased chloride. The EPIS+RL caused an increase of sodium and NaCl 0.9% caused an increase of chloride and a reduction of serum osmolarity. It is concluded that PEG treatment associated with Ringer lactate solution can cause the appearance of hypophosphatemia, EPIS causes hyperchloremia, NaCl 0.9% decreases the serum osmolality and EPIS+RL causes hypernatremia.
Keywords: equine, biochemistry, polyethylene glycol, solutions
INTRODUÇÃO
A administração de laxativos, a hidratação enteral e a intravenosa são terapias comumente realizadas em equinos com compactação no intestino grosso (White e Dabareiner, 1997). Porém, se utilizadas inadequadamente, podem alterar parâmetros bioquímicos nos pacientes, o que torna relevante conhecer seus efeitos no organismo.
O polietilenoglicol (PEG 3350) é um laxativo osmótico utilizado em humanos, efetivo para o tratamento de constipação e compactação intestinal sem provocar efeitos colaterais (Corazziari et al., 1996; Lemann et al., 1996). Essa substância vem associada a eletrólitos e requer a diluição em água, proporcionando baixo risco de ocasionar desidratação e desequilíbrio eletrolítico, o que ocorre com alguns outros laxativos. O produto ainda não foi estudado em equinos.
Soluções eletrolíticas ou iônicas são utilizadas para hidratar e recompor os equilíbrios hidroeletrolíticos e ácido-base dos pacientes (Seahorn e Cornick-Seahorn, 1994; Ribeiro Filho et al., 2009). As mais comumente utilizadas são o Ringer com lactato de sódio e o cloreto de sódio 0,9%, por infusão intravenosa (IV). Entretanto, suas composições não são similares ao plasma e possuem propriedades alcalinizantes (Leal et al., 2007) e acidificantes (Morgan, 2009), respectivamente. As soluções enterais, também efetivas para umedecer o conteúdo intestinal (Gomes, 2010; Farias, 2010) e estimular a motilidade colônica (Freeman et al., 1992), podem ter suas composições preparadas de acordo com a necessidade do paciente (Ribeiro Filho et al., 2009).
O uso de laxativos associados à hidratação IV é uma conduta médica comum no atendimento de equinos com cólica por compactação no cólon maior. A hiperidratação IV, associada ao sulfato de magnésio (Lopes, 2002), ou a planta Sene (Ribeiro Filho, 2003) demonstraram efeitos laxativos em equinos, mas o uso somente da hiperidratação IV pode estimular a secreção no lúmen intestinal, contribuindo para umedecer a ingesta em segmentos intestinais como o ceco (Gerard, 2003) e o cólon maior (White e Lopes, 2003; Lopes et al., 2004).
Embora os transtornos gastrintestinais que necessitam do uso de laxativos, hidratação enteral, intravenosa ou de suas associações sejam comuns na medicina equina, ainda há poucos estudos sobre o assunto, inclusive com poucos dados sobre seus efeitos na bioquímica clínica. Este estudo teve o objetivo de avaliar os efeitos de tratamentos com o polietilenoglicol (PEG 3350) e com soluções eletrolíticas, acidificantes e alcalinizantes administradas por via enteral e intravenosa, sobre o perfil bioquímico de equinos hígidos.
MATERIAL E MÉTODOS
Foram utilizadas cinco éguas mestiças, com idades entre cinco e 19 anos (média de 12,5 anos), com bom escore corporal e peso corporal médio de 392kg, sem evidência de doenças com base no exame físico, no hemograma, nos exames bioquímico e de urina e sem histórico de doença intestinal nos últimos seis meses. Dez dias antes do início do experimento, os animais foram vermifugados com ivermectina + praziquantel (Padock NF gel pasta® - Laboratório Vetbrands) por via oral e receberam banho de aspersão com deltrametrina 0,025% (Butox P® - Laboratório Quimio) para ação carrapaticida. Em seguida, foram mantidos em baias individuais durante o período da pesquisa, onde receberam dieta constituída de concentrado (Ração Equisul 15 especial - Total Alimentos) em quantidade equivalente a 1% do peso corporal, dividido em duas refeições/dia; volumoso (feno de Tifton 85) em quantidade equivalente a 2% do peso corporal, fornecido em duas refeições/dia; 50g/dia de suplemento mineral (Hiposal 80% = Total alimentos) associado ao concentrado; água ad libitum.
As coletas de sangue para exames bioquímicos foram realizadas segundo os intervalos: fase de pré-tratamento (T0h - imediatamente antes do início dos tratamentos); fase de transtratamento (T6h - seis horas de tratamento, T12h - 12 horas de tratamento); fase de pós-tratamento (T24h e T48h - 12 e 36 horas após término do tratamento). Durante a fase de tratamento, os animais foram submetidos a jejum hídrico-alimentar. Os tratamentos foram: polietilenoglicol 3350 (Muvinlax® - Libbs) (PEG) - administrado na dose de 1,5g kg-1, diluída em cinco litros de água, por meio de sonda nasogástrica (sonda nasogástrica para equinos - Provar), dose única; osmolaridade da solução: 252,66mMol L-1; pH: 8,65; PEG+RL - polietilenoglicol 3350 administrado na mesma posologia do tratamento PEG, associado ao Ringer lactato (solução de Ringer com lactato de sódio - Sanobiol), na dose de 15mL kg-1 h-1, por via intravenosa, durante 12 horas por fluxo contínuo (PEG+RL); osmolaridade do Ringer lacato: 272,22mMol L-1; pH: 6,75; SIPE - solução isotônica poliônica enteral composta de 6g de NaCl (cloreto de sódio - Química Sulfal Ltda.), 0,5g de KCl (cloreto de potássio - Química Sulfal Ltda.), 1g de gluconato de cálcio (gluconato de cálcio - Comércio e Indústria Farmos Ltda.), 300mg de pidolato de magnésio (Pidomag® - Laboratório Baldacci S.A.), 5g de maltodextrina pura (Maximus - Arve alimentos), diluídos em 1.000mL de água; osmolaridade: 321,14mMol L-1; pH: 7,20, administrada na dose de 15mL kg-1 h-1 ,durante 12 horas por fluxo contínuo, via sonda nasogástrica de pequeno calibre (sonda uretral para equino macho - Provar); SIPE+RL - solução isotônica poliônica enteral na mesma composição do tratamento SIPE, porém administrada na dose de 7,5mL kg-1 h-1 ,durante 12 horas por fluxo contínuo, via sonda nasogástrica de pequeno calibre associada ao Ringer lactato na dose de 7,5mL kg-1 h-1, IV, durante 12 horas em fluxo contínuo. A osmolaridade e o pH destas soluções foram iguais aos dos tratamento SIPE e PEG+RL, respectivamente; NaCl 0,9% - solução de cloreto de sódio 0,9% (solução de cloreto de sódio a 0,9% - Texon), 15mL kg-1 h-1, IV, durante 12 horas por fluxo contínuo; osmolaridade da solução: 309,80mMol L-1; pH: 5,60.
As amostras de sangue foram colhidas assepticamente por venipunção da jugular, utilizando-se agulhas hipodérmicas (agulhas 18G, BD - Becton e Dickinson Ind. Cirúrgica Ltda), que foram acondicionadas em frascos Vacutainer sem anticoagulante (frasco siliconizado a vácuo - 10mL sem anticoagulante - Vacuum II) para obtenção do soro. No soro foram mensurados o sódio e o potássio em fotometria de chama (Fotômetro de Chama Monocanal - Modelo FC 180: Celm). Em multianalisador bioquímico (Aparelho Automático Alizé - Clinine 150), foram mensurados o cloreto, o magnésio, o fósforo, a ureia, a creatinina, a proteína total e a albumina. No aparelho íon seletivo (Aparelho de íon seletivo AVL 9180 - Roche), foi analisado o cálcio sérico. A osmolaridade foi calculada pela fórmula descrita por Andrews e Grindem (2000):
Osmcal (mMol L-1) = [18(Na++K+)](mEq L-1) + [glicose/18](mg dL-1) + [ureia/2,8](mg dL-1).
Adotou-se um delineamento em quadrado latino 5x5, considerando-se os efeitos período, tratamento e tempo, com o efeito animal sendo aleatório. Empregou-se o programa estatístico SAEG (Sistema..., 2007) para análise dos dados. Os dados obtidos foram submetidos à ANOVA para verificar os efeitos de tratamentos e do tempo em cada tratamento. As médias significativas ao teste F foram comparadas pelo teste Tukey, e para as que não apresentaram distribuição normal, usou-se análise não paramétrica e comparação pelo teste de Kruskal-Wallis, sendo adotado P<0,05 para ambos os testes.
Este estudo experimental foi aprovado pela Comissão de Ética para Uso de Animais do Departamento de Veterinária da Universidade Federal de Viçosa, processo № 50/2007.
RESULTADOS E DISCUSSÃO
O aumento do sódio no T12h no grupo SIPE+RL (P<0,05) ocasionou acréscimo da osmolaridade no T12h (Tab. 1), pois este eletrólito é responsável por aproximadamente 85% da osmolaridade sérica (Feldman e Nelson, 1986).
Como os animais do SIPE+RL também receberam maltodextrina pela solução enteral e lactato por via IV, o qual é metabolizado à glicose no processo de gliconeogênese, a glicose gerada pode ter contribuído também para o aumento da osmolaridade. A adição de glicose na solução enteral maximiza a absorção de água por meio do mecanismo de absorção combinado com glicose e sódio pela mucosa do intestino delgado, em algumas espécies (Gisolfi e Duchan, 1992). Avanza (2007) mensurou o volume plasmático em equinos normovolêmicos tratados com soluções enterais (15mL kg-1 h-1), mas não detectou resultados satisfatórios com a adição de glicose ou de maltodextrina nas soluções, e verificou que uma solução eletrolítica enteral contendo glicose foi a que proporcionou a menor expansão do volume plasmático. O referido autor citou que esse fato provavelmente aconteceu devido à alta osmolaridade da solução utilizada (340mOsm kg-1), que resultou em redução na absorção da solução eletrolítica, determinando, por conseguinte, menor expansão do volume plasmático.
Proteínas plasmáticas, ureia e glicose contribuem para o índice da osmolaridade (Feldman e Nelson, 1986). No T6h e T12h, os valores da Osmcal no grupo NaCl 0,9% diminuíram apenas discretamente com relação ao T0h (P>0,05) (Tab. 1). Este fato pode estar associado com a hemodiluição ocasionada pelo volume e rápida infusão de NaCl 0,9% nos animais, gerando redução nos valores séricos da proteína total, albumina e ureia.
Em equinos, ainda não foi definida a osmolaridade ideal da solução enteral que favorece a melhor absorção de água e eletrólitos. No presente ensaio, o tratamento com a solução enteral contendo maltodextrina (SIPE), também administrada na dose de 15mL kg-1 h-1 e com osmolaridade de 321,14mMol L-1, não favoreceu a maior absorção de água, pois não diminuiu a osmolaridade sérica (Tab. 1). Além disso, por ter sido realizada em animais euvolêmicos, tal efeito
pode ter sido regulado por mecanismos de controle do volume plasmático por filtração renal. Então, é possível que soluções hipo-osmóticas em equinos ocasionem maior absorção de líquidos no intestino, fato este que necessita ser investigado para sua comprovação, pois estudos em ratos demonstraram que soluções salinas hipo-osmóticas contendo polímeros de glicose promoveram maior absorção de água no intestino delgado (Thillainayagami et al., 1998).
Os valores médios do sódio no tratamento SIPE+RL foram maiores (P<0,05) que os do SIPE nos tempos T12h, T24h e T48h, e maiores (P<0,05) que o do PEG+RL no T24h. No SIPE+RL, a concentração de sódio aumentou (P<0,05) no final da hidratação (T12h) em relação ao seu tempo basal (T0h), sinalizando o aparecimento de hipernatremia (Tab. 1). Hipernatremia ocorre quando a concentração de sódio no sangue ultrapassa 150mEq L-1 e geralmente está associada à perda de água oriunda da desidratação por diarreia ou à administração de soluções eletrolíticas contendo excesso de sódio (Barbosa e Stztasnboc, 1999). O aumento da concentração de sódio no SIPE+RL a partir de T12h até T48h foi decorrente da administração das duas soluções eletrolíticas utilizadas no referido tratamento, pois, apesar de as soluções conterem concentrações de sódio semelhantes ao plasma, elas continham sódio oriundo da composição da solução enteral (6g de NaCl), da solução intravenosa (6g de NaCl) e também do lactato de sódio (3g de Na+), ou seja, os animais desse tratamento receberam sódio de três origens, o que determinou o aumento sérico deste eletrólito. Esse achado revela que a administração de soluções eletrolíticas, concomitantemente por via intravenosa e enteral, dependendo das suas composições, pode ocasionar desequilíbrio eletrolítico.
Pacientes com hipernatremia podem manifestar sinais de agitação, letargia, irritação e convulsão, seguidos de espasmos musculares, hiper-reflexia, tremores, ataxia e hipertermia (Évora et al., 1999). No T12h, um animal do tratamento SIPE+RL manifestou aumento de temperatura, letargia, espasmos e tremores musculares. Alves et al. (2005) também verificaram hipernatremia em equinos com compactação induzida no cólon maior durante o tratamento com uma solução eletrolítica enteral isotônica na dose de 8mL kg-1 h-1 e presumiram como causa a composição da solução.
Não ocorreram diferenças (P>0,05) do potássio entre os tratamentos, tampouco nos tratamentos durante a fase experimental (Tab. 1). Ignácio (2006) detectou aumento na concentração plasmática do potássio em equinos que receberam administração de NaCl 0,9%, apesar de esta solução não conter potássio na sua composição. Segundo Ribeiro Filho et al. (2007), esse acréscimo provavelmente ocorre pela passagem do potássio intracelular para o plasma em resposta à acidose metabólica desencadeada pela hipercloremia decorrente da ação da solução salina. Embora o tratamento NaCl 0,9% do presente estudo tenha ocasionado hipercloremia (Tab. 1), esse evento não foi detectado; possivelmente a intensidade da hipercloremia não foi suficiente para ocasionar o evento acima descrito.
Os valores médios do cloreto no grupo NaCl 0,9% foram maiores (P<0,05) que os do PEG no T12h (Tab. 1). Na avaliação ao longo do tempo, o tratamento NaCl 0,9% aumentou a concentração de cloreto no T6h e no T12h (P<0,05). Segundo Burdett e Mythen (2009), a solução de NaCl 0,9% possui concentração de cloreto mais elevada do que o plasma equino, podendo provocar hipercloremia, assim a infusão de grandes volumes de solução salina ocasiona acidose hiperclorêmica. Hipercloremia também pode advir da administração de soluções contendo cloreto por via enteral (Cruz, 2008).
Como mostra a Tab. 2, no T6h e no T12h, os animais do tratamento NaCl 0,9% apresentaram os menores valores de cálcio ionizado quando comparados aos animais dos demais tratamentos (P<0,05). Na avaliação dos tratamentos ao longo do tempo, com exceção do SIPE e SIPE+RL, os demais apresentaram os menores índices durante T6h e T12h, porém os menores valores foram detectados no grupo NaCl 0,9%, que apresentou concentrações de cálcio ionizado abaixo da faixa de referência.
Nos animais dos grupos PEG e PEG+RL, ocorreu diminuição (P<0,05) do cálcio ionizado durante o período de tratamento (T6h e T12h), entretanto, tal fato não teve significado clínico, pois os valores mantiveram-se na faixa fisiológica de referência (Kaneko et al., 1997).
Embora as soluções eletrolíticas utilizadas nos tratamentos SIPE e SIPE+RL contivessem cálcio na sua composição, não foi detectado aumento significativo desse elemento no soro dos animais. Houve discreta diminuição deste eletrólito nos animais dos grupos PEG, PEG+RL e NaCl 0,9%. Esse achado demonstra que o gluconato de cálcio incorporado nas soluções eletrolíticas utilizadas nos tratamentos SIPE e SIPE+RL foi importante na manutenção da homeostase do cálcio sérico, principalmente quando observados os valores do cálcio nos animais do tratamento NaCl 0,9% no T6h e T12h (Tab. 2).
Segundo Garcia-Lopez (2001), a falta de cálcio em soluções eletrolíticas para infusão pode favorecer a redução do cálcio sanguíneo. Avanza (2007), ao comparar os efeitos de quatro soluções eletrolíticas sem cálcio, administradas por via enteral em equinos hígidos ou desidratados experimentalmente, também constatou discreta redução do cálcio ionizado. Portanto, a administração de soluções eletrolíticas contendo uma fonte de cálcio pode ser uma alternativa eficaz para prevenir a diminuição dos valores do cálcio sanguíneo durante a hidratação prolongada, principalmente se o animal já estiver apresentando hipocalcemia.
No T12h, detectou-se diferença entre tratamentos. O PEG apresentou os maiores valores de fósforo sérico que os demais tratamentos (P<0,05). No PEG+RL e SIPE, o fósforo apresentou diminuição (P<0,05). No PEG+RL, esse decréscimo ocorreu no T12h e no T24h, enquanto no SIPE aconteceu a partir de T6h, perdurando até o T48h. Como citou Barbosa e Stztasnboc (1999), os distúrbios do metabolismo do fósforo decorrem basicamente da sua redistribuição entre os compartimentos intra e extracelular e do balanço entre aporte e excreção. Os resultados encontrados no presente estudo demonstram que, à exceção do PEG, os tratamentos que receberam solução eletrolítica por via enteral, intravenosa, ou ambas apresentaram redução nos valores do fósforo (Tab. 2), sinalizando que a hemodiluição decorrente da hidratação e a redistribuição foram fatores essenciais no aparecimento desse decréscimo. Ressalta-se que, nos tratamentos PEG+RL, SIPE+RL e principalmente no SIPE, a glicose pode também ter contribuído para essa diminuição, pois, como relataram Kaneko et al. (1997), a translocação da glicose à célula, para ser aproveitada, induz o influxo intracelular do fósforo em resposta ao aumento de glicólise, determinando a redução do fósforo sérico. Isto ocorre porque a glicose induz secreção de insulina, e esta facilita a entrada da glicose e eletrólitos na célula. Esses resultados sugerem que animais com hipofosfatemia recebendo solução contendo glicose ou algum precursor desta por tempo prolongado devam receber fosfato.
Como demonstra a Tab. 2, no T6h, o valor médio do magnésio total no grupo SIPE foi maior que o do NaCl 0,9% (P<0,05). No PEG+RL, foi verificado que o magnésio total aumentou no T12h (P<0,05). Embora esses resultados tenham ocorridos, os valores de magnésio total de todos os tratamentos em todos os tempos permaneceram entre os níveis fisiológicos para equinos, portanto não apresentaram significado clínico.
Um dos fatores mais importantes quanto à absorção enteral de magnésio é a sua biodisponibilidade nos compostos em que este é presente. O pidolato de magnésio, quando administrado por via enteral, biodisponibiliza ao redor de 60% deste eletrólito. Estudo em equinos foi realizado por Cruz (2008) utilizando-se 15mL kg-1 h-1 de uma solução eletrolítica enteral contendo 0,2mg L-1 de pidolato de magnésio, entretanto não foi verificado aumento de magnésio total nos animais após 12h de infusão contínua por via enteral. No presente estudo, utilizou-se a dose de 0,3mg L-1 nos tratamentos SIPE SIPE+RL, porém também não ocorreu aumento no magnésio sérico. Por sua vez, Avanza (2007) ao utilizar sulfato de magnésio associado à solução enteral em equinos hígidos ou desidratados, na dose de 1g kg-1 de solução enteral (15ml kg-1 h-1 durante 12 h), também não encontrou alteração significativa nos valores do magnésio.
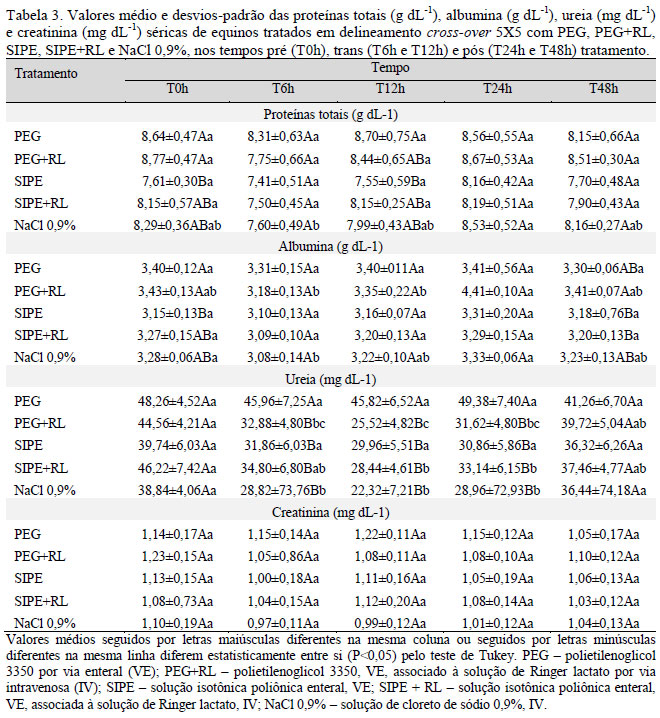
As concentrações de proteínas totais diminuíram no tratamento NaCl 0,9% no T6h (P<0,05), enquanto a albumina diminuiu no PEG+RL no T6 e no T12h, e no NaCl 0,9% no T6h (Tab. 3). A ureia diminuiu no grupo SIPE+RL no T12h e T24h (P<0,05), e nos tratamentos PEG+RL e NaCl 0,9% do T6h até o T24h (P<0,05). Os valores da creatinina não apresentaram diferença durante toda a fase experimental (P>0,05). A diminuição nos valores destes parâmetros foi devido à hemodiluição provocada pelos volumes infundidos das soluções intravenosas e enterais. Seahorn e Cornick-Seahorn (1994) descreveram que a hidratação intravenosa na dose de 10 a 20mL kg-1 h-1 pode provocar diurese devido à rápida expansão plasmática. Assim, os fluidos administrados intravenosamente expandiram mais rapidamente o volume plasmático, diluindo e reduzindo a concentração. Entretanto, convém ressaltar que, embora tenha ocorrido diminuição, os valores da proteína total, da albumina e da ureia mantiveram-se na faixa de referência, tornando-os sem significado clínico.
CONCLUSÕES
A administração do polietilenoglicol (PEG 3350) não altera o perfil bioquímico de equinos, enquanto sua associação com Ringer lactato por via intravenosa determina o aparecimento de hipofosfatemia. A solução isotônica poliônica enteral (SIPE) ocasiona hipercloremia, e a sua administração em conjunto com o Ringer lactato por via intravenosa (SIPE+RL) provoca hipernatremia, sinalizando que a administração de soluções eletrolíticas, concomitantemente por via intravenosa e enteral, dependendo de suas composições, pode ocasionar desequilíbrio eletrolítico. Por sua vez, a infusão de NaCl 0,9% diminui a osmolaridade sérica calculada e também causa hipercloremia.
AGRADECIMENTOS
À FAPEMIG (Fundação de Amparo à Pesquisa do Estado de Minas Gerais) e à CAPES (Coordenação de Aperfeiçoamento de Pessoal de Nível Superior).
Recebido em 24 de março de 2011
Aceito em 15 de maio de 2012
E-mail: claudioninagomes@uol.com.br
- ALVES, G.E.S.; RIBEIRO FILHO, J.D.; OLIVEIRA, H.P. et al Tratamento da compactação experimental do cólon maior em equinos: resultados de laboratório e exames bioquímicos. Arq. Bras. Med. Vet. Zootec., v.57, p.281-287, 2005.
- ANDREWS, J.M.; GRINDEM. C.B. Interpreting electrolyte, anion gap, and total carbon dioxide data. Vet. Med, v.95, p.548-553, 2000.
- AVANZA, M.F.B. Soluções eletrolíticas associadas ou não a glicose, maltodextrina e sulfato de magnésio administrada por via enteral em equinos hígidos e desidratados experimentalmente. 2007. 68f. Dissertação (Mestrado em Medicina Veterinária) - Departamento de Medicina Veterinária, Universidade Federal de Viçosa, Viçosa, MG.
- BARBOSA, P.A.; SZTAJNBOK, J. Distúrbios hidroeletrolíticos. Artigo de Revisão. J. Pediat, v.75, supl. 2, p.223-233, 1999.
- BURDETT, E.; MYTHEN, M. Hypercloremia. In: KELLUM, J.A.; ELBERS, P.W.G. (Ed). Stewart's texrbook of acid-base. Amsterdan: ACIDBASE.ORG, 2009. Cap. 21, p.367-373.
- CORAZZIARI, E.; BADIALI, D.; BAZZOCCHIB, G. et al Small volume isosmotic polyethylene glycol electrolyte balanced solution (PMF-100) in treatment of chronic nonorganic constipation. Digest. Dis. Sci., v.41. p.1636-1642, 1996.
- CRUZ, A.L. Avaliação dos efeitos de soluções eletrolíticas enterais sobre parâmetros clínicos e bioquímicos de equinos desidratados experimentalmente. 2008. 37f. Dissertação (Especialização em clínica e cirurgia de grandes animais) - Departamento de Medicina Veterinária, Universidade Federal de Viçosa, Viçosa, MG.
- ÉVORA, P.R.B.; REIS, C.L; FEREZ, M.A. et al Distúrbios do equilíbrio hidroeletrolítico e do equilíbrio acidobásico. Uma revisão prática. Medicina, n.32, p.451-469, 1999.
- FARIAS, S.K. Efeitos de soluções eletrolíticas associadas ou não à dextrose, maltodextrina e propionato de cálcio administradas por via enteral sobre parâmetros clínicos e laboratoriais de equinos. 2010. 85f. Dissertação (Mestrado em Medicina Vaterinária) - Departamento de Veterinária, Universidade Federal de Viçosa, Viçosa. MG.
- FELDMAN, E.C.; NELSON, R.W. (Ed). Canine and feline endocrinology and reproduction 2nd. ed. Missouri: Saunders, 1986. p.616-644.
- FREEMAN, D.E.; FERRANTE, P.I.; PALMER, J.E. Comparison of the effects of antragastric infusions of equal volumes of water, dioctyl sodium sulfoccinato and magnesium sulfate on fecal composition and output in clinically normal horses. Am. J. Vet. Res., v.53, p.1347-1353, 1992.
- GARCIA-LOPEZ, J.M. Prevalence e prognostic importance of hypomagnesemia and hypocalcemia in horses that have colic. Am. J. Vet. Res., v.62, p.7-12, 2001.
- GERARD, M.P. Cecal impactation. In: ROBINSON, E. (Ed). Current Therapy in Equine Medicine 5.ed. St. Louis: Saunders, cap.3, 2003. p.138-139.
- GISOLFI, C.V.; DUCHMAN, S.M. Guidelines for optimal replacement beverages for different athletic events. Med. Sci. Sports Exerc, v.24, p.679-687, 1992.
- GOMES, C.L.N. Efeitos do polietilenoglicol (PEG 3350) e soluções poliônicas administradas por via enteral e intravenosa em equinos. 2010. 130f. Tese (Doutorado em Medicina Veterinária). Departamento de Veterinária, Universidade Federal de Viçosa, Viçosa, MG.
- IGNÁCIO, F.S. Fluidoterapia enteral em equinos com NaCl 0,9% ou uma solução semelhante ao plasma. 2006. 19f. Dissertação (Especialização em Clínica e Cirurgia Veterinárias em Grandes Animais) - Departamento de Medicina Veterinária, Universidade Federal de Viçosa, Viçosa, MG.
- KANEKO, J.J.; HARVEY, J.W.; BRUSS, M.L. (Eds.). Clinical Biochemistry of Domestic Animals Califórnia: Academic Press, 1997, 932p.
- LEAL, M.L.R.; MARUTA, C.A.; ORTOLANI, E.L. Uso de bicarbonato e lactato-L para correção da acidose metabólica sistêmica em bovinos com acidose láctica ruminal aguda. Arq. Bras. Med. Vet. Zootec., v.59, p.971-976, 2007.
- LEMANN, M.; CHAUSSADE, S.; HALPHEN, M. et al Low dose polyethylene glycol in chronic constipation: double-blind placebo-controlled crossover trial. Gastroenterol., v.110, p.108-114, 1996.
- LOPES, M.A.F. Physiological aspects, indications and contraindications of enteral fluid therapy. Eq. Vet. Ed., v.4, p.330-336, 2002.
- LOPES, M.A.F.; WHITE, N.A.; DONALDSON, L. et al Effects of enteral and intravenous fluid therapy, magnesium sulfate, and sodium sulfate on colonic contents and feces in horses. Amer. J. Vet. Res, v.65, p.695-704, 2004.
- MORGAN, T.J. Buffers. In: KELLUM, J.A.; ELBERS, P.W.G. (Ed). Stewart's texrbook of acid-base. Amsterdan: ACIDBASE.ORG, 2009. Cap.15, p.281-291.
- RIBEIRO FILHO, J.D.; GOMES, C.L.N; FONSECA, B.P.A. et al Hidratação enteral em ruminantes e equídeos. Eficiência com menor custo. Rev. Cons. Fed. Med. Vet., p.63-67, 2009.
- RIBEIRO FILHO, J.D.; ABREU, J.M.G.; ALVES, G.E. et al Hemogasometria em equinos com compactação experimental do cólon maior tratados com sene, fluidoterapia enteral e parenteral. Cienc. Rural, v.37, p.755-761, 2007.
- RIBEIRO FILHO, J.D. Tratamento da compactação experimental do cólon maior de equinos com sene, fluidoterapia enteral e parenteral. 2003, 130f. Tese (Doutorado em Ciência Animal) - Escola de Veterinária, Universidade Federal de Minas Gerais, Belo Horizonte.
- SISTEMA para análises estatísticas - SAEG. Versão 9.1. Viçosa: UFV, Fundação Arthur Bernardes, 2007. 301p.
- SEAHORN, T.L.; CORNICK-SEAHORN, J. Fluid therapy. Vet. Clin. N. Am.: Equine Pract., v.10, p.517-525, 1994.
- THILLAINAYAGAMl, A.V.; HUNT, J.B.; FARTHINH, M.J.G. Viewpoints in digestive diseases. Enhancing clinical efficacy of oral rehydration therapy: is low osmolality the key? Gastroenterology, v.114, p.197-210, 1998.
- WHITE, N.; DABAREINER, R.M. Treatment of impaction colonic. Vet. Clin. N. Am.: Equine Pract., v.13, p.243-259, 1997.
- WHITE, N.; LOPES, M.A.F. Large colon impaction. In: ROBINSON, E. (Ed). Current Therapy in Equine Medicine 5.ed. St. Louis: Saunders, 2003. Cap.3, p.131-135.
Datas de Publicação
-
Publicação nesta coleção
31 Ago 2012 -
Data do Fascículo
Ago 2012
Histórico
-
Recebido
24 Mar 2011 -
Aceito
15 Maio 2012