Resumos
Avaliou-se e comparou-se, clinicamente, por meio de histopatologia e morfometria, o processo de reparação corneana de úlceras experimentais induzidas em coelhos, com o uso de plasma rico em plaquetas (PRP) sob a forma de colírio ou tampão. Foram utilizados 60 coelhos, constituindo-se quatro grupos experimentais de 15 animais cada, designados grupo plaqueta (GP), grupo tampão (GT), grupo controle (GC) e grupo controle amniótica (GA). Os grupos experimentais foram subdivididos em três subgrupos (M4, M7, M30), de acordo com o período final de avaliação, aos quatro, sete e 30 dias, respectivamente. Não houve diferenças entre os tratamentos utilizados quanto aos sinais relacionados à sensibilidade ocular, quemose e secreção ocular. Os grupos tratados com PRP, na forma de tampão ou colírio, apresentaram menor opacidade corneana do que os animais tratados apenas com membrana amniótica no momento final de avaliação. Quanto à presença da úlcera corneana, os grupos tratados com PRP apresentaram menor ulceração corneana em relação aos demais grupos. No exame histomorfométrico, verificou-se maior epitelização corneana na fase inicial da lesão no tratamento à base de colírio de plasma rico em plaquetas. O uso da membrana amniótica promoveu espessamento do epitélio e estroma corneano, com sinergismo dela quando associada ao plasma rico em plaquetas.
coelho; plaquetas; córnea; úlcera; histomorfométrica
The repair process induced corneal ulcer in rabbits using platelet-rich plasma in the form of eyedrop or clot was clinically evaluated and compared. Sixty rabbits were divided into four groups of 15 animals, denominated platelet group (PG), clot group (CLG), control group (CG), and amniotic control group (AG). Experimental groups were then subdivided into three groups (M4, M7, M30), corresponding to the end of the evaluation period. There were no differences between treatments regarding ocular sensitivity, chemosis and ocular secretion. The groups treated with PRP either as eyedrop or a clot showed less opacity than the animals treated only with amniotic membrane at the moment of the final evaluation. The presence of corneal ulcers in the groups treated with PRP showed lower intensity than the other groups. Histomorphometric examination showed that corneal epithelization in the initial phase of the lesion was greater when using PRP. The use of amniotic membrane promoted corneal epithelial and stromal thickness, as well as synergism when associated to PRP.
rabbit; platelet; cornea; ulcer; histomorphometric
MEDICINA VETERINÁRIA VETERINARY MEDICINE
Uso do plasma rico em plaquetas no reparo de úlceras de córnea profundas induzidas em coelhos. Avaliação clínica e histomorfométrica
Use of platelet-rich plasma in the treatment of deep corneal ulcers induced in rabbits. Clinical and histomorphometric evaluation
C. DonattiI; C.V.S. BrandãoI; J.J.T. RanzaniI; C.S. PerchesI; C.R. PadovaniII; C.H. PellizzonII; M.G. SerenoIII
IFaculdade de Medicina Veterinária e Zootecnia - Botucatu, SP
IIInstituto de Biociências - Universidade Estadual Paulista - Botucatu, SP
IIIMédica veterinária autônoma
RESUMO
Avaliou-se e comparou-se, clinicamente, por meio de histopatologia e morfometria, o processo de reparação corneana de úlceras experimentais induzidas em coelhos, com o uso de plasma rico em plaquetas (PRP) sob a forma de colírio ou tampão. Foram utilizados 60 coelhos, constituindo-se quatro grupos experimentais de 15 animais cada, designados grupo plaqueta (GP), grupo tampão (GT), grupo controle (GC) e grupo controle amniótica (GA). Os grupos experimentais foram subdivididos em três subgrupos (M4, M7, M30), de acordo com o período final de avaliação, aos quatro, sete e 30 dias, respectivamente. Não houve diferenças entre os tratamentos utilizados quanto aos sinais relacionados à sensibilidade ocular, quemose e secreção ocular. Os grupos tratados com PRP, na forma de tampão ou colírio, apresentaram menor opacidade corneana do que os animais tratados apenas com membrana amniótica no momento final de avaliação. Quanto à presença da úlcera corneana, os grupos tratados com PRP apresentaram menor ulceração corneana em relação aos demais grupos. No exame histomorfométrico, verificou-se maior epitelização corneana na fase inicial da lesão no tratamento à base de colírio de plasma rico em plaquetas. O uso da membrana amniótica promoveu espessamento do epitélio e estroma corneano, com sinergismo dela quando associada ao plasma rico em plaquetas.
Palavras-chave: coelho, plaquetas, córnea, úlcera, histomorfométrica
ABSTRACT
The repair process induced corneal ulcer in rabbits using platelet-rich plasma in the form of eyedrop or clot was clinically evaluated and compared. Sixty rabbits were divided into four groups of 15 animals, denominated platelet group (PG), clot group (CLG), control group (CG), and amniotic control group (AG). Experimental groups were then subdivided into three groups (M4, M7, M30), corresponding to the end of the evaluation period. There were no differences between treatments regarding ocular sensitivity, chemosis and ocular secretion. The groups treated with PRP either as eyedrop or a clot showed less opacity than the animals treated only with amniotic membrane at the moment of the final evaluation. The presence of corneal ulcers in the groups treated with PRP showed lower intensity than the other groups. Histomorphometric examination showed that corneal epithelization in the initial phase of the lesion was greater when using PRP. The use of amniotic membrane promoted corneal epithelial and stromal thickness, as well as synergism when associated to PRP.
Keywords: rabbit, platelet, cornea, ulcer, histomorphometric
INTRODUÇÃO
A região anterior do olho está em constante contato com o ambiente externo, sendo assim mais susceptível a traumas e agressões. Devido à sua estrutura relativamente simples, a resposta a qualquer insulto é limitada e muitas afecções podem causar opacificação e perda da visão (Gomes et al., 2002; Cremonini et al., 2007).
Plaquetas autólogas foram usadas primariamente com funções hemostáticas, ou seja, para tratar ou prevenir hemorragias secundárias à severa trombocitopenia. Recentemente tem sido relatado o uso do plasma rico em plaquetas (PRP) para promover a reparação dos tecidos (Kassolis et al., 2000; Ehrenfest et al., 2009).
A degranulação das plaquetas, e especialmente dos grânulos tipo α, que contêm os fatores de crescimento, é a responsável pela função do PRP. Estudos demonstraram que as células troncomesenquimais adultas, os osteoblastos, os fibroblastos, as células endoteliais e epidermais expressam receptores em sua membrana celular para os fatores de crescimento presentes no PRP. Assim, os fatores de crescimento presentes no PRP não entram na célula ou em seu núcleo, não são mutagênicos, somente atuam por meio da aceleração do processo de reparação normal dos tecidos e não têm capacidade de induzir a formação tumoral (Marx, 2004).
Em decorrência do modo de preparação autógena, o PRP apresenta-se seguro, livre da transmissão de doenças e histocompatível (Marx, 2004; Ferreira et al., 2005; Alio et al., 2007; Silva et al., 2007; Wang, 2007; Nikolidakis e Jansen, 2008). A vantagem do seu uso, em relação ao soro autólogo, é que o plasma enriquecido contém maior concentração de vitaminas e de fatores de crescimento; além disso, como as plaquetas permanecem intactas, podem aderir-se à superfície ocular, atuando de forma biológica e mecânica (Alio et al., 2007).
Na oftalmologia, vários fatores de crescimento presentes no PRP estão envolvidos na manutenção da estrutura e da função corneana, especialmente os relacionados à manutenção da transparência durante o processo de reparação (Imanishi et al., 2000).
Como os fatores de crescimento são altamente instáveis e não permanecem em estado livre na corrente sanguínea, o PRP é o veículo adequado para aumentar sua concentração nos tecidos lesados (Wilson et al., 2006). A secreção dos fatores de crescimento inicia-se 10 minutos após a formação do PRP, e mais de 95% dos fatores de crescimento pré-sintetizados são secretados durante a primeira hora. Após a liberação inicial desses fatores, as plaquetas sintetizam e secretam fatores de crescimento adicionais durante sete dias (Nikolidakis e Jansen, 2008). Segundo Froum et al. (2002), a liberação dos fatores de crescimento derivados do PRP ocorre com três a cinco dias e estes permanecem ativos por sete a 10 dias.
O presente estudo objetivou avaliar, por meio de exames clínico-oftalmológicos e de análise histomorfométrica, o processo de reparação de úlceras de córnea profundas, induzidas experimentalmente, em coelhos, com o uso do plasma rico em plaquetas sob a forma de colírio ou tampão.
MATERIAL E MÉTODOS
Foram utilizados 60 coelhos (Oryctolagus cuniculus), pertencentes ao grupo genético Botucatu, fornecidos pelo Biotério Central da Unesp, Campus de Botucatu, com idade variando entre 300 e 400 dias e peso entre 3,5 e 4,5kg. Os coelhos foram submetidos aos exames clínicos e oftalmológicos de rotina, com auxílio de lupa de pala e lanterna, bem como ao teste de Schirmer (Teste de Schirmer Ophthalmos®), à tonometria (Tonômetro de aplanação Tono Pen® - Med Tronic) e à oftalmoscopia direta (Oftalmoscópio direto Welch Allyn®). Após o procedimento cirúrgico, foram identificados e mantidos em gaiolas individuais, com água potável e ração comercial ad libitum.
Os procedimentos experimentais desenvolvidos seguiram as normas da Association for Research in Vision and Ophthalmology (ARVO) e foram submetidos à Câmara de Ética em Experimentação Animal da Faculdade de Medicina Veterinária e Zootecnia Unesp Campus de Botucatu, protocolo número 171/2007 CEEA.
Realizou-se a coleta de 10mL de sangue arterial individual dos coelhos por meio da canulação da artéria central da orelha com cateter 20g, ato contínuo à fixação deste cateter com esparadrapos e colocação de torneira de três vias, o que possibilitou a coleta fracionada do sangue. O sangue coletado foi distribuído em cinco frascos estéreis contendo citrato de sódio 3,2% (Greiner Bio-one Brasil tubo estéril com citrato de sódio 3,2%), resultando em 2mL de sangue total em cada frasco, protegido da luminosidade e à temperatura aproximada de 22ºC. Aguardaram-se 30 minutos para se iniciar a centrifugação, de modo a minimizar a agregação plaquetária.
A primeira etapa da centrifugação foi realizada a 200 gravidades (g), durante três minutos, em centrífuga refrigerada (Modelo Centrifuge 5702 R/Eppendorf) a 22ºC. Essa primeira etapa, com aplicação de menor força centrífuga, foi responsável pela separação do sangue em três camadas. As células vermelhas foram observadas no fundo do frasco, a camada leucoplaquetária ou creme leucocitário, onde se concentram a maior parte das plaquetas, apresentou-se na camada intermediária e o plasma acelular, ou seja, o plasma pobre em plaquetas (PPP), no sobrenadante. O plasma sobrenadante e a camada leucoplaquetária de cada um dos cinco tubos foram pipetados, resultando num volume aproximado de 1mL cada; este volume foi transferido para tubos tipo Eppendorf estéreis para a realização da segunda etapa da centrifugação, a 400g por 10 minutos, em centrífuga refrigerada a 22ºC. Do sobrenadante, 2/3 (660µL, aproximadamente) foram descartados como plasma pobre em plaquetas (PPP), e o 1/3 restante (330µL, aproximadamente) foi homogeneizado e denominado plasma rico em plaquetas (PRP), constituindo o colírio, que foi acondicionado a 4ºC e utilizado durante uma semana. Essa segunda etapa, caracterizada por uma força centrífuga maior, foi responsável pela separação entre PRP e PPP.
Para a preparação do tampão, foi adicionado cloreto de cálcio 10% ao PRP, na proporção de 1:10, como descrito por Aghaloo et al. (2002) e por Messora et al. (2007); (2007); após a homogeneização, o tubo tipo Eppendorf foi colocado em banho-maria a 37ºC, durante dois minutos, para a retração do coágulo e formação do tampão.
As placentas foram coletadas imediatamente após cesariana de cadela sem raça definida, com o feto a termo, considerando-se técnicas assépticas, inicialmente lavadas com solução fisiológica 0,9% (Solução fisiológica cloreto de sódio 0,9%) para a retirada dos coágulos e, a seguir, com solução antibiótica estéril. O âmnio, depois de separado do córion por descolamento, foi estendido com a face estromal voltada para o papel-filtro estéril de nitrocelulose com poros de 0,45µm (Kim e Tseng, 1995).
A membrana aderida ao papel foi recortada em quadrados de 4x4cm, e os fragmentos colocados em recipiente estéril contendo glicerina (Glicerina a 98% - APOTHEKER Química e Farmacêutica Ltda.) a 98% e mantidos à temperatura ambiente. Esses fragmentos foram utilizados após 30 dias de conservação, respeitando-se o período máximo de quatro meses de estocagem (Kim e Tseng, 1995).
Os 60 animais foram distribuídos, aleatoriamente, em quatro grupos experimentais, designados grupo controle (GC), grupo plaqueta (GP), grupo tampão (GT) e grupo controle ammiótica (GA), cada um deles composto por 15 animais.
Os animais foram anestesiados utilizando-se quetamina (ketamin S(+) 50mg/mL solução injetável Cristália) 20mg/kg, via intramuscular (IM), associada à xilazina (Anasedan®- solução injetável Vetbrands) 1mg/kg, IM e à morfina (Dimorf®- sulfato de morfina 10mg/mL solução injetável - Cristália) 0,5mg/kg, IM. Na anestesia tópica ocular, usou-se colírio anestésico (Anestalcon®- cloridrato de proximetacaína 0,5% - Alcon).
Os procedimentos operatórios foram realizados com auxílio de microscópio cirúrgico (Microscópio Cirúrgico Karl Kaps, modelo SOM 62 Standard, Alemanha) após antissepsia, utilizando-se solução de polivinilpirrolidona (PVP - iodo antisséptico aquoso, Brasiliquidos Produtos Farmacêuticos - Comercial Bono Ltda.) a 1:50 e, a seguir, foram empregados panos fenestrados oftálmicos estéreis. A fixação das pálpebras foi feita utilizando-se um blefarostato.
Foi realizada uma incisão cirúrgica circular na região corneana central, com auxílio de trépano a vácuo (Hessburg-Barron Vacuum Trephine JEDMED) de 6mm de diâmetro e profundidade de 0,25mm. A seguir, a córnea foi delaminada utilizando-se um bisturi crescente angulado (Bisturi crescente angulado Alcon) (Fig. 1). Todos os animais foram submetidos à ceratectomia experimental, sendo esse o único procedimento cirúrgico realizado nos GC e GP. No GA e no GT, a membrana amniótica conservada em glicerina foi hidratada em solução fisiológica, posicionada sobre a córnea com a face epitelial voltada para cima e suturada à esclera perilimbal, por meio de oito pontos simples separados com mononáilon 9-0 (Paralon 9-0- Paramed suturas), recobrindo toda a superfície corneana. Foi realizada, no GT, aplicação prévia do tampão rico em plaquetas na região da ceratectomia.
No pós-cirúrgico imediato e após 24 horas, foi administrado, em todos os animais, o antiinflamatório à base de meloxicam (Movatec® - meloxicam solução injetável - Boehringer Ingelheim), 0,2mg/kg, IM, além de morfina, 2mg/kg, IM, visando minimizar o desconforto operatório.
Na região ocular, foram feitas limpezas diárias com solução fisiológica a 0,9%, durante sete dias. Como profilaxia antimicrobiana, foram administrados nos grupos GT e GA colírio à base de tobramicina (Tobrex® - tobramicina 0,3% solução oftálmica estéril - Alcon), quatro vezes ao dia, e diclofenaco sódico 0,1% (Still® diclofenaco sódico 0,1% solução oftálmica estéril - Allergan), três vezes ao dia, para minimizar desconforto pós-operatório, durante sete dias. No GC, foi instilado colírio lubrificante (Lacribell Latinofarma) quatro vezes ao dia, durante sete dias, e no GP, colírio autólogo de plasma rico em plaquetas, cinco vezes ao dia, durante sete dias.
Os animais foram avaliados diariamente e durante os primeiros 10 dias, período de epitelização da lesão corneana e, a seguir, nos diferentes momentos experimentais. Todos os grupos foram subdivididos em três subgrupos, constituídos por cinco animais, de acordo com o período final de avaliação, aos quatro (M4), sete (M7) e 30 dias (M30) de pós-operatório.
Os procedimentos experimentais desenvolvidos foram submetidos à Câmara de Ética em Experimentação Animal da Faculdade de Medicina Veterinária e Zootecnia Unesp Campus de Botucatu, protocolo número 171/2007 CEEA.
A evolução clínico-patológica das lesões foi estudada, e os sinais relacionados à presença de dor como blefaroespasmo e fotofobia, bem como secreção ocular, hiperemia conjuntival, quemose, hemorragia conjuntival, neovascularização, pigmentação e opacidade corneana, foram qualificados e quantificados subjetivamente em: (0) ausente; (1) leve; (2) moderado e (3) severo. Foi realizado o teste de fluoresceína para avaliar a úlcera corneana, bem como a presença ou ausência de membrana amniótica, por meio de exame clínico.
No final do período de avaliação de cada subgrupo, os animais foram sacrificados, após anestesia com acepromazina (Acepran 0,2% - Univet), 1,5mg/kg, IM, e quetamina (Ketamin - S(+) 50mg/mL solução injetável Cristália, 20mg/kg), IM, seguida pela administração intravenosa de tiopental, 25mg/kg, e de cloreto de potássio 19,1%, 2mL/kg.
O globo ocular, fixado em formaldeído 10% (Formol solução 10%) durante 48 horas, foi fixado em solução de álcool a 70% (Álcool Zulu absoluto 99,3º), e as córneas isoladas e incluídas em parafina. Foram realizados cortes por microtomia (5 micrômetros), aplicados sobre lâminas, corados pelo método de hematoxila/eosina (HE) (Corantes Merck) e analisados ao microscópio de luz para realização da análise descritiva.
A presença de neovascularização e de células inflamatórias na área da lesão foi qualificada e quantificada subjetivamente em escores: (0) ausente; (1) leve; (2) moderado e (3) intenso. A análise morfométrica foi realizada por meio do analisador de imagens Qwin V3 (Leica), versão 2.4 (Microsystems Imaging Solutions Ltd., Cambridge, Inglaterra, 2001), para medições manuais. Na análise morfométrica, avaliou-se a espessura do epitélio e do estroma corneano na região da ceratectomia experimental, utilizada como padrão para análise. Foram realizadas cinco medidas, utilizando-se a média delas como a espessura final.
A análise estatística foi realizada pela análise de variância não paramétrica para o modelo de medidas repetidas em grupos independentes, complementada com o teste de comparações múltiplas de Dunn, a 5% de significância (Zar, 1999).
RESULTADOS
Não houve diferenças significativas entre os grupos em todos os momentos avaliados, bem como entre os momentos, para as variáveis blefaroespasmo, fotofobia, secreção ocular e quemose.
Quanto à hiperemia conjuntival, foi observado no M4 maior intensidade no GT quando comparado ao GP; os GC e GA demonstraram comportamento intermediário. Neste momento, todos os animais do GP apresentaram ausência de hiperemia conjuntival. No M7 e M30, todos os grupos se comportaram de maneira semelhante. Entre os momentos, observou-se redução significativa da hiperemia do M4 para o M7 no GC e do M7 para o M30 no GT (Tab. 1).
Não foi observada hemorragia conjuntival, neovascularização e pigmentação corneana em nenhum dos animais nos diferentes momentos de avaliação.
Quanto à presença da úlcera corneana, não houve diferença significativa entre os grupos no M4 e M7; já no M30, o GP e o GT apresentaram valores mais baixos que os demais grupos (Tab. 2).
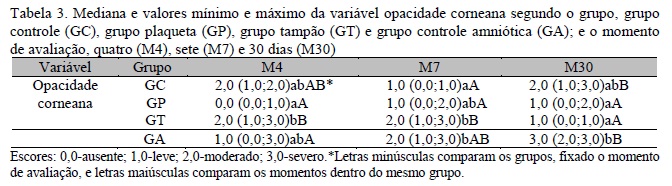
Quanto à opacidade corneana, no M4, o GP apresentou menor opacidade quando comparado ao GT, já o GC e o GA demonstraram comportamento intermediário; no M7, os animais do GT e do GA apresentaram maior opacidade corneana do que os do GC, sendo que o GP demonstrou comportamento intermediário; já no M30, verificou-se uma menor opacidade corneana nos GP e GT quando comparados ao GA. Dentro do mesmo grupo, observou-se, no GA, maior opacidade corneana no M30 em relação ao M4. Já no GT, verificou-se menor opacidade corneana no M30 em relação ao M4 e ao M7 (Tab. 3).
No presente estudo, uma córnea normal, após processamento histopatológico, foi mensurada utilizando-se o analisador de imagens Qwin V3 (Leica), versão 2.4, para medições manuais, e o resultado foi 17,85µm a média da espessura do epitélio e 265,94µm a média da espessura do estroma, totalizando 283,79µm.
Foi possível identificar e avaliar a região da ceratectomia, já que, nos limites desta, o epitélio corneano apresentou uma grande proliferação de células no local, o que facilitou sua identificação.
Quanto à espessura do epitélio corneano, no local da ceratectomia experimental, não houve diferença entre os grupos no M4 e M7, apesar de o GC (6,22µm) e o GP (9,12 µm) apresentarem valores medianos mais altos que o GT (0,00µm) e o GA (0,00µm) no M4. No M7, o GC (70,07µm) demonstrou valor mediado superior aos demais grupos. Já no M30, o GT (210,34µm) e o GA (169,31µm) apresentaram uma espessura do epitélio corneano significativamente maior quando comparados ao GC (14,19µm) e ao GP (15,75µm) (Tab. 4).
Quanto à espessura do estroma corneano, o GA (2444,08µm) mostrou valor mais alto que os demais grupos, no M4. No M7, no GT (2977,05µm), a espessura do estroma corneano foi maior que no GC (M7 403,82µm) e no GP (M7 238,43µm), e no GA (1050,81µm) a espessura foi intermediária. No M30, foi observada, no GA (2388,78µm) e no GT (2696,31µm), maior espessura do estroma corneano em relação aos demais grupos. Nos valores dentro do mesmo grupo, somente o GT apresentou espessamento progressivo do estroma corneano com relação ao momento de avaliação inicial (M4) (Tab. 5).
Na avaliação das células inflamatórias, observou-se a presença de neutrófilos, histiócitos, linfócitos e eosinófilos. Não houve diferença entre os grupos e momentos de avaliação quanto à presença de células inflamatórias. Somente no M30 foi observado discreto aumento da celularidade no GC, quando comparado ao GP e ao GT, já que o GA apresentou comportamento intermediário.
Quanto à presença de neovasos, foi observada maior neovascularização no M4 e no M7 e regressão no M30, entretanto não houve diferença significativa nos diferentes grupos e momentos de avaliação.
Não foi observada a presença da membrana amniótica em 100% das lâminas, possivelmente pelo fato de a sutura ser realizada na esclera perilimbal e não sobre a superfície corneana.
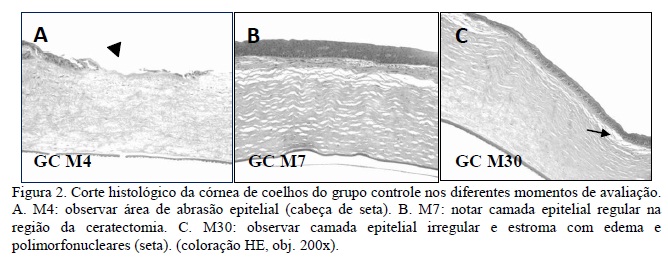
As Fig. 2 a 5 representam os cortes histológicos da córnea de coelhos nos diferentes grupos e momentos de avaliação.
DISCUSSÃO
Segundo El-Sharkawy et al. (2007), o PRP promove a regeneração tecidual por controlar a resposta inflamatória local, além de possuir grande atividade mitogênica e anabólica. Deste modo, a resposta favorável pós-operatória no GP, no momento inicial de avaliação, sugere a ação específica dos fatores de crescimento derivados das plaquetas, uma vez que nesta fase ocorre uma grande liberação deles.
No presente estudo, não foi necessária a utilização dos colírios de antibiótico e anti-inflamatório, no GP, durante o processo de cicatrização corneana; nos GA e GT, foi observada a ocorrência de uveíte severa e até endoftalmite durante a execução dos pilotos, fazendo-se necessária a utilização dos respectivos colírios no período pós- operatório, por questões éticas. Ressalta-se também que, na prática clínica diária, tais procedimentos são frequentemente realizados.
O processo de reparação inicial da lesão corneana ocorreu com maior rapidez no GP, por volta do terceiro dia pós-operatório; desta forma, a maioria dos animais apresentava teste de fluoresceína negativo já no primeiro momento de avaliação (M4). Além disso, no momento final de avaliação (M30), os grupos nos quais foi utilizado o PRP (GP e GT) apresentaram valores significativamente menores quanto à presença da úlcera corneana, sendo, portanto, uma característica esperada devido à grande liberação dos fatores de crescimento prontamente disponíveis no colírio de PRP, o que acelerou o processo de reparação da lesão corneana. Segundo Imanishi et al. (2000), vários fatores de crescimento têm papel importante na reparação corneana, ou seja, são expressos nas células epiteliais da córnea promovendo proliferação e migração celular. Os fatores de crescimento derivados das plaquetas são altamente instáveis e não duram muito em estado livre na corrente sanguínea, por isso o uso do PRP proporciona liberação lenta desses fatores pela degranulação das plaquetas, propiciando concentrações suficientes para desencadear a estimulação do crescimento tissular, semelhante ao descrito por Wilson et al. (2006).
A presença dos fatores de crescimento derivados do PRP prontamente disponíveis na superfície corneana lesionada permitiu uma modulação do processo de reparação, diminuindo a formação cicatricial, já que no presente estudo observou-se menor intensidade de opacidade corneana nos grupos em que foi utilizado o PRP, ou seja, GP e GT no período final de avaliação (M30).
O tampão de PRP apresentou efeito sinérgico quando associado à membrana amniótica. Pôde-se observar, frente aos resultados obtidos, uma atuação positiva interessante do PRP frente à reparação da lesão corneana, indicando o seu uso para o tratamento desta importante afecção oftalmológica.
A espessura do epitélio corneano variou de acordo com os momentos de avaliação e com os grupos estudados, sendo mais espesso no GT e no GA aos 30 dias de avaliação, provavelmente por maior migração de células, processo modulado possivelmente pela presença da membrana amniótica (Kim e Tseng, 1995).
Frente às análises realizadas, acredita-se que o tratamento à base de colírio de PRP é indicado para casos nos quais se objetiva uma rápida epitelização corneana. Já nas lesões com grande perda estromal, recomenda-se a associação do tampão de PRP com a membrana amniótica, ou o uso desta, de forma isolada.
CONCLUSÕES
Os sinais relacionados à sensibilidade ocular, blefaroespasmo e fotofobia, quemose e secreção ocular, não diferiram entre os grupos nos momentos de avaliação. O tratamento à base de colírio de PRP promove menor hiperemia e opacidade corneana no período inicial de avaliação em relação ao tampão de PRP. Os grupos tratados com PRP, na forma de tampão ou colírio, apresentam menor opacidade e presença de úlcera corneana do que os animais tratados apenas com membrana amniótica no momento final de avaliação. O tratamento à base de colírio de PRP promove maior epitelização corneana na fase inicial da lesão. O uso da membrana amniótica resulta no espessamento do epitélio e estroma corneano no período final de avaliação, sendo esses efeitos mais acentuados nos coelhos tratados com o tampão de PRP.
Recebido em 22 de outubro de 2012
Aceito em 7 de fevereiro de 2013
E-mail: camila_donatti@yahoo.com.br
- AGHALOO, T.L.; MOY, P.K.; FREYMILLER, E.G. Investigation of Platelet-Rich Plasma in Rabbit Cranial Defects: A Pilot Study. J. Oral Maxillofac. Surg, v.60, p.1176-1181, 2002.
- ALIO, J.L.; ABAD, M.; ARTOLA, A. et al Use of autologous platelet-rich plasma in the treatment of dormant corneal ulcers. Ophthalmology, v.114, p.1286-1293, 2007.
- CREMONINI, D.N.; RANZANI, J.J.T.; MARQUES, M.E.A. et al Transplante de membrana amniótica criopreservada para cicatrização de córnea com deficiência de células límbicas em coelhos. Arq. Bras. Med. Vet. Zootec., v.59, p.1462-1467, 2007.
- EL-SHARKAWY, H.; KANTARCI, A.; DEADY, J. et al Platelet-Rich Plasma: Growth Factors and Pro and Anti-Inflamatory Properties. J. Periodontol., v.78, p.661-669, 2007.
- EHRENFEST, D.M.D.; RASMUSSON, L.; ALBREKTSSON, T. Classification of platelet concentrates: from pure platelet-rich plasma (P-PRP) to leucocyte and platelet-rich fibrin (L-PRF). Trends Biotechnol., v.27, p.158-167, 2009.
- FERREIRA, C.F.; GOMES, M.C.C.; FILHO, J.S. et al Platelet-rich plasma influence on human osteoblasts growth. Clin. Oral Implants Res., v.16, p.456-460, 2005.
- FRECHETTE, J.P.; MARTINEAU, I.; GAGNON, G. Platelet-rich plasmas: growth factor content and roles in wound healing. J. Dental Res., v.84, p.434-439, 2005.
- FROUM, S.J.; WALLACE, S.S.; TARNOW, D.P. et al Effect of Platelet-Rich Plasma on Bone Growth and Osseointegration in Human Maxillary Sinus Grafts: Three Bilateral Case Reports. Int. J. Periodont. Restorative Dentist., v.22, p.45-53, 2002.
- GOMES, J.A.P.; PIRES, R.T.F.; ALVES, M.R. Doenças da superfície ocular: diagnóstico e tratamento. Rio de Janeiro: Cultura Médica, 2002. 130p.
- IMANISHI, J.; KAMIYAMA, K.; IGUCHI, I. et al Growth factors: importance in wound healing and maintenance of transparency of the córnea. Prog. Retinal Eye Res., v.19, p.113-129, 2000.
- KASSOLIS, J.D.; ROSEN, P.S.; REYNOLDS, M.A. Alveolar Ridge and Sinus Augmentation Utilizing Platelet-Rich Plasma in combination With Freeze-Dried Bone Allograft: Case Series. J. Periodontol., v.71, p.1654-1661, 2000.
- KIM, J.C.; TSENG, S.C.G. Transplantation of preserved human amniotic membrane for surface reconstruction in severely damaged rabbit corneas. Cornea, v.14, p.473-484,1995.
- MARX, R.E. Platelet-rich plasma: evidence to support its use. J. Oral Maxillof. Surg., v.2, p.489-496, 2004.
- MESSORA, M.R.; NAGATA, M.J.H.; MARIANO, R.C. et al. Bone healing in critical-size defects treated with platelet-rich plasma: a histologic and histometric study in a rat calvaria. J. Periodontal Res., v.43, p.723-729, 2008.
- NIKOLIDAKIS, D.; JANSEN, J.A. The Biology of Platelet-Rich Plasma ans Its Application in Oral Surgery: Literature Review. Tissue Engin., Part B, v.14, p.249-258, 2008.
- SILVA, S.B.; FERRIGNO, C.R.A.; ATERMAN, F.A. et al Plasma rico em plaquetas combinado a hidroxiapatita na formação do calo ósseo em fraturas induzidas experimentalmente no rádio de cães. Cienc. Rural, v.37, p.1045-1051, 2007.
- WANG, H.; AVILA, G. Platelet Rich Plasma: Myth or Reality? Eur. J. Dentist., v.1, p.192-194, 2007.
- WILSON, E.M.K.; BARBIERI, C.H.; MAZZER, N. Estimulação da cicatrização óssea pelo plasma autógeno rico em plaquetas. Estudo experimental em coelhos. Acta Ortop. Bras., v.14, p.208-212, 2006.
- ZAR, J.H. Biostatistical analysis New Jersey: Prentice-Hall, 1999. 663p.
Datas de Publicação
-
Publicação nesta coleção
16 Jul 2013 -
Data do Fascículo
Jun 2013
Histórico
-
Recebido
22 Out 2012 -
Aceito
07 Fev 2013