Resumos
O uso de fitoterápicos é uma alternativa de baixo custo e de fácil acesso para o tratamento de feridas cutâneas. Objetivou-se avaliar a ação do extrato oleoso de urucum na cicatrização de feridas cutâneas abertas. Inicialmente, identificaram-se os principais ácidos graxos do óleo de urucum. Foi realizado ensaio citotóxico para determinar as concentrações a serem utilizadas no ensaio in vivo. No experimento, feridas cutâneas em ratos Wistar foram diariamente tratadas com: extrato de urucum 0,1% (U 0,1%), extrato de urucum 0,01% (U 0,01%), vaselina (V) e solução fisiológica (SF), por até 21 dias. Aos quatro, sete, 14 e 21 dias, foi avaliada clinicamente a presença de exsudato, crosta e epitelização. Determinaram-se as áreas da lesão, e amostras de pele, fígado e rins foram coletadas para avalição histológica. Aos 21dias, amostras de pele foram coletadas para análise tensiométrica. Clinicamente, todos os grupos de tratamento apresentaram evolução cicatricial fisiológica. Os grupos U 0,1% e U 0,01% apresentaram maior presença de epitelização aos sete dias e maior retração cicatricial aos quatro dias. Na histologia, U 0,1% e U 0,01% apresentaram aos quatro e sete dias maior quantidade de fibrina e inflamação que V e SF, e, nos demais momentos, não houve diferenças entre os grupos. Quanto à fase cicatricial, aos quatro dias todos os grupos encontravam-se na fase inflamatória, aos sete dias U 0,1% e U 0,01% permaneciam na fase inflamatória, diferindo de SF e V, que se caracterizavam na fase proliferativa. Aos 14 dias, os grupos apresentavam-se em transição de fase proliferativa para maturação e, aos 21dias, estavam todos na fase de maturação. Os grupos tratados com urucum expressaram menor resistência à tensão que V e SF. Concluiu-se com este estudo que o extrato oleoso de urucum acelera o processo cicatricial nos primeiros dias, mas proporciona uma cicatriz de baixa qualidade.
fitoterápico; urucum; fibrina; cicatrização
Phytotherapies are a low cost, easily accessible alternative to traditional medicines in wound healing management. The purpose of this study was to assess the oil extract of Bixa orellana L. as a healing agent in the rat model of open wound healing. Initially, the oil was obtained and characterized through gas chromatography. Furthermore, the cytotoxic potential of the oil was verified in cell cultures to determine the doses used in animal experiments. Wounds were surgically produced in Wistar rats, these were treated with the oil extract at 0.1% (U 0.1%), 0.01% (U 0.01%), petrol jelly (V) and saline (SF) for up to 21 days. At four, seven and 14 days of treatment the wounds were assessed clinically regarding the presence of exudate, crust and epithelialization. The wound area was also determined and skin, kidney and liver tissues were harvested for histopathology. At 21 days of treatment the skins were also harvested for tension resistance assessment. Clinically, all groups evolved similarly, however, those treated with U 0.1% and U 0.01% had a greater amount of epithelialized wounds by day seven, and grater shrinkage by day four. Histopathologicaly, the skin samples of oil treated wounds had more lesions in the inflammatory phase at seven days, when compared to the controls, which were majorly in the proliferation phase. By 14 days no difference was observed among groups, which were all in the transition from the proliferation to the maturation phase. By day 21, all wounds were in the maturation phase. Oil treated wounds also had more fibrin in the first two assessment dates, when compared to the controls. Tension resistance of the oil treated wounds was, however, inferior to that of the controls. This study shows that B. orellana L. oil will hasten the onset of the healing process and its initial phases, but will ultimately produce a scar of poorer quality.
phytotherapy; annatto; fibrin; healing
INTRODUÇÃO
O ferimento cutâneo, de qualquer origem, é uma alteração anatômica da pele que afeta sua fisiologia, especialmente quando acomete a camada dérmica (Issac et al., 2010). Imediatamente após a lesão, inicia-se o processo de cicatrização com a infiltração de neutrófilos e macrófagos, fibroplasia, deposição de matriz extracelular, angiogênese e reepitelização. Essa sequência de eventos ocorre de forma interdependente e sobreposta, sendo estes divididos didaticamente em três fases (inflamatória, proliferativa e de maturação) para melhor compreensão e acompanhamento da evolução do processo cicatricial (Balbino et al., 2005BALBINO, C.A.;PEREIRA, L.M.; CURI,R. Mecanismos envolvidos na cicatrização: uma revisão. Rev. Bras. Cienc. Farm., v.41, p.27-51, 2005.; Laureano e Rodrigues, 2011LAUREANO, A.;RODRIGUES, A.M. Cicatrização de feridas.Rev. SPDV, v.69, p.355-367, 2011.). Os tratamentos tópicos de feridas abertas vêm sendo estudados desde a antiguidade e apresentam grandes avanços. Estes visam proteger a lesão e favorecer a cicatrização. Os medicamentos alopáticos mais utilizados no tratamento de feridas cutâneas são os antissépticos e degermantes (iodo povidona 1%, clorexidine 0,05%, açúcares, etc.) e os antibióticos tópicos à base de bacitracina-neomicina-polimixina e sulfato de gentamicina (Mandelbaum et al., 2003MANDELBAUM, S.H.; DI SANTIS, É.P.;MANDELBAUM, M.H.S. Cicatrização: Conceitos atuais e recursos auxiliares - Parte II. An. Bras. Dermatol., v.78, p.525-542, 2003.; Tillmann et al., 2015TILLMANN, M.T.;FELIX, S.R.; MUNDSTOK,C.P. et al. Tratamento e manejo de feridas cutâneas em cães e gatos: revisão de literatura. Nosso Clin., n.103, p.12-19, 2015.).
A utilização empírica de plantas medicinais em diversos tipos de enfermidades é comum no Brasil, por serem elementos naturais e uma alternativa de baixo custo e de fácil acesso à população (Leão et al., 2007; Ribeiro et al., 2014RIBEIRO, D.A.;MACÊDO, D.G.; OLIVEIRA,L.G.S. et al. Potencial terapêutico e uso de plantas medicinais em uma área da Caatinga no estado do Ceará, nordeste do Brasil. Rev. Bras. Pl. Med., v.16, p.912-930, 2014.). A Bixa orellana L. é uma planta nativa brasileira, da região amazônica, conhecida popularmente por urucum. Possui, em sua composição química, aminoácidos (triptofano, metionina e lisina), carotenoides (bixina e norbixina), além de alto teor de ácidos graxos e pequenas quantidades de ácido linoleico e oleico. É amplamente utilizada nas indústrias alimentícia e cosmética por ser um corante natural; além disso, estudos demostram sua atividade antibacteriana, antifúngica, anti-inflamatória, hiperlipidêmica, laxativa e hipotensora, quando o óleo é extraído de diferentes formas e de partes variadas da planta (Shilpi et al., 2006SHILPI, J.A.; TAUFIQ-UR-RAHMAN, Md.; UDDIN,S.J. et al. Preliminary pharmacological screening of Bixa orellana L. leaves. J. Ethnopharmacol., v.108, p.264-271,2006.; Ferreira et al., 2013FERREIRA, J.M.;SOUSA, D.F.; DANTAS,M.B. et al. Effects of Bixa orellana L. seeds on hyperlipidemia.Phytother. Res., v.27, p.144-147, 2013.; Stohs, 2013STOHS, S.J. Safety and efficacy of bixa orellana (Achiote, Annatto) leaf extracts. Phytotherapy research, 2013. Disponível em: <wileyonlinelibrary.com,DOI:10.1002/ptr.5088>. Acessado em: 27 ago. 2014.
wileyonlinelibrary.com,DOI:10.1002/ptr.5...
; Vilar et al., 2014VILAR, D.A.; VILAR,M.S.A.; MOURA, T.F.A.L. et al. Traditional uses, chemical constituents, and biological activities of Bixa orellana L.: a review. Sci. World J., v.2014, p.11, 2014.).
Mesmo com a gama de produtos encontrados no mercado, são poucos os ensaios que avaliaram o seu uso na cicatrização de feridas (Santos et al., 2001SANTOS, J.A.A.;SOUSA, M.F.A.M.; SILVA,E.L.V.; AGUIAR JÚNIOR, F.C.A.. Avaliação histomorfométrica do efeito do extrato aquoso de urucum (norbixina) no processo de cicatrização de feridas cutâneas em ratos. Rev. Bras. Pl. Med., v.16, supl.I, p.637-643,2014.4). Assim, o presente estudo busca determinar a ação do extrato oleoso da semente de urucum no tratamento de feridas abertas, em modelos experimentais.
MATERIAL E MÉTODOS
Os extratos foram obtidos de amostras da planta urucum (Bixa orellana L.), colhida no mês de maio de 2013, na cidade de Jaru, Rondônia, Brasil. A planta foi previamente identificada e registrada (PEL N° 25.971), pelo Herbário Botânico (Instituto de Biologia da Universidade Federal de Pelotas-UFPel), por meio da análise das folhas, flores, frutos e sementes.
Após a identificação, as sementes secas de urucum foram trituradas para aumentar sua superfície de contato, favorecendo a extração. Utilizou-se a técnica Sohlet com hexano como solvente, a uma temperatura de 68°C, por seis horas. O óleo obtido passou pelo evaporador rotativo para remoção do solvente e obtenção do óleo de urucum purificado. O óleo foi, então, acondicionado em refrigerador (4°C), ao abrigo da luz, até sua utilização.
A quantificação e identificação dos compostos presentes no extrato oleoso de Bixa orellana L. baseou-se nos estudos de Kumari et al. (2011)KUMARI, P.; REDDY,C.R.K.; JHA, B. Comparative evaluation and selection of a method for lipid and fatty acid extraction from macroalgae. Anal. Biochem., v.415, p.134-144,2011. e Monzote et al. (2014)MONZOTE, L.;GARCÍA, M.; SCULL,R. et al. Antileishmanial Activity of the Essential Oil from Bixa Orellana. Phytother. Res., v.28, p.753-758,2014.. Para tal, utilizou-se o cromatógrafo a gás acoplado ao detector de massas, modelo GC/MS-QP 2010SE (Shimadzu, Japão), equipado com autoinjetor AOC-20i. A separação ocorreu em uma coluna capilar RTX-5MS (Restek, EUA), com dimensões de 30m x 0,25mm x 0,25μm, nas seguintes condições cromatográficas: temperatura inicial de 50°C, elevando 10°C/min até atingir 280ºC, permanecendo nessa condição por 11min; volume injetado: 1µL; interface: 300ºC; temperatura do injetor: 280°C; gás de arraste: hélio; fluxo linear de gás: 1,22mL.min-1; split: 1:50; corrida em modo scan; faixa de massa 40 a 700m/z e voltagem do filamento 70eV. As quantificações foram estabelecidas por área normatizada, e as identificações dos compostos pelo espectro de massas, utilizando a biblioteca NIST 8 do GC/MS, a qual armazena informações de compostos previamente identificados.
Com a obtenção do extrato de Bixa orellana L., foi realizado o ensaio de citotoxicidade em células VERO (African Green Monkey Kidney), determinando-se a dose a ser utilizada no ensaio in vivo. As células VERO foram cultivadas em meio essencial mínimo (MEM), após formarem uma monocamada confluente, alíquotas foram coletadas para realizar o subcultivo em placas de 96 cavidades com fundo chato, para a realização do teste do efeito citotóxico por 48 horas, por meio do MTT (brometo de 3-(4,5-dimetiltiazol-2-ilo)-2,5-difeniltetrazólio). Para que o tratamento testado fosse emulsificado ao MEM, foi adicionado a este DMSO (dimetilsulfóxido), numa diluição de 1:200. As diluições utilizadas foram da seguinte relação: 10% de tratamento (10µL extrato/90µL MEM/DMSO), 5%, 1% e seguida uma diluição seriada de 0,1% até 0,00001% (conforme legenda da Fig. 1). Cada ensaio contou com oito poços de cada concentração (e controle). Os testes foram feitos em triplicata (para um N final de 24 ensaios por concentração), e a viabilidade celular foi obtida por meio do seguinte cálculo: média da absorbância dos tratados/média dos controles x 100 (Wang et al., 2011WANG, J.P.; RUAN,J.L.; CAI, Y.L. et al. In vitro and in vivo evalution of the wound healing properties of Siegesbeckia pubescens. J. Ethnopharmacol., v.134, p.1033-1038,2011.).
Percentual de viabilidade celular em diferentes concentrações do extrato oleoso de urucum (Bixa orellana L.) evidenciado por ensaio de citotoxicidade em células VERO. A viabilidade do grupo controle (CC) representa 100%. A barra horizontal representa 90% do CC (ponto de corte para viabilidade). Estão apresentados resultados médios de oito poços/tratamento/ensaio e três repetições (N final=24 por tratamento).
De acordo com o teste in vitro, estabeleceram-se as concentrações de 0,1% e 0,01% (Fig. 1) para a utilização em ensaio in vivo. Este estudo foi aprovado pelo Comitê de Ética e Experimentação Animal - UFPel, processo n° 23110.007605/2012-21, registro CEEA 7605-2012. Foram utilizados 120 ratos (Rattus norvegicus) Wistar, machos, com idade média de 60 dias, sendo alocados dois animais por caixa, os quais foram mantidos com água e ração específica ad libitum durante todo período experimental. Os animais foram divididos aleatoriamente em quatro grupos, de acordo com o tratamento recebido: solução fisiológica (Grupo SF), vaselina (Grupo V), extrato oleoso de urucum 0,1% (Grupo U 0,1%) e extrato oleoso de urucum 0,01% (Grupo U 0,01%). Foi utilizada a vaselina sólida como veiculo para a administração do extrato de urucum nas diferentes concentrações.
Os animais receberam anestesia dissociativa com associação de xilazina (10mg/kg) e cetamina (100mg/kg), por via intraperitoneal, para a confecção de duas lesões no dorso, utilizando punch metálico (n° 8mm). Cada ferida foi tratada imediatamente após o procedimento cirúrgico e diariamente com 0,5mL de solução fisiológica (NaCl 0,9%) para a limpeza, seguida de aplicação de 0,1mL dos tratamentos. O período experimental foi de 21 dias de tratamento; aos quatro, sete, 14 e 21 dias, os animais foram eutanasiados (conforme a resolução n° 1000, de 12 de maio de 2012, CFMV) para avaliação clínica, histopatológica e tensiométrica das lesões.
Na avaliação clínica, foram analisadas as lesões de cada grupo, nos diferentes tempos de tratamento, quanto à presença/ausência de exsudato, crosta e epitelização. Para a análise de retração cicatricial, foi realizado registro fotográfico das lesões utilizando-se câmera fotográfica digital (Samsung ES17) fixada ao tripé, de modo a mantê-la a 15cm de distância da ferida. A imagem obtida foi transferida para o programa GIMP 2(r) e recebeu tratamento para obtenção de uma camada única da lesão. Posteriormente, a imagem tratada foi exportada para o programa Image J(r), quando se determinou a área da lesão em mm2.
As amostras de tecidos coletadas na necropsia foram fixadas em formol 10%, processadas e coradas em hematoxilina-eosina. Nas amostras de fígado e rins, observou-se a presença/ausência de alterações degenerativas, inflamatórias ou proliferativas. As amostras de pele foram analisadas, atribuindo-se escores aos seguintes parâmetros: crosta, debris celular, epitelização, quantidade de inflamação, padrão inflamatório, densidade fibroblástica, padrão de colágeno e angiogênese. Com o somatório dos escores, classificaram-se as amostras quanto à fase de cicatrização (inflamatória, proliferativa, maturação). Além destes, avaliou-se a quantidade de fibrina na lesão.
Na avaliação tensiométrica, utilizou-se um molde em formato de ampulheta para que as amostras de pele tivessem duas extremidades para fixação ao equipamento e a ferida não apresentasse pele íntegra adjacente. Foram utilizadas 15 amostras de cada grupo de tratamento aos 21 dias, nas quais se verificou a tensão (Pascal) máxima suportada pela área da lesão no momento da deformação, por meio da máquina universal de ensaio (DL 500).
Os dados contínuos foram comparados por meio do teste T de Student. Dados categóricos foram comparados mediante o teste de Fisher (nominais) ou de Kruskal-Wallis (ordinais), e as comparações múltiplas entre os grupos foram feitas com o teste de Mann-Whitney (ordinais). Todos os ensaios foram rodados nos pacotes de software GraphPad Prism(r) e Microsoft(tm) Excel 11.
RESULTADOS
Na caracterização cromatográfica, foram encontrados os seguintes compostos majoritários: ácido linoleico (37%), geranil linalool (28%), ácido palmítico (16%) e ácido oleico (9%), além de ácido esteárico (4%), escaleno (3%) e geranil-α-terpinene (3%).
No teste de citotoxicidade, as diluições iguais ou menores que 0,1% se mostraram tóxicas e diluições maiores apresentaram viabilidade superior a 90% (exceto a diluição 0,0001%), quando comparadas ao controle. Os resultados completos do ensaio de citotoxicidade estão expressos na Fig. 1. Optou-se por utilizar para o estudo experimental in vivo a primeira concentração não citotóxica (0,01%) e a última citotóxica (0,1%), pelo fato de a célula ser uma unidade básica enquanto os tecidos são formados pela união de diversas células, mostrando-se uma unidade mais complexa (Moura et al., 2013MOURA, J.; DEUS,M.S.M.; GONÇALVES, N.M.N.; PERON, A.P. Biologia/genética: O ensino de biologia, com enfoque a genética, das escolas públicas no Brasil - Breve relato e reflexão. Semina: Ciênc. Biol.Saúde, v.34, p.167-174, 2013.) e podendo ser mais resistente a maiores concentrações do extrato.
Nas análises clínicas, verificou-se a presença dos parâmetros exsudato, crosta e epitelização em percentuais esperados no processo cicatricial nos distintos momentos de avaliação. Aos quatro dias, todos os grupos expressavam presença de exsudato em 50% ou mais das lesões, reduzindo-se em todos ao longo do tempo. Quanto aos percentuais de crosta, aos quatros dias os grupos U 0,1% e U 0,01% (83% e 66%) apresentaram percentuais iguais ou maiores que os grupos V e SF (66% e 41%), mesmo não havendo diferenças estatísticas. Aos sete dias, todos os grupos expressaram 100% de presença de crostas, reduzindo-se ao longo do período de tratamento. A presença de epitelização foi evidenciada, aos sete dias, nos grupos U 0,1% (92%) e U 0,01% (75%), com significativa diferença (P< 0,05) dos grupos V (16%) e SF (ausência) (Fig. 2).
Percentual de presença de epitelização em feridas tratadas com diferentes doses de extrato oleoso de urucum (Bixa orellana L.), vaselina e solução fisiológica aos quatro, sete, 14 e 21 dias. Letras diferentes representam frequências estatisticamente diferentes (P<0,05).
Na planimetria digital, foi observada, em todas as lesões tratadas, a aproximação dos bordos da ferida ao longo do período experimental. Aos quatro dias de tratamento, os grupos U 0,1% e U 0,01% apresentaram áreas médias de 37,2mm2 e 34,1mm2, diferindo (P<0,05) dos grupos V e SF (55mm2 e 52,6mm2). Aos setes dias, foram constatadas áreas médias de 36,4mm2, 39,2mm2, 32,7mm2 e 24,5mm2 (U 0,1%, U 0,01%, V e SF, respectivamente), resultando em diferença (P<0,05) do grupo SF quando comparado aos grupos U0,1% e U0,01% (Fig. 3).
Demonstração de média (desvio-padrão) das áreas de lesão em mm², representando a retração cicatricial de feridas tratadas com óleo de urucum (Bixa orellana L.), nas concentrações de 0,1% e 0,01% de vaselina e solução fisiológica aos quatro, sete, 14 e 21 dias. Letras diferentes representam frequências estatisticamente diferentes (P<0,05).
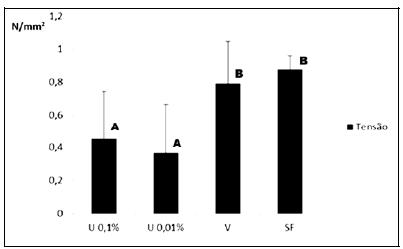
A análise tensiométrica, realizada aos 21 dias de tratamento, demonstrou que U 0,1% e U 0,01% apresentaram tensão significativamente menor (P<0,05) que os tratamentos com V e SF (Fig. 4).
Médias (desvio-padrão) da tensão suportada (em Pascal) pelas amostras de pele dos grupos tratados com extrato de urucum, nas concentrações de 0,1% e 0,01%, de vaselina e solução fisiológica aos 21 dias. Letras diferentes representam frequências estatisticamente diferentes (P<0,05).
Histologicamente, quando observadas as amostras de pele, verificou-se, em todos os grupos, a evolução cicatricial dentro dos padrões fisiológicos. Aos quatro dias, todos os grupos encontravam-se majoritariamente na fase inflamatória. Entretanto, aos sete dias, o grupo SF apresentou mais lesões na fase proliferativa, diferindo significativamente (P<0,05) dos grupos tratados com extrato oleoso de urucum, nos quais prevalecia a fase inflamatória, assim como o grupo V mostrou maior percentual de amostras na fase proliferativa (75%), quando comparado ao grupo U 0,01% (17%) (Fig. 5). Aos 14 dias de tratamento, todos os grupos apresentavam-se em uma etapa de transição entre as fases proliferativa e de maturação, não diferindo significativamente. Ao final dos 21 dias de tratamento, predominava a fase de maturação em todos os grupos. Nas amostras teciduais de rins e fígado, observaram-se características celulares dentro dos padrões fisiológicos, sem alterações degenerativas, inflamatórias ou proliferativas.
Demonstração da prevalência de fase da cicatrização nos grupos U 0,1%, U 0,01%, V e SF aos sete dias de tratamento. Marcadores representam a mediana do grupo, barras representam o alcance (escores máximo e mínimo). Letras diferentes representam frequências estatisticamente diferentes (P<0,05).
Na visualização do padrão fibrina, o grupo U 0,1% expressou maior quantidade quando comparado aos grupos V e SF aos quatro dias de tratamento (P<0,05) (Fig. 6A). Essa diferença se manteve aos sete dias, percebendo-se uma abundante quantidade de fibrina nos grupos tratados à base do extrato oleoso de urucum quando comparados aos grupos cujas lesões foram tratadas com vaselina (P<0,05) e solução fisiológica (P<0,05). Além disso, o grupo U 0,01% apresentou importante exuberância de fibrina, diferindo estatisticamente do grupo U 0,1% (P<0,05) (Fig. 6B). Quando observada a fibrina aos 14 dias, houve uma redução de sua densidade, sem diferenças significativas entre os grupos, porém os grupos tratados com óleo de urucum (U 0,1% e U 0,01%) apresentavam algumas amostras com discreta ou moderada presença de fibrina quando comparados aos grupos vaselina e solução fisiológica. Aos 21 dias, não havia presença de fibrina em nenhum dos grupos de tratamento.
Quantidade de fibrina presente nos grupos U 0,1%, U 0,01%, V, SF, aos quatro dias (A) e aos sete dias (B). Marcadores representam a mediana do grupo, barras representam o alcance (escores máximo e mínimo). Letras diferentes representam frequências estatisticamente diferentes (P<0,05).
DISCUSSÃO
Os resultados gerados neste estudo mostram que o tratamento de feridas cutâneas com extrato oleoso da semente de urucum é capaz de acelerar as fases iniciais da cicatrização. No extrato oleoso utilizado, foram identificados ácidos graxos com conhecida importância terapêutica, como os ácidos linoleico e oleico. De Nardi et al. (2004) indicam o uso de tratamento à base de ácidos graxos essenciais, lecitina e vitaminas para acelerar a cicatrização de feridas abertas limpas e sugerem que a ação ocorra devido à capacidade quimiotática dos ácidos graxos para células poli e mononucleares. Neste estudo, o extrato oleoso de urucum expressou ação pró-inflamatória, acelerando o processo cicatricial, demonstrado pela maior formação de crostas e epitelização em menor tempo nos grupos U 0,1% e U 0,01% quando comparado aos demais grupos. Além disso, os grupos U 0,1% e U 0,01% proporcionaram maior retração cicatricial aos quatro dias do reparo tecidual, possivelmente pela ação dos ácidos linoleico e oleico, que aceleram a retração de feridas nos primeiros dias de tratamento (Cardoso et al., 2004CARDOSO, C.R.B.;SOUZA, M.A.; FERRO,E.A.V. Influence of topical administration of n-3 and n-6 essential and n-9 nonessential fatty acids on the healing of cutaneous wounds. Wound Repair Regen., v.12, p.235-243, 2004.). Já nos demais períodos de avaliação, a retração cicatricial evoluiu em todos os grupos de forma semelhante.
Na análise histopatológica da pele, aos quatro dias de tratamento não houve diferenças estatísticas entre os grupos tratados quanto à fase da cicatrização prevalente, exibindo-se os eventos fisiológicos esperados do processo cicatricial no período. No entanto, as feridas tratadas com óleo de urucum apresentaram maior densidade inflamatória que os demais tratamentos, possivelmente devido à ação quimiotática dos ácidos graxos presentes no extrato de urucum. Além disso, os ácidos graxos agem facilitando a ação de fatores de crescimento, mantêm o meio úmido e estimulam a formação de tecido de granulação, acelerando a cicatrização (Marques et al., 2004MARQUES, S.R.;PEIXOTO, C.A.; MESSIAS,J.B. et al. The effects of topical application of sunflower-seed oil on open wound healing in lambs. Acta Cir. Bras., v.19, p.196-209, 2004.; Manhezi et al., 2008MANHEZI, A.C.;BACHION, M.M.; PEREIRA,Â.L. Utilização de ácidos graxos essenciais no tratamento de feridas. Rev. Bras. Enf., v.61, p.620-629, 2008.). Este último é formado por uma fibrina, que se deposita como uma rede no local lesionado e é infiltrada por plaquetas e eritrócitos (Balbino et al., 2005). Corroborando este estudo, aos quatro dias de tratamento o grupo U 0,1% apresentou maior densidade de fibrina em relação aos grupos V e SF (P<0,05), e o grupo U 0,01% também evidenciou um ligeiro aumento na quantidade de fibrina quando comparado aos grupos V e SF, apesar de não expressar diferença estatística.
Aos setes dias, houve a permanência de intenso infiltrado inflamatório e a formação exuberante de uma rede de fibrina nos grupos U 0,1% e U 0,01%, o que não foi observado nos grupos V e SF, mais uma indicação da ação pró-inflamatória e quimiotática desse extrato. Nesse momento, as amostras tratadas com urucum, em sua maioria, apresentaram-se na fase inflamatória, diferindo dos grupos V e SF, os quais se classificavam na fase proliferativa; estas últimas demonstraram menor densidade inflamatória e maior densidade de fibroblastos e colágeno. O infiltrado inflamatório é responsável pela degradação de fibrina (Laureano et al., 2011). Aos sete dias, foi observado que a rede de fibrina era menos exuberante no grupo com menor concentração de urucum (U 0,01%) em relação ao grupo de maior concentração (U 0,1%) (P<0,05). Esse fato se justifica, mais uma vez, pelo efeito pró-inflamatório do urucum.
Com a evolução da cicatrização, já aos 14 dias, todos os grupos de tratamento encontravam-se nas fases proliferativa ou de maturação, não diferindo significativamente entre si. O mesmo resultado pôde ser observado aos 21 dias, quando predominou a fase de maturação em todos os grupos. Apesar da semelhança clínica e histopatológica das lesões aos 21 dias, os grupos U 0,1% e U 0,01% suportaram menor força de tensão, demonstrando menor resistência do que os grupos V e SF. Dessa forma, ambos os tratamentos à base de urucum levaram a uma cicatriz de baixa qualidade, sugerindo a formação de um tecido imaturo. Tal fato corrobora o observado nas análises histopatológicas, em que se visualizou um padrão desorganizado de colágeno nas feridas tratadas com urucum em comparação com as tratadas com vaselina e solução fisiológica. A qualidade da cicatriz depende da quantidade e da organização do colágeno, sendo a cicatriz mais resistente conforme as fibras de colágeno vão se organizando; mesmo assim, jamais uma cicatriz atinge a mesma resistência de um tecido íntegro (Balbino et al., 2005).
Quando avaliada a morfologia do fígado e dos rins, não se observaram alterações degenerativas, inflamatórias ou proliferativas, indicando que o extrato oleoso de urucum não possui efeito deletério em nível sistêmico, o que corrobora estudo que observou a ação positiva do extrato aquoso de urucum no controle da hipertrigliceridemia, sugerindo seu efeito hepatoprotetor (Ferreira et al., 2013).
No extrato oleoso de urucum, foram identificados ácidos graxos com conhecida importância terapêutica, que asseguram a ação pró-inflamatória do óleo de urucum, acelerando o processo de cicatrização nos primeiros dias. Contudo, a aplicação em longo prazo implicou a persistência de células inflamatórias, retardando o processo de remodelação tecidual. Assim, sugere-se a utilização do extrato oleoso de urucum para o tratamento de feridas abertas extensas, em que há risco de contaminação, visando à aceleração da fase inicial da cicatrização e à formação rápida de um tecido de granulação que forme uma barreira protetora.
CONCLUSÕES
Nas condições apresentadas neste estudo, demonstrou-se que o extrato oleoso de urucum acelera o processo cicatricial nos primeiros sete dias da cicatrização, mas proporciona uma cicatriz que suporta menor força de tensão.
AGRADECIMENTOS
À Capes e ao CNPq (305072/2012-9), pela concessão de bolsas de estudo e pelo apoio financeiro; ao Instituto de Biologia - UFPel; ao Instituto de Química - UFPel; ao Centro de Desenvolvimento e Controle de Biomateriais da Faculdade de Odontologia - UFPel; ao Biotério Central - UFPel.
REFERÊNCIAS
- BALBINO, C.A.;PEREIRA, L.M.; CURI,R. Mecanismos envolvidos na cicatrização: uma revisão. Rev. Bras. Cienc. Farm., v.41, p.27-51, 2005.
- CARDOSO, C.R.B.;SOUZA, M.A.; FERRO,E.A.V. Influence of topical administration of n-3 and n-6 essential and n-9 nonessential fatty acids on the healing of cutaneous wounds. Wound Repair Regen., v.12, p.235-243, 2004.
- DE NARDI, A.B.;RODASKI, S.; SOUSA,R.S. et al. Cicatrização secundária em feridas dermoepidérmicas tratadas com ácidos graxos essenciais, vitaminas A e E, lecitina de soja e iodo polivinilpirrolidona em cães. Arch. Vet. Sci., v.9, p.1-16, 2004.
- FERREIRA, J.M.;SOUSA, D.F.; DANTAS,M.B. et al. Effects of Bixa orellana L. seeds on hyperlipidemia.Phytother. Res., v.27, p.144-147, 2013.
- ISAAC, C.; LADEIRA,P.R.S.; RÊGO, F.M.P. et al. Processo de cura das feridas: cicatrização fisiológica. Rev. Med., v.89, p.125-131, 2010.
- KUMARI, P.; REDDY,C.R.K.; JHA, B. Comparative evaluation and selection of a method for lipid and fatty acid extraction from macroalgae. Anal. Biochem., v.415, p.134-144,2011.
- LAUREANO, A.;RODRIGUES, A.M. Cicatrização de feridas.Rev. SPDV, v.69, p.355-367, 2011.
- LEÃO, R.B.A.;FERREIRA, M.R.C.; JARDIM,M.A.G. Levantamento de plantas de uso terapêutico no município de Santa Barbara do Pará, estado do Pará, Brasil. Rev. Bras.Farm., v.88, p.21-25, 2007.
- MANDELBAUM, S.H.; DI SANTIS, É.P.;MANDELBAUM, M.H.S. Cicatrização: Conceitos atuais e recursos auxiliares - Parte II. An. Bras. Dermatol., v.78, p.525-542, 2003.
- MANHEZI, A.C.;BACHION, M.M.; PEREIRA,Â.L. Utilização de ácidos graxos essenciais no tratamento de feridas. Rev. Bras. Enf., v.61, p.620-629, 2008.
- MARQUES, S.R.;PEIXOTO, C.A.; MESSIAS,J.B. et al. The effects of topical application of sunflower-seed oil on open wound healing in lambs. Acta Cir. Bras., v.19, p.196-209, 2004.
- MOURA, J.; DEUS,M.S.M.; GONÇALVES, N.M.N.; PERON, A.P. Biologia/genética: O ensino de biologia, com enfoque a genética, das escolas públicas no Brasil - Breve relato e reflexão. Semina: Ciênc. Biol.Saúde, v.34, p.167-174, 2013.
- MONZOTE, L.;GARCÍA, M.; SCULL,R. et al. Antileishmanial Activity of the Essential Oil from Bixa Orellana. Phytother. Res., v.28, p.753-758,2014.
- RIBEIRO, D.A.;MACÊDO, D.G.; OLIVEIRA,L.G.S. et al. Potencial terapêutico e uso de plantas medicinais em uma área da Caatinga no estado do Ceará, nordeste do Brasil. Rev. Bras. Pl. Med., v.16, p.912-930, 2014.
- SANTOS, J.A.A.;SOUSA, M.F.A.M.; SILVA,E.L.V.; AGUIAR JÚNIOR, F.C.A.. Avaliação histomorfométrica do efeito do extrato aquoso de urucum (norbixina) no processo de cicatrização de feridas cutâneas em ratos. Rev. Bras. Pl. Med., v.16, supl.I, p.637-643,2014.
- SHILPI, J.A.; TAUFIQ-UR-RAHMAN, Md.; UDDIN,S.J. et al. Preliminary pharmacological screening of Bixa orellana L. leaves. J. Ethnopharmacol., v.108, p.264-271,2006.
- STOHS, S.J. Safety and efficacy of bixa orellana (Achiote, Annatto) leaf extracts. Phytotherapy research, 2013. Disponível em: <wileyonlinelibrary.com,DOI:10.1002/ptr.5088>. Acessado em: 27 ago. 2014.
» wileyonlinelibrary.com,DOI:10.1002/ptr.5088 - TILLMANN, M.T.;FELIX, S.R.; MUNDSTOK,C.P. et al. Tratamento e manejo de feridas cutâneas em cães e gatos: revisão de literatura. Nosso Clin., n.103, p.12-19, 2015.
- VILAR, D.A.; VILAR,M.S.A.; MOURA, T.F.A.L. et al. Traditional uses, chemical constituents, and biological activities of Bixa orellana L.: a review. Sci. World J., v.2014, p.11, 2014.
- WANG, J.P.; RUAN,J.L.; CAI, Y.L. et al. In vitro and in vivo evalution of the wound healing properties of Siegesbeckia pubescens. J. Ethnopharmacol., v.134, p.1033-1038,2011.
Datas de Publicação
-
Publicação nesta coleção
Jan-Feb 2016
Histórico
-
Recebido
17 Abr 2015 -
Aceito
17 Ago 2015