RESUMO
A fasciolose é uma doença parasitária causada por trematódeo do gênero Fasciola sp., que pode ocasionar fibrose hepática. Objetivou-se caracterizar o imunofenótipo das células que participam da fibrogênese de fígados bovinos frente à infecção por F. hepatica. Foram utilizados fragmentos dos lobos direito e esquerdo de 74 fígados bovinos com fasciolose. Os fragmentos foram submetidos a processamento histológico, coloração com tricrômico de Masson e imuno-histoquímica. Utilizaram-se análise estatística descritiva e teste de correlação de Spearmann com 5% de probabilidade. Na classificação do grau de fibrose, observou-se prevalência do grau 1, com associação positiva e significativa entre o grau de fibrose e o lobo hepático esquerdo (ρ=0,41; P<0,0001). Os imunofenótipos observados foram células estreladas hepáticas (CEHs) no parênquima e miofibroblastos (MFs) no espaço porta (EP). Não foram encontrados fibroblastos. Não houve correlação significativa entre o grau de fibrose e a quantidade de CEH nos lobos hepáticos, direito e esquerdo. Verificou-se aumento do número de estruturas portais, bem como do número de camadas circundando cada estrutura no EP, contudo não houve influência de qualquer estrutura sobre o grau de fibrose hepática (P>0,05). Concluiu-se que as células CEH e os MFs participam da fibrogênese de fígados bovinos com fasciolose crônica.
Palavras-chaves:
bovino; fasciolose; fibrogênese; imuno-histoquímica
ABSTRACT
Fascioliasis is a parasitic disease caused by a fluke of the genus Fasciola sp., which can lead to end liver fibrosis. This study aimed to characterize the immunophenotype of cells that participate in the fibrogenesis of livers of cattle that face infection by F. hepatica. Fragments of the right and left lobes of 74 cattle livers with fascioliasis were used. The fragments were subjected to histological analysis, Masson's trichrome special stain, and immunohistochemistry. A descriptive statistical analysis was used, with a 5% probability in Spearman correlation test. The classification of degree of fibrosis revealed prevalence of grade 1, with a positive and significant association between the degree of fibrosis and the left hepatic lobe (ρ = 0.41; p <0.0001). The observed immunophenotypes corresponded to hepatic stellate cells (HSCs) in the parenchyma and myofibroblasts (MFs) in the portal tract (PT). Fibroblasts were not found. There was no significant correlation between the degree of fibrosis and the amount of HSC in right and left hepatic lobes. There was an increase in the number of portal structures, as well as in the number of layers surrounding each structure of the PT, but there was no influence of any structure of the PT on the degree of liver fibrosis (P>0.05). HSCs and MFs were concluded to play a role in the fibrogenesis of cattle livers with chronic fascioliasis.
Keywords:
cattle; fascioliasis; fibrogenesis; immunohistochemistry
INTRODUÇÃO
A fasciolose é uma doença parasitária causada por um trematoda Fasciola hepatica ou F. gigantica, que acomete os ductos biliares de várias espécies animais, inclusive os seres humanos, por isso é considerada um problema de saúde pública em muitas regiões tropicais e subtropicais (Marcos et al., 2007MARCOS, L.A.; MACHICADO, A.; ANDRADE, R. et al. Hepatic fibrosis and Fasciola hepatica infection in cattle. J. Helminthol., v.81, p.381-386, 2007.; Espinoza et al., 2010ESPINOZA, J.R.; TERASHIMA, A.; HERRERA-VELIT, P.; MARCOS, L. Fasciolosis humana y animal en el perú: impacto en la economía de las zonas endêmicas. Rev. Peru Med. Exp. Salud Publica, v.27, p.604-12, 2010. ).
As perdas econômicos anuais geradas por essa infecção são de aproximadamente 50 milhões de dólares, resultado direto do aumento das condenações de fígados em matadouros frigoríficos e, de forma indireta, da diminuição da produtividade, sem estimar o impacto na saúde pública (Espinoza et al., 2010ESPINOZA, J.R.; TERASHIMA, A.; HERRERA-VELIT, P.; MARCOS, L. Fasciolosis humana y animal en el perú: impacto en la economía de las zonas endêmicas. Rev. Peru Med. Exp. Salud Publica, v.27, p.604-12, 2010. ).
Desse modo, a fibrose hepática induzida por F. hepatica coloca essa infecção parasitária no contexto das doenças crônicas do fígado (Marcos et al., 2011MARCOS, L.A.; TERASHIMA. A.; YI, P. et al. Mechanisms of liver fibrosis associated with experimental Fasciola hepatica infection: roles of Fas2 proteinase and hepatic stellate cell activation. J. Parasitol., v.97, p.82-87. 2011.). No fígado, independentemente da causa, as principais células responsáveis por produzir matriz extracelular são as células estreladas hepáticas (CEH), que, quando ativadas, adquirem um fenótipo de miofibroblastos (MF) (Friedman, 2008FRIEDMAN, S.L. Hepatic stellate cells: protean, multifunctional, and enigmatic cells of the liver. Physiol. Rev., v.88, p.125-172, 2008.).
No entanto, estudos de cultura e in situ de fígados com fibrose forneceram evidências que indicam que miofibroblastos podem derivar de células que são distintas das CEHs (Cassiman et al., 2002CASSIMAN, D.; LIBBRECHT, L.; DESMET, V. et al. Hepatic stellate cell/myofibroblast subpopulations in fibrotic human and rat livers. J. Hepatol., v.36, p.200-209, 2002. ; Uchio et al., 2002UCHIO, K.; TUCHWEBER, B.; MANABE, N. et al. Cellular retinol-binding protein-1 expression and modulation during in vivo and in vitro myofibroblastic differentiation of rat hepatic stellate cells and portal fibroblasts. Lab. Investig. , v.82, p.619-628, 2002.; Magness et al., 2004MAGNESS, S.T.; BATALLER, R.; YANG, L.; BRENNER, D.A. A dual reporter gene transgenic mouse demonstrates heterogeneity in hepatic fibrogenic cell populations. Hepatology , v.40, p.1151-1159, 2004.; Ramadori e Saile, 2004RAMADORI, G.; SAILE, B. Portal tract fibrogenesis in the liver. Lab. Investig. , v.84, p.153-159, 2004.; Bataller e Brenner, 2005BATALLER, R.; BRENNER, D.A. Liver fibrosis. J. Clin. Invest., v.115, p.209-218, 2005. Available in: <http://www.jci.org/articles/ view/24282/pdf>. Accessed in:13 nov. 2013.
http://www.jci.org/articles/ view/24282/...
). Essas são denominadas como subpopulação de miofibroblastos portais (MFP), que incluem: células mesenquimais residentes, células semelhantes a fibroblastos chamados fibrócitos, MFs derivados de pequenos vasos portais, hepatócitos e fibrócitos derivadas de medula óssea (Lemoinne et al., 2013LEMOINNE, S.; CADORET, A.; EL MOURABIT, H. et al. Origins and functions of liver myofibroblasts. Biochim. Biophys. Acta, v.1832, p.948-954, 2013.; Lemoinne et al., 2015LEMOINNE, S.; CADORET, A.; RAUTOU, P.E. et al. Portal myofibroblasts promote vascular remodeling underlying cirrhosis formation through the release of microparticles. Hepatology , v.61, p.1041-1055, 2015.).
Sabendo disso, Marcos et al. (2011MARCOS, L.A.; TERASHIMA. A.; YI, P. et al. Mechanisms of liver fibrosis associated with experimental Fasciola hepatica infection: roles of Fas2 proteinase and hepatic stellate cell activation. J. Parasitol., v.97, p.82-87. 2011.) apontam que as informações disponíveis sobre a fibrose hepática induzida pela infecção por F. hepatica são escassas, tanto em animais quanto em seres humanos. Dessa forma, objetivou-se caracterizar o imunofenótipo das células que participam da fibrogênese de fígados bovinos frente à infecção por F. hepatica, buscando se obterem dados sobre a população celular e a distribuição da fibrose.
MATERIAL E MÉTODOS
Foram coletados 74 fígados de bovinos condenados por fasciolose, e um fígado normal para controle negativo, no matadouro frigorífico de Atílio Vivácqua, Espírito Santo, sob autorização e fiscalização do Instituto de Defesa Agropecuária e Florestal do Espírito Santo (IDAF-ES), no período de dezembro de 2010 a janeiro de 2011, seguindo as normas do Comitê de Ética no Uso de Animais (Ceua), número 055/2010.
Os fígados foram avaliados e seccionados seguindo a divisão anatômica dos lobos direito e esquerdo. De cada lobo hepático foi coletado um fragmento medindo aproximadamente 2cm3. Cada um deles foi fixado em formalina 10% e, em seguida, encaminhado ao Laboratório de Patologia Animal do Hospital Veterinário da Universidade Federal do Espírito Santo para processamento histológico de rotina, coloração com hematoxilina-eosina (HE) e tricrômico de Masson, para a avaliação e graduação da fibrose hepática segundo Oliveira et al. (2004OLIVEIRA, L.; SOUZA, M.M.; ANDRADE, Z. Capillaria hepatica-induced hepatic fibrosis in rats: paradoxical effect of repeated infections. Rev. Soc. Bras. Med. Trop., v.37, p.123-127, 2004.).
As amostras, anteriormente classificadas no HE, foram desparafinizadas e hidratadas; em seguida, foram colocadas por 15 minutos em solução de água oxigenada 30 volumes diluídos em metanol, na proporção de 1:9, para bloqueio de peroxidases endógenas. Após esse procedimento, realizou-se lavagem em água destilada e recuperação de antigênica, com duas técnicas: uma com solução de citrato 10mM pH 6,0, em autoclave microprocessada (Brastec® Q290M22) a 120ºC por 30 segundos, para os anticorpos antielastina e antifibroblasto, e a outra com solução de citrato 10mM pH 6,0 em panela de pressão microprocessada (Dako, S2800-1) a 125ºC por 30 segundos, para o anticorpo anti-α-SMA.
O material foi resfriado em temperatura ambiente por 20 minutos e lavado com solução tampão de TRIS pH 7,40 (TRIZMA BASE, Sigma Chemical CO., St. Louis MO., EUA), seguido de bloqueio de proteínas inespecíficas com solução de leite em pó Molico® a 3%, durante uma hora.
Depois disso, o material foi lavado com solução tampão de TRIS e incubado com anticorpo primário em câmara úmida por 18 horas a 4ºC. As respectivas diluições dos anticorpos primários foram antielastina 1:100 (BA-4, Santa Cruz Biotechnology, Inc., Santa Cruz, CA), antifibroblasto 1:150 (TE7, Santa Cruz Biotechnology, Inc., Santa Cruz, CA) e anti-alpha smooth muscle actin 1:1250 (1A4 DakoCytomation). Os controles positivos foram cordão umbilical humano, artéria aorta bovina, tecido de granulação bovino, respectivamente para os anticorpos anti-α-SMA, antielastina e antifibroblasto. Como controle negativo, foi omitido o anticorpo primário.
Após a incubação, o material foi lavado em solução de TRIS e, para a amplificação da reação, utilizou-se o sistema de detecção à base de polímeros NovoLink (Novocastra, 7280-K), incubado em temperatura ambiente com cada reagente por 30 minutos. Em seguida, as lâminas foram lavadas novamente com solução de TRIS e depois tratadas com solução de 3,3´diaminobenzidina (Liquid DAB, Dako K-3466) durante cinco minutos, em temperatura ambiente. Seguiu-se lavagem em água corrente, depois água destilada e contracorado com hematoxilina de Harris, por 30 segundos; após, as lâminas foram lavadas em água corrente por 10 minutos e submetidas aos processos de desidratação e montagem em resina sintética.
A caracterização imuno-histoquímica das células que compõem a fibrose hepática, como células estreladas hepáticas (CEH), miofibroblastos (MFP) e fibroblastos (FB), foi baseada na morfologia de cada tipo celular e na marcação positiva dessas células para cada anticorpo utilizado, de acordo com Ramadori e Saile (2004RAMADORI, G.; SAILE, B. Portal tract fibrogenesis in the liver. Lab. Investig. , v.84, p.153-159, 2004.). O MFP foi considerado positivo quando expressava α-SMA e elastina, as CEH foram positivas para α-SMA e negativas para elastina e o FB mostrou-se positivo para TE7.
As células positivamente marcadas pelos anticorpos propostos foram quantificadas em dois sítios distintos, a saber: espaço porta e parênquima. A quantificação no parênquima baseou-se na contagem de células imunopositivas em cinco campos lineares aleatórios, em microscopia de luz e objetiva de 20x. Após a avaliação, foi obtida a quantidade média de células por lobo hepático.
A análise imuno-histoquímica no espaço porta considerou a classificação da fibrose hepática proposta. Foi avaliado o número de células positivas por estruturas que compõem o espaço porta, como vênula (VP), arteríola (AP) e ducto biliar (DB), em cinco espaços porta aleatórios em cada lobo hepático. A análise estatística foi feita por análise descritiva, com os valores expressos em percentuais, e o teste de correlação de Spearmann foi realizado com 5% de probabilidade.
RESULTADOS E DISCUSSÃO
A classificação histológica da fibrose nos fígados infectados por F. hepatica revelou fibrose septal discreta em alguns espaços porta com infiltrado inflamatório linfo-histioplasmocitário leve na fibrose grau 1 (Fig.1A e 1B). Na fibrose grau 2, observou-se fibrose portal multifocal moderada com septos de tecido conjuntivo delgado e incompletos, além de proliferação moderada de ductos biliares e infiltrado linfo-histioplasmocitário leve (Fig. 1C), e na fibrose grau 3 havia fibrose portal em ponte, com septos de tecido conjuntivo espessos (Fig. 1D), frequentemente ligando um espaço porta a outro, associado à proliferação de ductos multifocal intensa (Fig. 1E) e infiltrado linfo-histioplasmocitário e eosinofílico multifocal moderado (Fig. 1F).
Fotomicrografia de fígado bovino com fasciolose. A) Fibrose grau 1, com discreta profileração de tecido conjuntivo ao redor das estruturas do espaço porta (seta), hematoxilina e eosina (HE), barra 6,4µm. B) Fibrose grau 1, com tecido conjuntivo (azul) ao redor das estruturas do espaço porta (seta). Tricrômico de Masson, barra 6,4 µm. C) Fibrose grau 2, com proliferação de ductos biliares (cabeça de seta) no espaço porta, proliferação de tecido conjuntivo moderado e infiltrado inflamatório leve, HE, barra 6,4µm. D) Fibrose grau 3 apresentando infiltrado inflamatório multifocal moderado, proliferação de ducto bilar e septos de tecido conjuntivo espesso unindo um espaço porta ao outro (setas). HE, barra 14,5µm. E) Fibrose grau 3, com espaço porta apresentando moderada quantidade de tecido conjuntivo (azul), arteríolas, vênulas, ductos biliares e infiltrado linfo-histioplasmocitário difuso leve. Tricrômico de Masson, barra 46,5µm. F) Fibrose grau 3 apresentando no espaço porta infiltrado linfo-histioplasmocitário e eosinofílico difuso moderado e alguns ductos biliares, HE, barra 6,4µm.
O resultado dos percentuais de fibrose por graus nos lobos hepáticos, dos fígados infectados por F. hepatica, encontra-se na Tab. 1. Observou-se uma associação positiva e significativa do grau de fibrose com o lobo hepático esquerdo (ρ=0,41; P<0,0001).
Porcentagem de fibrose por grau em cada lobo hepático nos fígados infectados por F. hepatica
A classificação proposta por Oliveira et al. (2004OLIVEIRA, L.; SOUZA, M.M.; ANDRADE, Z. Capillaria hepatica-induced hepatic fibrosis in rats: paradoxical effect of repeated infections. Rev. Soc. Bras. Med. Trop., v.37, p.123-127, 2004.) tem sido mais utilizada por ter como vantagens o desenvolvimento de fibrose em 100% dos animais infectados, além de previsão cronológica com boa margem de confiança (Gomes et al., 2006GOMES, A.T.; CUNHA, L.M.; BASTOS, C.G. et al. Capillaria hepatica in rats: focal parasitic hepatic lesions and septal fibrosis run independent courses. Mem. Inst. Oswaldo Cruz, v.101, p.895-898, 2006.). Mas, para bovinos, não há uma classificação bem estabelecida que avalie a progressão da fibrose com fasciolose.
No presente estudo, houve maior prevalência de fibrose grau 1. No entanto, Marcos et al. (2007MARCOS, L.A.; MACHICADO, A.; ANDRADE, R. et al. Hepatic fibrosis and Fasciola hepatica infection in cattle. J. Helminthol., v.81, p.381-386, 2007.) verificaram maior prevalência de fibrose grau 3, enquanto Trivilin et al. (2014TRIVILIN, L.O.; SOUSA, D.R.; NUNES, L.C. et al. Histopathology aspects and fibrosis evaluation of bovine naturally infected livers by Fasciola hepatica. Arch. Vet. Sci., v.19, p.61-69, 2014.) encontraram fibrose grau 2. Tais divergências podem ser decorrentes de diferentes critérios morfológicos avaliados. Marcos et al. (2007)MARCOS, L.A.; MACHICADO, A.; ANDRADE, R. et al. Hepatic fibrosis and Fasciola hepatica infection in cattle. J. Helminthol., v.81, p.381-386, 2007. associaram a fibrose à carga parasitária, enquanto Trivilin et al. (2014)TRIVILIN, L.O.; SOUSA, D.R.; NUNES, L.C. et al. Histopathology aspects and fibrosis evaluation of bovine naturally infected livers by Fasciola hepatica. Arch. Vet. Sci., v.19, p.61-69, 2014. utilizaram como critério as alterações inflamatórias, ao passo que Oliveira et al. (2004OLIVEIRA, L.; SOUZA, M.M.; ANDRADE, Z. Capillaria hepatica-induced hepatic fibrosis in rats: paradoxical effect of repeated infections. Rev. Soc. Bras. Med. Trop., v.37, p.123-127, 2004.) usaram a ocorrência de reinfecções. Ainda, deve-se considerar a resposta imune de cada hospedeiro frente à infecção, bem como às características bioquímicas do parasito (Meeusen e Piedrafita, 2003MEEUSEN, E.N.T.; PIEDRAFITA, D. Exploting natural immunity to helminth parasites for the development of veterinary vaccines. Int. J. Parasitol. , v.33, p.1285-1290, 2003.). Além disso, características epidemiológicas, como temperatura, pluviosidade, altitude dos locais, também podem influenciar a progressão da lesão hepática frente ao parasitismo (Alves et al., 2011ALVES, D.P.; CARNEIRO, M.B.; MARTINS, I.V.F. et al. Distribution and factors associated with Fasciola hepatica infection in cattle in the south of Espírito Santo state, Brazil. J. Venom. Anim. Toxins Incl. Trop. Dis., v.17, p.271-276, 2011. Available in: <http://dx.doi.org/10.1590/S1678-91992011000300006>. Accessed in: 13 nov. 2013.
http://dx.doi.org/10.1590/S1678-91992011...
).
O predomínio de fibrose no lobo hepático esquerdo foi observado por Shirai et al. (2006SHIRAI, W.; SATO, T.; SHIBUYA, H. et al. Anatomicopathological study of vascular and biliary system using cast samples of Fasciola-infected bovine livers. J. Vet. Med. A Physiol. Pathol. Clin. Med., v.53, p.239-245, 2006. ) e Tessele et al. (2013TESSELE, B.; BRUM, J.S.; BARROS, C.S.L. Lesões parasitárias encontradas em bovinos abatidos para consumo humano. Pesqui. Vet. Bras ., v.33, p.873-889, 2013.), respaldando os resultados obtidos neste estudo. Segundo Shirai et al. (2006)SHIRAI, W.; SATO, T.; SHIBUYA, H. et al. Anatomicopathological study of vascular and biliary system using cast samples of Fasciola-infected bovine livers. J. Vet. Med. A Physiol. Pathol. Clin. Med., v.53, p.239-245, 2006. , a presença de um único ramo de veia porta e de um único ducto biliar no lobo hepático esquerdo, paralelo com a superfície visceral e a superfície diafragmática, favorece a fibrose atrófica nesta área, agravando também pelo infiltrado inflamatório, o edema e a proliferação de tecido conjuntivo fibroso (Parola e Pinzan, 2009PAROLA, M.; PINZANI, M. Hepatic wound repair. Fibrogenesis Tissue Repair, v.2, p.4-9, 2009.).
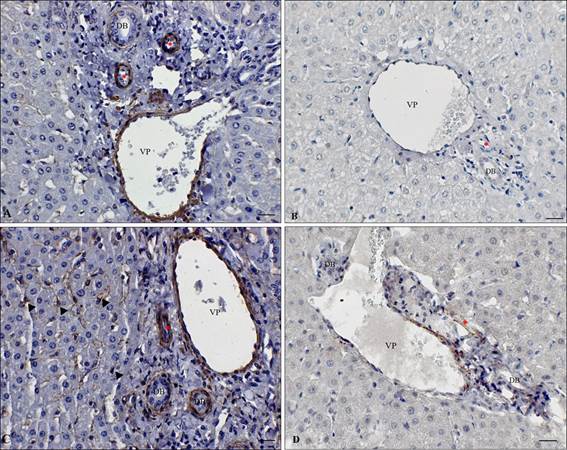
Em relação à caracterização do imunofenótipo das células que compõem a fibrose hepática, observou-se imunomarcação nas células estreladas hepáticas (CEHs) e em miofibroblastos portais (Fig. 2). A distribuição das CEHs foi observada unicamente no parênquima (Fig. 2C), localizadas entre os hepatócitos e os espaços de Disse, corroborando Kukolj et al. (2015KUKOLJ, V.; NEŠIĆ, S.; VUČIĆEVIĆ, I. Distribution of hepatic stellate cells and their role in the development of parasitic fibrosis and liver cirrhosis in domestic animals. Vet. Glasnik, v.69, p.3-11, 2015.), e os miofibroblastos foram observados nos EP. Resultados semelhantes foram relatados por Golbar et al. (2013GOLBAR, H.M.; IZAWA, T.; JUNIANTITO, V. et al. Immunohistochemical characterization of macrophages and myofibroblasts in fibrotic liver lesions due to Fasciola infection in cattle. J. Vet. Med. Sci., v.75, p.857-865, 2013.).
Imuno-histoquímica de fígado bovino condenado por fasciolose. A) Miofibroblastos em arteríolas (*), vênula portal (vp) e ductos biliares (DB), imunomarcados com o anticorpo α-SMA, barra 14,5µm. B) Região de espaço porta com arteríola (*), vênula portal (vp) (v) e ducto biliar (DB) sem imunomarcação para fibroblasto. Anticorpo TE7, barra 14,5µm. C) Células estreladas hepáticas α-SMA positivas (cabeça de seta) com distribuição predominante no parênquima, fibrose grau 1. Barra 6,4µm. D) Miofibroblastos imunomarcados com elastina circundando de vênula portal (v) e arteríolas (*) e ductos biliares (DB). Anticorpo antielastina, barra 14,5µm.
Carpino et al. (2005CARPINO, G.; MORINI, S.; CORRADINI, S.G. et al. Alpha-SMA expression in hepatic stellate cells and quantitative analysis of hepatic fibrosis in cirrhosis and in recurrent chronic hepatitis after liver transplantation. Dig. Liver Dis., v.37, p.349-356, 2005. Available in: <http://dx.doi.org/10.1016/j.dld.2004.11.009>. Accessed in: 13 nov.2013
http://dx.doi.org/10.1016/j.dld.2004.11....
) consideraram o anticorpo α-SMA um marcador confiável de CEH ativadas, em seres humanos e em rato. Uchio et al. (2002UCHIO, K.; TUCHWEBER, B.; MANABE, N. et al. Cellular retinol-binding protein-1 expression and modulation during in vivo and in vitro myofibroblastic differentiation of rat hepatic stellate cells and portal fibroblasts. Lab. Investig. , v.82, p.619-628, 2002.), no entanto, relataram que nenhum marcador permite discriminar totalmente os MFs das CEH ativadas, na fase de miofibroblastos. Em concordância a isso, Cassiman et al. (2002CASSIMAN, D.; LIBBRECHT, L.; DESMET, V. et al. Hepatic stellate cell/myofibroblast subpopulations in fibrotic human and rat livers. J. Hepatol., v.36, p.200-209, 2002. ) e Ramadori e Saile (2004RAMADORI, G.; SAILE, B. Portal tract fibrogenesis in the liver. Lab. Investig. , v.84, p.153-159, 2004.) descreveram que os MFs de vasos e os FBP podem expressar essa proteína, o que revela a heterogenicidade do miofibroblastos hepáticos. A fim de diferenciar MFs de vasos de FBP presente no EP, utilizou-se o anticorpo TE7, contudo não houve imunomarcação nas amostras avaliadas.
A ausência de FB nas amostras avaliadas pode ser decorrente da ativação dessas células para miofibroblastos (Libbrecht et al., 2002LIBBRECHT, L.; CASSIMAN, D.; DESMET, V.; ROSKAMS, T. The correlation between portal myofibroblasts and development of intrahepatic bile ducts and arterial branches in human liver. Liver, v.22, p.252-258, 2002.; Uchio et al., 2002UCHIO, K.; TUCHWEBER, B.; MANABE, N. et al. Cellular retinol-binding protein-1 expression and modulation during in vivo and in vitro myofibroblastic differentiation of rat hepatic stellate cells and portal fibroblasts. Lab. Investig. , v.82, p.619-628, 2002.; Asahina et al., 2009ASAHINA, K.; TSAI, L.Y.; LI, P. et al. Mesenchymal origin of hepatic stellate cells, submesothelial cells, and perivascular mesenchymal cells during mouse liver development. Hepatology, v.49, p.998-1011, 2009. Available in: <http://onlinelibrary. wiley.com/doi/10.1002/hep.23003/pdf>. Accessed in: 13 nov. 2013.
http://onlinelibrary. wiley.com/doi/10.1...
). Kinnman e Housset (2002KINNMAN, N.; HOUSSET, C. Peribiliary myofibroblasts in biliary type liver fibrosis. Front. Biosci., v.1, p.496-503, 2002.) relataram que obstruções de ductos biliares ativam os FBP em MFPs. À presença de lesão e/ou de células inflamatórias, os FB são estimulados por fator transformador de crescimento (TGF-β1) e por fator de crescimento derivado de plaquetas e sofrem transdiferenciação para MFP (Safadi e Friedman, 2002SAFADI, R.; FRIEDMAN, S.L. Hepatic fibrosis role of hepatic stellate cell activation. Medscape J. Med., v.4, p.27, 2002.; Bataller e Brenner, 2005BATALLER, R.; BRENNER, D.A. Liver fibrosis. J. Clin. Invest., v.115, p.209-218, 2005. Available in: <http://www.jci.org/articles/ view/24282/pdf>. Accessed in:13 nov. 2013.
http://www.jci.org/articles/ view/24282/...
; Gressner e Weiskirchen, 2006GRESSNER, AM.; WEISKIRCHEN, R. Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-β as major players and therapeutic targets. J. Cell. Mol. Med., v.10, p.76-99, 2006.).
Estudos em fígados com fasciolose crônica indicaram que existe associação entre a intensidade da infecção e a progressão da fibrose em diversos modelos animais (Marcos et al., 2007MARCOS, L.A.; MACHICADO, A.; ANDRADE, R. et al. Hepatic fibrosis and Fasciola hepatica infection in cattle. J. Helminthol., v.81, p.381-386, 2007.). Golbar et al. (2013GOLBAR, H.M.; IZAWA, T.; JUNIANTITO, V. et al. Immunohistochemical characterization of macrophages and myofibroblasts in fibrotic liver lesions due to Fasciola infection in cattle. J. Vet. Med. Sci., v.75, p.857-865, 2013.) e Kukolj et al. (2015KUKOLJ, V.; NEŠIĆ, S.; VUČIĆEVIĆ, I. Distribution of hepatic stellate cells and their role in the development of parasitic fibrosis and liver cirrhosis in domestic animals. Vet. Glasnik, v.69, p.3-11, 2015.) demostraram que a intensidade de expressão de α-SMA nas CEH aumenta com a progressão da fibrose, em fígados bovinos e ovinos infectados por F. hepatica.
No presente estudo, não houve associação entre a quantidade de CEH e o grau de fibrose (1, 2 e 3) no lobo hepático direito (ρ=-0,20; P=0,09) nem no lobo hepático esquerdo (ρ=0,02; P=0,85). Por outro lado, houve uma correlação negativa e significativa entre os graus de fibrose (ρ=-0,44; P<0,0001) e a quantidade de CEH (ρ=-0,61; P<0,0001), contrapondo-se ao que se observa em seres humanos (Carpino et al., 2005CARPINO, G.; MORINI, S.; CORRADINI, S.G. et al. Alpha-SMA expression in hepatic stellate cells and quantitative analysis of hepatic fibrosis in cirrhosis and in recurrent chronic hepatitis after liver transplantation. Dig. Liver Dis., v.37, p.349-356, 2005. Available in: <http://dx.doi.org/10.1016/j.dld.2004.11.009>. Accessed in: 13 nov.2013
http://dx.doi.org/10.1016/j.dld.2004.11....
; Chu et al., 2008CHU, C.M.; SHYU, W.C.; LIAW, Y.F. Comparative studies on expression of alpha smooth muscle actin in hepatic stellate cells in chronic hepatitis B and C. Dig. Dis. Sci., v.53, p.1364-1369, 2008.) e em ratos, em que há aumento das CEH durante a progressão da fibrose hepática (Cassiman et al., 2002CASSIMAN, D.; LIBBRECHT, L.; DESMET, V. et al. Hepatic stellate cell/myofibroblast subpopulations in fibrotic human and rat livers. J. Hepatol., v.36, p.200-209, 2002. ). Essa correlação negativa pode estar relacionada com a apoptose das CEH ativadas (Issa et al., 2001ISSA, R.; WILLIAMS, E.; TRIM, N. et al. Apoptosis of hepatic stellate cells: involvement in resolution of biliary fibrosis and regulation by soluble growth factors. Gut, v.48, p.548-557, 2001.), pois, segundo Beaussier et al. (2007BEAUSSIER, M.; WENDUM, D.; SCHIFFER, E. et al. Prominent contribution of portal mesenchymal cells to liver fibrosis in ischemic and obstructive cholestatic injuries. Lab. Investig., v.87, p.292-303, 2007.), essas células são mais susceptíveis à apoptose espontânea.
Ao se avaliar a quantidade de células imunomarcadas nos espaços porta, verificou-se aumento no número das estruturas portais, bem como aumento no número de camadas circundando cada uma dessas estruturas, arteríolas (AP), vênulas (VP) e ductos biliares (DB) (Fig. 3). Mas não houve influência de qualquer estrutura do espaço porta, em particular, sobre o grau de fibrose hepática (P>0,05).
Valores médios da quantidade de estruturas (vênulas, arteríolas e ductos biliares) e do número de camadas de miofibroblastos circundando cada estrutura por lobo hepático em fígados bovinos infectados por F. hepatica.
Diferentemente do observado neste trabalho, Kinnman e Housset (2002KINNMAN, N.; HOUSSET, C. Peribiliary myofibroblasts in biliary type liver fibrosis. Front. Biosci., v.1, p.496-503, 2002.), Uchio et al. (2002UCHIO, K.; TUCHWEBER, B.; MANABE, N. et al. Cellular retinol-binding protein-1 expression and modulation during in vivo and in vitro myofibroblastic differentiation of rat hepatic stellate cells and portal fibroblasts. Lab. Investig. , v.82, p.619-628, 2002.) e Magness et al. (2004MAGNESS, S.T.; BATALLER, R.; YANG, L.; BRENNER, D.A. A dual reporter gene transgenic mouse demonstrates heterogeneity in hepatic fibrogenic cell populations. Hepatology , v.40, p.1151-1159, 2004.) verificaram aumento de MF circundando os vasos portais e os ductos biliares à medida que a fibrose hepática progride. Libbrecht et al. (2002LIBBRECHT, L.; CASSIMAN, D.; DESMET, V.; ROSKAMS, T. The correlation between portal myofibroblasts and development of intrahepatic bile ducts and arterial branches in human liver. Liver, v.22, p.252-258, 2002.) e Lemoinne et al. (2015LEMOINNE, S.; CADORET, A.; RAUTOU, P.E. et al. Portal myofibroblasts promote vascular remodeling underlying cirrhosis formation through the release of microparticles. Hepatology , v.61, p.1041-1055, 2015.) relatam que as células residentes na parede da artéria portal contribuem para reparar os danos no espaço porta, assim essas células contribuem efetivamente para a fibrogênese hepática. Dados semelhantes foram verificados nesses estudos.
CONCLUSÃO
As CEH e os MFs desempenham um papel importante na fibrogênese de fígados bovinos frente à infecção por F. hepatica e estão distribuídos no parênquima hepático e no EP, respectivamente, em qualquer grau de fibrose.
AGRADECIMENTOS
Ao suporte financeiro da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes), ao Programa Nacional de Cooperação Acadêmica (Procad) e à Fundação de Amparo à Pesquisa do Estado do Espírito Santo (Fapes), pelas bolsas concedidas.
REFERÊNCIAS
- ALVES, D.P.; CARNEIRO, M.B.; MARTINS, I.V.F. et al. Distribution and factors associated with Fasciola hepatica infection in cattle in the south of Espírito Santo state, Brazil. J. Venom. Anim. Toxins Incl. Trop. Dis., v.17, p.271-276, 2011. Available in: <http://dx.doi.org/10.1590/S1678-91992011000300006>. Accessed in: 13 nov. 2013.
» http://dx.doi.org/10.1590/S1678-91992011000300006 - ASAHINA, K.; TSAI, L.Y.; LI, P. et al. Mesenchymal origin of hepatic stellate cells, submesothelial cells, and perivascular mesenchymal cells during mouse liver development. Hepatology, v.49, p.998-1011, 2009. Available in: <http://onlinelibrary. wiley.com/doi/10.1002/hep.23003/pdf>. Accessed in: 13 nov. 2013.
» http://onlinelibrary. wiley.com/doi/10.1002/hep.23003/pdf - BATALLER, R.; BRENNER, D.A. Liver fibrosis. J. Clin. Invest., v.115, p.209-218, 2005. Available in: <http://www.jci.org/articles/ view/24282/pdf>. Accessed in:13 nov. 2013.
» http://www.jci.org/articles/ view/24282/pdf - BEAUSSIER, M.; WENDUM, D.; SCHIFFER, E. et al. Prominent contribution of portal mesenchymal cells to liver fibrosis in ischemic and obstructive cholestatic injuries. Lab. Investig., v.87, p.292-303, 2007.
- CARPINO, G.; MORINI, S.; CORRADINI, S.G. et al. Alpha-SMA expression in hepatic stellate cells and quantitative analysis of hepatic fibrosis in cirrhosis and in recurrent chronic hepatitis after liver transplantation. Dig. Liver Dis., v.37, p.349-356, 2005. Available in: <http://dx.doi.org/10.1016/j.dld.2004.11.009>. Accessed in: 13 nov.2013
» http://dx.doi.org/10.1016/j.dld.2004.11.009 - CASSIMAN, D.; LIBBRECHT, L.; DESMET, V. et al. Hepatic stellate cell/myofibroblast subpopulations in fibrotic human and rat livers. J. Hepatol., v.36, p.200-209, 2002.
- CHU, C.M.; SHYU, W.C.; LIAW, Y.F. Comparative studies on expression of alpha smooth muscle actin in hepatic stellate cells in chronic hepatitis B and C. Dig. Dis. Sci., v.53, p.1364-1369, 2008.
- ESPINOZA, J.R.; TERASHIMA, A.; HERRERA-VELIT, P.; MARCOS, L. Fasciolosis humana y animal en el perú: impacto en la economía de las zonas endêmicas. Rev. Peru Med. Exp. Salud Publica, v.27, p.604-12, 2010.
- FRIEDMAN, S.L. Hepatic stellate cells: protean, multifunctional, and enigmatic cells of the liver. Physiol. Rev., v.88, p.125-172, 2008.
- GOLBAR, H.M.; IZAWA, T.; JUNIANTITO, V. et al. Immunohistochemical characterization of macrophages and myofibroblasts in fibrotic liver lesions due to Fasciola infection in cattle. J. Vet. Med. Sci., v.75, p.857-865, 2013.
- GOMES, A.T.; CUNHA, L.M.; BASTOS, C.G. et al. Capillaria hepatica in rats: focal parasitic hepatic lesions and septal fibrosis run independent courses. Mem. Inst. Oswaldo Cruz, v.101, p.895-898, 2006.
- GRESSNER, AM.; WEISKIRCHEN, R. Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-β as major players and therapeutic targets. J. Cell. Mol. Med., v.10, p.76-99, 2006.
- ISSA, R.; WILLIAMS, E.; TRIM, N. et al. Apoptosis of hepatic stellate cells: involvement in resolution of biliary fibrosis and regulation by soluble growth factors. Gut, v.48, p.548-557, 2001.
- KINNMAN, N.; HOUSSET, C. Peribiliary myofibroblasts in biliary type liver fibrosis. Front. Biosci., v.1, p.496-503, 2002.
- KUKOLJ, V.; NEŠIĆ, S.; VUČIĆEVIĆ, I. Distribution of hepatic stellate cells and their role in the development of parasitic fibrosis and liver cirrhosis in domestic animals. Vet. Glasnik, v.69, p.3-11, 2015.
- LEMOINNE, S.; CADORET, A.; EL MOURABIT, H. et al. Origins and functions of liver myofibroblasts. Biochim. Biophys. Acta, v.1832, p.948-954, 2013.
- LEMOINNE, S.; CADORET, A.; RAUTOU, P.E. et al. Portal myofibroblasts promote vascular remodeling underlying cirrhosis formation through the release of microparticles. Hepatology , v.61, p.1041-1055, 2015.
- LIBBRECHT, L.; CASSIMAN, D.; DESMET, V.; ROSKAMS, T. The correlation between portal myofibroblasts and development of intrahepatic bile ducts and arterial branches in human liver. Liver, v.22, p.252-258, 2002.
- MAGNESS, S.T.; BATALLER, R.; YANG, L.; BRENNER, D.A. A dual reporter gene transgenic mouse demonstrates heterogeneity in hepatic fibrogenic cell populations. Hepatology , v.40, p.1151-1159, 2004.
- MARCOS, L.A.; MACHICADO, A.; ANDRADE, R. et al. Hepatic fibrosis and Fasciola hepatica infection in cattle. J. Helminthol., v.81, p.381-386, 2007.
- MARCOS, L.A.; TERASHIMA. A.; YI, P. et al. Mechanisms of liver fibrosis associated with experimental Fasciola hepatica infection: roles of Fas2 proteinase and hepatic stellate cell activation. J. Parasitol., v.97, p.82-87. 2011.
- MEEUSEN, E.N.T.; PIEDRAFITA, D. Exploting natural immunity to helminth parasites for the development of veterinary vaccines. Int. J. Parasitol. , v.33, p.1285-1290, 2003.
- OLIVEIRA, L.; SOUZA, M.M.; ANDRADE, Z. Capillaria hepatica-induced hepatic fibrosis in rats: paradoxical effect of repeated infections. Rev. Soc. Bras. Med. Trop., v.37, p.123-127, 2004.
- PAROLA, M.; PINZANI, M. Hepatic wound repair. Fibrogenesis Tissue Repair, v.2, p.4-9, 2009.
- RAMADORI, G.; SAILE, B. Portal tract fibrogenesis in the liver. Lab. Investig. , v.84, p.153-159, 2004.
- SAFADI, R.; FRIEDMAN, S.L. Hepatic fibrosis role of hepatic stellate cell activation. Medscape J. Med., v.4, p.27, 2002.
- SHIRAI, W.; SATO, T.; SHIBUYA, H. et al. Anatomicopathological study of vascular and biliary system using cast samples of Fasciola-infected bovine livers. J. Vet. Med. A Physiol. Pathol. Clin. Med., v.53, p.239-245, 2006.
- TESSELE, B.; BRUM, J.S.; BARROS, C.S.L. Lesões parasitárias encontradas em bovinos abatidos para consumo humano. Pesqui. Vet. Bras ., v.33, p.873-889, 2013.
- TRIVILIN, L.O.; SOUSA, D.R.; NUNES, L.C. et al. Histopathology aspects and fibrosis evaluation of bovine naturally infected livers by Fasciola hepatica. Arch. Vet. Sci., v.19, p.61-69, 2014.
- UCHIO, K.; TUCHWEBER, B.; MANABE, N. et al. Cellular retinol-binding protein-1 expression and modulation during in vivo and in vitro myofibroblastic differentiation of rat hepatic stellate cells and portal fibroblasts. Lab. Investig. , v.82, p.619-628, 2002.
Datas de Publicação
-
Publicação nesta coleção
Jun 2017
Histórico
-
Recebido
08 Set 2016 -
Aceito
30 Set 2016