RESUMO
Com o objetivo de estudar o efeito da condroitinase associada às células-tronco mesenquimais na lesão aguda da medula espinhal, utilizaram-se 50 ratos Lewis, distribuídos igualmente nos grupos: controle negativo (CN), tratamento com placebo (PLA), condroitinase (CDN), células-tronco mesenquimais (CTM) e condroitinase mais células-tronco mesenquimais (CDN+CTM). Todos os animais tiveram a medula espinhal exposta por laminectomia, e os grupos PLA, CDT, CTM e CDT+CTM sofreram também trauma medular compressivo. Após sete dias, procedeu-se à reexposição da medula espinhal, quando os grupos PLA e CTM receberam 4µL de líquido cefalorraquidiano artificial via intralesional, e os grupos CDT e CDT+CTM receberam o mesmo líquido contendo 2,2U de condroitinase. Após 14 dias da cirurgia inicial, todos os animais receberam 0,2mL de PBS via endovenosa, contudo, nos grupos CTM e CDT+CTM, esse líquido continha 1x106 CTM. Avaliou-se a capacidade motora até o 28o dia pós-trauma e, posteriormente, as medulas espinhais foram analisadas por RT-PCR, para quantificação da expressão gênica para BDNF, NT-3, VEGF, KDR e PECAM-1, e por imunoistoquímica, para detecção das células-tronco GFP injetadas (anti-GFP), quantificação dos neurônios (anti-NeuN) e da GFAP e vimentina, para avaliação da cicatriz glial. As análises estatísticas foram realizadas com o auxílio do Prism 5 for Windows, com o nível de significância de 5%. Não houve diferença entre os grupos quanto à capacidade motora. O grupo CDT+CTM apresentou maior imunoexpressão de neurônios viáveis do que o placebo. No CTM, houve maior expressão dos fatores neurotróficos BDNF e VEGF. E no CDT, houve menor imunoexpressão de vimentina. Concluiu-se que a associação CDT+CTM favorece a viabilidade neuronal após o trauma, que o tratamento com CTM promove aumento na expressão dos fatores tróficos BDNF e VEGF e que o tratamento com condroitinase é efetivo na redução da cicatriz glial.
Palavras-chave:
trauma medular; fatores tróficos; neuroproteção; cicatriz glial
ABSTRACT
The aim of this work was to study the effect of chondroitinase associated with mesenchymal stem cells in acute spinal cord injury. Therefore, 50 Lewis rats were distributed in the following groups: negative control (NC), treatment with placebo (PLA), chondroitinase (CDT), mesenchymal stem cells (MSC), and chondroitinase associated with mesenchymal stem cells (CDT + MSC). All animals had their spinal cord exposed by laminectomy, and the groups named PLA, CDT, MSC and CDT + MSC also suffered compressive spinal cord trauma. After seven days, the spinal cord was re-exposed, when the PLA and MSCs groups received 4uL of artificial cerebrospinal fluid through the lesion, and the CDT group and CDT + MSC received the same fluid containing 2,2U of chondroitinase. 14 days after the first surgery, all animals received 0.2ml of PBS intravenously; however, the MSC and CDT + MSC groups received the same liquid also containing 1x106 MSCs. The motor skills were evaluated up to 28 days post-injury and, subsequently, the spinal cords were analyzed by RT-PCR for BDNF, NT-3, VEGF, PECAM-1 and KDR gene expression quantification, immunohistochemistry to detect injected stem cells GFP (anti-GFP), to quantify neurons (anti-NeuN), GFAP and detect vimentin in order to evaluate the glial scar. Statistical analyzes were performed by Prism 5 for Windows using a 5% level of significance. There was no difference between groups with regarding motor capacity. The CDT + MSC group showed increased immunoreactivity of viable neurons than placebo. In MSC, there was a greater expression of neurotrophic factors BDNF and VEGF. Also, there was less vimentin immunostaining in group CDT. It was concluded that CDT + MSC association promotes neuronal viability after trauma, in which treatment with MSC promotes increased expression of BDNF and VEGF trophic factors, and also that treatment with chondroitinase is effective in reducing the glial scar.
Keywords:
spinal cord injury; trophic factors; neuroprotection; glial scar
INTRODUÇÃO
Quando a medula espinhal é submetida à ação traumática, ocorre ruptura de vasos e de axônios por força mecânica primária. Essa lesão inicial desencadeia os eventos secundários causados por interrupção na perfusão vascular normal, com consequente isquemia, alterações eletrolíticas e liberação de uma cascata de mediadores da degeneração tecidual (Han et al., 2012HAN, X.; YANG, N.; CUI, Y. et al. Simvastatin mobilizes bone marrow stromal cells migrating to injured areas and promotes functional recovery after spinal cord injury in the rat. Neurosci. Lett. v.521, p.136-141, 2012.). Os eventos secundários continuam a ocorrer nas semanas que seguem à lesão medular, levando à formação de cistos e cavidades que exacerbam a disfunção neurológica (Grill, 2005GRILL, R.J. User-defined variables that affect outcome in spinal cord contusion/compression models. Exp. Neurol., v.196, p.1-5, 2005.).
O processo de reparação após a lesão medular envolve angiogênese (Ng et al., 2011NG, M.T.L.; STAMMERS, A.T.; KWON, B.K. Vascular disruption and the role of angiogenic proteins after spinal cord injury. Transl. Stroke Res., v.2, p.474-491, 2011.; Milbreta et al., 2014MILBRETA, U.; BOXBERG, Y.V.; MAILLY, P. et al. Astrocytic and vascular remodeling in the injured adult rat spinal cord after chondroitinase ABC treatment. J. Neurotrauma, v.31, p.803-818, 2014.), que auxilia na redução do dano secundário, levando oxigênio e nutrientes para o sítio de regeneração e removendo os restos metabólitos (Han et al., 2012HAN, X.; YANG, N.; CUI, Y. et al. Simvastatin mobilizes bone marrow stromal cells migrating to injured areas and promotes functional recovery after spinal cord injury in the rat. Neurosci. Lett. v.521, p.136-141, 2012.). Essa angiogênese é regulada por proteínas produzidas em resposta à privação de oxigênio, como o fator de crescimento do endotélio vascular (VEGF) (Kundi et al., 2013KUNDI, S.; BICKNELL, R.; AHMED, Z. The role of angiogenic and wound-healing factors after spinal cord injury in mammals. Neurosci. Res., v.76, p.1-9, 2013. ). Contudo, o reparo do sistema nervoso central é muito limitado após lesões que causam ruptura axonal e comprometimento neuronal, e as terapias disponíveis têm resultados limitados na recuperação neurológica (Ng et al., 2011; Ahuja et al., 2016AHUJA, C.S.; MARTIN, A.R.; FEHLINGS, M. Recent advances in managing a spinal cord injury secondary to trauma. F1000 Res., v.5, 2016. Available in: <https://www.ncbi.nlm.nih.gov/pubmed/27303644>. Accessed in: 15 Sep. 2016.
https://www.ncbi.nlm.nih.gov/pubmed/2730...
).
A utilização das células-tronco nesse tipo de lesão surge como possibilidade de terapia promissora, pois, além de se diferenciarem em neurônios e componentes da glia, repondo as células perdidas, elas também atuam como ponte de apoio para a regeneração axonal (Ryu et al., 2009RYU, H.H.; LIM, J.H.; BYEON, Y.E. et al. Functional recovery and neural differentiation after transplantation of allogenic adipose-derived stem cells in a canine model of acute spinal cord injury. J. Vet. Sci., v.10, p.273-284, 2009.). Contudo, o principal mecanismo de ação dessas células relaciona-se à influência exercida no meio ambiente da lesão devido à secreção, ou ao estímulo à liberação endógena, de fatores neurotróficos. Esses fatores atuam na matriz extracelular favorecendo o reparo axonal, além de estimularem o desenvolvimento, o crescimento e a sobrevivência neuronal. Entre os principais fatores produzidos por essas células, estão o fator neurotrófico derivado do encéfalo (BDNF), o fator de crescimento do endotélio vascular (VEGF) e a neurotrofina-3 (NT-3) (Lu et al., 2005LU, P.; JONES, L.L.; TUSZYNSKI, M.H. BDNF-expressing marrow stromal cells support extensive axonal growth at sites of spinal cord injury. Exp. Neurol., v.191, p.344-360, 2005.). Apesar de as células-tronco terem se tornado uma das terapias mais promissoras para tratar a lesão de medula espinhal, a forma e a via de inoculação mais adequadas para sua utilização precisam ser mais pesquisadas (Ahuja et al., 2016AHUJA, C.S.; MARTIN, A.R.; FEHLINGS, M. Recent advances in managing a spinal cord injury secondary to trauma. F1000 Res., v.5, 2016. Available in: <https://www.ncbi.nlm.nih.gov/pubmed/27303644>. Accessed in: 15 Sep. 2016.
https://www.ncbi.nlm.nih.gov/pubmed/2730...
). Além disso, quando as células-tronco são transplantadas na medula espinhal lesionada, geralmente encontram ambiente desfavorável ao seu crescimento e diferenciação devido à existência da cicatriz glial (Kanno et al., 2014KANNO, H.; PRESSMAN, Y.; MOODY, A. et al. Combination of engineered schwann cell grafts to secrete neurotrophin and chondroitinase promotes axonal regeneration and locomotion after spinal cord injury. J. Neurosci., v.34, p.1838-1855, 2014.; Wu et al., 2016WU, D.; KLAW, M.C.; KHOLODILOV, N. et al. Expressing constitutively active rheb in adult dorsal root ganglion neurons enhances the integration of sensory axons that regenerate across a chondroitinase-treated dorsal root entry zone following dorsal root crush. Front. Mol. Neurosci., v.9, 2016. Available in: <https://www.ncbi.nlm.nih.gov/pubmed/27458339>. Accessed in: 22 Aug. 2016.
https://www.ncbi.nlm.nih.gov/pubmed/2745...
). Essa cicatriz é resultante da proliferação e da hipertrofia de astrócitos (Hu et al., 2010HU, R.; ZHOU, J.; LOU, C. et al. Glial scar and neuroregeneration: histological, functional, and magnetic resonance imaging analysis in chronic spinal cord injury. J. Neurosurg. Spine, v.13, p.169-180, 2010.), que produzem os proteoglicanos sulfato de condroitina e passam a expressar mais filamentos intermediários, como a proteína ácida fibrilar glial (GFAP) e a vimentina (Tom e Houlé, 2008TOM, V.J.; HOULÉ, J.D. Intraspinal microinjection of chondroitinase ABC following injury promotes axonal regeneration out of a peripheral nerve graft bridge. Exp. Neurol., v.211, p.315-319, 2008.; Luna et al., 2010LUNA, G.; LEWIS, G.P.; BANNA, C.D. et al. Expression profiles of nestin and synemin in reactive astrocytes and Müller cells following retinal injury: a comparison with glial fibrillar acidic protein and vimentin. Mol. Vis., v.16, p.2511-2523, 2010.). O sulfato de condroitina está entre os principais componentes desse tecido cicatricial e tem propriedades que impedem o crescimento axonal (Ikegami et al., 2005IKEGAMI, T.; NAKAMURA, M.; YAMANE, J. et al. Chondroitinase ABC combined with neural stem/progenitor cell transplantation enhances graft cell migration and outgrowth of growth-associated protein-43-positive fibers after rat spinal cord injury. Eur. J. Neurosci., v.22, p.3036-3046, 2005. ; Rolls et al., 2008ROLLS, A.; SHECHTER, R.; LONDON, A. et al. Two faces of chondroitin sulfate proteoglycan in spinal cord repair: A role in microglia/macrophage activation. Plos Med., v.5, p.1262-1277, 2008. ; Wright et al., 2011WRIGHT, K.T.; MASRI, W.E.; OSMAN, A. et al. Concise review: bone marrow for the treatment of spinal cord injury: Mechanisms and clinical applications. Stem Cells, v.29, p.169-178, 2011.). Essa ação inibitória se deve à presença, em suas moléculas, das cadeias de glicosaminoglicanos, que podem ser digeridas pela enzima bacteriana condroitinase ABC (Iseda et al., 2008ISEDA, T.; OKUDA, T.; KANE-GOLDSMITH, N. et al. Single, high-dose intraspinal injection of chondroitinase reduces glycosaminoglycans in injured spinal cord and promotes corticospinal axonal regrowth after hemisection but not contusion. J. Neurotrauma, v.25, p.334-349, 2008.; Wu et al., 2016).
A utilização dessa enzima tem demonstrado aumento na regeneração e no brotamento axonal (Tom et al., 2009TOM, V.J.; KADAKIA, R.; SANTI, L. et al. Administration of chondroitinase ABC rostral or caudal to spinal cord injury site promotes anatomical but not functional plasticity. J. Neurotrauma, v.26, p.2323-2333, 2009.; Lin et al., 2011LIN, R.; ROSAHL, T.W.; WHITING, P.J. et al. 6-sulphated chondroitins have a positive influence on axonal regeneration. Plos One, v.6, p.1-10, 2011.), promovendo melhor desempenho funcional após lesão da medula espinhal (Ikegami et al., 2005IKEGAMI, T.; NAKAMURA, M.; YAMANE, J. et al. Chondroitinase ABC combined with neural stem/progenitor cell transplantation enhances graft cell migration and outgrowth of growth-associated protein-43-positive fibers after rat spinal cord injury. Eur. J. Neurosci., v.22, p.3036-3046, 2005. ; Hu et al., 2010HU, R.; ZHOU, J.; LOU, C. et al. Glial scar and neuroregeneration: histological, functional, and magnetic resonance imaging analysis in chronic spinal cord injury. J. Neurosurg. Spine, v.13, p.169-180, 2010.) e aumento da plasticidade sináptica (Tom e Houlé, 2008; Zhao e Fawcett, 2013ZHAO, R.R.; FAWCETT, J. Combination treatment with chondroitinase ABC in spinal cord injury-breaking the barrier. Neurosci. Bull., v.29, p.477-483, 2013. ). Estudos envolvendo a combinação de terapias parecem mais promissores para promover o completo reparo da medula lesionada (Zhao e Fawcett, 2013; Ahuja et al., 2016AHUJA, C.S.; MARTIN, A.R.; FEHLINGS, M. Recent advances in managing a spinal cord injury secondary to trauma. F1000 Res., v.5, 2016. Available in: <https://www.ncbi.nlm.nih.gov/pubmed/27303644>. Accessed in: 15 Sep. 2016.
https://www.ncbi.nlm.nih.gov/pubmed/2730...
). A combinação de terapias incluindo a condroitinase tem demonstrado efeitos benéficos em lesões medulares (Alluin et al., 2014ALLUIN, O.; DELIVET-MONGRAIN, H.; GAUTHIER, M.K. et al. Examination of the combined effects of chondroitinase ABC, growth factors and locomotor training following compressive spinal cord injury on neuroanatomical plasticity and kinematics. Plos One, v.9, 2014. Available in: <https://www.ncbi.nlm.nih.gov/pubmed/25350665>. Accessed in: 22 Aug. 2016.
https://www.ncbi.nlm.nih.gov/pubmed/2535...
; Shinozaki et al., 2016; Wu et al., 2016WU, D.; KLAW, M.C.; KHOLODILOV, N. et al. Expressing constitutively active rheb in adult dorsal root ganglion neurons enhances the integration of sensory axons that regenerate across a chondroitinase-treated dorsal root entry zone following dorsal root crush. Front. Mol. Neurosci., v.9, 2016. Available in: <https://www.ncbi.nlm.nih.gov/pubmed/27458339>. Accessed in: 22 Aug. 2016.
https://www.ncbi.nlm.nih.gov/pubmed/2745...
).
Alguns pesquisadores demonstraram resultados favoráveis da combinação dessa enzima com a terapia celular (Zhang et al., 2013ZHANG, C.; HE, X.; LI, H. et al. Chondroitinase ABC plus bone marrow mesenchymal stem cells for repair of spinal cord injury. Neural Regen. Res., v.8, p.965-974, 2013.; Kanno et al., 2014KANNO, H.; PRESSMAN, Y.; MOODY, A. et al. Combination of engineered schwann cell grafts to secrete neurotrophin and chondroitinase promotes axonal regeneration and locomotion after spinal cord injury. J. Neurosci., v.34, p.1838-1855, 2014.; Sarveazad et al., 2014SARVEAZAD, A.; BAKHTIARI, M.; BABAHAJIAN, A. et al. Comparison of human adipose-derived stem cells and chondroitinase ABC transplantation on locomotor recovery in the contusion model of spinal cord injury in rats. Iran J. Basic Med. Sci., v.17, p.685-693, 2014.; Sarveazad et al., 2017). No entanto, ainda não foi avaliado o protocolo de tratamento utilizado neste estudo, que consta da utilização da enzima condroitinase, via intralesional, aplicada uma semana após o trauma, combinada com a aplicação das CTM 14 dias após o trauma, via intravenosa. Espera-se que essa combinação possa dar bons resultados, uma vez que a utilização da enzima é mais interessante na fase não aguda (Rolls et al., 2008ROLLS, A.; SHECHTER, R.; LONDON, A. et al. Two faces of chondroitin sulfate proteoglycan in spinal cord repair: A role in microglia/macrophage activation. Plos Med., v.5, p.1262-1277, 2008. ). A CDT, além de reduzir os efeitos inibitórios da cicatriz glial, tornaria a matriz extracelular mais favorável à cinética das CTM, e estas, por sua vez, melhorariam a regeneração neuronal por meio da secreção de fatores neurotróficos, remielinização e/ou reconexão dos circuitos neuronais interrompidos (Ikegami et al., 2005IKEGAMI, T.; NAKAMURA, M.; YAMANE, J. et al. Chondroitinase ABC combined with neural stem/progenitor cell transplantation enhances graft cell migration and outgrowth of growth-associated protein-43-positive fibers after rat spinal cord injury. Eur. J. Neurosci., v.22, p.3036-3046, 2005. ).
Nesse contexto, objetivou-se estudar o efeito de ambos os tratamentos, isolados ou associados, e verificar se a utilização de CTM da medula óssea em lesões da medula espinhal previamente tratadas com a CDT otimizaria os dois tratamentos.
MATERIAL E MÉTODOS
Este estudo foi desenvolvido de acordo com as normas estabelecidas pelo Comitê de Ética em Experimentação Animal da Universidade Federal de Minas Gerais (Cetea/UFMG, protocolo no145/2011).
Foram utilizados 50 ratos adultos, linhagem Lewis, machos, com três meses de idade, distribuídos aleatoriamente em cinco grupos com 10 animais cada, sendo eles: controle negativo (CN), tratamento com placebo (PLA), tratamento com condroitinase (CDN), tratamento com células-tronco mesenquimais (CTM) e tratamento com condroitinase e células-tronco mesenquimais (CDN+CTM). Todos os animais tiveram a medula espinhal exposta por meio de laminectomia, e os grupos PLA, CDT, CTM e CDT+CTM foram submetidos também ao trauma medular compressivo. Após sete dias dessa cirurgia, eles foram submetidos à reexposição da medula espinhal, quando os animais do grupo CN não receberam tratamento e os demais grupos receberam 4µL de líquido cefalorraquidiano artificial (NaCl 127mmol/L, KCl 2mmol/L, NaHCO3 26mmol/L, MgSO4 2mmol/L, CaCl2 2mmol/L, KH2PO4 1,2mmol/L, HEPES 13mmol/L, glicose 10nM e pH 7,4) via intralesional. Nos grupos CDT e CDT+CTM, esse líquido continha 2,2U de condroitinase diluída. Após 14 dias da cirurgia inicial, todos os animais receberam 0,2mL de PBS (tampão fosfato-salino “phosphate buffered saline”) injetado via endovenosa, contudo, nas injeções dos grupos CTM e CDT+CTM, esse líquido continha 1x106 CTM.
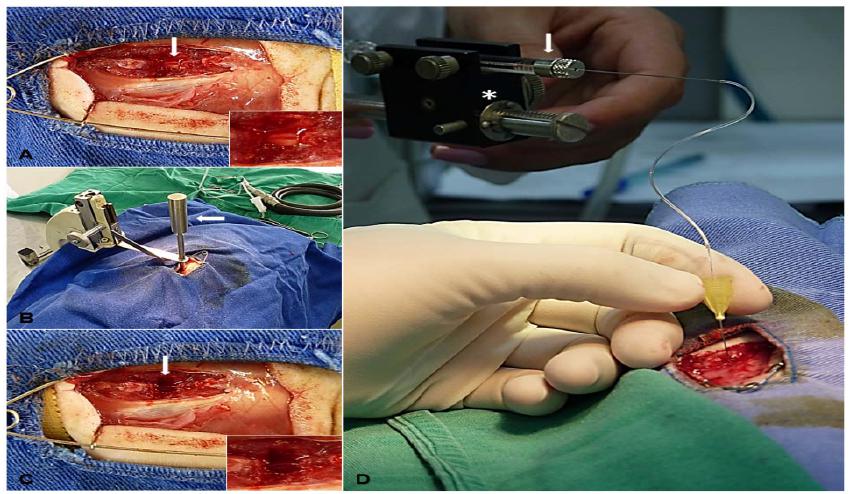
Para realização dos procedimentos cirúrgicos, os animais receberam indução e manutenção anestésicas com isoflurano (Isofluorane, Cristália Produtos Químicos Farmacêuticos Ltda., Brasil), antibiótico profilático com cefalotina sódica (Cefalotina, Ariston Indústrias e Farmacêuticas Ltda., Brasil) (60mg/kg, IV) e medicação pré-anestésica com cloridrato de tramadol (Tramadol, Laboratórios Pfizer, Brasil) (4mg/kg, SC). Eles foram, então, posicionados em decúbito esternal em uma plataforma de polietileno, a qual continha embaixo bolsas com água aquecida destinadas a manter a temperatura dos animais. Nos animais dos grupos com trauma, essa plataforma era conectada ao aparelho estereotáxico desenvolvido na Escola de Veterinária da UFMG (Torres et al., 2010TORRES, B.B.J.; SILVA, C.M.O.; ALMEIDA, F.M.C. et al. Modelo experimental de trauma medular agudo produzido por aparelho estereotáxico modificado. Arq. Bras. Med. Vet. Zootec., v.62, p.92-99, 2010. ). O processo espinhoso de T12 foi identificado, retirado e, com auxílio de drill pneumático neurológico (ECCOS® Aesculap, Laboratório B. Braun, Brasil), retirou-se a lâmina dorsal da vértebra (laminectomia). Após a visualização da medula espinhal (Fig. 1A), a haste metálica do aparelho estereotáxico foi colocada em contato com a dura-máter e solta suavemente, permanecendo cinco minutos exercendo pressão de 70,5g sobre a medula (Fig. 1B), provocando, assim, o trauma compressivo (Fig. 1C) de acordo com modelo preestabelecido (Torres et al., 2010). Esse procedimento não foi realizado nos animais do grupo CN, que sofreram apenas laminectomia.
Fotografias A, B e C demonstram rato em procedimento cirúrgico de trauma medular experimental. A) Visualização, após laminectomia, da medula espinhal com aspecto normal (seta). B) Aparelho estereotáxico posicionado para estabelecer a lesão compressiva da medula com peso de 70,5g (seta). C) Visualização da medula com hemorragia após o trauma (seta). D) Infusão intramedular de condroitinase ou líquido cefalorraquidiano artificial; observa- se a micro bomba de infusão (estrela) conectada a uma seringa de Hamilton (seta).
Uma semana após a primeira intervenção cirúrgica, de laminectomia com ou sem trauma, os ratos foram submetidos à reexposição da medula espinhal e à aplicação intralesional de líquido cefalorraquidiano artificial contendo ou não condroitinase (Fig. 2). Após identificação da área submetida à laminectomia, com auxílio de uma microbomba de infusão conectada a uma seringa de Hamilton (seringa 1701RN-HP 10µL SYR, Hamilton Company, USA), foram infundidos no epicentro da lesão 4µL de condroitinase ABC (0,55u/µL) nos animais dos grupos CDT e CDT+CTM; ou 4µL de líquido cefalorraquidiano artificial nos animais do grupo PLA e CTM, ambos na velocidade de 0,8µL/min (Fig. 1D).
Linha de tempo demonstrando a localização temporal dos procedimentos realizados nos ratos: avaliação da capacidade motora pela escala de escores motores proposta por Basso, Beatie e Bresnahan (BBB) desde a avaliação zero (Aval. 0), realizada antes do procedimento cirúrgico, até a última (Aval. 8); cirurgia de laminectomia com ou sem trauma (laminectomia ou trauma); injeção intramedular de condroitinase ou placebo (injeção CDT ou placebo); injeção de células-tronco mesenquimais da medula óssea ou placebo (injeção CTM ou placebo) e eutanásia.
As células-tronco mesenquimais da medula óssea foram extraídas de três Rattus norvegicus da linhagem Lewis, machos, com dois meses de idade, transgênicos para proteína verde fluorescente - GFP (green fluorescent protein) (LEW-Tg eGFP F455/Rrrc). Essas células foram obtidas e cultivadas segundo protocolos já estabelecidos (Tropel et al., 2004TROPEL, P.; NOËL, D.; PLATEL, N. et al. Isolation and characterisation of mesenchymal stem cells from adult mouse bone marrow. Exp. Cell Res., v.295, p.395-406, 2004.). O meio de cultivo foi trocado duas vezes por semana e, quando eram observados 80 a 90% de confluência das células, elas eram suspensas com tripsina e replicadas. Esse procedimento foi feito quatro vezes até o dia da inoculação nos animais. O fenótipo celular foi analisado por meio da expressão de moléculas de superfície (CD - cluster of differentiation), utilizando-se os anticorpos monoclonais primários de camundongo (BD Biosciences, EUA) anti-CD45 (clone 69), anti-CD73 (clone 5F/B9), anti-CD54 (clone 1A29) e anti-CD90 (clone 0X-7), seguindo protocolo estabelecido (Castanheira et al., 2009CASTANHEIRA, P.; TORQUETTI, L.T.; MAGALHÃES, D.R.S. et al. DAPI diffusion after intravitreal injection of mesenchymal stem cells in the injured retina of rats. Cell Transplant., v.18, p.1-100, 2009.).
Imediatamente antes da inoculação nos animais, as células foram avaliadas quanto à viabilidade celular pelo azul de tripan. O número de células viáveis foi utilizado para determinar o volume de tampão fosfato salino (PBS) estéril a ser adicionado ao pellet de células para uma concentração final de 5 x 106 células/mL, utilizada para o transplante celular. Antes de serem colocadas nessa concentração final, as células foram lavadas e centrifugadas três vezes com PBS para retirada de resquícios de soro fetal bovino. A injeção do PBS, contendo ou não células, dependendo do grupo, foi realizada duas semanas após a primeira intervenção cirúrgica (Fig. 2). Para esse procedimento, os ratos foram contidos manualmente e receberam uma injeção de 0,2mL na veia caudal. Os animais dos grupos CN, PLA e CDT receberam PBS, e os dos grupos CTM e CDT+CTM receberam o mesmo volume de PBS contendo cerca de 1 x 106 CTM.
A avaliação da capacidade motora foi realizada em todos os animais 24 horas antes e após a primeira cirurgia, bem como a cada quatro dias até o 280 dia após a cirurgia (Fig. 2). A avaliação realizada 24 horas após o primeiro procedimento cirúrgico foi intitulada avaliação 1, por ser a primeira após a submissão dos animais a procedimento experimental potencialmente lesivo. Foi utilizada a escala de escores motores proposta por Basso, Beatie e Bresnahan (BBB) (Basso et al., 1995BASSO, M.; BEATTIE, M.S.; BRESNAHAN, J.C.A sensitive and reliable locomotor rating scale for open field testing in rats. J. Neurotrauma, v.12, p.1-21, 1995.), em que os escores variam de zero, quando não se observa nenhum movimento nos membros, a 21, com deambulação normal. Os animais foram colocados em campo plano de 1m2 e filmados durante dois minutos. Os filmes foram posteriormente assistidos por dois avaliadores experientes e sem conhecimento dos grupos dos animais. Eles classificaram o padrão locomotor e atribuíram escores de acordo com a escala de escores para capacidade motora proposta por Basso, Beatie e Bresnahan em 1995 (BBB).
Trinta dias após o trauma ou laminectomia, todos os animais foram submetidos à eutanásia com sobredose de tiopental sódico (180mg/kg), por via intraperitoneal, seguida de punção cardíaca até o óbito (Fig. 2). De cada grupo experimental, composto por 10 animais, quatro foram destinados à avaliação da expressão gênica, por meio da reação em cadeia da polimerase transcriptase-reversa (RT-PCR) em tempo real, e seis foram destinados à avaliação anatomopatológica e à imunoistoquímica.
Para avaliação da expressão dos transcriptos, dos quatro animais de cada grupo, imediatamente após a eutanásia, retirou-se assepticamente um segmento de 0,5cm da medula espinhal contendo o epicentro da lesão. Cada segmento foi colocado em criotubo e prontamente congelado em nitrogênio líquido e, em seguida, transferido para o freezer à temperatura de -80ºC. Posteriormente, utilizaram-se esses segmentos para avaliar a expressão gênica relativa do BDNF, da NT-3, do VEGF e do seu receptor KDR (kinase insert domain receptor), da molécula de adesão celular endotélio plaquetária (PECAM-1) e do gene normalizador da beta-actina por RT-PCR tempo real, utilizando-se os primers iniciadores forward (F) e reverse (R) indicados na Tab. 1.
Genes com a respectiva sequência de nucleotídeos dos primers iniciadores para RT-PCR em tempo real
O RNA foi extraído utilizando-se trizol (Invitrogen, Life Technologies, USA) de acordo com as instruções do fabricante. Desse RNA, retirou-se uma amostra para quantificação e congelou-se o restante a -80ºC para posterior confecção do DNA complementar (cDNA), com utilização de kit comercial (SuperScript III Platinum® Two-Step qRT-PCR Kit with SYBR® Green Invitrogen, USA). Os reagentes foram estimados para utilização com 1,0µg de RNA, calculado pelo grau de pureza da amostra. A PCR em tempo real foi realizada com a utilização dos reagentes SYBR Green e Rox, além dos primers iniciadores forward e reverse e do cDNA sintetizado. As reações de amplificação do cDNA dos genes foram realizadas na plataforma de instrumentação ABI Prism 7900, adotando-se 45 ciclos de 15 segundos a 95ºC para desnaturação da fita dupla, um minuto a 60ºC para anelamento dos iniciadores dos respectivos genes, um minuto a 75ºC para extensão dos amplicons e mais 10 minutos a 75ºC para término da reação. O software 7500 v.2.0.1 Applied Biosystems apresentou os resultados em gráfico de fluorescência em relação ao número de ciclos, sendo o ciclo limiar, ou threshold (CT), aquele em que foi detectada fluorescência acima do limite basal estabelecido.
A expressão gênica relativa ou fold change (FC) de cada gene foi calculada utilizando-se o método do 2-∆∆C
T. Assim, o delta CT (∆CT) foi determinado pela subtração do CT do gene pesquisado pelo CT do gene normalizador beta-actina. O delta-delta CT (∆∆CT) foi encontrado pela diferença entre o ∆CT e a média do ∆CT do grupo controle; dessa forma, o grupo controle foi utilizado na realização do cálculo dos demais grupos, ficando o seu resultado isolado omitido. A expressão gênica relativa foi dada pela fórmula: FC= 2-∆∆C
T (Yuan et al., 2006YUAN, J.S.; REED, A.; CHEN, F. et al. Statistical analysis of real-time PCR data. B.M.C. Bioinformatics, v.7, 2006. Available in: <http://www.biomedcentral.com/1471-2105/7/85>. Accessed in: 16 Feb. 2012.
http://www.biomedcentral.com/1471-2105/7...
).
Para avaliação histopatológica e imunoistoquímica, seis animais de cada grupo, imediatamente após a eutanásia, foram submetidos à perfusão transcardíaca em bomba de infusão com PBS (0,15M, Ph=7,4) seguida de solução fixadora formol 10% tamponado. Logo após, o local do trauma foi inspecionado, e a medula espinhal removida e colocada em formol 10% tamponado. Um segmento de 2,7cm de cada medula espinhal, contendo o epicentro da lesão em sua região central, foi processado pela técnica de rotina para inclusão em parafina e, posteriormente, submetido a cortes seriados.
Para avaliação histológica, os cortes foram corados com hematoxilina e eosina e analisados em microscopia óptica para caracterização da lesão. Na avaliação imunoistoquímica, selecionou-se, para cada anticorpo, uma secção histológica por animal contendo área de necrose focalmente extensa moderada no corno dorsal, localizada na região caudal adjacente ao epicentro da lesão. As lâminas foram colocadas em xilol para retirada da parafina, hidratadas em concentrações decrescentes de álcool e colocadas em solução de peróxido de metanol 0,3% durante 30 minutos para bloqueio da peroxidase endógena. Após lavagem em PBS, as secções foram incubadas por 30 minutos com solução bloqueio e depois incubadas overnight a 4ºC com o anticorpo primário. Foi utilizada, como controle negativo, a substituição do anticorpo primário por PBS, para verificar a especificidade da marcação. No dia seguinte, foi realizada a ligação com anticorpo secundário, o bloqueio da biotina com estreptovidina-peroxidase, a revelação da relação com 3-3’diaminobenzidina (DAB, Dako, USA) e a contracoloração com hematoxilina.
Foram utilizados os anticorpos primários para marcação de neurônios íntegros anti-NeuN (Anti-neuN, Chemicon Internacional Inc., USA) (1:500) e dos componentes dos filamentos intermediários dos astrócitos, representados pela GFAP (Anti-GFAP, Invitrogen, Life Technologies, USA) (1:200) e pela vimentina (V9, Dako, USA) (1:200), para avaliação da cicatriz glial. As secções histológicas marcadas por esses anticorpos foram fotografadas com a objetiva de 40x. Foram retiradas fotos de cinco campos por secção englobando apenas a substância cinzenta, para o anticorpo anti-NeuN, e seis campos por secção para os demais, incluindo as substâncias branca e cinzenta da medula espinhal.
As fotografias foram analisadas utilizando-se o software de análise de imagem ImageJ® (National Institutes of Health, USA) e, para cada imagem, quantificou-se a média da densidade integrada de pixels das células subtraída do background. Utilizou-se ainda o anticorpo anti-GFP (Anti-GFP ab 290, Abcam, UK) (1:1500) para análise qualitativa das células-tronco GFP na medula espinhal lesionada dos animais receptores.
Para análise estatística, o delineamento utilizado foi inteiramente ao acaso. Verificou-se a normalidade dos parâmetros pelo teste Kolmogorov-Smirnov e as variâncias foram comparadas pelo teste F. Os dados referentes às expressões gênicas e imunomarcações foram submetidos à análise de variância (ANOVA) e ao teste de Student-Newman-Keuls (SNK) para comparação das médias. Os escores da avaliação da capacidade motora foram submetidos ao procedimento não paramétrico de Kruskal-Wallis (KW), seguido de comparações múltiplas entre pares de tratamentos pelo teste de Dunn. As análises foram realizadas com o auxílio do Prism 5 for Windows, version 5.01, GraphPad Software Inc., La Jolla, CA, USA. O nível de significância adotado foi de 5%.
RESULTADOS
Quanto à capacidade motora, todos os animais, na avaliação 0, realizada 24 horas antes do primeiro procedimento cirúrgico, apresentaram escore máximo 21, indicando ausência de anormalidades sensoriais e motoras. Na avaliação 1, realizada 24 horas após o primeiro procedimento cirúrgico, todos os grupos que sofreram trauma medular apresentaram escore zero ou um, sem diferença significativa entre eles, indicando déficit neurológico grave, com paraplegia e movimentação ausente ou discreta em uma ou duas articulações do membro posterior analisado, enquanto o grupo CN continuou com escore máximo, confirmando que a laminectomia isoladamente não prejudica a função motora. Nas avaliações 2 e 3, também não houve diferença significativa entre os grupos que sofreram o trauma medular (Fig. 3).
Perfil das medianas dos escores motores de ratos Lewis submetidos à laminectomia ou trauma medular espinhal e tratados com células-tronco mesenquimais e/ou condroitinase, ou veículo, em cada um dos oito dias da avaliação após o procedimento cirúrgico. (CN= controle negativo, PLA= placebo, CDT= condroitinase, CTM= células-tronco mesenquimais e CDT+CTM= condroitinase e células-tronco). Observa-se que, na oitava avaliação, 28 dias após o trauma, o grupo CDT apresenta escores motores semelhantes ao CN, mas não se difere dos demais grupos. Letras minúsculas diferentes expressam diferença estatística (P<0,05).
Na avaliação 3, realizada um dia após a administração intramedular de condroitinase ou placebo, os escores médios dos grupos tratados foram maiores do que os escores da segunda avaliação, indicando que a aplicação intramedular não causou deterioração neurológica. Da avaliação 4 à 8, o grupo CDT apresentou escores motores semelhantes estatisticamente ao grupo CN, contudo sem se diferir dos demais grupos, indicando uma possível tendência do grupo que recebeu a condroitinase a apresentar melhor recuperação motora.
Na última avaliação, todos os grupos submetidos ao trauma medular apresentaram escores médios condizentes com a fase inicial de recuperação motora estabelecida pelo teste BBB, em que os membros posteriores arrastavam no chão durante a deambulação, e apresentavam ou não movimentos nas articulações, com amplitude discreta ou extensa. A exceção foi o CDT, que apresentou escore médio pertencente à fase intermediária de recuperação, caracterizada pela presença de passada dorsal ou plantar com apoio de peso ocasional, consistente ou frequente, achado que corrobora a possível tendência da condroitinase em favorecer a recuperação motora. A associação da condroitinase com as células-tronco (CDT + CTM) não potencializou os resultados observados no grupo CDT.
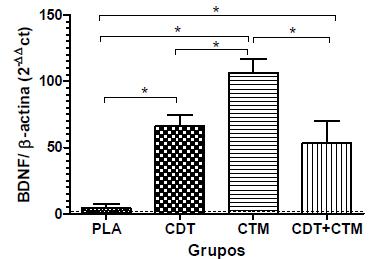
Em relação ao número de cópias criadas do RNAm do BDNF, o grupo CTM apresentou a maior expressão gênica relativa, seguido dos grupos CDT e CDT+CTM, com expressões semelhantes entre si e significativamente superiores às do PLA (Fig. 4).
Quantificação relativa das médias da expressão gênica (± erro-padrão médio) de BDNF em grupos de ratos submetidos a trauma agudo da medula espinhal e tratados com placebo (PLA), condroitinase (CDT), células-tronco mesenquimais (CTM) ou condroitinase mais células-tronco mesenquimais (CDT+CTM). Avaliação realizada 30 dias após o trauma medular. Os dados estão expressos em relação ao controle negativo (linha tracejada). * P<0,05.
Comparando as avaliações das expressões gênicas e considerando a interação entre os grupos e os fatores neurotróficos, constatou-se que o BDNF e o NT-3 apresentaram o mesmo padrão de distribuição entre os tratamentos; em ambos, o grupo CTM teve o maior valor, seguido pelo CDT+CTM e depois pelo CDT, enquanto o PLA teve o menor valor. Entretanto, no caso do NT-3, não houve diferença estatística entre os tratamentos.
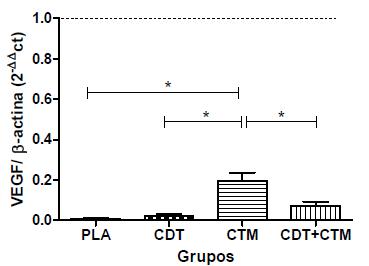
Com relação ao VEGF, o grupo CTM obteve maior expressão gênica relativa. Os demais tratamentos (CDT e CDT+CTM) mostraram resultados estatisticamente semelhantes ao PLA (Fig. 5). Quanto ao receptor kinase do VEGF, o KDR, não houve diferença estatística entre os tratamentos.
Quantificação relativa das médias da expressão gênica (± erro-padrão médio) de VEGF em grupos de ratos submetidos a trauma agudo da medula espinhal e tratados com placebo (PLA), condroitinase (CDT), células-tronco mesenquimais (CTM) ou condroitinase mais células-tronco mesenquimais (CDT+CTM). Avaliação realizada 30 dias após o trauma medular. Os dados estão expressos em relação ao controle negativo (linha tracejada). * P<0,05.
A expressão gênica da molécula de adesão PECAM-1 também não diferiu significativamente entre os grupos.
Nos animais submetidos ao trauma, observaram-se alterações histológicas semelhantes, independentemente do grupo, como cavitações com perda de substância associada a células de Gitter, gliócitos reativos, degeneração e tumefação axonal, além de vasos sanguíneos neoformados, visualizados principalmente nos grupos que receberam condroitinase. Não foi evidenciada alteração nas secções histológicas das medulas espinhais do grupo CN.
Na medula dos animais com trauma, a imunomarcação dos neurônios com o anticorpo anti-NeuN foi maior no grupo CDT+CTM em relação ao PLA.
O grupo que recebeu a associação de tratamentos teve número de neurônios viáveis marcados semelhantemente ao CN, enquanto os demais grupos não se diferiram do placebo (Fig. 6).
Fotomicrografias e gráfico de secções transversais da medula espinhal de ratos submetidos à imunoistoquímica com anti-neuN 30 dias após a realização da laminectomia, com ou sem trauma medular. A) Medula espinhal de animal pertencente ao grupo controle negativo (CN). B) Medula espinhal de animal pertencente ao grupo placebo (PLA). C) Medula espinhal de animal pertencente ao grupo condroitinase (CDT). D) Medula espinhal de animal pertencente ao grupo células-tronco mesenquimais (CTM). E) Medula espinhal de animal pertencente ao grupo condroitinase mais células-tronco mesenquimais (CDT+CTM). Pode-se observar imunomarcação intensa nas secções pertencentes a animais dos grupos CN, CTM e CDT+CTM. (Barra=44μm). F) Gráfico da média da intensidade integrada de pixels (± erro-padrão médio) da marcação por imunoistoquímica para anticorpo anti-neuN na medula espinhal dos ratos dos grupos CN, PLA, CDT, CTM ou CDT+CTM. * P<0,05.
A imunomarcação para o GFAP foi significativamente maior no grupo CDT+CTM comparado ao grupo sem trauma (CN). O CDT e CTM permaneceram semelhantes tanto ao CN quanto ao PLA e CDT+CTM (Fig.7).
Fotomicrografias e gráfico de secções transversais da medula espinhal de ratos submetidos à imunoistoquímica com anti-GFAP 30 dias após a realização da laminectomia, com ou sem trauma medular. A) Medula espinhal de animal pertencente ao grupo controle negativo (CN). B) Medula espinhal de animal pertencente ao grupo placebo (PLA). C) Medula espinhal de animal pertencente ao grupo condroitinase (CDT). D) Medula espinhal de animal pertencente ao grupo células-tronco mesenquimais (CTM). E) Medula espinhal de animal pertencente ao grupo condroitinase mais células-tronco mesenquimais (CDT+CTM). As secções pertencentes aos animais do grupo PLA e CDT+CTM tiveram imunomarcação maior do que as do CN (Barra=44μm). F) Gráfico da média da intensidade integrada de pixels (± erro-padrão médio) da marcação por imunoistoquímica para anticorpo anti-GFAP na medula espinhal dos ratos dos grupos CN, PLA, CDT, CTM ou CDT+CTM. *P<0,05.
Quanto à vimentina, entre os grupos com trauma, o CDT obteve a menor expressão e foi o único que apresentou diferença significativa em relação ao PLA. Os demais tratamentos (CTM e CDT+CTM) tiveram resultados semelhantes tanto ao PLA quanto ao CDT. Além disso, todos os grupos com trauma tiveram imunomarcação superior ao do CN (Fig. 8).
Fotomicrografias e gráfico de secções transversais da medula espinhal de ratos submetidos à imunoistoquímica com antivimentina 30 dias após a realização da laminectomia, com ou sem trauma medular. A) Medula espinhal de animal pertencente ao grupo controle negativo (CN). B) Medula espinhal de animal pertencente ao grupo placebo (PLA). C) Medula espinhal de animal pertencente ao grupo condroitinase (CDT). D) Medula espinhal de animal pertencente ao grupo células-tronco mesenquimais (CTM). E) Medula espinhal de animal pertencente ao grupo condroitinase mais células-tronco mesenquimais (CDT+CTM). Pode-se observar que todas as secções pertencentes a animais submetidos a trauma medular apresentam imunomarcação mais intensa do que a secção pertencente ao CN e que a secção do grupo PLA possui imunomarcação mais intensa do que a do grupo CDT (Barra=44μm). F) Gráfico da média da intensidade integrada de pixels (± erro-padrão médio) da marcação por imunoistoquímica para anticorpo antivimentina na medula espinhal dos ratos dos grupos CN, PLA, CDT, CTM ou CDT+CTM. *P<0,05.
A imunoistoquímica com o anticorpo GFP permitiu a visualização das células transgênicas para proteína verde fluorescente na medula espinhal dos animais receptores. As células marcadas não foram encontradas nos animais que não receberam as CTM (Fig. 9).
Fotomicrografias de secções transversais da medula espinhal de ratos submetidos à imunoistoquímica com anti-GFP 30 dias após a realização da laminectomia com trauma medular. A) Medula espinhal de animal pertencente ao grupo placebo (PLA). B) Medula espinhal de animal pertencente ao grupo células-tronco mesenquimais da medula óssea (CTM). Pode-se observar imunomarcação somente na secção pertencente ao animal do grupo CTM (Barra=500µm).
DISCUSSÃO
Foi constatado que a via intramedular é viável para administração da condroitinase, em concordância com Iseda et al. (2008ISEDA, T.; OKUDA, T.; KANE-GOLDSMITH, N. et al. Single, high-dose intraspinal injection of chondroitinase reduces glycosaminoglycans in injured spinal cord and promotes corticospinal axonal regrowth after hemisection but not contusion. J. Neurotrauma, v.25, p.334-349, 2008.), Tom et al. (2009TOM, V.J.; KADAKIA, R.; SANTI, L. et al. Administration of chondroitinase ABC rostral or caudal to spinal cord injury site promotes anatomical but not functional plasticity. J. Neurotrauma, v.26, p.2323-2333, 2009.), Milbreta et al. (2014MILBRETA, U.; BOXBERG, Y.V.; MAILLY, P. et al. Astrocytic and vascular remodeling in the injured adult rat spinal cord after chondroitinase ABC treatment. J. Neurotrauma, v.31, p.803-818, 2014.) e Sarveazed et al. (2016). Os escores motores crescentes apresentados pelos animais na avaliação 3, um dia após a aplicação por essa via, confirmaram que sua utilização não causou comprometimento adicional da função motora. A administração única, o pequeno volume injetado (4µL), a baixa velocidade (0,8µL/min) e com agulha fina (30G) são fatores que podem ter contribuído para a preservação tecidual. A dose utilizada, única, de 2,2U, sete dias após a lesão medular, foi baseada em dados que sugerem sucesso na aplicação nesse período (Garcia-Alías et al., 2008), ressaltando-se que a atividade da enzima ainda se mantém cerca de 50% após sete dias de sua administração (Ikegami et al., 2005IKEGAMI, T.; NAKAMURA, M.; YAMANE, J. et al. Chondroitinase ABC combined with neural stem/progenitor cell transplantation enhances graft cell migration and outgrowth of growth-associated protein-43-positive fibers after rat spinal cord injury. Eur. J. Neurosci., v.22, p.3036-3046, 2005. ). Ficou comprovado por Iseda et al. (2008) que uma única dose administrada in bolus pode digerir os PGSC durante várias semanas in vivo.
Rools et al. (2008) verificaram que a inibição do sulfato de condroitina, feita pela condroitinase, quando aplicada imediatamente após a lesão medular em ratos, compromete a recuperação motora e aumenta a perda tecidual. Essa inibição precoce alterou a organização espacial do infiltrado de células mieloides em volta do local da lesão, causou diminuição do fator de crescimento semelhante à insulina 1 (IGF-1), produzido pela micróglia/macrófagos, e aumento dos níveis do fator de necrose tumoral alfa (TNF-α). Em contraste, quando a inibição ocorreu somente dois dias após a lesão, a recuperação funcional foi melhorada. Verificou-se, dessa forma, que os proteoglicanos sulfato de condroitina são requeridos nos estágios iniciais da recuperação, enquanto na fase crônica, eles inibem o crescimento axonal e a regeneração.
As células-tronco injetadas via intravenosa foram detectadas na medula espinhal de animais receptores por meio da imunomarcação com GFP. Esse achado demonstrou que, após serem injetadas na veia caudal, essas células foram capazes de migrar até a área lesionada da medula espinhal e permanecer lá por pelo menos 16 dias após sua inoculação. Essa via foi utilizada por ser considerada pouco traumática, de fácil aplicação, viável clinicamente e com resultados favoráveis em estudos de trauma medular (Osaka et al., 2010OSAKA, M.; HONMOU, O.; MURAKAMI, T. et al. Intravenous administration of mesenchymal stem cells derived from bone marrow after contusive spinal cord injury improves functional outcome. Brain Res., v.1343, p.226-235, 2010.; Han et al., 2012HAN, X.; YANG, N.; CUI, Y. et al. Simvastatin mobilizes bone marrow stromal cells migrating to injured areas and promotes functional recovery after spinal cord injury in the rat. Neurosci. Lett. v.521, p.136-141, 2012.).
Quanto à capacidade motora, os escores baixos apresentados pelos grupos que sofreram o trauma medular na primeira avaliação, sem diferença estatística entre eles, indicam que o modelo de trauma é viável e produz lesões padronizadas, enquanto o escore máximo apresentado pelo grupo CN em todas as avaliações demonstrou que os animais não sofreram lesões devido ao procedimento cirúrgico de acesso à medula espinhal, a laminectomia dorsal. A partir da avaliação 4, a permanência do grupo CDT em igualdade estatística com o CN, embora sem se diferir do placebo, pode ser indicativo de uma possível ação benéfica da enzima na recuperação motora. Essa ação possivelmente relaciona-se à digestão enzimática dos PGSC da cicatriz glial, reduzindo seu efeito inibitório no crescimento axonal, e/ou ser decorrente do efeito da enzima na matriz extracelular que, ao torná-la mais propícia à invasão por células endoteliais, levaria ao aumento na vascularização com consequente aporte de nutrientes, diminuição ao dano secundário e neuroproteção. Vários autores relatam melhora funcional após a utilização da condroitinase (Garcia-Alias et al., 2008; Alluin et al., 2014ALLUIN, O.; DELIVET-MONGRAIN, H.; GAUTHIER, M.K. et al. Examination of the combined effects of chondroitinase ABC, growth factors and locomotor training following compressive spinal cord injury on neuroanatomical plasticity and kinematics. Plos One, v.9, 2014. Available in: <https://www.ncbi.nlm.nih.gov/pubmed/25350665>. Accessed in: 22 Aug. 2016.
https://www.ncbi.nlm.nih.gov/pubmed/2535...
; Sarveazad et al., 2014SARVEAZAD, A.; BAKHTIARI, M.; BABAHAJIAN, A. et al. Comparison of human adipose-derived stem cells and chondroitinase ABC transplantation on locomotor recovery in the contusion model of spinal cord injury in rats. Iran J. Basic Med. Sci., v.17, p.685-693, 2014.; Shinozaki et al., 2016), enquanto outros descrevem crescimento axonal, mas sem incremento funcional (Tom et al., 2009TOM, V.J.; KADAKIA, R.; SANTI, L. et al. Administration of chondroitinase ABC rostral or caudal to spinal cord injury site promotes anatomical but not functional plasticity. J. Neurotrauma, v.26, p.2323-2333, 2009.).
Quanto à ação das células no escore motor, alguns trabalhos relataram melhora rápida após a aplicação (Osaka et al., 2010OSAKA, M.; HONMOU, O.; MURAKAMI, T. et al. Intravenous administration of mesenchymal stem cells derived from bone marrow after contusive spinal cord injury improves functional outcome. Brain Res., v.1343, p.226-235, 2010.), outros encontraram escores maiores somente após quatro (Sarveazad et al., 2014SARVEAZAD, A.; BAKHTIARI, M.; BABAHAJIAN, A. et al. Comparison of human adipose-derived stem cells and chondroitinase ABC transplantation on locomotor recovery in the contusion model of spinal cord injury in rats. Iran J. Basic Med. Sci., v.17, p.685-693, 2014.), cinco (Hofstetter et al., 2002HOFSTETTER, C.P.; SCHWARZ, E.J.; HESS, D. et al. Marrow stromal cells form guiding strands in the injured spinal cord and promote recovery. Proc. Natl. Acad. Sci. U.S.A., v.99, p.2199-2204, 2002.; Kamada et al., 2011KAMADA, T.; KODA, M.; DEZAWA, M. et al. Transplantation of human bone marrow stromal cell-derived Schwann cells reduces cystic cavity and promotes functional recovery after contusion injury of adult rat spinal cord. Neuropathology, v.31, p.48-58, 2011.) ou sete semanas do trauma (Lee et al., 2007LEE, K.H.; SUH-KIM, H.; CHOI, J.S. et al. Human mesenchymal stem cell transplantation promotes functional recovery following acute spinal cord injury in rats. Acta Neurobiol. Exp., v.67, p.13-22, 2007.), e algumas pesquisas não relataram qualquer melhora funcional (Lu et al., 2005LU, P.; JONES, L.L.; TUSZYNSKI, M.H. BDNF-expressing marrow stromal cells support extensive axonal growth at sites of spinal cord injury. Exp. Neurol., v.191, p.344-360, 2005.; Parr et al., 2008PARR, A.M.; KULBATSKI, I.; WANG, X.H. et al. Fate of transplanted adult neural stem/progenitor cells and bone marrow-derived mesenchymal stromal cells in the injured adult rat spinal cord and impact on functional recovery. Surg. Neurol., v.70, p.600-607, 2008.). Há, ainda, relatos de melhora funcional constatada pelo teste BBB em ratos que receberam a associação da enzima condroitinase com a terapia celular (Zhang et al., 2013ZHANG, C.; HE, X.; LI, H. et al. Chondroitinase ABC plus bone marrow mesenchymal stem cells for repair of spinal cord injury. Neural Regen. Res., v.8, p.965-974, 2013.; Kanno et al., 2014KANNO, H.; PRESSMAN, Y.; MOODY, A. et al. Combination of engineered schwann cell grafts to secrete neurotrophin and chondroitinase promotes axonal regeneration and locomotion after spinal cord injury. J. Neurosci., v.34, p.1838-1855, 2014., Sarveazad et al., 2017), fato que não foi encontrado no presente trabalho.
A recuperação funcional, após traumas medulares experimentais, não apresenta resultados homogêneos na literatura consultada. Contudo, é difícil comparar os resultados entre os diferentes estudos, pois os traumas experimentais são diferentes, assim como os tratamentos, os períodos, as doses e as vias de aplicação. A recuperação motora é o resultado da combinação de regeneração, brotamento e alterações na plasticidade, assim, depende da interação adequada entre as vias remanescentes (Rossignol e Frigon, 2011ROSSIGNOL, S.; FRIGON A. Recovery of locomotion after spinal cord injury: some facts and mechanisms. Annu. Rev. Neurosci., v.34, p.413-440, 2011. ). Dessa forma, supunha-se que a ação dos fatores tróficos propiciaria neuroproteção com maior preservação dessas vias e ambiente mais propício à regeneração por maior aporte nutricional pela angiogênese. Adicionalmente, as células serviriam de apoio ao brotamento axonal, favorecendo a plasticidade com consequente recuperação funcional, fato que não foi constatado neste estudo. No entanto, percebe-se que uma importante consideração para o desenvolvimento de estratégias terapêuticas para atuar após o trauma medular é definir um protocolo ideal de administração da terapia (Hu et al., 2010HU, R.; ZHOU, J.; LOU, C. et al. Glial scar and neuroregeneration: histological, functional, and magnetic resonance imaging analysis in chronic spinal cord injury. J. Neurosurg. Spine, v.13, p.169-180, 2010.; Ahuja et al., 2016AHUJA, C.S.; MARTIN, A.R.; FEHLINGS, M. Recent advances in managing a spinal cord injury secondary to trauma. F1000 Res., v.5, 2016. Available in: <https://www.ncbi.nlm.nih.gov/pubmed/27303644>. Accessed in: 15 Sep. 2016.
https://www.ncbi.nlm.nih.gov/pubmed/2730...
).
A maior expressão de BDNF e VEGF no foco da lesão das medulas tratadas com CTM indica que as células-tronco foram eficientes para aumentar a secreção desses fatores, seja por meio de secreção direta, seja por efeito parácrino, induzindo a secreção no tecido hospedeiro (Osaka et al., 2010OSAKA, M.; HONMOU, O.; MURAKAMI, T. et al. Intravenous administration of mesenchymal stem cells derived from bone marrow after contusive spinal cord injury improves functional outcome. Brain Res., v.1343, p.226-235, 2010.). No caso do BDNF, o tratamento com condroitinase isolada ou em associação com as CTM também foi capaz de aumentar sua produção, porém de maneira menos eficiente do que as CTM isoladamente. O efeito neuroprotetor desses fatores neurotróficos está claramente associado ao benefício terapêutico da administração das células (Parr et al., 2008PARR, A.M.; KULBATSKI, I.; WANG, X.H. et al. Fate of transplanted adult neural stem/progenitor cells and bone marrow-derived mesenchymal stromal cells in the injured adult rat spinal cord and impact on functional recovery. Surg. Neurol., v.70, p.600-607, 2008.; Osaka et al., 2010). Entretanto, Wright et al. (2011WRIGHT, K.T.; MASRI, W.E.; OSMAN, A. et al. Concise review: bone marrow for the treatment of spinal cord injury: Mechanisms and clinical applications. Stem Cells, v.29, p.169-178, 2011.) relataram que essas neurotrofinas podem ter efeito limitado na medula espinhal lesionada diante das moléculas inibitórias presentes na cicatriz glial, ou seja, PGSC, glicoproteína associada a mielina (MAG) e Nogo-A. Nesse contexto, era esperado que a condroitinase, por inibir os PGSC, contribuísse para melhor ação das neurotrofinas, aumentadas pela ação das células-tronco, contudo esse fato não foi comprovado.
O maior número de neurônios viáveis encontrado na medula espinhal lesionada tratada com condroitinase associada às CTM sugere neuroproteção mais eficiente dessa associação em relação ao grupo placebo. O neuN é considerado um marcador específico e confiável e tem sido extensivamente utilizado para caracterizar os neurônios (Gill et al., 2005GILL, S.K.; ISHAK, M.; RYLETT, R.J. Exposure of nuclear antigens in formalin-fixed, paraffin-embedded necropsy human spinal cord tissue: detection of NeuN. J. Neurosci. Methods, v.148, p.26-35, 2005.; Han et al., 2012HAN, X.; YANG, N.; CUI, Y. et al. Simvastatin mobilizes bone marrow stromal cells migrating to injured areas and promotes functional recovery after spinal cord injury in the rat. Neurosci. Lett. v.521, p.136-141, 2012.). A maior preservação neuronal encontrada nesse grupo possivelmente foi mediada pela neuroproteção causada pelo BDNF, NT-3 ou VEGF, fato que pode ter ocorrido também no grupo CTM. Era esperado que, no grupo CDT+CTM, a condroitinase apresentasse efeito sinérgico com as CTM, o que melhoraria a cinética dessas células na lesão medular e tornaria o ambiente mais propício à ação das neurotrofinas e à regeneração axonal, favorecendo, assim, a vascularização e seus efeitos benéficos. Contudo, tal fato não foi verificado, pois esse grupo teve número de neurônios viáveis semelhante ao grupo tratado somente com as CTM, embora sem se diferir do placebo. Lim et al. (2011LIM, J.Y.; JEONG, C.H.; JUN, J.A. et al. Therapeutic effects of human umbilical cordblood-derived mesenchymal stem cells after intrathecal administration by lumbar puncture in a rat model of cerebral ischemia. Stem Cell Res. Ther., v.2, p.1-13, 2011.) encontraram maior imunomarcação de neuN no grupo de ratos com isquemia cerebral que recebeu CTM e atribuíram esse achado à migração e diferenciação das células injetadas, o que também pode ter contribuído para o resultado encontrado no grupo CDT+CTM, pois a transdiferenciação de células da medula óssea em células neuronais, embora controversa, é outro mecanismo proposto para explicar o efeito terapêutico das CTM (Osaka et al., 2010OSAKA, M.; HONMOU, O.; MURAKAMI, T. et al. Intravenous administration of mesenchymal stem cells derived from bone marrow after contusive spinal cord injury improves functional outcome. Brain Res., v.1343, p.226-235, 2010.; Uccelli et al., 2011UCCELLI, A.; BENVENUTO, F.; LARONI, A. et al. Neuroprotective features of mesenchymal stem cells. Best. Pract. Res. Clin. Haematol., v.24, p.59-64, 2011.).
Na análise imunoistoquímica da GFAP, os grupos CDT e CTM apresentaram resultados semelhantes ao CN, sem, entretanto, diferirem-se do placebo. Quanto à vimentina, os grupos com trauma apresentaram imunomarcação superior ao CN, como esperado, visto que, diante das agressões ao sistema nervoso, ocorre reação astrocitária (Luna et al., 2010LUNA, G.; LEWIS, G.P.; BANNA, C.D. et al. Expression profiles of nestin and synemin in reactive astrocytes and Müller cells following retinal injury: a comparison with glial fibrillar acidic protein and vimentin. Mol. Vis., v.16, p.2511-2523, 2010.).
Entre os grupos com trauma, o tratado com condroitinase apresentou menor expressão de vimentina, sendo o único a se diferenciar significativamente do grupo placebo. A cicatriz glial envolve principalmente astrócitos que são ativados na tentativa de limitar a extensão da lesão (Rolls et al., 2008ROLLS, A.; SHECHTER, R.; LONDON, A. et al. Two faces of chondroitin sulfate proteoglycan in spinal cord repair: A role in microglia/macrophage activation. Plos Med., v.5, p.1262-1277, 2008. ) e restaurar a barreira hematoencefálica (Wright et al., 2011WRIGHT, K.T.; MASRI, W.E.; OSMAN, A. et al. Concise review: bone marrow for the treatment of spinal cord injury: Mechanisms and clinical applications. Stem Cells, v.29, p.169-178, 2011.). Essas células são os principais componentes da cicatriz glial e expressam GFAP e vimentina. Dessa forma, a menor imunomarcação da vimentina neste grupo é indicativo da ação dessa enzima na redução da cicatriz glial.
Apesar de a capacidade motora não ter apresentado diferença significativa entre os grupos tratados e em comparação ao grupo não tratado, ao longo dos 28 dias pós- cirurgia, foram observadas alterações significativas no que concerne à expressão de fatores angiogênicos como o VEGF e de fatores neurotrópicos e de filamentos da cicatriz glial nos grupos tratados. O tratamento com condroitinase ABC reduziu a cicatriz glial pela menor expressão de vimentina, ao passo que o tratamento com CTM foi mais eficiente para promover aumento na expressão dos fatores tróficos BDNF e VEGF, que ocasionam neuroproteção. Mas somente na associação da condroitinase com CTM houve significativo aumento do número de neurônios viáveis na lesão.
A ausência de correlação entre a recuperação locomotora e os demais achados, possivelmente, pode ser atribuída a algum dos seguintes fatores: gravidade da lesão medular experimental, tempo de avaliação ou mesmo protocolo terapêutico não adequado para promover melhora na deambulação. Tem sido postulado que a neuroproteção pode ocorrer como resultado da produção de fatores de crescimento pelas células transplantadas (Parr et al., 2008PARR, A.M.; KULBATSKI, I.; WANG, X.H. et al. Fate of transplanted adult neural stem/progenitor cells and bone marrow-derived mesenchymal stromal cells in the injured adult rat spinal cord and impact on functional recovery. Surg. Neurol., v.70, p.600-607, 2008.). Contudo, assim como ocorreu com Parr et al. (2008), é possível que a lesão causada à medula espinhal nesse experimento tenha sido tão acentuada que impediu a ocorrência de neuroproteção significativa e que o tempo avaliado tenha sido insuficiente para perceber os possíveis efeitos benéficos na plasticidade, remielinização e regeneração neuronais. Estudos que relataram recuperação funcional com o transplante de CTM da medula óssea e a observaram precocemente, duas ou três semanas após a lesão, sugeriram a ocorrência de neuroproteção mais relevante do que ação regenerativa. Hofstetter et al. (2002HOFSTETTER, C.P.; SCHWARZ, E.J.; HESS, D. et al. Marrow stromal cells form guiding strands in the injured spinal cord and promote recovery. Proc. Natl. Acad. Sci. U.S.A., v.99, p.2199-2204, 2002.), Lee et al. (2007LEE, K.H.; SUH-KIM, H.; CHOI, J.S. et al. Human mesenchymal stem cell transplantation promotes functional recovery following acute spinal cord injury in rats. Acta Neurobiol. Exp., v.67, p.13-22, 2007.) e Kamada et al. (2011KAMADA, T.; KODA, M.; DEZAWA, M. et al. Transplantation of human bone marrow stromal cell-derived Schwann cells reduces cystic cavity and promotes functional recovery after contusion injury of adult rat spinal cord. Neuropathology, v.31, p.48-58, 2011.) só conseguiram obter escores do BBB mais altos nos grupos tratados com células-tronco nas avaliações após cinco ou mais semanas do trauma.
CONCLUSÕES
Conclui-se que, na lesão traumática aguda da medula espinhal, o tratamento com células-tronco mesenquimais, como terapia única, é mais promissor para promover aumento na expressão dos fatores tróficos BDNF e VEGF, ambos com funções neuroprotetoras; que o tratamento com condroitinase, como terapia única, aumenta a expressão da neurotrofina BDNF e reduz a expressão de vimentina em relação ao placebo, gerando neuroproteção e redução da cicatriz glial; que o tratamento com CTM associadas à condroitinase aumenta a viabilidade neuronal no foco da lesão e, por fim, que, em relação ao grupo placebo, nenhum tratamento resultou em melhora da capacidade motora até os 28 dias de observação após o trauma.
AGRADECIMENTOS
Agradecimentos a Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) e ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pelo auxílio financeiro do projeto.
REFERÊNCIAS
- AHUJA, C.S.; MARTIN, A.R.; FEHLINGS, M. Recent advances in managing a spinal cord injury secondary to trauma. F1000 Res., v.5, 2016. Available in: <https://www.ncbi.nlm.nih.gov/pubmed/27303644>. Accessed in: 15 Sep. 2016.
» https://www.ncbi.nlm.nih.gov/pubmed/27303644 - ALLUIN, O.; DELIVET-MONGRAIN, H.; GAUTHIER, M.K. et al. Examination of the combined effects of chondroitinase ABC, growth factors and locomotor training following compressive spinal cord injury on neuroanatomical plasticity and kinematics. Plos One, v.9, 2014. Available in: <https://www.ncbi.nlm.nih.gov/pubmed/25350665>. Accessed in: 22 Aug. 2016.
» https://www.ncbi.nlm.nih.gov/pubmed/25350665 - BASSO, M.; BEATTIE, M.S.; BRESNAHAN, J.C.A sensitive and reliable locomotor rating scale for open field testing in rats. J. Neurotrauma, v.12, p.1-21, 1995.
- CASTANHEIRA, P.; TORQUETTI, L.T.; MAGALHÃES, D.R.S. et al. DAPI diffusion after intravitreal injection of mesenchymal stem cells in the injured retina of rats. Cell Transplant., v.18, p.1-100, 2009.
- GARCIA-ALÍAS, G.; LIN, R.; AKRIMI, S.F. et al. Therapeutic time window for the application of chondroitinase ABC after spinal cord injury. Exp. Neurol., v.210, p.331-338, 2008.
- GILL, S.K.; ISHAK, M.; RYLETT, R.J. Exposure of nuclear antigens in formalin-fixed, paraffin-embedded necropsy human spinal cord tissue: detection of NeuN. J. Neurosci. Methods, v.148, p.26-35, 2005.
- GRILL, R.J. User-defined variables that affect outcome in spinal cord contusion/compression models. Exp. Neurol., v.196, p.1-5, 2005.
- HAN, X.; YANG, N.; CUI, Y. et al. Simvastatin mobilizes bone marrow stromal cells migrating to injured areas and promotes functional recovery after spinal cord injury in the rat. Neurosci. Lett. v.521, p.136-141, 2012.
- HOFSTETTER, C.P.; SCHWARZ, E.J.; HESS, D. et al. Marrow stromal cells form guiding strands in the injured spinal cord and promote recovery. Proc. Natl. Acad. Sci. U.S.A., v.99, p.2199-2204, 2002.
- HU, R.; ZHOU, J.; LOU, C. et al. Glial scar and neuroregeneration: histological, functional, and magnetic resonance imaging analysis in chronic spinal cord injury. J. Neurosurg. Spine, v.13, p.169-180, 2010.
- IKEGAMI, T.; NAKAMURA, M.; YAMANE, J. et al. Chondroitinase ABC combined with neural stem/progenitor cell transplantation enhances graft cell migration and outgrowth of growth-associated protein-43-positive fibers after rat spinal cord injury. Eur. J. Neurosci., v.22, p.3036-3046, 2005.
- ISEDA, T.; OKUDA, T.; KANE-GOLDSMITH, N. et al. Single, high-dose intraspinal injection of chondroitinase reduces glycosaminoglycans in injured spinal cord and promotes corticospinal axonal regrowth after hemisection but not contusion. J. Neurotrauma, v.25, p.334-349, 2008.
- KAMADA, T.; KODA, M.; DEZAWA, M. et al. Transplantation of human bone marrow stromal cell-derived Schwann cells reduces cystic cavity and promotes functional recovery after contusion injury of adult rat spinal cord. Neuropathology, v.31, p.48-58, 2011.
- KANNO, H.; PRESSMAN, Y.; MOODY, A. et al. Combination of engineered schwann cell grafts to secrete neurotrophin and chondroitinase promotes axonal regeneration and locomotion after spinal cord injury. J. Neurosci., v.34, p.1838-1855, 2014.
- KUNDI, S.; BICKNELL, R.; AHMED, Z. The role of angiogenic and wound-healing factors after spinal cord injury in mammals. Neurosci. Res., v.76, p.1-9, 2013.
- LEE, K.H.; SUH-KIM, H.; CHOI, J.S. et al. Human mesenchymal stem cell transplantation promotes functional recovery following acute spinal cord injury in rats. Acta Neurobiol. Exp., v.67, p.13-22, 2007.
- LIM, J.Y.; JEONG, C.H.; JUN, J.A. et al. Therapeutic effects of human umbilical cordblood-derived mesenchymal stem cells after intrathecal administration by lumbar puncture in a rat model of cerebral ischemia. Stem Cell Res. Ther., v.2, p.1-13, 2011.
- LIN, R.; ROSAHL, T.W.; WHITING, P.J. et al. 6-sulphated chondroitins have a positive influence on axonal regeneration. Plos One, v.6, p.1-10, 2011.
- LU, P.; JONES, L.L.; TUSZYNSKI, M.H. BDNF-expressing marrow stromal cells support extensive axonal growth at sites of spinal cord injury. Exp. Neurol., v.191, p.344-360, 2005.
- LUNA, G.; LEWIS, G.P.; BANNA, C.D. et al. Expression profiles of nestin and synemin in reactive astrocytes and Müller cells following retinal injury: a comparison with glial fibrillar acidic protein and vimentin. Mol. Vis., v.16, p.2511-2523, 2010.
- MILBRETA, U.; BOXBERG, Y.V.; MAILLY, P. et al. Astrocytic and vascular remodeling in the injured adult rat spinal cord after chondroitinase ABC treatment. J. Neurotrauma, v.31, p.803-818, 2014.
- NG, M.T.L.; STAMMERS, A.T.; KWON, B.K. Vascular disruption and the role of angiogenic proteins after spinal cord injury. Transl. Stroke Res., v.2, p.474-491, 2011.
- OSAKA, M.; HONMOU, O.; MURAKAMI, T. et al. Intravenous administration of mesenchymal stem cells derived from bone marrow after contusive spinal cord injury improves functional outcome. Brain Res., v.1343, p.226-235, 2010.
- PARR, A.M.; KULBATSKI, I.; WANG, X.H. et al. Fate of transplanted adult neural stem/progenitor cells and bone marrow-derived mesenchymal stromal cells in the injured adult rat spinal cord and impact on functional recovery. Surg. Neurol., v.70, p.600-607, 2008.
- ROLLS, A.; SHECHTER, R.; LONDON, A. et al. Two faces of chondroitin sulfate proteoglycan in spinal cord repair: A role in microglia/macrophage activation. Plos Med., v.5, p.1262-1277, 2008.
- ROSSIGNOL, S.; FRIGON A. Recovery of locomotion after spinal cord injury: some facts and mechanisms. Annu. Rev. Neurosci., v.34, p.413-440, 2011.
- RYU, H.H.; LIM, J.H.; BYEON, Y.E. et al. Functional recovery and neural differentiation after transplantation of allogenic adipose-derived stem cells in a canine model of acute spinal cord injury. J. Vet. Sci., v.10, p.273-284, 2009.
- SARVEAZAD, A.; BABAHAJIAN, A.; BAKHTIARI, M. et al. The combined application of human adipose derived stem cells and Chondroitinase ABC in treatment of a spinal cord injury model. Neuropeptides, v.61, p.39-47, 2017.
- SARVEAZAD, A.; BAKHTIARI, M.; BABAHAJIAN, A. et al. Comparison of human adipose-derived stem cells and chondroitinase ABC transplantation on locomotor recovery in the contusion model of spinal cord injury in rats. Iran J. Basic Med. Sci., v.17, p.685-693, 2014.
- SHINOZAKIA, M.; IWANAMIB, A.; FUJIYOSHIB, K. et al. Combined treatment with chondroitinase ABC and treadmill rehabilitation for chronic severe spinal cord injury in adult rats. Neurosci. Res., v.113, p.37-47, 2016.
- TOM, V.J.; HOULÉ, J.D. Intraspinal microinjection of chondroitinase ABC following injury promotes axonal regeneration out of a peripheral nerve graft bridge. Exp. Neurol., v.211, p.315-319, 2008.
- TOM, V.J.; KADAKIA, R.; SANTI, L. et al. Administration of chondroitinase ABC rostral or caudal to spinal cord injury site promotes anatomical but not functional plasticity. J. Neurotrauma, v.26, p.2323-2333, 2009.
- TORRES, B.B.J.; SILVA, C.M.O.; ALMEIDA, F.M.C. et al. Modelo experimental de trauma medular agudo produzido por aparelho estereotáxico modificado. Arq. Bras. Med. Vet. Zootec., v.62, p.92-99, 2010.
- TROPEL, P.; NOËL, D.; PLATEL, N. et al. Isolation and characterisation of mesenchymal stem cells from adult mouse bone marrow. Exp. Cell Res., v.295, p.395-406, 2004.
- UCCELLI, A.; BENVENUTO, F.; LARONI, A. et al. Neuroprotective features of mesenchymal stem cells. Best. Pract. Res. Clin. Haematol., v.24, p.59-64, 2011.
- WRIGHT, K.T.; MASRI, W.E.; OSMAN, A. et al. Concise review: bone marrow for the treatment of spinal cord injury: Mechanisms and clinical applications. Stem Cells, v.29, p.169-178, 2011.
- WU, D.; KLAW, M.C.; KHOLODILOV, N. et al. Expressing constitutively active rheb in adult dorsal root ganglion neurons enhances the integration of sensory axons that regenerate across a chondroitinase-treated dorsal root entry zone following dorsal root crush. Front. Mol. Neurosci., v.9, 2016. Available in: <https://www.ncbi.nlm.nih.gov/pubmed/27458339>. Accessed in: 22 Aug. 2016.
» https://www.ncbi.nlm.nih.gov/pubmed/27458339 - YUAN, J.S.; REED, A.; CHEN, F. et al. Statistical analysis of real-time PCR data. B.M.C. Bioinformatics, v.7, 2006. Available in: <http://www.biomedcentral.com/1471-2105/7/85>. Accessed in: 16 Feb. 2012.
» http://www.biomedcentral.com/1471-2105/7/85 - ZHANG, C.; HE, X.; LI, H. et al. Chondroitinase ABC plus bone marrow mesenchymal stem cells for repair of spinal cord injury. Neural Regen. Res., v.8, p.965-974, 2013.
- ZHAO, R.R.; FAWCETT, J. Combination treatment with chondroitinase ABC in spinal cord injury-breaking the barrier. Neurosci. Bull., v.29, p.477-483, 2013.
Datas de Publicação
-
Publicação nesta coleção
May-Jun 2018
Histórico
-
Recebido
16 Out 2016 -
Aceito
20 Abr 2017