RESUMO
A avaliação proteica do humor aquoso (HA) pode ser utilizada como método diagnóstico nas uveítes. Entretanto, estudos sobre as proteínas nesse fluido, em equinos hígidos, são escassos e apresentam variações conforme a metodologia empregada. Dessa forma, objetivou-se realizar a análise proteica e citológica do HA nessa espécie, bem como verificar sua correlação com as proteínas plasmáticas. Foram avaliados 13 equinos adultos (26 olhos), sem raça definida, machos ou fêmeas. Mediante aqueocentese, foi coletado 0,5 mL de humor aquoso de cada olho. Cada amostra foi encaminhada para quantificação proteica pelo método de Bradford modificado e pela eletroforese em gel de poliacrilamida - dodecil sulfato de sódio (SDS-PAGE), bem como para avaliação citológica. Por meio de venopunção, coletou-se sangue para determinação da concentração de proteínas séricas. Treze olhos (50% das amostras) apresentaram valor proteico médio de 40,3 mg/dL±6,45 e a eletroforese demonstrou presença de proteínas de massas mais elevadas que 43 KDa. Houve ausência de células em 96,15% das amostras (25 olhos). Equinos hígidos apresentaram baixa concentração de proteínas no HA. Já a correlação entre proteína no humor aquoso/proteína plasmática total foi de 0,56%.
Palavras-chave:
aqueocentese; citologia; proteínas; cavalo
ABSTRACT
Evaluation of equine aqueous humor (AH) proteins can help the diagnosis of uveitis. However, studies on proteins in this fluid in healthy horses are scarce and present variations according to the methodology employed. This study aimed to perform protein analysis and cytology of equine aqueous humor of healthy horses and verify its correlation with plasmatic proteins. Thirteen adult horses (26 eyes), mixed breed, male or female were evaluated. A volume of 0.5 mL of aqueous humor was collected through aqueocentesis from both eyes. The samples were submitted to protein quantification by modified Bradford method and to sodium dodecyl sulphate - polyacrylamide gel electrophoresis (SDS-PAGE), and to cytological evaluation. Blood was collected for determination of plasmatic protein concentration. Thirteen eyes (50% of the samples) had values larger than zero by the Bradford method, with an average of 40.3 mg/dl±6.45. Electrophoresis showed presence of higher masses of proteins (43 KDa). There were no cells in 96.15% of the samples (25 eyes). Healthy equines presented low protein concentration in the HA. The ratio between protein concentration in the aqueous humor / total plasma protein of 0.56%.
Keywords:
aqueous humor; proteins; horse
INTRODUÇÃO
O HA é o fluido incolor que preenche o segmento anterior do bulbo do olho, responsável pelo suporte trófico e pela remoção de metabólitos da córnea e da lente, uma vez que ambas são avasculares. Por se tratar de um meio transparente, esse fluido também proporciona um índice de refração apropriado entre a córnea e a lente (Goel et al., 2010GOEL, M.; RENATA G.P.; LEE, R.K. et al. Aqueous humor dynamics: a review. Open Ophthalmol. J., v.4, p.52-59, 2010.; Gabelt e Kaufman, 2011GABELT, B.T.; KAUFMAN, P.L. Production and flow of aqueous humor. In: LEVIN, L.A.; NILSSON, S.F.E.; VER HOEVE, J.; WU, S.M. (Eds.). Adler’s physiology of the eye. 11.ed. Edinburgh: Elsevier, 2011. p.274-307.; Gilger e Stoppini, 2011GILGER, B.C.; STOPPINI, R. Equine ocular examination: routine and advanced diagnostic techniques. In: GILGER, B.C. (Ed.). Equine ophthalmology. 2.ed. St. Louis: Elsevier Saunders, 2011. p.1-36.).
O HA é formado a partir do sangue por três mecanismos: difusão, ultrafiltração e secreção ativa pelo epitélio do corpo ciliar (Gum e Mackay, 2013GUM, G.G.; MACKAY, E.O. Physiology of the eye. In: GELATT, K.N. (Ed.). Veterinary ophthalmology. 5ed. Philadelphia: Blackwell Publishers, 2013. p.183-192.). Sua baixa viscosidade decorre principalmente da grande quantidade de água (99,6%) e do baixo teor proteico (Goel et al., 2010GOEL, M.; RENATA G.P.; LEE, R.K. et al. Aqueous humor dynamics: a review. Open Ophthalmol. J., v.4, p.52-59, 2010.; Gabelt e Kaufman, 2011GABELT, B.T.; KAUFMAN, P.L. Production and flow of aqueous humor. In: LEVIN, L.A.; NILSSON, S.F.E.; VER HOEVE, J.; WU, S.M. (Eds.). Adler’s physiology of the eye. 11.ed. Edinburgh: Elsevier, 2011. p.274-307.). A drenagem pela via uveoescleral depende da espécie e considera-se que tenha maior importância em equinos, já que, nos cães e nos seres humanos, a drenagem é realizada principalmente por meio do ângulo iridocorneal (Van der Woerdt et al., 1995).
A composição bioquímica do HA tem sido alvo de diversos estudos (Millar et al., 2006MILLAR, J.C.; GABELT, B.T.; KAUFMAN, P.L. Aqueous humor dynamics. In: TASMAN, W. (Ed.). Duane’s clinical ophthalmology. Philadelphia: Lippincott Williams & Wilkins, 2006. CD Rom.; Goel et al., 2010GOEL, M.; RENATA G.P.; LEE, R.K. et al. Aqueous humor dynamics: a review. Open Ophthalmol. J., v.4, p.52-59, 2010.; Gabelt e Kaufman, 2011GABELT, B.T.; KAUFMAN, P.L. Production and flow of aqueous humor. In: LEVIN, L.A.; NILSSON, S.F.E.; VER HOEVE, J.; WU, S.M. (Eds.). Adler’s physiology of the eye. 11.ed. Edinburgh: Elsevier, 2011. p.274-307.; Gum e Mackay, 2013GUM, G.G.; MACKAY, E.O. Physiology of the eye. In: GELATT, K.N. (Ed.). Veterinary ophthalmology. 5ed. Philadelphia: Blackwell Publishers, 2013. p.183-192.). Por ser o humor aquoso um ultrafiltrado do plasma, sua composição assemelha-se a ele, com algumas exceções notáveis, como baixa concentração proteica, quantidades reduzidas de glicose, ureia e nitrogênio não proteico e elevada concentração de ascorbato e lactato (Gabelt e Kaufman, 2011; Gilger e Deeg, 2011GILGER, B.C.; STOPPINI, R. Equine ocular examination: routine and advanced diagnostic techniques. In: GILGER, B.C. (Ed.). Equine ophthalmology. 2.ed. St. Louis: Elsevier Saunders, 2011. p.1-36.).
O aumento de proteínas e de células no HA pode ser desencadeado pela desestabilização da barreira hematoaquosa (BHA), considerada reversível, se mediada por receptores, ou irreversível, quando secundária a alterações anatômicas. Pode decorrer de uveítes, intervenções cirúrgicas ou paracentese, por exemplo (Albaugh et al., 2011ALBAUGH, R.A.; ROUSH, J.K.; RANKIN, A.J. et al. Fluorophotometric and tonometric evaluation of ocular effects following aqueocentesis performed with needles of various sizes in dogs. Am. J. Vet. Res., v.72, p.556-561, 2011.). O insulto traumático estimula a contração das células endoteliais do corpo ciliar, o que induz ao extravasamento de proteínas do leito vascular (Khrone et al., 1995). O estudo do HA de equinos pode ser adjutório ao diagnóstico e pode auxiliar em tratamentos precoces (Gilger, 2013GILGER, B. Equine ophthalmology. In: GELATT, K.N. Veterinary ophthalmology. 5ed. Philadelphia: Blackwell Publishers, 2013. p.1560-1609.; Linn-Pearl et al., 2014), a exemplo da uveíte recorrente equina (Gilger e Deeg, 2011).
Amostras do HA são adquiridas por meio da aqueocentese e podem ser encaminhadas para exames distintos, como citologia, sorologia, quantificação proteica, cultura bacteriana, titulação de anticorpos e PCR (Gilger e Deeg, 2011GILGER, B.C.; STOPPINI, R. Equine ocular examination: routine and advanced diagnostic techniques. In: GILGER, B.C. (Ed.). Equine ophthalmology. 2.ed. St. Louis: Elsevier Saunders, 2011. p.1-36.). A citologia do humor aquoso é auxiliar ao diagnóstico de infecções ou de processos neoplásicos e consiste na contagem de células totais, seguida pela sedimentação do fluido para realização do esfregaço ou preparação com fixador próprio (Young, 2007YOUNG, K.M. Ocular cytology: basic and advanced cães - 2 part. CONGRESSO INTERNAZIONALE MULTISALA, 56., 2007, Florence. Annali... Florence, Italy: SCIVAC, 2007.). Já os métodos de Bradford e a eletroforese em gel são empregados para a quantificação proteica (Bradford, 1976BRADFORD, M.M. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem., v.72, p.248-254, 1976.; Bollag et al., 1996BOLLAG, D.M.; ROZYCKI, M.D.; EDELSTEIN, S.J. Gel electrophoresis under non denaturing conditions. In: BOLLAG, D.M.; ROZYCKI, M.D.; EDELSTEIN, S.J. (Eds.). Protein methods. 2.ed. New York: John Wiley & Sons,1996. p.155-172.; Grus et al., 2007GRUS, F.H.; JOACHIM, S.C.; PFEIFFER, N. Proteomics in ocular fluids. Proteomics Clin. Appl., v.1, p.876-888, 2007.).
Embora haja descrição da concentração proteica do HA de equinos hígidos (Hazel et al., 1985HAZEL, S.J.; THRALL, M.A.; SEVERIN, G.A. et al. Laboratory evaluation of aqueous humor in the healthy dog, cat, horse, and cow. Am. J. Vet. Res., v.46, p.657-659, 1985.; Gum e Mackay, 2013GUM, G.G.; MACKAY, E.O. Physiology of the eye. In: GELATT, K.N. (Ed.). Veterinary ophthalmology. 5ed. Philadelphia: Blackwell Publishers, 2013. p.183-192.), verifica-se a escassez da padronização metodológica, o que dificulta a interpretação dos resultados. Dessa forma, objetivou-se mensurar a concentração das proteínas do humor aquoso de cavalos saudáveis e correlacioná-la com a concentração de proteínas plasmáticas. Ainda, pretendeu-se avaliar a citologia desse fluido.
MATERIAL E MÉTODOS
Esta pesquisa foi submetida e aprovada pelo Comitê de Ética no Uso Animal (protocolo nº 50973/2010). Foram incluídos, neste estudo, 13 equinos adultos (26 olhos), sete machos castrados e seis fêmeas, sem raça definida e com massa corpórea entre 356 e 515 kg (447,8±47,9 kg), provenientes do Hospital Veterinário. Os animais foram submetidos à avaliação clínica rotineira e coleta de sangue venoso para exames laboratoriais, para confirmação do estado de higidez. Dez mililitros de sangue foram obtidos da veia jugular, sendo a amostra dividida em dois tubos, um com anticoagulante para o hemograma, análise de fibrinogênio e proteína plasmática total por densitometria, e outro sem anticoagulante, do qual se extraiu o soro para as análises bioquímicas de albumina, proteína total, creatinina, ureia, aspartato aminotransferase e gamaglutamiltransferase.
Seguiu-se semiotécnica oftálmica para que se descartassem alterações oculares, mediante avaliação dos reflexos pupilares, biomicroscopia com lâmpada em fenda (SL-15®, Kowa, Califórnia, EUA), teste da lágrima de Schirmer (Teste de Schirmer®, Ophthalmos - São Paulo, SP), oftalmoscopia binocular indireta (Oftalmoscópio binocular indiretoEytec, São Paulo, Brasil), prova da fluoresceína (Fluoresceína Strips ®, Ophthalmos - São Paulo, SP) e tonometria de aplanação (Tono Pen® XL, Medtronic, Flórida, EUA).
Os animais foram submetidos à contenção física em brete, seguida por sedação com xilazina 10% (Sedomin®, Laboratórios König S.A., Avellaneda, Argentina), na dose de 1,0 mg/kg, por via intravenosa. O nervo auriculopalpebral foi bloqueado bilateralmente, com o uso de 10mL de cloridrato de lidocaína a 2% sem vasoconstritor (Xylestesin®, Cristal Pharma Ltda., Minas Gerais, Brasil), conforme descrito por Muir e Hubbell (2009MUIR, W.W.; HUBBELL, J.A.E. Equine anesthesia: monitoring and emergency therapy. 2.ed. [Rio de Janeiro]: Saunders, 2009. 478p.). Após a constatação da acinesia palpebral, realizou-se antissepsia ocular com solução de polivinil pirrolidona iodo a 1%, seguida da anestesia tópica com cloridrato de proximetacaína 0,5% (Anestalcon®, Alcon Laboratórios do Brasil Ltda., São Paulo - SP, Brasil). Ato contínuo, executou-se a aqueocentese em região próxima ao limbo e paralela ao plano da íris, com a utilização de agulha hipodérmica 13x4,5 acoplada a uma seringa de 1 mL (Galera et al., 2009GALERA, P.D.; LAUS, J.L.; SOARES, A.M.B. et al. Avaliação dos efeitos da flunixina meglumina, por via subconjuntival, sobre a concentração e padrão proteico do humor aquoso de cães submetidos à paracentese da câmara anterior. Ciênc. Anim. Bras. v.4, p.1310-1316, 2009.). Foi coletado 0,5 mL de HA de cada olho, sendo 0,25 mL encaminhado para imediata análise citológica e o remanescente armazenado em microtubos de polipropileno (Eppendorf), sob refrigeração de -20°C, por até três dias, para a posterior mensuração proteica.
Após o procedimento, foram instiladas duas gotas de sulfato de atropina 1% (Atropina® colírio, 5 mL, Allergan Laboratórios do Brasil Ltda.), a cada oito horas, e duas gotas de colírio de tobramicina 0,3% (Tobrex® colírio, 5mL, Alcon Laboratórios do Brasil Ltda.), a cada seis horas, por três dias consecutivos. Os animais foram observados durante sete dias consecutivos, e não foram observadas alterações oculares.
O HA foi centrifugado e colocado sobre lâmina de microscopia, para a preparação do esfregaço. Após, realizou-se coloração com panótico (Instant Porv®), de acordo com as recomendações do fabricante. As lâminas foram examinadas, posteriormente à secagem, com a utilização de óleo de imersão no aumento de 100x.
A análise proteica do HA foi realizada pelo método de Bradford (Bradford, 1976BRADFORD, M.M. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem., v.72, p.248-254, 1976.) modificado, com a utilização do comprimento de onda de 595 nm. A concentração de proteínas foi estabelecida de acordo com a absorbância da amostra e sua posterior substituição na equação da curva padrão. Para a preparação da solução reagente de Bradford, utilizou-se álcool etílico (95%), ácido fosfórico (85%) e Commassie blue G250. Foram dissolvidos 350 mg de Comassie G250 em 100 mL de etanol 95% e adicionaram-se 200 mL de ácido fosfórico 88%, formando-se, assim, a solução de estoque, que foi armazenada no escuro. A solução de trabalho foi formada com 42,5 mL de água milli-Q, 1,5 mL de etanol 95%, 3 mL de ácido fosfórico 88% e 3 mL da solução de estoque. A BSA (albumina sérica bovina) foi utilizada na concentração de 2 mg/mL, e o HCl (ácido clorídrico) a 0,1 M.
Pipetaram-se 3, 5, 10, 15, 20 e 25 µL de BSA, com acréscimo de, respectivamente: 87, 85, 80, 75, 70 e 65 µL de água Milli-Q e 10 µL de HCl em Eppendorfs, de forma a se obterem as concentrações finais de 0,06, 0,1, 0,2, 0,3, 0,4 e 0,5 µg/µL. A solução do branco foi composta por 90 µL de água Milli-Q e 10 µL de HCl. A solução das amostras de HA foi composta por 10 µL de cada amostra, 30 µL de água Milli-Q e 10 µL de HCl. As amostras foram previamente descongeladas e centrifugadas a 14.000 rpm, durante 10 minutos.
Em seguida, retirou-se uma alíquota de 10µL de cada Eppendorf, que foi transferida para a placa, sendo depositada em seu poço correspondente. A cada poço, foram adicionados 300µL do reagente de Bradford previamente preparado. Decorridos 15 minutos de incubação no escuro, seguiu-se leitura em espectrofotômetro utilizando-se absorvância de 595 nm. Com base nos valores de absorvância mensurados em triplicata (Bradford, 1976), confeccionou-se um gráfico de dispersão de concentração versus absorvância, no programa Excel®(2013), obtendo-se um valor de equação da reta para as medidas referentes à BSA, que foi utilizada para quantificação das proteínas totais de humor aquoso. A concentração de proteínas plasmáticas totais (PT) (g/dL) foi determinada com auxílio de um refratômetro.
Para a utilização dos géis de poliacrilamida - dodecil sulfato de sódio (SDS-PAGE), preparados a 12%, aplicou-se o sistema de placas Hoefer SE 600 series electrophoresis unit (Pharmacia Biotech), o qual foi imerso em tampão TRIS-Glicina pH 8.8, a uma temperatura de 19oC controlada pelo aparelho de refrigeração Multitemp II Cooling Bath (Amersham Biosciences), e submetido a uma fonte elétrica com corrente constante de 20 mA e voltagem máxima de 300 V.
As amostras foram centrifugadas durante 10 minutos a 14.000 rpm. Utilizaram-se 30 µL de cada amostra, ressuspendidos em 30 µL de solução tampão (Tris-HCl 125 mmol; azul de bromofenol 0,01%; sacarose 20%; SDS 4,0% e DTT 100 mmol), e as amostras foram, então, aquecidas durante 10 minutos a 94 ºC. Posteriormente, elas foram aplicadas nos poços do gel, em um pente de 20 poços com capacidade de 100 µL cada. Os géis foram corados com prata de alta sensibilidade, como descrito em Teles et al. (2012TELES, L.M.; AQUINO, E.N.; NEVES, A.C. et al. Comparison of the neutrophil proteome in trauma patients and normal controls. Protein Pept Lett., v.19, p.663-672, 2012. ). Resumidamente, os géis foram submetidos a etapas de fixação com ácido tricloroacético 12% e metanol 50% por uma hora; uma segunda fixação foi realizada após uma hora, por incubação com ácido acético 5% e etanol 50%. O gel foi lavado com água Milli-Q por cinco minutos, em dois ciclos.
Seguiu-se incubação do gel com a solução de coloração de prata por 20 minutos, lavagem com água Milli-Q. Ato contínuo, procedeu-se à revelação da prata com uma solução de revelação contendo 0,017% de ácido cítrico e 0,236% de formaldeído. Em seguida, o gel foi imerso na solução de parada da revelação (30% de etanol, 7% de ácido acético e 2,5% de glicerol 87%), onde permaneceu por 20 minutos, e, para finalizar a coloração, adicionou-se sobre o gel a solução de hidratação com 28.5% de etanol e 2,175% de glicerol.
Os géis foram digitalizados com o scanner Image scan UMAX GE, cujas imagens geradas foram armazenadas em modo TIFF em tons de cinza e modo JPG colorida. As imagens do formato TIFF foram encaminhadas para o software ImageJ (Schneider et al., 2012SCHNEIDER, C.A.; RASBAND, W.S.; ELICEIRI, K.W. NIH Image to imageJ: 25 years of image analysis. Nat. Methods, v.9, p.671-675, 2012.), versão 1.50i, e foram submetidas à análise por densitometria, de forma a se medir a densidade óptica relativa, considerando-se todas as bandas presentes em cada poço de forma aditiva. A densidade óptica de cada poço foi normalizada em relação ao maior valor obtido.
Os valores de concentração de proteínas obtidos pelo teste de Bradford foram tabulados, avaliados quanto à normalidade (teste de Kolmogorov-Smirnov) e quanto à correlação entre os valores de proteínas plasmáticas e proteínas do HA, calculando-se a correlação de Pearson. O intervalo de confiança adotado foi de 95%, baseado na transformação de Fisher. As amostras também foram avaliadas quanto a diferenças entre os olhos direito e esquerdo (teste t de Student de duas caudas, pareado) e entre os grupos macho e fêmea (teste t de Student para amostras independentes de igual variância).
RESULTADOS
Ao exame citológico, verificou-se ausência de células em 96,15% das amostras (25 olhos) de HA, e em um olho (3,95%) observou-se a presença de um melanócito repleto de grânulos de melanina.
Das 26 amostras de humor aquoso quantificadas pelo método de Bradford modificado, apenas 13 amostras (50%) tiveram valores diferentes de zero. Nessas amostras, o valor proteico médio obtido foi de 40,3±6,45mg/dL (min: 32,43mg/dL; máx: 52,0mg/dL), sendo as médias de 39,05mg/dL±5,32 e 41,37mg/dL±7,52 para olhos direito e esquerdo, respectivamente.
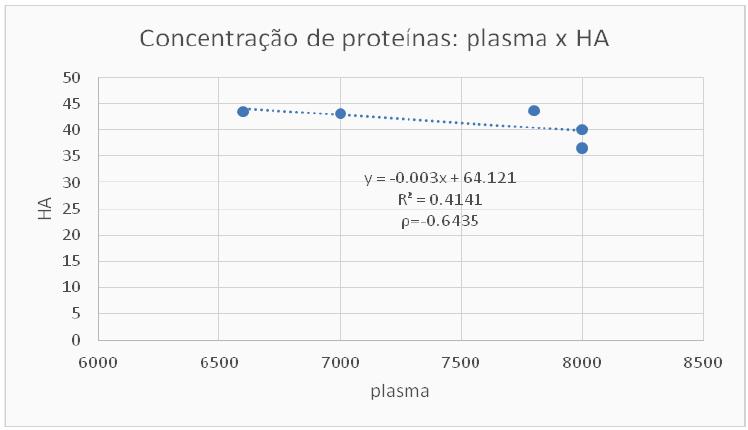
Observou-se ainda, dentre as amostras que tiveram valores proteicos diferentes de zero, a razão de 0,56% entre os valores médios de proteína no humor aquoso (HA)/proteína plasmática total (PPT), observando-se distribuição normal dos valores e correlação de Pearson negativa moderada (ρ=-0.64, R2 linear=0.41, 95% CI -0.97 a 0.55) (Mukaka, 2012MUKAKA, M.M. A guide to appropriate use of correlation coefficient in medical research. Malawi Med. J., v.24, p.69-71, 2012.) ao se comparar a concentração de proteínas plasmáticas totais à concentração média de proteínas do HA de ambos os olhos, dosada pelo método de Bradford (Fig. 1). As comparações entre os olhos direito e esquerdo e entre machos e fêmeas não se mostraram significativas (P>0.05)
Curva de regressão linear entre a concentração de proteínas plasmáticas totais e a concentração média de proteínas no HA de ambos os olhos.
A produção do gel SDS-PAGE possibilitou a separação das proteínas presentes no HA de equinos por massa molecular, demonstrando visualmente uma variação na distribuição proteica de indivíduo para indivíduo, e variações entre olhos direito e esquerdo em um mesmo indivíduo, como se observa nos indivíduos 6 e 7 (Fig. 2). Verificou-se, também, que a maioria das bandas com elevada densidade óptica se encontra na região de massas acima de 43KDa. A Fig. 2 representa o perfil eletroforético de proteínas de cada animal, em que de 5 a 8, há diferentes equinos hígidos, e as letras D e E representam, respectivamente, o olho direito e o olho esquerdo de cada animal.
Perfil eletroforético de proteínas do humor aquoso de diferentes animais em gel SDS-PAGE a 12%, demonstrando visualmente uma variação na distribuição proteica de indivíduo para indivíduo e em um mesmo indivíduo variando de um olho para outro. O inserto destaca a diferença entre os indivíduos 7 e 8, observando-se uma banda intensa no indivíduo 7, com intensidade muito menor no indivíduo 8. Os valores à esquerda correspondem às posições dos marcadores de massa molecular no gel.
A avaliação dos géis por densitometria mostrou que também há considerável variação no total de proteínas entre os indivíduos. Em geral, a concentração de proteínas é semelhante entre os olhos do mesmo indivíduo, com algumas exceções. A Fig. 3 mostra o perfil densitométrico normalizado das proteínas de HA dos olhos incluídos no estudo.
Densitometria de proteínas do HA dos olhos avaliados neste estudo. As barras indicam a área normalizada medida por densitometria do total de proteínas em cada poço do gel de eletroforese. Os números sob cada barra indicam o número do animal e as letras D e E representam o olho direito e o esquerdo, respectivamente.
Os valores médios de proteínas plasmáticas totais (PPT), calculados com o refratômetro, foram de 7,29 g/dL±0,51. Já a análise de proteína total teve como resultado a média de 7,76 g/dL±0,82 e a albumina resultou em uma média de 2,28 g/dL±0,43.
DISCUSSÃO
A análise do humor aquoso tem sido preconizada no diagnóstico de uveítes, a despeito de a aqueocentese não ser isenta de riscos (Featherstone e Heinrich, 2013FEATHERSTONE, H.J.; HEINRICH, C.L. Ophthalmic examination and diagnostic procedures. Part 1: the eye examination and diagnostic procedures. In: GELATT, K.N.; GILGER, B.C.; KERN, T.J. (Eds.). Veterinary ophthalmology. 5.ed. Iowa: John Wiley & Sons, 2013. p.533-613.; Wiggans et al., 2014WIGGANS, K.; VERNAU, W.; LAPPIN, M. et al. Diagnostic utility of aqueocentesis and aqueous humor analysis in dogs and cats with anterior uveitis. Vet. Ophthalmol., v.17, p.212-220, 2014.). A fim de se minimizar a desestabilização da barreira hematoaquosa, utilizou-se agulha com menor calibre e instilação de atropina 1% após a punção (Albaugh et al., 2011ALBAUGH, R.A.; ROUSH, J.K.; RANKIN, A.J. et al. Fluorophotometric and tonometric evaluation of ocular effects following aqueocentesis performed with needles of various sizes in dogs. Am. J. Vet. Res., v.72, p.556-561, 2011.).
O exame citológico do humor aquoso deve revelar um padrão acelular, uma vez que é um fluido com baixo teor proteico, e, ocasionalmente, podem ser observados grânulos livres de melanina ou melanócitos (Hazel et al., 1985HAZEL, S.J.; THRALL, M.A.; SEVERIN, G.A. et al. Laboratory evaluation of aqueous humor in the healthy dog, cat, horse, and cow. Am. J. Vet. Res., v.46, p.657-659, 1985.; Young, 2007YOUNG, K.M. Ocular cytology: basic and advanced cães - 2 part. CONGRESSO INTERNAZIONALE MULTISALA, 56., 2007, Florence. Annali... Florence, Italy: SCIVAC, 2007.). Resultados semelhantes foram observados, verificando-se ausência de células em 96,15% das amostras (25 olhos).
A avaliação proteica pelo método de Bradford resultou na leitura de metade das 26 amostras de HA avaliadas, uma vez que o restante das amostras apresentou valor proteico igual a zero, possivelmente pelo fato de a quantidade de proteína da amostra estar abaixo da sensibilidade do método de Bradford. Utilizou-se curva padrão variando entre 6 e 50 microgramas, e 13 amostras apresentaram leituras abaixo até mesmo da absorbância do branco do método, acarretando a perda da linearidade. Assim, estes valores não foram considerados e foram normalizados a zero.
Entretanto, mediante eletroforese em gel poliacrilamida, foi possível observar proteínas nessas amostras, por coloração com prata, evidenciando-se bandas proteicas mesmo nas amostras quantificadas pelo teste de Bradford modificado como zero. A eletroforese é um método de custo acessível, reprodutível e rápido para a quantificação e visualização do perfil proteico, que separa as proteínas conforme sua massa molecular (Bollag et al., 1996BOLLAG, D.M.; ROZYCKI, M.D.; EDELSTEIN, S.J. Gel electrophoresis under non denaturing conditions. In: BOLLAG, D.M.; ROZYCKI, M.D.; EDELSTEIN, S.J. (Eds.). Protein methods. 2.ed. New York: John Wiley & Sons,1996. p.155-172.; Grus et al., 2007GRUS, F.H.; JOACHIM, S.C.; PFEIFFER, N. Proteomics in ocular fluids. Proteomics Clin. Appl., v.1, p.876-888, 2007.), mostrando ser mais sensível que o método de Bradfod.
Descrições prévias reportam concentração proteica do humor aquoso de equinos hígidos entre 10-50 mg/dL (Hazel et al., 1985HAZEL, S.J.; THRALL, M.A.; SEVERIN, G.A. et al. Laboratory evaluation of aqueous humor in the healthy dog, cat, horse, and cow. Am. J. Vet. Res., v.46, p.657-659, 1985.; Gum e Mackay, 2013GUM, G.G.; MACKAY, E.O. Physiology of the eye. In: GELATT, K.N. (Ed.). Veterinary ophthalmology. 5ed. Philadelphia: Blackwell Publishers, 2013. p.183-192.), com métodos que diferem entre si, dificultando a comparação dos valores de proteína do humor aquoso.
O valor médio das PPT foi de 7,76 g/dL±0,82, semelhante ao descrito em literatura, de 6,9 g/dL±0,4 (Boscan et al., 2007BOSCAN, P.; WATSON, Z.; STEFFEY, E.P. Plasma colloid osmotic pressure and total protein trends in horses during anesthesia. Vet. Anaesth. Analg., v.34, p.275-283, 2007.). A concentração proteica do humor aquoso geralmente é 200 vezes inferior à concentração proteica plasmática (Townsend, 2008TOWNSEND, W.M. Canine and feline uveitis. Vet. Clin. Small Anim. Pract., v.38, p.323-346, 2008.), conforme verificado neste trabalho, cujo valor médio da porcentagem de proteína no humor aquoso (HA) em relação ao valor da proteína plasmática total (PPT) foi 0,56%.
CONCLUSÃO
Neste estudo, são sugeridos valores de referência para concentração proteica do humor aquoso de equinos pelo método de Bradford. A maioria das bandas proteicas situou-se acima de 43KDa, por meio da eletroforese, e este método detectou proteínas em amostras não lidas pelo método de Bradford. Verificou-se, ainda, ser a aqueocentese um procedimento viável economicamente e de baixo risco, que pode ser empregada para corroborar o diagnóstico de afecções oculares em equinos.
REFERÊNCIAS
- ALBAUGH, R.A.; ROUSH, J.K.; RANKIN, A.J. et al. Fluorophotometric and tonometric evaluation of ocular effects following aqueocentesis performed with needles of various sizes in dogs. Am. J. Vet. Res., v.72, p.556-561, 2011.
- BOLLAG, D.M.; ROZYCKI, M.D.; EDELSTEIN, S.J. Gel electrophoresis under non denaturing conditions. In: BOLLAG, D.M.; ROZYCKI, M.D.; EDELSTEIN, S.J. (Eds.). Protein methods. 2.ed. New York: John Wiley & Sons,1996. p.155-172.
- BOSCAN, P.; WATSON, Z.; STEFFEY, E.P. Plasma colloid osmotic pressure and total protein trends in horses during anesthesia. Vet. Anaesth. Analg., v.34, p.275-283, 2007.
- BRADFORD, M.M. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem., v.72, p.248-254, 1976.
- FEATHERSTONE, H.J.; HEINRICH, C.L. Ophthalmic examination and diagnostic procedures. Part 1: the eye examination and diagnostic procedures. In: GELATT, K.N.; GILGER, B.C.; KERN, T.J. (Eds.). Veterinary ophthalmology. 5.ed. Iowa: John Wiley & Sons, 2013. p.533-613.
- GABELT, B.T.; KAUFMAN, P.L. Production and flow of aqueous humor. In: LEVIN, L.A.; NILSSON, S.F.E.; VER HOEVE, J.; WU, S.M. (Eds.). Adler’s physiology of the eye. 11.ed. Edinburgh: Elsevier, 2011. p.274-307.
- GALERA, P.D.; LAUS, J.L.; SOARES, A.M.B. et al. Avaliação dos efeitos da flunixina meglumina, por via subconjuntival, sobre a concentração e padrão proteico do humor aquoso de cães submetidos à paracentese da câmara anterior. Ciênc. Anim. Bras. v.4, p.1310-1316, 2009.
- GILGER, B. Equine ophthalmology. In: GELATT, K.N. Veterinary ophthalmology. 5ed. Philadelphia: Blackwell Publishers, 2013. p.1560-1609.
- GILGER, B.C.; DEEG, C. Equine recurrent uveitis. In In: GILGER, B.C. (Ed.). Equine ophthalmology. 2.ed. St. Louis: Elsevier Saunders, 2011. p.317-340.
- GILGER, B.C.; STOPPINI, R. Equine ocular examination: routine and advanced diagnostic techniques. In: GILGER, B.C. (Ed.). Equine ophthalmology. 2.ed. St. Louis: Elsevier Saunders, 2011. p.1-36.
- GOEL, M.; RENATA G.P.; LEE, R.K. et al. Aqueous humor dynamics: a review. Open Ophthalmol. J., v.4, p.52-59, 2010.
- GRUS, F.H.; JOACHIM, S.C.; PFEIFFER, N. Proteomics in ocular fluids. Proteomics Clin. Appl., v.1, p.876-888, 2007.
- GUM, G.G.; MACKAY, E.O. Physiology of the eye. In: GELATT, K.N. (Ed.). Veterinary ophthalmology. 5ed. Philadelphia: Blackwell Publishers, 2013. p.183-192.
- HAZEL, S.J.; THRALL, M.A.; SEVERIN, G.A. et al. Laboratory evaluation of aqueous humor in the healthy dog, cat, horse, and cow. Am. J. Vet. Res., v.46, p.657-659, 1985.
- KROHNE, S.G.; KROHNE, D.T.; LINDLEY, D.M. et al. Use of laser flaremetry to measure aqueous humor protein concentration in dogs. J. Am. Vet. Med. Assoc., v.206, p.1167-1172, 1995.
- LINN-PEARL, R.N.; POWELL, R.M.; NEWMAN, H.A. et al. Validity of aqueocentesis as a component of anterior uveitis investigation in dogs and cats. Vet. Ophthalmol., v.18, p.1-9, 2014.
- MILLAR, J.C.; GABELT, B.T.; KAUFMAN, P.L. Aqueous humor dynamics. In: TASMAN, W. (Ed.). Duane’s clinical ophthalmology. Philadelphia: Lippincott Williams & Wilkins, 2006. CD Rom.
- MUIR, W.W.; HUBBELL, J.A.E. Equine anesthesia: monitoring and emergency therapy. 2.ed. [Rio de Janeiro]: Saunders, 2009. 478p.
- MUKAKA, M.M. A guide to appropriate use of correlation coefficient in medical research. Malawi Med. J., v.24, p.69-71, 2012.
- SCHNEIDER, C.A.; RASBAND, W.S.; ELICEIRI, K.W. NIH Image to imageJ: 25 years of image analysis. Nat. Methods, v.9, p.671-675, 2012.
- TELES, L.M.; AQUINO, E.N.; NEVES, A.C. et al. Comparison of the neutrophil proteome in trauma patients and normal controls. Protein Pept Lett., v.19, p.663-672, 2012.
- TOWNSEND, W.M. Canine and feline uveitis. Vet. Clin. Small Anim. Pract., v.38, p.323-346, 2008.
- VAN DER WOERDT, A.; GILGER. B.C.; WILKIE, D.A. et al. Effect of auriculopalpebral nerve block and intravenous administration of xylazine on intraocular pressure and corneal thickness in horses. Am. J. Vet. Res., v.56, p.155-158, 1995.
- WIGGANS, K.; VERNAU, W.; LAPPIN, M. et al. Diagnostic utility of aqueocentesis and aqueous humor analysis in dogs and cats with anterior uveitis. Vet. Ophthalmol., v.17, p.212-220, 2014.
- YOUNG, K.M. Ocular cytology: basic and advanced cães - 2 part. CONGRESSO INTERNAZIONALE MULTISALA, 56., 2007, Florence. Annali... Florence, Italy: SCIVAC, 2007.
Datas de Publicação
-
Publicação nesta coleção
Nov-Dec 2018
Histórico
-
Recebido
19 Jun 2017 -
Aceito
03 Nov 2017