Resumos
Objetivou-se induzir o processo de microtuberização in vitro de cultivares de mandioca (Manihot esculenta Crantz.), em dois tipos de meio, sob a ação de diferentes reguladores de crescimento e concentrações de sacarose, e verificar as alterações estruturais decorrentes do processo de tuberização. Foram analisadas a influência do tipo de meio, a ação do BAP e ANA e doses de sacarose (3%, 6% e 8% p/v) através das características comprimento da parte aérea, o número médio de raízes, o padrão morfológico das raízes tuberiformes, bem como características anatômicas. Verifica-se que as cultivares de mandioca respondem diferentemente à microtuberização in vitro. A cultivar Parazinha responde melhor à indução de raízes tuberiformes, tendo o tratamento constituído de 0,4 µM BAP, 1,6 µM ANA e 8% sacarose como indutor na formação da raiz tuberosa, tanto em meio semisólido quanto em meio líquido. Para o comprimento da parte aérea, da raiz mais longa e o número de raízes destaca-se a Mantiqueira, porém, em meio de indução à raiz tuberiforme, foi considerada recalcitrante. Anatomicamente, a microtuberização in vitro caracteriza-se pela presença de grãos de amido.
Manihot esculenta (Crantz); cultura in vitro; regulador de crescimento; tuberização
The goal of this work was to induce in vitro tuberization of cassava cultivars (Manihot esculenta Crantz.) in two kinds of media, under the influence of different growth regulators and sucrose concentrations, as well as to determine subsequent structural alterations due to the tuberization. The influence of the kind of media, action of BAP and NAA and doses of sucrose (3%, 6% and 8% w/v) were analyzed by measuring the length of the aerial portion, number of roots, morphological pattern of the tuber roots, as well as anatomical changes. There were differences among the cultivars regarding the response to in vitro tuberization. Cultivar Parazinha had better induction of tuber roots, where treatment was with 0.4 µM BAP, 1.6 µM NAA and 8% sucrose as inducing medium, whether in solid or liquid medium. Cultivar Mantiqueira had the tallest aerial portion, longest root and largest number of roots, but the induction of tuber roots was recalcitrant. Anatomically, the microtuberization in vitro was characterized by the presence of starch grains.
Manihot esculenta Crantz; in vitro culture; growth regulator; tuberization
ARTIGOS
Microtuberização in vitro de cultivares de mandioca: aspectos morfológicos e anatômicos
In vitro microtuberization of cassava cultivars: morphological and anatomical aspects
Cláudia Martellet FogaçaI,* * Autor para correspondência: claudia_fogaca@yahoo.com.br ; Bruno Francisco Sant' Anna-SantosII; Delaine Correia CordeiroIII; Teresa Drummond CorreiaIII; Fernando Luiz FingerIII; Wagner Campos OtoniIII; Adeliano CargninI
IEmbrapa Trigo, Passo Fundo, RS, Brasil
IIUniversidade Federal de Minas Gerais, Instituto de Ciências Agrárias, Montes Claros, MG, Brasil
IIIUniversidade Federal de Viçosa, Campus Universitário, Viçosa, MG, Brasil
RESUMO
Objetivou-se induzir o processo de microtuberização in vitro de cultivares de mandioca (Manihot esculenta Crantz.), em dois tipos de meio, sob a ação de diferentes reguladores de crescimento e concentrações de sacarose, e verificar as alterações estruturais decorrentes do processo de tuberização. Foram analisadas a influência do tipo de meio, a ação do BAP e ANA e doses de sacarose (3%, 6% e 8% p/v) através das características comprimento da parte aérea, o número médio de raízes, o padrão morfológico das raízes tuberiformes, bem como características anatômicas. Verifica-se que as cultivares de mandioca respondem diferentemente à microtuberização in vitro. A cultivar Parazinha responde melhor à indução de raízes tuberiformes, tendo o tratamento constituído de 0,4 µM BAP, 1,6 µM ANA e 8% sacarose como indutor na formação da raiz tuberosa, tanto em meio semisólido quanto em meio líquido. Para o comprimento da parte aérea, da raiz mais longa e o número de raízes destaca-se a Mantiqueira, porém, em meio de indução à raiz tuberiforme, foi considerada recalcitrante. Anatomicamente, a microtuberização in vitro caracteriza-se pela presença de grãos de amido.
Palavras-chave:Manihot esculenta (Crantz), cultura in vitro, regulador de crescimento, tuberização
ABSTRACT
The goal of this work was to induce in vitro tuberization of cassava cultivars (Manihot esculenta Crantz.) in two kinds of media, under the influence of different growth regulators and sucrose concentrations, as well as to determine subsequent structural alterations due to the tuberization. The influence of the kind of media, action of BAP and NAA and doses of sucrose (3%, 6% and 8% w/v) were analyzed by measuring the length of the aerial portion, number of roots, morphological pattern of the tuber roots, as well as anatomical changes. There were differences among the cultivars regarding the response to in vitro tuberization. Cultivar Parazinha had better induction of tuber roots, where treatment was with 0.4 µM BAP, 1.6 µM NAA and 8% sucrose as inducing medium, whether in solid or liquid medium. Cultivar Mantiqueira had the tallest aerial portion, longest root and largest number of roots, but the induction of tuber roots was recalcitrant. Anatomically, the microtuberization in vitro was characterized by the presence of starch grains.
Key words:Manihot esculenta Crantz., in vitro culture, growth regulator, tuberization
Introdução
A mandioca (Manihot esculenta Crantz.), originária da América do Sul, é uma planta arbustiva, eudicotiledônea, perene, heliófila, da família Euphorbiaceae (Viana et al., 2002). É uma espécie altamente heterozigótica e poliplóide (2n=4x=36), razão pela qual sua propagação geralmente é feita por estacas (manivas) e não por sementes (Fao 2000).
A planta é conhecida pela rusticidade e pela função social que desempenha junto às populações de baixa renda. A cultura da mandioca tem grande adaptabilidade aos diferentes ecossistemas, o que possibilita o seu cultivo praticamente em todo o território nacional (Reis 1987). Situa-se entre os nove primeiros produtos agrícolas do país, em área cultivada, e o sexto em valor de produção (Fao 2000). Embora não possa ser considerada alimento completo, a mandioca é de vital importância nos países subdesenvolvidos, já que é extraordinária fonte de carboidratos (Albuquerque 2008). Sua principal parte, sob o aspecto econômico, são as raízes tuberosas, ricas em amido. A parte aérea da planta, geralmente desprezada, tem grande potencial na alimentação animal e humana (Ciat 2004).
Contudo, alguns fatores interferem negativamente na produtividade desta cultura, sendo a rápida deterioração pós-colheita o mais significativo. Entre 24 e 48 horas após a colheita dependendo da cultivar, raízes de mandioca são alteradas, se tornam não palatáveis e não são aceitas no mercado. Outro fator severo que limita a produtividade é a bacteriose (Xanthomonas campestris pv. manihots), doença que causa murcha, seca e queda das folhas, culminando com a morte da planta (Vidigal Filho et al. 2000).
Espécies tuberosas, como a mandioca, apresentam órgãos de reservas com desenvolvimento subterrâneo. A formação de raízes de mandioca a campo é conseqüência, principalmente, da elevada produção de elementos do xilema e floema provenientes da atividade do câmbio, seguida do depósito de substâncias de reserva, principalmente amido e sacarose, nas células parenquimáticas (Cabral & Carvalho 2001).
A tuberização é um complexo processo de desenvolvimento que é influenciado por variáveis genéticas, ambientais e fisiológicas (Villafranca et al. 1998). Este processo é caracterizado por significativas mudanças anatômicas, hormonais e bioquímicas (Ross et al. 1994). Os principais estudos do processo de tuberização são realizados, na sua maioria, com a batata (Solanum tuberosum L.) No entanto com mandioca os trabalhos concentram-se, principalmente, no desenvolvimento de sistemas de conservação, propagação e regeneração (Roca 1992).
Trabalhos com microtuberização em batata (Hussey & Tacey 1984; Nowak & Colborne 1989; Lopez-Delgado & Scott 1997; Villafranca et al. 1998; Silva et al. 2001) têm focado principalmente no uso de reguladores de crescimento como aspecto favorável à formação de raízes, em trabalhos que buscam elucidar os fenômenos bioquímicos envolvidos na formação do tubérculo. Outro ponto chave deste processo são os níveis de açúcares presentes no meio de cultura, especialmente a sacarose. Xu et al. (1998) trabalhando com batata, e Omokolo et al. (2003) com taioba constataram que concentrações elevadas de sacarose também afetam a tuberização in vitro. Em estudo realizado com batata, Peres et al. (2005) confirmaram a importância da sacarose no meio de cultura e ressaltaram a importância da relação fonte-dreno entre a parte aérea e o tubérculo em desenvolvimento.
A formação da raiz tuberosa de mandioca é resultado da atividade cambial, seguida de depósito de amido predominantemente nas células do parênquima do xilema secundário (Indira &. Kurian 1977; Cabral & Carvalho 2001). No caso da batata, inicialmente ocorre intensa divisão celular, seguida do alongamento das células, divisões das células parenquimáticas próximas ao floema e depósito de amido (Ewing & Struik 1992).
Portanto, a tuberização decorre da interação de diversos fatores endógenos e do ambiente. Entretanto, há grandes variações entre espécies e cultivares. Diante do exposto, objetivou-se com este trabalho induzir o processo de microtuberização in vitro de cultivares de mandioca, sob a ação diferentes reguladores de crescimento, concentrações de sacarose e verificar as alterações estruturais ocorridas decorrentes do processo de tuberização.
Material e métodos
Material vegetal - As cultivares de mandioca (Manihot esculenta Crantz.) utilizadas no estudo foram 'Mantiqueira', obtida do Laboratório de Cultura de Tecidos/BIOAGRO/UFV e 'Parazinha' e 'Vassourinha', da EMBRAPA/CERNAGEN, Brasília-DF, já em condições assépticas.
Estabelecimento e manutenção das culturas - As cultivares de mandioca foram propagados in vitro mediante subcultivos mensais empregando-se segmentos nodais cultivados em meio MS (Murashige & Skoog 1962), adicionado de mio-inositol (0,01% p/v), vitaminas de MS e sacarose (3% p/v), desprovido de reguladores de crescimento e solidificado com Fitagel (0,23%). O pH dos meios foi corrigido para 5,7 ± 0,1, utilizando-se alíquotas de 12 mL por tubo de ensaio, vedados com tampa de poliestireno. A autoclavagem dos meios foi a 120ºC e a 1,5 atm, durante 15 minutos. As culturas foram mantidas em sala de crescimento com temperatura controlada e irradiância de 50-60 µmol m-2 s-1. Esta etapa teve como meta a micropropagação das cultivares, para estabelecimento de culturas estoques a serem usadas como fonte de material vegetal durante todo o trabalho. Condições de microtuberização - Esta fase teve por objetivo a obtenção de raízes tuberiformes de mandioca in vitro. Após aproximadamente três subcultivos (± 40 dias cada), as culturas de mandioca foram submetidas a diferentes meios de indução de raiz tuberiforme.
Todos os experimentos foram conduzidos sob dois fotoperíodos. O primeiro, denominado indução, com 16 horas de luz, por quatro dias em meio semi-sólido ou seis dias em meio líquido; o segundo regime luminoso consta de 8 horas diárias de luz (dia curto) todos à temperatura de 27 ± 1ºC e irradiância de 50-60 µmol m-2 s-1.
A avaliação foi realizada aos 25-30 dias após o início dos tratamentos, com avaliação do comprimento médio da parte aérea (CPA), comprimento médio da raiz mais longa (CR), em centímetros, número médio de raízes (NR), e padrão de desenvolvimento das raízes tuberiformes.
Ápices caulinares de mandioca 'Mantiqueira', 'Parazinha' e 'Vassourinha' com aproximadamente 3 cm foram submetidos ao meio de indução por seis (meio líquido) ou quatro (meio semi-sólido) dias, período de emissão das raízes. Os tratamentos de indução de raízes tuberiformes utilizados foram: T1 = MS0 + 3% sacarose, T2 = 0,4 µM BAP + 1,6 µM ANA + 3% sacarose, T3 = 0,4 µM BAP + 1,6 µM ANA + 6% sacarose, T4 = 0,4 µM BAP + 1,6 µM ANA + 8% sacarose, T5 = 22,2 µM BAP + 3% sacarose, T6 = 22,2 µM BAP + 6% sacarose e T7 = 22,2 µM BAP + 8% sacarose.
Posteriormente, foram transferidas para o meio de formação de raízes tuberiformes, meio MS líquido, acrescido de mio-inositol (0,01%), complexo vitamínico de MS (0,02% p/v de glicina, 0,005% p/v de ácido nicotínico, 0,005% p/v de piridoxina.HCl e 0,001% p/v de tiamina.HCl) e solidificado ou não com Fitagel (0,23%).
O delineamento experimental em meio semi-sólido foi inteiramente casualisado, em esquema fatorial de 3x7, três cultivares, sete tratamentos, com oito repetições por tratamento, sendo cada unidade experimental constituída por um frasco contendo duas plantas, totalizando 56 unidades amostrais por cultivar.
O delineamento experimental em meio líquido foi inteiramente casualisado, em esquema fatorial de 3x7, três cultivares, sete tratamentos, com 10 repetições, sendo cada unidade experimental constituída por um frasco contendo uma planta, totalizando 70 unidades amostrais por cultivar.
Análise estatística - Os dados foram submetidos à análise de variância (ANOVA), empregando-se o programa SAEG - Sistema de Análises Estatísticas e Genéticas da UFV (Euclydes 1983), e as médias dos tratamentos foram comparadas pelo teste de Tukey, a 5% de probabilidade.
Preparo das lâminas permanentes de raízes de mandioca - Raízes tuberiformes de mandioca obtidas nos experimentos foram submetidas a análises anatômicas sob luz normal e polarizada.
Amostras das raízes tuberiformes de mandioca foram fixadas em FAA70 (Johansen 1940) e estocadas em etanol 70%. Após desidratação em série etílica, os fragmentos foram incluídos em metacrilato e os blocos seccionados em micrótomo rotativo. Secções transversais, com 10 µm de espessura, foram coradas em Azul de Toluidina pH 4,0 (O'Brien & Mccully 1981), para caracterização estrutural ou submetidos a reação com PAS - Ácido Periódico/Reagente de Schiff (Mcmanus 1948), para detecção de polissacarídeos neutros. As lâminas foram montadas em Permount. A análise do material e a captura de imagens foram realizadas em microscópio de luz (modelo Olympus AX70TRF) equipado com sistema U-Photo e com câmera digital acoplada.
Resultados e discussão
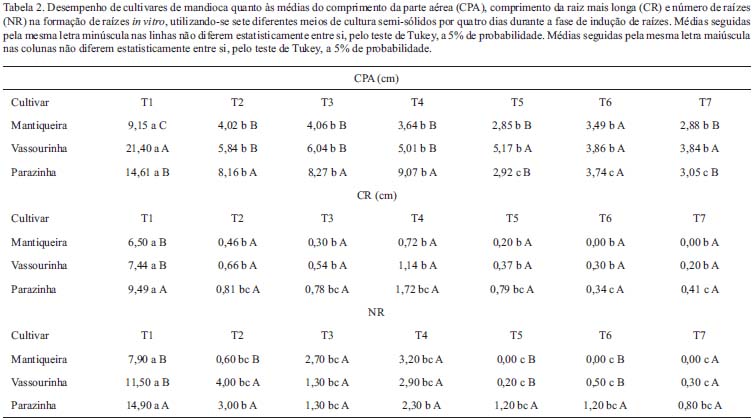
Meio líquido - No experimento em meio líquido, objetivou-se analisar a eficácia de diferentes meios das cultivares Mantiqueira, Parazinha e Vassourinha em meio MS líquido. Foram observadas diferenças significativas entre as características analisadas quando os explantes foram cultivados no tratamento T1 (Tab. 1). A cultivar Mantiqueira apresentou as melhores respostas de desenvolvimento da planta em relação à Vassourinha e Parazinha para as características CR e NR (Tab. 1).
Em relação aos tratamentos testados pode-se verificar que o tratamento T1 resultou em maior eficiência de enraizamento entre as cultivares. Este resultado era esperado, pois este meio já está estabelecido para a propagação de mandioca. Ainda sobre este aspecto, a cultivar Mantiqueira foi a que apresentou melhor resposta (maior comprimento e número de raízes), mesmo sob os diferentes tratamentos (Tab. 1).
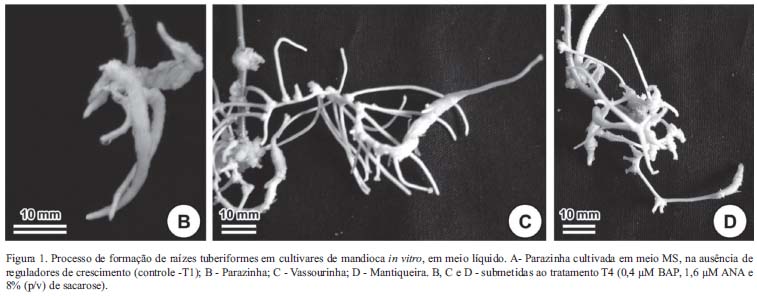
Quanto ao processo de formação de raízes tuberiformes, observou-se que o tratamento T4 foi o que apresentou a melhor resposta para as três cultivares (Fig. 1). Contudo, a cultivar mais responsiva à formação de raiz tuberiforme foi a Parazinha (Fig. 1B), apresentando uniformidade no aspecto e na textura da raiz tuberosa. Também se verificou regularidade e constância desta cultivar na formação das raízes tuberiformes (dados não apresentados). A cultivar Vassourinha também respondeu ao processo de formação de raiz tuberiforme (Fig. 1C), porém com certa irregularidade, tanto na freqüência como também na formação da raiz tuberosa propriamente dita (dados não apresentados), pois o processo não foi uniforme como na cultivar Parazinha. Já na cultivar Mantiqueira (Fig. 1D), verificou-se apenas indícios do processo de tuberização, com desenvolvimento irregular ao longo das raízes. Apesar de apresentar os melhores resultados com relação aos diferentes parâmetros indicativos da eficiência do enraizamento e do crescimento da parte aérea (CR, NR e CPA), diante dos tratamentos a qual foi submetida, a cultivar Mantiqueira pode ser considerada recalcitrante ao processo de formação de raízes tuberiformes. Esta resposta pode estar associada diretamente às diferenças genotípicas específicas das cultivares, apresentando respostas distintas ao processo de formação de raiz tuberiforme.
Análise da anatomia da raiz das plantas cultivados no tratamento T1 mostra que as raízes apresentam epiderme unisseriada, córtex com células isodiamétricas, porém de menor calibre que o tratamento T4 (Fig. 2A, 2B e 2C). Além disso, as raízes do tratamento T4 apresentaram aumento considerável dos espaços intercelulares nas camadas mais periféricas do córtex, como também a presença de grãos de amido na região do córtex (Fig. 2D). Verificaram-se também diferenças no acúmulo de polissacarídeos, do tratamento T1 (Fig. 2C) comparado ao tratamento T4, onde se detectou amiloplastos repletos de grãos de amido (Fig. 2D, 2E e 2F). As diferenças anatômicas apresentadas na Fig. 2 corroboram com os resultados da ação conjunta do BAP e de níveis altos de sacarose (Estrada et al. 1986; Omokolo et al. 2003), favorecendo o acúmulo de grãos de amido (Ross et al. 1994; Veramendi et al. 1999).
Meio semi-sólido - As raízes tuberiformes de mandioca em meio MS semi-sólido tiveram melhor crescimento no tratamento T1, distinguindo-se de forma significativa dos demais tratamentos em todas as características analisadas: CPA, CR e NR, como também nas três cultivares estudadas (Tab. 2). Ainda com relação ao efeito dos tratamentos, podemos observar que a cultivar Parazinha apresentou melhores respostas quanto ao CR, o que corrobora com a sua habilidade de responder ao processo de formação de raízes tuberiformes que ocorreram no tratamento T4 (Fig. 3A e 3B).
As análises morfológicas e anatômicas realizadas com raízes de plantas submetidas aos tratamentos em meio semi-sólido produziram resultados equivalentes aos observados em meio líquido. Novamente, o tratamento mais eficiente na indução de tuberização foi o T4 e a cultivar com maior eficiência de tuberização das raízes foi a Parazinha (Fig. 3B, em comparação com 3C e 3D).
Discussão geral - A combinação do ANA com BAP foi importante para a indução do processo de formação de estruturas semelhantes a raízes tuberosas in vitro em Ipomoea batatas (Corrêa et al. 2003). Além disso, evidenciou-se que 'Vassourinha' também exibiu bons resultados ao processo de tuberização in vitro sob o mesmo tratamento (Fig. 3C), porém não foi uniforme, e ainda apresenta menor comprimento e número de raízes quando comparado com 'Parazinha'. Já 'Mantiqueira' apresentou um elevado percentual de calos (43% dos explantes formaram calos e 57% formaram raízes, quando cultivados em meio líquido no tratamento T4. Os calos (Fig. 3 D) podem ter impedido ou interferido na formação de raízes tuberiformes, principalmente nos tratamentos que continham somente o BAP na concentração de 22,2 µM. Possivelmente, a explicação para a calogênese seja a ausência da auxina (ANA), que favorece o alongamento celular (Taiz & Zeiger 2004); a concentração elevada da citocinina (Estrada et al. 1986), quando comparada aos outros tratamentos; e a especificidade do genótipo (Lopez-Delgado & Scott 1997), sugerindo que a cultivar Mantiqueira apresenta menor potencialidade de formação de raiz tuberiforme in vitro).
Conclusões
Há especificidade genotípica no processo de microtuberização de cultivares de mandioca;
A cultivar Parazinha responde melhor à indução de raiz tuberiforme;
O tratamento com 0,4 µM BAP, 1,6 µM ANA e 8% de sacarose foi a melhor condição para a indução e formação de raiz tuberiforme, tanto em meio semi-sólido quanto em meio líquido;
O comprimento médio da parte aérea, da raiz mais longa e o número médio de raízes, foram maiores na cultivar Mantiqueira. Porém, em meio de indução de raiz tuberiforme, esta cultivar é considerada recalcitrante;
A microtuberização in vitro é caracterizada pela presença de grãos de amido nas raízes tuberiformes de mandioca.
Agradecimentos
Ao CNPq (Conselho Nacional de Desenvolvimento e Tecnologia) e UFV (Universidade Federal de Viçosa - MG) pelo apoio financeiro.
Referências Bibliográficas
Albuquerque, J.A.A.; Sediyama, T.; Silva, A.A.; Carneiro, J.E.S.; Cecon, P.R.; Alves, J.M.A. 2008. Interferência de plantas daninhas sobre a produtividade da mandioca (Manihot esculenta Crantz.). Planta Daninha 26: 279-289.
Cabral, G.B.; Carvalho, L.J.C.B. 2001. Analysis of Proteins Associated with storage root formation in cassava using two-dimensional gel electrophoresis. Revista Brasileira de Fisiologia Vegetal 13: 41-48.
CIAT (Centro Internacional de Agricultura Tropical). 2004. Yuca: Lo ultimo acerca de um cultivo milenario. Cali, CIAT. (Boletim informativo).
Corrêa, R.M.; Pinto, J.E.B.P.; Bertolucci, S.K.V.; Reis, E.S. & Souza, A.V. 2003. Potencial do carvão ativado, filtro amarelo e interação fotoperíodo/temperatura na formação de raízes tuberosas de batatadoce in vitro. Ciência Rural 33: 423-430.
Estrada, R.; Tovar, P. & Dodds, J.H. 1986. Induction of in vitro tubers in a broad range of potato genotypes. Plant Cell, Tissue and Organ Culture 7: 3-10.
Euclydes, R.F. 1983. Sistema de Análises Estatísticas e Genéticas da UFV (SAEG). Viçosa, CPD/UFV, Divisão de Pesquisas e Desenvolvimento.
Ewing, E.E. & Struik, P.C. 1992. Tuber formation in potato: induction, initiation, and growth. Horticutural Reviews 14: 89-198.
Food And Agriculture Of The United Nations (FAO). 2000. A new strategy for cassava. FAO: Rome.
Hussey, G. & Stacey, N.J. 1984. Factors affecting the formation of in vitro tubers of potato (Solanum tuberosum L.). Annals Botany 53: 565-578.
Indira, P.; Kurian, T. 1977. A study on the comparative anatomical changes undergoing tuberization in roots of cassava and sweet potato. Journal of Root Crops 3: 29-32.
Johansen, D.A. 1940. Plant Microtechnique. New York, McGraw- Hill.
Lopez-Delgado, H. & Scott, I. 1997. Induction of in vitro tuberization of potato microplants by acetylsalicylic acid. Journal of Plant Physiology 151: 74-78.
McManus, J. F. A. 1948. Histological and histochemical uses of periodic acid. Stain Technology 23: 99-108.
Murashige, T. & Skoog, F. 1962. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiologia Plantarum 15: 473-497.
Nowak, J. & Colborne, D. 1989. In vitro tuberization and tuber proteins as indicators of heat stress tolerance in potato. American Potato Journal 66: 35-45.
O'Brien, T.P. & McCully, M.E. 1981. The study of plant structure principles and select methods. Melbourne, Termarcarphi Pty. Ltda.
Omokolo, N.D.; Boudjeko, T. & Tsafack-Takadong, J.J. 2003. In vitro tuberization of Xanthosoma sagittifolium L. Shott: effects of phytohormones, sucrose, nitrogen and photoperiod. Scientia Horticulturae 98: 337-345.
Peres, L.E.P.,;Carvalho, R.F.; Zsögön, A.; Bermúdez-Zambrano, O.D.; Robles, W.G.R. & Tavares, S. 2005. Grafting of tomato mutants onto potato rootstocks: an approach to study leaf-derived signaling on tuberization. Plant Science 169: 680-688.
Reis, A.J. 1987. Aspectos Econômicos da Mandioca. Informe Agropecuário 145: 3-8.
Roca, W.M.; Henry, G.; Angel, F.; Sarria, R. 1992. Biotechnology research applied to cassava improvement at the CIAT. Ag. Biotechnology News Informations 4: 303-308.
Ross, H.A.; Davies, H.V.; Burch, L.R.; Viola, R. & Mcrae, D. 1994. Developmental changes in carbohydrate content and sucrose degrading enzymes in tuberising stolons of potato (Solanum tuberosum). Physiologia Plantarum 90: 748-756.
Silva, J.A.B.; Otoni, W.C.; Martinez, C.A.; Dias, L.M. & Silva, M.A.P. 2001. Microtuberization of Andean potato species (Solanum spp.) as effected by salinity. Scientia Horticulturae 89: 91-101.
Taiz, L. & Zeiger, E. 2004. Fisiologia vegetal. 3 ed. Porto Alegre, Artmed Editora Ltda.
Veramendi, J.; Willmitzer, L. & Trethewey, R.N. 1999. In vitro grown potato microtubers are a suitable system for the study o primary carbohydrate metabolism. Plant Physiology and Biochemistry 37: 693-697.
Viana, A.E.S.; Sediyama, T.; Cecon, P.R.; Lopes. S.C.; Sediyama, M.A.N. 2002. Estimativas de tamanho de parcela em experimentos com mandioca. Horticultura Brasileira 20: 58-63.
Vidigal Filho, P.S.; Pequeno, M.G.; Scapim, C.A.; Vidigal, M.C.G.; Maia, R.R.; Sagrilo, E.; Simon, G.A.; Limar, R.S. 2000. Avaliação de cultivares de mandioca na região noroeste do Paraná. Bragantia 59: 69-75.
Villafranca, M.J.; Veramendi, J.; Sota, V. & Mingo-Castel, A.M. 1998. Effect of physiological age of mother tuber and number of subcultures on in vitro tuberization of potato (Solanum tuberosum L.). Plant Cell Reports 17: 787-790.
Xu, X.; Van Lammeren, A.M.; Vermeer, E. & Vreugdenhil, D. 1998. The role of gibberellin, abscísico acid, and sucrose in the regulation of potato tuber formation in vitro. Plant Physiology 117: 575-584.
Recebido em 3/11/2008.
Aceito em 7/10/2009
- Albuquerque, J.A.A.; Sediyama, T.; Silva, A.A.; Carneiro, J.E.S.; Cecon, P.R.; Alves, J.M.A. 2008. Interferência de plantas daninhas sobre a produtividade da mandioca (Manihot esculenta Crantz.). Planta Daninha 26: 279-289.
- Cabral, G.B.; Carvalho, L.J.C.B. 2001. Analysis of Proteins Associated with storage root formation in cassava using two-dimensional gel electrophoresis. Revista Brasileira de Fisiologia Vegetal 13: 41-48.
- CIAT (Centro Internacional de Agricultura Tropical). 2004. Yuca: Lo ultimo acerca de um cultivo milenario. Cali, CIAT. (Boletim informativo).
- Corrêa, R.M.; Pinto, J.E.B.P.; Bertolucci, S.K.V.; Reis, E.S. & Souza, A.V. 2003. Potencial do carvão ativado, filtro amarelo e interação fotoperíodo/temperatura na formação de raízes tuberosas de batatadoce in vitro Ciência Rural 33: 423-430.
- Estrada, R.; Tovar, P. & Dodds, J.H. 1986. Induction of in vitro tubers in a broad range of potato genotypes. Plant Cell, Tissue and Organ Culture 7: 3-10.
- Euclydes, R.F. 1983. Sistema de Análises Estatísticas e Genéticas da UFV (SAEG). Viçosa, CPD/UFV, Divisão de Pesquisas e Desenvolvimento.
- Ewing, E.E. & Struik, P.C. 1992. Tuber formation in potato: induction, initiation, and growth. Horticutural Reviews 14: 89-198.
- Food And Agriculture Of The United Nations (FAO). 2000. A new strategy for cassava. FAO: Rome.
- Hussey, G. & Stacey, N.J. 1984. Factors affecting the formation of in vitro tubers of potato (Solanum tuberosum L.). Annals Botany 53: 565-578.
- Indira, P.; Kurian, T. 1977. A study on the comparative anatomical changes undergoing tuberization in roots of cassava and sweet potato. Journal of Root Crops 3: 29-32.
- Johansen, D.A. 1940. Plant Microtechnique. New York, McGraw- Hill.
- Lopez-Delgado, H. & Scott, I. 1997. Induction of in vitro tuberization of potato microplants by acetylsalicylic acid. Journal of Plant Physiology 151: 74-78.
- McManus, J. F. A. 1948. Histological and histochemical uses of periodic acid. Stain Technology 23: 99-108.
- Murashige, T. & Skoog, F. 1962. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiologia Plantarum 15: 473-497.
- Nowak, J. & Colborne, D. 1989. In vitro tuberization and tuber proteins as indicators of heat stress tolerance in potato. American Potato Journal 66: 35-45.
- O'Brien, T.P. & McCully, M.E. 1981. The study of plant structure principles and select methods. Melbourne, Termarcarphi Pty. Ltda.
- Omokolo, N.D.; Boudjeko, T. & Tsafack-Takadong, J.J. 2003. In vitro tuberization of Xanthosoma sagittifolium L. Shott: effects of phytohormones, sucrose, nitrogen and photoperiod. Scientia Horticulturae 98: 337-345.
- Peres, L.E.P.,;Carvalho, R.F.; Zsögön, A.; Bermúdez-Zambrano, O.D.; Robles, W.G.R. & Tavares, S. 2005. Grafting of tomato mutants onto potato rootstocks: an approach to study leaf-derived signaling on tuberization. Plant Science 169: 680-688.
- Reis, A.J. 1987. Aspectos Econômicos da Mandioca. Informe Agropecuário 145: 3-8.
- Roca, W.M.; Henry, G.; Angel, F.; Sarria, R. 1992. Biotechnology research applied to cassava improvement at the CIAT. Ag. Biotechnology News Informations 4: 303-308.
- Ross, H.A.; Davies, H.V.; Burch, L.R.; Viola, R. & Mcrae, D. 1994. Developmental changes in carbohydrate content and sucrose degrading enzymes in tuberising stolons of potato (Solanum tuberosum). Physiologia Plantarum 90: 748-756.
- Silva, J.A.B.; Otoni, W.C.; Martinez, C.A.; Dias, L.M. & Silva, M.A.P. 2001. Microtuberization of Andean potato species (Solanum spp.) as effected by salinity. Scientia Horticulturae 89: 91-101.
- Taiz, L. & Zeiger, E. 2004. Fisiologia vegetal. 3 ed. Porto Alegre, Artmed Editora Ltda.
- Veramendi, J.; Willmitzer, L. & Trethewey, R.N. 1999. In vitro grown potato microtubers are a suitable system for the study o primary carbohydrate metabolism. Plant Physiology and Biochemistry 37: 693-697.
- Viana, A.E.S.; Sediyama, T.; Cecon, P.R.; Lopes. S.C.; Sediyama, M.A.N. 2002. Estimativas de tamanho de parcela em experimentos com mandioca. Horticultura Brasileira 20: 58-63.
- Vidigal Filho, P.S.; Pequeno, M.G.; Scapim, C.A.; Vidigal, M.C.G.; Maia, R.R.; Sagrilo, E.; Simon, G.A.; Limar, R.S. 2000. Avaliação de cultivares de mandioca na região noroeste do Paraná. Bragantia 59: 69-75.
- Villafranca, M.J.; Veramendi, J.; Sota, V. & Mingo-Castel, A.M. 1998. Effect of physiological age of mother tuber and number of subcultures on in vitro tuberization of potato (Solanum tuberosum L.). Plant Cell Reports 17: 787-790.
- Xu, X.; Van Lammeren, A.M.; Vermeer, E. & Vreugdenhil, D. 1998. The role of gibberellin, abscísico acid, and sucrose in the regulation of potato tuber formation in vitro. Plant Physiology 117: 575-584.
Datas de Publicação
-
Publicação nesta coleção
10 Nov 2010 -
Data do Fascículo
Set 2010
Histórico
-
Aceito
07 Out 2009 -
Recebido
03 Nov 2008