Resumos
OBJETIVO: Comparar a percentagem de neoformação óssea promovida pelo enxerto ósseo autógeno e três tipos de materiais de substituição de características distintas em cavidades em fêmures de ratos. MÉTODOS: Foram realizadas duas cavidades de 5,4 x 2,7mm, em cada fêmur (direito e esquerdo), de 14 ratos Wistar isogênicos. Cada um dos quatro defeitos criados foi preenchido com o osso autógeno ou com um dos três materiais testados - hidroxiapatita (HA), Genphos® (HA+ β-TCP) e GenMix® (um enxerto ósseo bovino composto). Ao final dos períodos de seis semanas (n = 6) e 12 semanas (n = 8), os animais foram sacrificados. As lâminas (coradas com Picro-Sirius) foram analisadas por microscopia óptica normal e software específico. RESULTADOS: Os grupos com o osso autógeno se mostraram muito superiores aos demais nos dois tempos analisados, tendo média de neoformação óssea ± DP de 90,6 ± 10,8% em seis semanas, e 98 ± 9,2% em 12 semanas (p > 0,0001 em ambos os tempos analisados). Em seis semanas, os resultados para os demais grupos foram os seguintes: Genphos®, 46 ± 7,1%; HA, 43,1 ± 8,4%; e GenMix®, 57,3 ± 4,5%. Em 12 semanas: Genphos®, 47,8 ± 11,1%; HA, 39,9 ± 5,4%; GenMix®, 59,7 ± 4,8%, significativa (p = 0,007). CONCLUSÕES: Em ambos os tempos analisados, os três materiais de substituição óssea testados se mostraram inferiores ao osso autógeno quanto à percentagem de neoformação óssea.
Regeneração óssea; Transplante ósseo; Substitutos ósseos; Durapatita; Fosfatos de cálcio; Transplante heterólogo; Transplante autólogo; Materiais biocompatíveis; Ratos Wistar
OBJECTIVE: Compare the percentage of bone neoformation promoted by autologous bone grafting and three kinds of replacement materials with different characteristics in rats' femoral holes. METHODS: Two holes measuring 5.4 x 2.7mm, were produced on each femur (right and left) of 14 isogenic Wistar rats. Each of the four defects produced was filled by autologous bone or by one of three tested materials - hydroxyapatite (HA), Genphos® (HA+ β-TCP) and GenMix® (a combined bovine bone graft). In the end of the 6-week (n = 6) and 12-week (n = 8) periods, the animals were sacrificed. The sections (stained with Picro-Sirius) were assessed by optical microscopy and specific software. RESULTS: The groups with autologous bone were shown to be significantly superior to the others at both assessed times, showing a mean bone formation rate ± SD of 90.6 ± 10.8% in six weeks, and 98 ± 9.2% in 12 weeks (p > 0.0001 for both assessed times). In six weeks, the results for the other groups were the following: Genphos®, 46 ± 7.1%; HA, 43.1 ± 8.4%; and GenMix®, 57.3 ± 4.5%. In 12 weeks: Genphos®, 47.8 ± 11.1%; HA, 39.9 ± 5.4%; GenMix®, 59.7 ± 4.8%, significant (p = 0.007). CONCLUSIONS: In both assessed times, the three bone replacement materials tested in the study showed to be inferior to autologous bone graft for bone neoformation percentage.
Bone regeneration; Bone transplantation; Durapatite; Calcium phosphates; Transplantation, heterotopic; Transplantation, autologous; Biocompatible materials; Rats, Wistar
ARTIGO ORIGINAL
Estudo comparativo da neoformação óssea utilizando-se o enxerto autógeno e três substitutos: defeitos ósseos em ratos
Comparative study of bone neoformation using autologous grafting and three replacements: bone defects in rats
Rodrigo Steffen SteinI; Jefferson Braga SilvaII; Vinicius Duval da SilvaIII
IMestre em Ciências da Saúde (Cliníca Cirúrgica) pela PUC/RS; Especialista em Implantodontia, ABO/RS
IIPhD em Cirurgia; Professor Titular da Faculdade de Medicina da PUCRS; Professor Livre-Docente da Unifesp
IIIPhD em Medicina - UFRGS; Professor Titular da Faculdade de Medicina da PUCRS
Correspondência Correspondência: Alameda Coelho Neto, 40, sala 401 91340-340 Porto Alegre, RS Tel.: (51) 3061-3159 E-mail: rodrigosstein@gmail.com
RESUMO
OBJETIVO: Comparar a percentagem de neoformação óssea promovida pelo enxerto ósseo autógeno e três tipos de materiais de substituição de características distintas em cavidades em fêmures de ratos.
MÉTODOS: Foram realizadas duas cavidades de 5,4 x 2,7mm, em cada fêmur (direito e esquerdo), de 14 ratos Wistar isogênicos. Cada um dos quatro defeitos criados foi preenchido com o osso autógeno ou com um dos três materiais testados hidroxiapatita (HA), Genphos® (HA+ β-TCP) e GenMix® (um enxerto ósseo bovino composto). Ao final dos períodos de seis semanas (n = 6) e 12 semanas (n = 8), os animais foram sacrificados. As lâminas (coradas com Picro-Sirius) foram analisadas por microscopia óptica normal e software específico.
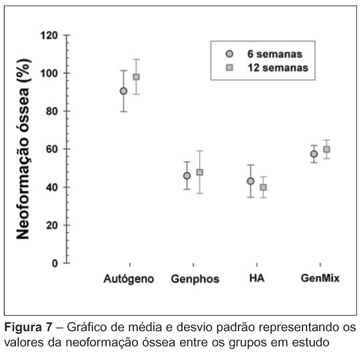
RESULTADOS: Os grupos com o osso autógeno se mostraram muito superiores aos demais nos dois tempos analisados, tendo média de neoformação óssea ± DP de 90,6 ± 10,8% em seis semanas, e 98 ± 9,2% em 12 semanas (p > 0,0001 em ambos os tempos analisados). Em seis semanas, os resultados para os demais grupos foram os seguintes: Genphos®, 46 ± 7,1%; HA, 43,1 ± 8,4%; e GenMix®, 57,3 ± 4,5%. Em 12 semanas: Genphos®, 47,8 ± 11,1%; HA, 39,9 ± 5,4%; GenMix®, 59,7 ± 4,8%, significativa (p = 0,007).
CONCLUSÕES: Em ambos os tempos analisados, os três materiais de substituição óssea testados se mostraram inferiores ao osso autógeno quanto à percentagem de neoformação óssea.
Descritores: Regeneração óssea; Transplante ósseo; Substitutos ósseos; Durapatita; Fosfatos de cálcio; Transplante heterólogo; Transplante autólogo; Materiais biocompatíveis; Ratos Wistar
ABSTRACT
OBJECTIVE: Compare the percentage of bone neoformation promoted by autologous bone grafting and three kinds of replacement materials with different characteristics in rats' femoral holes.
METHODS: Two holes measuring 5.4 x 2.7mm, were produced on each femur (right and left) of 14 isogenic Wistar rats. Each of the four defects produced was filled by autologous bone or by one of three tested materials hydroxyapatite (HA), Genphos® (HA+ β-TCP) and GenMix® (a combined bovine bone graft). In the end of the 6-week (n = 6) and 12-week (n = 8) periods, the animals were sacrificed. The sections (stained with Picro-Sirius) were assessed by optical microscopy and specific software.
RESULTS: The groups with autologous bone were shown to be significantly superior to the others at both assessed times, showing a mean bone formation rate ± SD of 90.6 ± 10.8% in six weeks, and 98 ± 9.2% in 12 weeks (p > 0.0001 for both assessed times). In six weeks, the results for the other groups were the following: Genphos®, 46 ± 7.1%; HA, 43.1 ± 8.4%; and GenMix®, 57.3 ± 4.5%. In 12 weeks: Genphos®, 47.8 ± 11.1%; HA, 39.9 ± 5.4%; GenMix®, 59.7 ± 4.8%, significant (p = 0.007).
CONCLUSIONS: In both assessed times, the three bone replacement materials tested in the study showed to be inferior to autologous bone graft for bone neoformation percentage.
Keywords: Bone regeneration; Bone transplantation; Durapatite; Calcium phosphates; Transplantation, heterotopic; Transplantation, autologous; Biocompatible materials; Rats, Wistar
INTRODUÇÃO
São numerosos os acidentes ou as doenças em que há perda de tecido ósseo que precisará ser reposto (somente nos Estados Unidos, estimam-se cerca de 500.000 procedimentos de enxertos ósseos por ano)(1). Até os dias atuais, o tratamento de eleição para recuperar esse tipo de lesão é o enxerto ósseo autógeno (padrão-ouro), um procedimento cirúrgico consagrado e muito eficaz, mas longe de ser perfeito. Dentre algumas de suas desvantagens, podem ser citadas sua difícil aceitação por parte dos pacientes (por ser preciso remover osso de outra área), o volume e a forma limitados das áreas doadoras, e o defeito gerado na extração do enxerto e o pós-operatório desta área, que normalmente apresenta mais complicações do que na área receptora(1-6). Devido a tais limitações, existe a busca constante por um material para enxertia que possa substituir o osso autógeno com a mesma qualidade do tratamento, porém, com menos inconvenientes; um substituto ideal parece ainda estar para ser criado(6-8).
Um substituto ósseo com características ideais deveria ter propriedades físico-químicas parecidas com as do osso, para facilitar a regeneração óssea; ter a capacidade de associar propriedades osteoindutoras e osteocondutoras; ser biocompatível e reabsorvível, sendo completamente substituído por osso(8,9).
O objetivo deste estudo foi comparar a percentagem de neoformação óssea pós-enxertia entre o padrão-ouro atual (enxerto ósseo autógeno) e três substitutos ósseos com características distintas, para se ver se algum desses teria a capacidade de substituí-lo sem perdas significativas de qualidade.
MÉTODO
Foram utilizados 14 ratos (Rattus norvegicus) da raça Wistar, machos, adultos jovens entre dois e quatro meses, isogênicos da linhagem Kyoto, com peso entre 220 e 300 gramas, provenientes do Laboratório de Microcirurgia e Habilidades Médicas da PUC/RS, lugar este onde foram realizados todos os procedimentos cirúrgicos. Os espécimes foram alocados randomicamente em dois grupos experimentais que receberam o mesmo tratamento; foram, contudo, sacrificados e analisados em tempos diferentes; seis semanas (n = 6) e 12 semanas (n = 8).
Em cada espécime tratado foi administrada anestesia intraperitoneal com uma solução constituída por 0,2ml de cloridrato de clorpromazina (5mg/ml) + 0,8ml de ketamina (50mg/ml,) na dose de 0,3ml de solução/100 gramas de peso corporal do rato (o que é equivalente a 0,3mg de clorpromazina + 12mg de ketamina/100g de peso corporal do rato). Foi realizada a tricotomia na área de acesso cirúrgico sobre os dois fêmures (esquerdo e direito). Doses de manutenção anestésica foram contempladas para ser ministradas no transcorrer do ato cirúrgico, conforme necessário (metade da dose inicial).
Uma incisão longitudinal de cerca de 4cm foi realizada, paralela e anterior ao eixo de ambos os fêmures foi feita uma de cada vez. Com a dissecção delicada do músculo e periósteo, foi exposta a área anterior de cada fêmur. Com o auxílio de um motor elétrico Blm 600 plus e contra ângulo odontológico 1 x 1, foram confeccionadas duas cavidades de 5,4mm, utilizando broca trefina de 2,7mm, em duas cavidades adjacentes 2,7 x 2 = 5,4mm. Para confecção destas cavidades, foi estipulado um torque constante de 45N, velocidade de 45.000rpm e irrigação abundante (70% - regulagem do motor elétrico) com soro fisiológico para viabilidade de regeneração óssea.
Após as perfurações, os fragmentos ósseos foram removidos com cuidado (Figura 1) e armazenados em potes Dapen estéreis. Posteriormente, esses serão utilizados como osso autógeno para ser enxertado (após ser particulado com minialveolótomo odontológico) em uma das cavidades. Cada uma das demais cavidades foi preenchida por um dos materiais de substituição óssea testados: (HA) hidroxiapatita (Bionnovation S.A., Brasil), (há + β-TCP) - Genphos® (Baumer S.A., Brasil) e (um enxerto ósseo bovino composto) - GenMix® (Baumer S.A., Brasil). A distribuição da posição dos materiais nas cavidades dos fêmures sofreu rotação no sentido horário para padronização de áreas enxertadas com cada material.
Tanto a sutura do periósteo quanto a sutura por planos e da pele foram executadas com fio mononylon 4-0 (Ethilon®, Johnson & Johnson, Brasil). Os ratos foram mantidos em gaiolas individuais após as cirurgias.
Para o sacrifício dos animais nos tempos determinados, uma dose da anestesia, já mencionada, foi realizada; posteriormente, foi aplicada uma sobredosagem de pentobarbital sódico de 100mg/kg intracardíaca com o rato já previamente anestesiado.
Após a eutanásia dos animais, foi feita uma remoção delicada dos fêmures direito e esquerdo (Figura 2), que imediatamente foram colocados em solução de formol a 10% por três dias. Em seguida, os fêmures foram seccionados com ajuda de um disco de carborundo odontológico, do mesmo motor elétrico utilizado nas demais cirurgias, e da peça reta 1 x 1. Foi seccionado, além da área enxertada, cerca de 0,5 a 1mm de osso sadio de ambos os lados da área tratada.
Todos os tratamentos foram separados de acordo com o tipo de enxerto realizado; sua descalcificação lenta foi realizada com ácido fórmico em concentração de 30% em uma estufa a 37ºC, sendo trocado a cada três dias pelo período de duas semanas. Após completa descalcificação, foi feita a inclusão das peças em parafina para corte em micrótomo e confecção de lâminas histológicas.
Após se descartar o 1.º milímetro de cada região testada, foram confeccionadas 10 lâminas histológicas com dois a cinco cortes de 50μm do fêmur em cada, repetindo- se o procedimento a cada 1mm da região analisada.
Depois de ficar 24 horas em estufa a 60ºC, as lâminas foram colocadas em solução de Picro-Sirius a 1% por uma hora; em seguida, foi efetuada uma lavagem em água corrente por 20 minutos. Quando secas, as lâminas foram catalogadas e examinadas para escolha das áreas a serem fotografadas e analisadas.
Todos os grupos estudados foram examinados com microscopia óptica normal, com aumento de 5x. Ao capturar as imagens com o auxílio da câmera Cool Snap Pro, é produzido aumento similar de uma objetiva de 10x; com isso, as imagens resultantes passam a ter aumento de 50x.
Para a análise, foram estipuladas ao menos três áreas diferentes, com o mínimo de 1mm de distância entre elas. Para cada área tratada, foi eleita, na mesma lâmina, em região adjacente à da lesão, uma área com extensão e larguras similares para o controle dos 100% de neoformação óssea.
As imagens, após sua captura, foram analisadas, com o programa Image Pro plus, versão 4.5.1., utilizado pelo departamento de Patologia do Hospital São Lucas da PUC/RS.
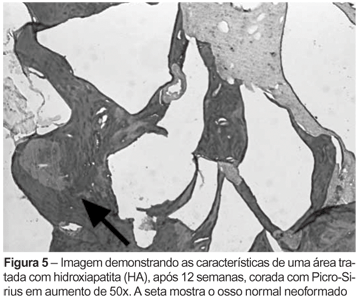
Com auxílio desse programa, foi selecionada a área correspondente à do osso existente em cada imagem capturada (Figuras 3, 4, 5 e 6), sendo aplicada nesta uma "máscara" específica. Essa área, quando mensurada com o programa acima descrito, gera uma contagem do número de pixels a que corresponde. A percentagem de neoformação óssea da área tratada foi calculada pela comparação de osso nessa área (tratada) em relação ao osso presente na área adjacente não tratada (controle), que foi estipulado como 100% de neoformação (ideal).
Os dados foram descritos por média e desvio padrão. Para comparação da neoformação óssea entre os grupos, utilizou-se a análise de variância (ANOVA), seguida de procedimento post hoc de Tukey. A comparação dos tempos foi realizada pelo teste t de Student. O nível de significância adotado foi de α = 0,05. Os dados foram analisados com o programa SPSS.
O protocolo de pesquisa do experimento foi submetido ao Comitê de Ética em Pesquisa da Pontifícia Universidade Católica do Rio Grande do Sul, não recebendo alterações ou modificações nos procedimentos propostos.
RESULTADOS
Nenhum dos ratos utilizados morreu após o procedimento ou durante o período do experimento. Apesar de todos os animais estarem aparentemente sadios não apresentavam limitações em sua movimentação , ao se fazer a dissecção dos fêmures foram constatados três fraturados no grupo de seis semanas e cinco fraturas no grupo de 12 semanas (Tabela 1), causadas provavelmente pelo grande tamanho das cavidades confeccionadas e pelo fato de as lesões terem sido realizadas em ambos os fêmures.
As demais perdas se devem a falhas na descalcificação ou confecção das lâminas, não tendo com isso condições de serem analisadas; por esse motivo, foram excluídas do estudo.
Os valores das médias de neoformações ósseas bem como seus respectivos desvios padrões estão expostos na tabela 2 e figura 7.
DISCUSSÃO
Atualmente, no mercado, numerosos são os substitutos ósseos (HA, β-TCP, vidro bioativo) e contam com as mais diversas características para tentar substituir o osso autógeno. As empresas que os produzem utilizam um marketing forte, tentando convencer que este ou aquele produz melhores resultados e que, como parece óbvio, o seu produto tem qualidade superior ao de outras empresas.
Bons estudos sobre muitos desses materiais ainda são inconclusivos e escassos. Normalmente, comparam-se somente dois ou três materiais distintos e raríssimos são os experimentos em que se comparam vários grupos de substitutos com o padrão-ouro atual, o enxerto ósseo autógeno.
Além do osso autógeno, foram testadas uma HA + β-TCP (Genphos®) e uma HA reabsorvível (Bionnovation) dois enxertos aloplásticos que teriam apenas características osteocondutoras e o GenMix®, exemplo de xenoenxerto, que teoricamente poderia possuir características osteocondutoras pela matriz inorgânica e osteoindutoras pela matriz orgânica, que, por outro lado, diminuiria, em tese, sua capacidade de sustentação(9).
Os aloenxertos derivados de HA sintética (e suas variações) são altamente biocompatíveis e parecem ter resposta biológica semelhante à do osso(9). Os resultados na literatura dependem das diversas formulações e ainda são inconclusivos quanto à quantidade e à qualidade do osso neoformado(6-8,10-14). Alterando-se sua composição (como a adição de β-TCP) e seu método de fabricação, poderia ser modificada a velocidade de reabsorção da HA, que naturalmente ocorreria de forma muito lenta(8,9).
Os xenoenxertos teriam como uma grande vantagem a maior similaridade com o osso natural quando analisado seu componente inorgânico (variando sua cristalinidade e morfologia de acordo com o método de preparo)(15) e poderiam, em tese, manter as características osteoindutoras em seu componente inorgânico(6,9), que supostamente teria maior potencial imunogênico(3). Com a associação dos dois componentes, o GenMix® ou somaria as vantagens dos dois ou teria sua capacidade de osteoindução e/ou sustentação afetadas por essa mistura(6,10,13,16).
Os osteoclastos, tanto humanos como de ratos, apresentam um padrão similar de reabsorção. Com isso, o modelo animal utilizado neste trabalho seria válido para o estudo sobre reabsorção de substitutos ósseos(17).
Em todos os tempos analisados, a área tratada com osso autógeno apresentava até mesmo dificuldade de localização por causa de sua ótima regeneração (Figura 2); em todos os demais materiais é bem notável a presença de seus grânulos da porção inorgânica, não existindo nenhum que tenha sido completamente reabsorvido. Esses achados podem ser confirmados pelos resultados da histologia (Figuras 3, 4, 5 e 6), podendo também ser vistos em imagens de radiografia (Figura 8) retiradas após a dissecção dos fêmures.
Não houve nenhuma área com falha completa de enxertia, tendo os materiais servido para a manutenção relativa do volume da área tratada. O questionamento que deve ser feito é realmente quanto à quantidade de osso normal presente nessas áreas e a qualidade do osso resultante desse tratamento. No osso autógeno, por outro lado, em algumas áreas houve até um espessamento em relação à imagem de controle, o que explica alguns valores acima de 100% na estatística.
Concluindo, em ambos os tempos analisados (seis e 12 semanas) e no modelo testado, o enxerto ósseo autógeno apresentou média de percentagem de neoformação óssea muito superior à dos substitutos ósseos testados. Dentre os substitutos, somente houve diferenças estatisticamente significantes entre os grupos com HA e GenMix® em 12 semanas com p = 0,007 (Tabela 3).
CONCLUSÕES
Em ambos os tempos analisados, o enxerto ósseo autógeno apresentou média de percentagem de neoformação óssea muito superior à dos substitutos ósseos testados.
Trabalho realizado no Laboratório de Microcirurgia e Habilidades Médicas da PUC/RS.
- 1. Bostrom MP, Seigerman DA. The clinical use of allografts, demineralized bone matrices, synthetic bone graft substitutes and osteoinductive growth factors: a survey study. HSS J. 2005;1(1):9-18.
- 2. Burg KJ, Porter S, Kellam JF. Biomaterial developments for bone tissue engineering. Biomaterials.2000;21(23):2347-59.
- 3. Lane JM, Yasko AW, Tomin E, Cole BJ, Waller S, Browne M, et al. Bone marrow and recombinant human bone morphogenetic protein-2 in osseous repair. Clin Orthop Relat Res.1999;(361):216-27.
- 4. Pollock R, Alcelik I, Bhatia C, Chuter G, Lingutla K, Budithi C, et al. Donor site morbidity following iliac crest bone harvesting for cervical fusion: a comparison between minimally invasive and open techniques. Eur Spine J. 2008;17(6):845-52.
- 5.Öztürk A, Yetkin H, Memis L, Cila E, Bolukbasi S, Gemalmaz C. Demineralized bone matrix and hydroxyapatite/tri-calcium phosphate mixture for bone healing in rats. Int Orthop. 2006;30(3):147-52.
- 6. Soost F, Koch S, Stoll C, Amthauer H, Grosse-Siestrup C, Zorn P. Validation of bone conversion in osteoconductive and osteoinductive bone substitutes. Cell Tissue Bank. 2001;2(2):77-86.
- 7. Fariña NM, Guzon FM, Pena ML, Cantalapiedra AG. In vivo behaviour of two different biphasic ceramic implanted in mandibular bone of dogs. J Mater Sci Mater Med. 2008;19(4):1565-73.
- 8. Spector M. Basic principles of tissue engineering. In: Lynch SE, Genco RJ, Marx RE, editors. Tissue engineering: applications in maxillofacial surgery and periodontics. Chicago: Quintessence Pub. Co.; 1999. p.3-16.
- 9. Giannoudis PV, Dinopoulos H, Tsiridis E. Bone substitutes: an update. Injury. 2005;36(Suppl 3):S20-7.
- 10. Rodrigues CV, Serricella P, Linhares AB, Guerdes RM, Borojevic R, Rossi MA, et al. Characterization of a bovine collagen-hydroxyapatite composite scaffold for bone tissue engineering. Biomaterials. 2003;24(27):4987-97.
- 11. Nair MB, Suresh Babu S, Varma HK, John A. A triphasic ceramic-coated porous hydroxyapatite for tissue engineering application. Acta Biomater. 2008;4(1):173-81.
- 12. Allegrini S Jr., Yoshimoto M, Salles MB, Konig B Jr. The effects of bovine BMP associated to HA in maxillary sinus lifting in rabbits. Ann Anat. 2003;185(4):343-9.
- 13. Busenlechner D, Tangl S, Mair B, Fugger G, Gruber R, Redl H, et al. Simultaneous in vivo comparison of bone substitutes in a guided bone regeneration model. Biomaterials. 2008;29(22):3195-200.
- 14. Ye F, Lu X, Lu B, Wang J, Shi Y, Zhang L, et al. A long-term evaluation of osteoinductive HA/beta-TCP ceramics in vivo: 4.5 years study in pigs. J Mater Sci Mater Med. 2007;18(11):2173-8.
- 15. Accorsi-Mendonca T, Conz MB, Barros TC, de Sena LA, Soares Gde A, Granjeiro JM. Physicochemical characterization of two deproteinized bovine xenografts. Braz Oral Res. 2008;22(1):5-10.
- 16. Kasten P, Luginbuhl R, van Griensven M, Barkhausen T, Krettek C, Bohner M, et al. Comparison of human bone marrow stromal cells seeded on calcium-deficient hydroxyapatite, beta-tricalcium phosphate and demineralized bone matrix. Biomaterials. 2003;24(15):2593-603.
- 17. Monchau F, Lefevre A, Descamps M, Belquin-myrdycz A, Laffargue P, Hildebrand HF. In vitro studies of human and rat osteoclast activity on hydroxyapatite, beta-tricalcium phosphate, calcium carbonate. Biomol Eng. 2002;19(2-6):143-52.
Correspondência:
Datas de Publicação
-
Publicação nesta coleção
09 Set 2009 -
Data do Fascículo
2009