Resumos
OBJETIVO: O objetivo deste estudo foi de avaliar o efeito de um centrifugado de medula óssea na cicatrização de lesão muscular em coelhos. MÉTODOS: Este estudo experimental envolveu a utilização de 15 coelhos machos, adultos, da raça Nova Zelândia Branco. Em cada animal, realizou-se uma lesão transversal na região média do músculo tibial anterior direito, onde se adicionou uma esponja de colágeno absorvível, embebida em um centrifugado de aspirado de medula óssea do osso ilíaco ipsilateral. O membro posterior esquerdo foi utilizado como controle, sendo submetido à mesma lesão; porém, neste caso, adicionando-se somente a esponja de colágeno absorvível. Após 30 dias, os animais foram sacrificados para o estudo da cicatrização muscular. As áreas de cicatrização muscular foram submetidas à análise histológica com histomorfometria, interessando-se a mensuração do número de células musculares em regeneração por micrômetro quadrado e a proporção de fibrose formada. RESULTADOS: O método de centrifugação utilizado neste estudo resultou em uma concentração média de células nucleadas maior que o número destas células nos aspirados originais, sem provocar destruição celular significativa. A adição do centrifugado de medula óssea não resultou em aumento significante do número de células musculares em regeneração em relação ao grupo controle. Também não houve diferença significante na proporção de fibrose formada em relação ao grupo controle. CONCLUSÃO: A administração de centrifugado de medula óssea utilizada neste estudo não favoreceu a cicatrização de lesão muscular em coelhos.
Medula Óssea; Células-Tronco; Regeneração; Músculo Esquelético; Modelos Animais; Coelhos
OBJECTIVE: The objective of this study was to evaluate the effect of bone-marrow centrifugate on the healing of muscle injuries in rabbits. METHODS: This experimental study involved use of fifteen adult male New Zealand White rabbits. Each animal received a transverse lesion in the middle of the right tibialis anterior muscle, to which an absorbable collagen sponge, soaked in a centrifugate of bone marrow aspirate from the ipsilateral iliac bone, was added. The left hind limb was used as a control and underwent the same injury, but in this case only the absorbable collagen sponge. Thirty days later, the animals were sacrificed to study the muscle healing. These muscle areas were subjected to histological analysis with histomorphometry, with the aim of measuring the number of muscle cells per square micrometer undergoing regeneration and the proportion of resultant fibrosis. RESULTS: The centrifugation method used in this study resulted in an average concentration of nucleated cells greater than the number of these cells in original aspirates, without causing significant cell destruction. Addition of the bone marrow centrifugate did not result in any significant increase in the number of muscle cells undergoing regeneration, in relation to the control group. There was also no significant difference in the proportion of resultant fibrosis, compared with the control group. CONCLUSION: Administration of the bone marrow centrifugate used in this study did not favor healing of muscle injuries in rabbits.
Bone Marrow; Stem Cells; Regeneration; Skeletal Muscle; Animals Models; Rabbits
ARTIGO ORIGINAL
Efeito da utilização de um centrifugado de medula óssea no tratamento de lesão muscular: estudo experimental em coelhos
Daniel Ferreira Fernandes VieiraI; Roberto GuarnieroII; Carlos Eduardo Sanches VazIII; Paulo José de SantanaIV
IOrtopedia e Traumatologia, Mestre em Medicina e Ciências da Saúde Universidade Estadual de Londrina - Londrina, PR, Brasil
IIProfessor Associado da Faculdade de Medicina da Universidade de São Paulo - São Paulo, SP, Brasil
IIIProfessor Adjunto Doutor da Disciplina de Ortopedia e Traumatologia da Universidade Estadual de Londrina - Londrina, PR, Brasil
IVProfessor Adjunto Doutor da Disciplina de Ortopedia e Traumatologia da Universidade Estadual de Londrina - Londrina, PR, Brasil
Correspondência Correspondência: Carlos Eduardo Sanches Vaz Rua Borba Gato, 1.078, ap. 1.202, Jardim das Américas 86010-630 - Londrina, PR E-mail: carlos.vaz@sercomtel.com.br
RESUMO
OBJETIVO: O objetivo deste estudo foi de avaliar o efeito de um centrifugado de medula óssea na cicatrização de lesão muscular em coelhos.
MÉTODOS: Este estudo experimental envolveu a utilização de 15 coelhos machos, adultos, da raça Nova Zelândia Branco. Em cada animal, realizou-se uma lesão transversal na região média do músculo tibial anterior direito, onde se adicionou uma esponja de colágeno absorvível, embebida em um centrifugado de aspirado de medula óssea do osso ilíaco ipsilateral. O membro posterior esquerdo foi utilizado como controle, sendo submetido à mesma lesão; porém, neste caso, adicionando-se somente a esponja de colágeno absorvível. Após 30 dias, os animais foram sacrificados para o estudo da cicatrização muscular. As áreas de cicatrização muscular foram submetidas à análise histológica com histomorfometria, interessando-se a mensuração do número de células musculares em regeneração por micrômetro quadrado e a proporção de fibrose formada.
RESULTADOS: O método de centrifugação utilizado neste estudo resultou em uma concentração média de células nucleadas maior que o número destas células nos aspirados originais, sem provocar destruição celular significativa. A adição do centrifugado de medula óssea não resultou em aumento significante do número de células musculares em regeneração em relação ao grupo controle. Também não houve diferença significante na proporção de fibrose formada em relação ao grupo controle.
CONCLUSÃO: A administração de centrifugado de medula óssea utilizada neste estudo não favoreceu a cicatrização de lesão muscular em coelhos.
Descritores: Medula Óssea; Células-Tronco; Regeneração; Músculo Esquelético; Modelos Animais; Coelhos
INTRODUÇÃO
As lesões musculares compõem um dos problemas mais desafiadores da traumatologia esportiva, pois, apesar de serem comuns, seu tratamento ainda é controverso e, muitas vezes, ineficiente(1). Habitualmente, longos períodos de afastamento são necessários para que o atleta retorne plenamente às suas atividades e as sequelas podem fazer parte do resultado final(2).
O processo de cicatrização do tecido muscular costuma se iniciar prontamente assim que ocorre um traumatismo; porém, pode evoluir de maneira lenta e irregular, dificultado por uma formação excessiva de tecido conjuntivo cicatricial (fibrose)(3). Este tecido cicatricial em excesso inibe a regeneração completa da estrutura muscular preexistente e, por ser mais frágil e anômalo, contribui para a recidiva local da lesão, impedindo a recuperação completa da função muscular(4).
O tratamento mais empregado nas lesões musculares é o conservador, do qual fazem parte medidas como repouso, imobilização do membro afetado por tempo variável, aplicação local de gelo e acompanhamento fisioterápico. Em alguns casos, dependendo da gravidade da lesão, pode ser indicada a sua reparação cirúrgica. Embora estes tratamentos frequentemente conduzam a bons resultados clínicos, parecem ter efeito limitado sobre a recuperação funcional e o risco de recidiva(2).
As limitações descritas deram origem a pesquisas investigando medidas biológicas capazes de estimular o processo de regeneração muscular e prevenir a formação de fibrose(5). Isto resultou em uma melhor identificação das vias celulares e moleculares envolvidas na regeneração muscular e em um entendimento mais completo da atividade de células satélites e células pluripotentes, capazes de diferenciação miogênica durante a cicatrização muscular(6,7). Essa melhor compreensão do processo de reparação muscular abriu perspectivas favoráveis no surgimento de novas terapias(8).
Recentemente, técnicas de reparação, substituição e regeneração tecidual, empregando conhecimentos de engenharia tecidual, têm alcançado resultados promissores, dentre as quais incluem-se a captura e o transplante de células precursoras e uso de matrizes bioativas, hormônios peptídeos e fatores de crescimento(9).
Dentre estas novas técnicas, duas linhas de pesquisa têm sido bastante estudas: 1) a aplicação local do plasma rico em plaquetas, devido a suas supostas propriedades cicatrizantes, atribuídas à capacidade de recrutar, proliferar e diferenciar células envolvidas com a reparação tecidual; e 2) as terapias baseadas na adição local direta de culturas de células-tronco embrionárias, na esperança de que estas últimas se diferenciem nas células do tecido alvo.
Apesar de as terapias baseadas na adição local de culturas de células-tronco embrionárias produzidas in vitro terem demonstrado a capacidade de diferenciação em células musculares (miócitos)(10,11), a cultura e o transplante de células indiferenciadas da medula óssea são procedimentos complexos, caros e que têm tecnologia restrita a grandes centros de pesquisa(12). Por isso, a aplicação local de aspirados de medula óssea, contendo células-tronco adultas, tem sido pesquisada clínica e experimentalmente(13). Estas últimas possuem potencial de diferenciação tecidual limitado em relação às células-tronco embrionárias, porém são capazes de originar células ósseas, cartilaginosas e musculares(14). Como a adição local de miócitos está relacionada a um aumento da regeneração muscular no sítio lesado, a aplicação local de um número suficiente de suas células precursoras constitui uma abordagem promissora na tentativa de melhorar a cicatrização muscular(15,16).
O objetivo deste estudo foi avaliar o efeito positivo da adição de um centrifugado de medula óssea na cicatrização de lesão muscular em coelhos.
MÉTODOS
Este estudo experimental foi avaliado e aprovado, em 13 de março de 2007, pelo Comitê de Ética em Experimentação Animal da Universidade Estadual de Londrina.
Foram utilizados 15 coelhos machos, adultos, da raça Nova Zelândia Branco (Orytolagus cuniculus), com peso médio de 3kg e idade aproximada de quatro meses, provenientes da Fazenda Experimental de Iguatemi, da Universidade Estadual de Maringá, e criados no Biotério do Centro de Ciências da Saúde, da Universidade Estadual de Londrina. Como não há consenso na literatura quanto à forma adequada para se calcular o tamanho da amostra ideal para o estudo em questão, optou-se em se utilizar um número de animais semelhante ao utilizado nos trabalhos de referência. Alem disso, as atuais diretrizes éticas para a experimentação animal recomendam que seja utilizado o menor número possível de animais, desde que forneçam resultados estatísticos significativos. Os animais foram previamente avaliados por médico veterinário e ficaram alojados em gaiolas metálicas individuais, iluminadas diariamente por 12 horas contínuas, com temperatura, umidade e ruído ambientes mantidos estáveis. A alimentação constituiu-se de água ad libitum e ração industrial apropriada, balanceada e peletizada.
Preparo do centrifugado de medula óssea
O procedimento anestésico foi baseado no protocolo de anestesia preconizado pelo Canadian Council on Animal Care, no Guide to the Care and Use of Experimental Animals(17). Foi aplicado em cada animal, como medicação pré-anestésica, 1mg/kg de sulfato de atropina, por via intramuscular. A anestesia iniciou-se com a aplicação intramuscular, na região proximal do membro pélvico, de uma solução contendo 40 mg/kg de cloridrato de quetamina a 10%, associada a 5mg/kg de cloridrato de xilazina. Logo após a indução anestésica, os animais foram identificados com numeração, de 1 a 15, tatuada na orelha esquerda. A administração fracionada de cloridrato de xilazina 1mg/kg foi realizada quando necessário o prolongamento da anestesia.
A pele da região da crista ilíaca direita foi tricotomizada, e, após assepsia e antissepsia adequadas, realizou-se a punção da medula óssea da crista ilíaca posterior, com agulha calibre 16G com trocater. A cavidade medular foi atingida com movimentos de rotação delicados. A seguir, o trocater foi retirado, conectando-se então à agulha uma seringa plástica descartável de 10ml, cuja parte interna foi previamente embebida em solução de heparina a 1:1.000. Foram aspirados aproximadamente 5ml de medula óssea, com tração firme do êmbolo da seringa.
O material foi processado em câmara de fluxo laminar em condições estéreis. Para dispersar os agregados celulares, a amostra de 5ml da seringa plástica foi transferida para um tubo graduado estéril, inicialmente por meio de agulha calibre 19, e, a seguir, com agulha calibre 22. O material foi centrifugado a 400G e a 20°C, durante 10 minutos. Após a centrifugação, o aspirado se dividiu em três níveis distintos: uma camada superior contendo o plasma sanguíneo, uma camada intermediária denominada buffy-coat, onde são encontradas as células nucleadas (devido a sua maior densidade), das quais fazem parte células precursoras hematopoiéticas e células do estroma da medula óssea, local onde se encontram as células mesenquimais e progenitoras (precursoras de células ósseas, cartilaginosas e musculares). Finalmente, a última camada é composta pelas células vermelhas sedimentadas no fundo do tubo. O material do buffy-coat foi então homogeneizado, e uma amostra de 50 microlitros foi separada para a contagem das células e realização de teste de viabilidade celular, para se evitar a administração de células mortas que pudessem resultar do processo de centrifugação.
Técnica cirúrgica
O animal anestesiado foi posicionado em decúbito dorsal na mesa operatória, sendo feita a tricotomia das faces anteriores das pernas direita e esquerda e assepsia e antissepsia adequadas.
Realizou-se uma via de acesso anteromedial, longitudinal, no terço médio do membro posterior, com aproximadamente 3cm de extensão. Procedeu-se a dissecção por planos, abordando-se pele, tecido subcutâneo e fascia, os quais foram afastados, expondo-se o corpo do músculo tibial anterior. Com o uso de uma lâmina de bisturi nº 15, realizou-se uma incisão transversal no corpo do músculo tibial anterior, interessando 75% de sua largura, 50% de sua espessura e aproximadamente 60% de seu comprimento, a partir de sua origem proximal, conforme modelo de Menetrey et al(18). Desta forma, evita-se a secção transversal total do ventre muscular, possibilitando uma cicatrização mais uniforme entre as porções musculares separadas pela incisão e poupando-se o nervo motor em seu ponto de entrada no músculo(6).
A seguir, foram feitos pontos de reparo proximal e distal a 5mm de distância dos rebordos da lesão muscular, utilizando-se fio de sutura mononylon 4.0, segundo procedimento recomendado por Marlow et al(19). Uma amostra de esponja de gelatina absorvível (Gelfoam®) de 1,0 x 0,5cm foi embebida com o centrifugado de medula óssea e colocada sobre a lesão (Figura 1).
A ferida cirúrgica foi suturada por planos utilizando-se fio de sutura mononylon 4.0 e ocluída com curativo impermeável estéril. O mesmo procedimento foi realizado no músculo tibial anterior esquerdo; porém, apenas a esponja de gelatina absorvível foi aplicada no local.
Ao término da cirurgia, o animal foi isolado dos outros animais, colocado em caixa apropriada e aquecido. Foi administrada uma dose intramuscular de antibacteriano e anti-inflamatório, contendo penicilina G benzatina, penicilina G procaína, sulfato de diidroestreptomicina e piroxicam. Após a recuperação anestésica total, o coelho foi devolvido à sua gaiola, recebendo água e ração à vontade. A carga total nos membros operados foi liberada e permitida imediatamente, sem qualquer tipo de restrição ou imobilização. Segundo Järvinen et al(1), a mobilização precoce induz um crescimento capilar mais rápido e intenso para a área lesada, melhor regeneração e orientação mais paralela das fibras musculares, enquanto que a inatividade associa-se à atrofia significativa das fibras musculares e deposição excessiva de fibrose.
Trinta dias após a data da cirurgia, os animais foram sacrificados. Os músculos tibial anterior direito e esquerdo de cada animal foram dissecados cuidadosamente de sua inserção proximal até a sua inserção distal e retirados. Foram localizados os pontos cirúrgicos de reparo proximal e distal, a 5mm do local da lesão, sendo o músculo seccionado entre estes pontos, conforme modelo experimental descrito por Menetrey et al(18).
A seguir, as metades proximais e distais dos músculos foram colocadas em recipientes adequados, fixadas em solução de formalina a 10%, e identificadas com o número do coelho e membro posterior correspondente (direito ou esquerdo).
As amostras do tecido muscular foram então desidratadas e embebidas em parafina para o estudo histológico, orientadas de modo que a localização da face da linha média permitisse secções transversais do ponto médio da lesão. Dos blocos de parafina foram obtidos cortes histológicos de 4µm de espessura, que seguiram a rotina histológica para coloração pela hematoxilina-eosina, para avaliação histopatológica e histomorfométrica.
A avaliação dos resultados foi realizada pela mensuração histológica quantitativa (número de células musculares por µm2 e proporção de fibrose) da cicatrização da lesão muscular, comparando-se o músculo tibial anterior direito com o esquerdo a partir da face da linha média dos seus segmentos, na região intermediária da lesão muscular, sendo esta a região ideal para a quantificação da regeneração muscular, pois ocorre independentemente do suprimento vascular e em um ambiente não influenciada pelo reparo fibroso, refletindo apenas o potencial miogênico.
Os achados foram então documentados em imagens digitalizadas captadas com auxílio do sistema analisador de imagem Kontron Electronic 300 (Zeiss®), para a avaliação quantitativa. Esta rotina, semiautomatizada, foi realizada em cada campo da lâmina em estudo, sendo 10 campos por lâmina. Os resultados obtidos em cada campo, correspondentes à área analisada (número de células musculares por µm2 e proporção de fibrose), foram arquivados em planilha Microsoft Excel® para posterior análise estatística.
A análise estatística foi realizada no Departamento de Estatística do Centro de Ciências Exatas da Universidade Estadual de Londrina.
Foram calculados a média, o desvio padrão, a mediana e a amplitude interquartil das variáveis quantitativas contínuas.
Tabelas estatísticas e gráficos de coluna (média ± desvio padrão) apresentaram a estatística descritiva das variáveis: número de células musculares/µm2 e proporção de fibrose.
Foi utilizado o teste de Wilcoxon para a inferência sobre a diferença entre as observações das amostras pareadas e não paramétricas.
O nível de significância adotado foi de 5% (α = 0,05).
RESULTADOS
Na Tabela 1 estão expostos os resultados da contagem de células e do teste de viabilidade celular, realizados após a centrifugação do aspirado de medula óssea.
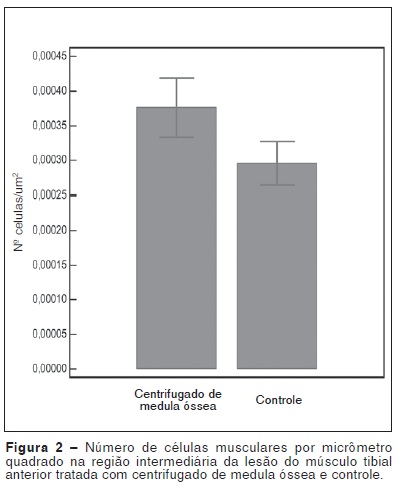
A Tabela 2 e a Figura 2 demonstram o número de células musculares por micrômetro quadrado formadas no local da lesão muscular, tratadas com centrifugado de medula óssea, em comparação com o grupo controle.
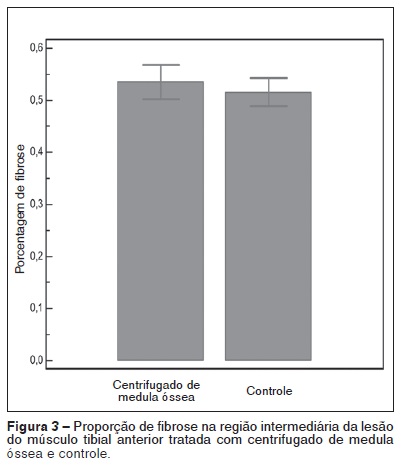
A Tabela 3 e a Figura 3 demonstram a porcentagem de fibrose formada no local da lesão muscular, tratadas com centrifugado de medula óssea, em comparação com o grupo controle.
DISCUSSÃO
As lesões musculares são extremamente comuns, constituindo em torno de 35-55% de todas as lesões relacionadas com a prática esportiva. A morbidade associada é significativa; já que essas lesões podem levar a contraturas dolorosas e atrofias musculares, requererem longos períodos de recuperação, aumentar o risco de recorrência e, em alguns casos, resultarem em impedimento para que o atleta regresse a seu nível de atividade pré-lesão.
Nos últimos anos, o desenvolvimento de terapias celulares e de engenharia tecidual estimularam pesquisas empregando estas técnicas no tratamento de lesões musculares. Estas terapias têm como finalidade estimular um aumento na formação de celulares musculares na região afetada, e, ao mesmo tempo, diminuir a formação de tecido conjuntivo cicatricial em excesso (fibrose). Esta última está diretamente relacionada ao índice de recidiva da lesão e foi demonstrada capaz de impedir o retorno do atleta à sua condição pré-lesão, em parte por prevenir a formação de novas miofibrilas, contribuindo para o declínio da contratilidade muscular e da amplitude de movimento(20). A dor resultante da formação de fibrose é também um fator limitante da recuperação funcional total durante a fisioterapia e a longo prazo.
Apesar de estudos evidenciarem a capacidade de culturas de células embrionárias progenitoras (células- tronco embrionárias) formarem tecidos ósseo, cartilaginoso e muscular, esta tecnologia é cara e complexa, e, portanto, ainda longe da prática clínica diária. Por isso, a iniciativa de utilizarmos em nossa pesquisa aspirados da medula óssea, a qual possui comprovadamente, em seu estroma, células precursoras de tecido mesenquimal adultas. Estas células também apresentam potencial, ainda que mais limitado que as células precursoras embrionárias, de se diferenciarem em células musculares.
Utilizamos o modelo de lesão muscular descrito por Menetrey et al(18), que impede a separação total das fibras musculares, favorecendo o estudo da cicatrização. Sobre o local da lesão, aplicamos uma espuma de colágeno absorvível, embebida no centrifugado de medula óssea, para impedir a dispersão das células e permitir um contato mais prolongado das mesmas com a lesão, já que a espuma permanece no local por aproximadamente quinze dias antes de ser absorvida completamente. As amostras de aspirado de medula óssea foram centrifugadas com o objetivo de separar as células nucleadas, das quais fazem parte tanto células precursoras hematopoiéticas quanto as células do estroma. Após o processo de centrifugação estar completo, estas células ficam concentradas na camada intermediária dos tubos (buffy-coat).
Embora o modelo utilizado não reproduza com fidelidade as lesões musculares mais frequentemente encontradas na prática clínica, quais sejam, as causadas por mecanismo de contusão ou laceração, optamos pelo modelo proposto pelos autores citados por este permitir uma melhor padronização da lesão em cada animal. Segundo estes autores, este modelo é de fácil execução e elimina variáveis como extensão, profundidade e intensidade da força aplicada quando se tenta causar a lesão por contusão ou laceração, permitindo uma melhor caracterização da cicatrização muscular.
Outro fator conflitante em nosso estudo foi a opção por sacrificar os animais com um intervalo de tempo único de quatro semanas. Idealmente, deveríamos avaliar a cicatrização em diversos períodos, o que permitiria um acompanhamento mais uniforme e linear. No entanto, isto exigiria uma amostra bem maior de animais, o que vem sendo desaconselhado pelos conselhos e sociedades protetoras dos animais. Preconiza-se hoje a utilização do menor número possível de animais, e, de preferência, que se trabalhe a nível tecidual (histologia). Também não há uniformização, na literatura, do cálculo do número mais adequado de animais para este tipo de estudo.
Apesar de todos estes cuidados, nossos resultados demonstraram que não houve diferença significativa no número de células musculares formadas no local das lesões musculares onde se aplicou o centrifugado de medula óssea, comparando-se com o lado controle. Também não houve diferença na porcentagem de fibrose formada, o que nos permite concluir que o concentrado de medula óssea não foi capaz de melhorar a qualidade da cicatriz muscular.
Embora a literatura frequentemente refira-se às células progenitoras mesenquimais da medula óssea como uma população homogênea, estas células na verdade são muito heterogêneas, diferindo grandemente na sua capacidade de diferenciar-se em células musculares adultas. Portanto, os aspirados de medula óssea podem ser, mesmo quando empregada a mesma técnica para sua obtenção, muito distintos com relação a quantidade de células verdadeiramente precursoras presentes em cada amostra coletada. Isto pode ser uma das causas de insucesso em nosso trabalho. De acordo com Matziolis et al(21), o processo inflamatório desencadeado pela lesão muscular pode levar à morte das células precursoras miogênicas implantadas imediatamente, podendo resultar em sobrevivência celular menor do que 10% no quinto dia após o trauma. Isto seria causado pelos fatores celulares e humorais que fazem parte dos processos de inflamação fisiológica durante os primeiros dias após a lesão. Além disso, o dano à microvascularização resulta em resposta regenerativa pobre nesta fase. Reunidos, estes fatores criam um ambiente hostil que dificulta a sobrevivência, a proliferação e a diferenciação de células transplantadas, colaborando para justificar os resultados negativos encontrados em nosso estudo.
Apesar da regeneração tecidual mediada por células- tronco embrionárias in vitro possuir potencial terapêutico promissor, Musarò et al(10) acham que a diferenciação no músculo esquelético de células-tronco adultas provenientes da medula óssea é de pouco significado clínico.
No presente estudo, a maior proporção de fibrose no grupo do tratamento, apesar de não significativa, foi uma surpresa, demonstrando ser a formação excessiva de tecido conjuntivo cicatricial, conforme a opinião de outros autores, um problema ainda a ser resolvido.
Os resultados obtidos neste estudo demonstram que o centrifugado de medula óssea não foi capaz de induzir uma melhor qualidade da cicatrização muscular, aumentando o número de fibras musculares e diminuindo a formação de fibrose.
Uma alternativa que tem sido foco de recentes pesquisas buscando-se reparar e/ou regenerar o tecido muscular é o emprego do concentrado de plaquetas, também conhecido como plasma rico em plaquetas (PRP)(22).
As plaquetas são as primeiras células a atingirem o local da lesão e são muito ativas na fase inflamatória inicial da reparação dos tecidos. Elas atuam na homeostasia tecidual, por meio de aderência, agregação, formação de coágulo e liberação de substâncias (fatores de crescimento) que promovem a reparação tecidual e que influenciam a neovascularização local(23).
As plaquetas liberam fatores de crescimento por degranulação, e o interesse em sua aplicação local nos sítios de lesão reside justamente na possibilidade de se ampliar o potencial de cicatrização tecidual pela administração direta desses fatores. Esses fatores são concentrados por meio de técnicas de centrifugação de sangue autólogo do próprio paciente, produzindo uma substância rica em plaquetas que pode ser aplicada sob forma líquida ou gelatinosa no tecido lesado(23).
Apesar do seu grande apelo, estudos recentes demonstram que há ainda muitas controvérsias sobre a real eficácia do PRP, principalmente devido à não uniformização de variáveis como quantidade a ser aplicada, concentração, intervalo de tempo etc. A maioria das pesquisas parece demonstrar um efeito favorável no tratamento das tendinoses crônicas, mas resultados conflitantes na aplicação óssea e muscular(24).
Novos estudos devem ser realizados, talvez utilizando-se populações homogêneas de células progenitoras mesenquimais, na tentativa de se regenerar as fibras musculares, resultando em uma cicatrização muscular mais adequada e na recuperação completa da função muscular pré-lesão.
CONCLUSÃO
A administração do centrifugado de medula óssea utilizada neste estudo não favoreceu a cicatrização de lesão muscular em coelhos.
Trabalho recebido para publicação: 30/11/2010, aceito para publicação: 26/05/2011.
Trabalho realizado no LIM 41 - Laboratório de Investigação Médica do Sistema Musculoesquelético do Departamento de Ortopedia e Traumatologia da Faculdade de Medicina da Universidade de São Paulo e na Disciplina de Ortopedia e Traumatologia da Universidade Estadual de Londrina.
Os autores declaram inexistência de conflito de interesses na realização deste trabalho
Este artigo está disponível online nas versões Português e Inglês nos sites: www.rbo.org.br e www.scielo.br/rbort
- 1. Järvinen TA, Järvinen TL, Kääriäinen M, Kalimo H, Järvinen M. Muscle injuries:biology and treatment. Am J Sports Med. 2005;33(5):745-64.
- 2. Armfield DR, Kim DH, Towers JD, Bradley JP, Robertson DD. Sports-related muscle injury in the lower extremity. Clin Sports Med. 2006;25(4):803-42.
- 3. Buckwalter JA, Cruess RL. A cura dos tecidos musculoesqueléticos. In: Rockwood CA, Green DP, Bucholz RW, editores. Fraturas em adultos. 3a. ed.. São Paulo: Manole; 1993. p. 179-219.
- 4. Garrett WE Jr, Seaber AV, Boswick J, Urbaniak JR, Goldner JL. Recovery of skeletal muscle after laceration and repair. J Hand Surg Am. 1984;9(5):683-92.
- 5. Huard J, Li Y, Fu FH. Muscle injuries and repair: current trends in research. J Bone Joint Surg Am. 2002;84-A(5):822-32.
- 6. Chargé SB, Rudnicki MA. Cellular and molecular regulation of muscle regeneration. Physiol Rev. 2004;84(1):209-38.
- 7. Shefer G, Wleklinski-Lee M, Yablonka-Reuveni Z. Skeletal muscle satellite cells can spontaneously enter an alternative mesenchymal pathway. J Cell Sci. 2004;117(Pt 22):5393-404.
- 8. Griffith LG, Naughton G. Tissue engineering--current challenges and expanding opportunities. Science. 2002;295(5557):1009-14.
- 9. Muschler GF, Nakamoto C, Griffith LG. Engineering principles of clinical cell-based tissue engineering. J Bone Joint Surg Am. 2004;86(7):1541-58.
- 10. Musarò A, Giacinti C, Borsellino G, Dobrowolny G, Pelosi L, Cairns L, et al. Stem cell-mediated muscle regeneration is enhanced by local isoform of insulin- like growth factor 1. Proc Natl Acad Sci U S A. 2004;101(5):1206-10.
- 11. Fukada S, Miyagoe-Suzuki Y, Tsukihara H, Yuasa K, Higuchi S, Ono S, et al. Muscle regeneration by reconstitution with bone marrow or fetal liver cells from green fluorescent protein-gene transgenic mice. J Cell Sci. 2002;115(Pt 6):1285-93.
- 12. Vaz CES. Avaliação do efeito de centrifugado osteogênico de medula óssea na consolidação de fratura: estudo experimental em coelhos [tese]. São Paulo: Universidade de São Paulo; 2006.
- 13. Connolly JF. Injectable bone marrow preparations to stimulate osteogenic repair. Clin Orthop Relat Res. 1995;(313):8-18.
- 14. Bianco P, Riminucci M, Gronthos S, Robey PG. Bone marrow stromal stem cells: nature, biology, and potential applications. Stem Cells. 2001;19(3):180-92.
- 15. Ferrari G, Cusella-De Angelis G, Coletta M, Paolucci E, Stornaiuolo A, Cossu G, et al. Muscle regeneration by bone marrow-derived myogenic progenitors.Science. 1998;279(5356):1528-30.
- 16. Muschler GF, Midura RJ. Connective tissue progenitors: practical concepts for clinical applications. Clin Orthop Relat Res. 2002;(395):66-80.
- 17. Olfert ED, Cross BM, McWilliam AA. editors. (1993). Guide to the Care and Use of Experimental Animals. 2nd ed. Ottawa: Canadian Council on Animal Care; 1993.
- 18. Menetrey J, Kasemkijwattana C, Fu FH, Moreland MS, Huard J. Suturing versus immobilization of a muscle laceration. A morphological and functional study in a mouse model. Am J Sports Med. 1999;27(2):222-9.
- 19. Marlow SA, McGeachie JK, Tennant M, Papadimitriou JM. A morphometric technique for the histological quantification of skeletal muscle regeneration. J Anat. 1996;189 ( Pt 1):151-8.
- 20. Kääriäinen M, Järvinen T, Järvinen M, Rantanen J, Kalimo H. Relation between myofibers and connective tissue during muscle injury repair. Scand J Med Sci Sports. 2000 Dec;10(6):332-7. Review. PubMed PMID: 11085560.
- 21. Matziolis G, Winkler T, Schaser K, Wiemann M, Krocker D, Tuischer J, Perka C,Duda GN. Autologous bone marrow-derived cells enhance muscle strength following skeletal muscle crush injury in rats. Tissue Eng. 2006;12(2):361-7.
- 22. Cole BJ, Seroyer ST, Filardo G, Bajaj S, Fortier LA. Platelet-Rich Plasma:Where are we now and where are we going?. Sports Health. 2010;2:203-10.
- 23. Foster TE, Puskas BL, Mandelbaum BR, Gerhardt MB, Rodeo SA. Platelet- rich plasma: from basic science to clinical applications. Am J Sports Med. 2009;37(11):2259-72.
- 24. Hall MP, Band PA, Meislin RJ, Jazrawi LM, Cardone DA. Platelet-rich plasma: current concepts and application in sports medicine. J Am Acad Orthop Surg. 2009;17(10):602-8.
Correspondência:
Datas de Publicação
-
Publicação nesta coleção
24 Fev 2012 -
Data do Fascículo
2011
Histórico
-
Aceito
26 Maio 2011 -
Recebido
30 Nov 2010