RESUMO
Introdução:
Muitos estudos publicados estimaram a associação dos polimorfismos rs2435357 e rs1800858 do proto-oncogene rearranjado durante a transfecção (RET) com o risco de doença por Hirschsprung (HSCR). No entanto, os resultados permanecem inconsistentes e controversos.
Objetivo:
Realizar metanálise para obter estimativa mais precisa da associação dos polimorfismos rs2435357 e rs1800858 no proto-oncogene RET com risco de HSCR.
Método:
A literatura elegível foi pesquisada pelo PubMed, Google Scholar, EMBASE e CNKI até 30 de junho de 2018.
Resultados:
Um total de 20 estudos, incluindo dez (1.136 casos 2.420 controles) para rs2435357 e dez (917 casos 1.159 controles) para rs1800858 foram incluídos. Os resultados globais indicaram que o rs2435357 (modelo alelo: OR=0,230, IC 95% 0,178-0,298, p=0,001; modelo homozigoto: OR=0,079, IC 95% 0,048-0,130, p=0,001; modelo heterozigoto: OR=0,149 , IC 95% 0,048-0,130, p=0,001, modelo dominante: OR=0,132, IC 95% 0,098-0,179, p=0,001 e modelo recessivo: OR=0,239, IC 95% 0,161-0,353, p=0,001) e rs1800858 (modelo alelo: OR=5,594, IC 95% 3,653-8,877, p=0,001; modelo homozigoto: OR=8,453, IC 95% 3,783-18,890, p=0,001; modelo dominante: OR=3,469, IC 95% 1,881- 6,396, p=0,001 e modelo recessivo: OR=6,120, 95% CI 3,608-10,381, p=0,001) polimorfismos foram associados com o aumento do risco de HSCR em geral.
Conclusões:
Os resultados sugerem que os polimorfismos rs2435357 e rs1800858 no proto-oncogene RET podem estar associados ao HSCR.
DESCRITORES:
Doença de Hirschsprung; Polimorfismo de nucleotídeo único; Metanálise
ABSTRACT
Introduction:
Many published studies have estimated the association of rs2435357 and rs1800858 polymorphisms in the proto-oncogene rearranged during transfection (RET) gene with Hirschsprung disease (HSCR) risk. However, the results remain inconsistent and controversial.
Aim:
To perform a meta-analysis get a more accurate estimation of the association of rs2435357 and rs1800858 polymorphisms in the RET proto-oncogene with HSCR risk.
Methods:
The eligible literatures were searched by PubMed, Google Scholar, EMBASE, and Chinese National Knowledge Infrastructure (CNKI) up to June 30, 2018. Summary odds ratios (ORs) and 95% confidence intervals (CIs) were used to evaluate the susceptibility to HSCR.
Results:
A total of 20 studies, including ten (1,136 cases 2,420 controls) for rs2435357 and ten (917 cases 1,159 controls) for rs1800858 were included. The overall results indicated that the rs2435357 (allele model: OR=0.230, 95% CI 0.178-0.298, p=0.001; homozygote model: OR=0.079, 95% CI 0.048-0.130, p=0.001; heterozygote model: OR=0.149, 95% CI 0.048-0.130, p=0.001; dominant model: OR=0.132, 95% CI 0.098-0.179, p=0.001; and recessive model: OR=0.239, 95% CI 0.161-0.353, p=0.001) and rs1800858 (allele model: OR=5.594, 95% CI 3.653-8.877, p=0.001; homozygote model: OR=8.453, 95% CI 3.783-18.890, p=0.001; dominant model: OR=3.469, 95% CI 1.881-6.396, p=0.001; and recessive model: OR=6.120, 95% CI 3.608-10.381, p=0.001) polymorphisms were associated with the increased risk of HSCR in overall.
Conclusions:
The results suggest that the rs2435357 and rs1800858 polymorphisms in the RET proto-oncogene might be associated with HSCR risk.
HEADINGS:
Hirschsprung disease; Polymorphism; Single Nucleotide; Meta-Analysis
INTRODUÇÃO
A doença de Hirschsprung (HSCR), também conhecida como megacólon congênito, é um defeito congênito com risco de vida caracterizado pela ausência de gânglios entéricos nos plexos submucoso e mioentérico do trato gastrointestinal66 Butler Tjaden NE, Trainor PA. The developmental etiology and pathogenesis of Hirschsprung disease. Translational research?: the journal of laboratory and clinical medicine. 2013;162(1):1-15.. Sua incidência varia de 1:5.000 a 1:10.000 nascidos vivos, com uma proporção total de homens para mulheres de 3:1 a 5:1, particularmente naqueles com segmentos curtos1616 Hofstra RMW, Elfferich P, Osinga J, Verlind E, Fransen E, LópezPisón J, et al. Hirschsprung disease and L1CAM: is the disturbed sex ratio caused by L1CAM mutations? Journal of medical genetics. 2002;39(3):E11.,2121 Lin Y-C. Nationwide Population-Based Epidemiologic Study of Hirschsprung's Disease in Taiwan. Pediatrics & Neonatology. 2016;57(3):165-6.. O diagnóstico é estabelecido em 15% no primeiro mês de vida, em 40-50% nos primeiros três meses, em 60% no final do primeiro ano de vida e em 85% em quatro anos77 Chumpitazi B, Nurko S. Pediatric gastrointestinal motility disorders: challenges and a clinical update. Gastroenterology & hepatology. 2008;4(2):140-8.. O mecanismo exato dela é desconhecido, mas é claro que fatores genéticos e ambientais estão envolvidos66 Butler Tjaden NE, Trainor PA. The developmental etiology and pathogenesis of Hirschsprung disease. Translational research?: the journal of laboratory and clinical medicine. 2013;162(1):1-15.. O cromossomo 21 da trissomia é a anormalidade cromossômica mais frequente (>90% dos casos) associada à doença HSCR11 Amiel J, Sproat-Emison E, Garcia-Barcelo M, Lantieri F, Burzynski G, Borrego S, et al. Hirschsprung disease, associated syndromes and genetics: a review. Journal of Medical Genetics. 2007;45(1):1-14.. Além disso, está acompanhada de outras malformações congênitas em 5-32% dos casos, incluindo o trato gastrintestinal, por anomalias do SNC, deficiência auditiva e anomalias congênitas do rim e do trato urinário2828 Moore SW. The contribution of associated congenital anomalies in understanding Hirschsprung's disease. Pediatric Surgery International. 2006;22(4):305-15.,3131 Pini Prato A, Rossi V, Mosconi M, Holm C, Lantieri F, Griseri P, et al. A prospective observational study of associated anomalies in Hirschsprung's disease. Orphanet journal of rare diseases. 2013;8:184.. Fatores de risco perinatais e ambientais para a HSCR, como vitamina A, idade materna, obesidade, paridade, hipotireoidismo durante a gravidez, uso de medicamentos têm sido pouco estudados; no entanto, os resultados não foram consistentes1515 Heuckeroth RO. Hirschsprung disease-integrating basic science and clinical medicine to improve outcomes. Nature Reviews Gastroenterology & Hepatology. 2018;15(3):152-67.,2222 Lo f Granstro m A, Svenningsson A, Hagel E, Oddsberg J, Nordenskjo ld A, Wester T. Maternal Risk Factors and Perinatal Characteristics for Hirschsprung Disease. PEDIATRICS. 2016;138(1):e20154608-e20154608.,4343 Zwink N, Jenetzky E. Maternal drug use and the risk of anorectal malformations: systematic review and meta-analysis. Orphanet journal of rare diseases. 2018;13(1):75.
A HSCR pode ser hereditária autossômica dominante, autossômica recessiva e até mesmo poligênica11 Amiel J, Sproat-Emison E, Garcia-Barcelo M, Lantieri F, Burzynski G, Borrego S, et al. Hirschsprung disease, associated syndromes and genetics: a review. Journal of Medical Genetics. 2007;45(1):1-14.. Entretanto, aproximadamente em 30% dos casos, está associado a outras malformações88 de Pontual L, Pelet A, Trochet D, Jaubert F, Espinosa-Parrilla Y, Munnich A, et al. Mutations of the RET gene in isolated and syndromic Hirschsprung's disease in human disclose major and modifier alleles at a single locus. Journal of medical genetics. 2006;43(5):419-23.. Análises de associação genética identificaram 12 loci de susceptibilidade incluindo EDNRB, EDN3, GDNF, NTN, SOX10, PHOX2B, ECE1, KIAA1279 / KBP, ZFHX1B, TTF-1 e NRG113. Entretanto, variações na maioria desses locos são encontradas principalmente nos casos sindrômicos, nos quais a HSCR está associada a outras malformações congênitas11 Amiel J, Sproat-Emison E, Garcia-Barcelo M, Lantieri F, Burzynski G, Borrego S, et al. Hirschsprung disease, associated syndromes and genetics: a review. Journal of Medical Genetics. 2007;45(1):1-14.,88 de Pontual L, Pelet A, Trochet D, Jaubert F, Espinosa-Parrilla Y, Munnich A, et al. Mutations of the RET gene in isolated and syndromic Hirschsprung's disease in human disclose major and modifier alleles at a single locus. Journal of medical genetics. 2006;43(5):419-23.. Análises de ligação de famílias de HSCR multiplexadas estabeleceram que o proto-oncogene rearranjado durante a transfecção (RET) é o principal gene de susceptibilidade ao seu desenvolvimento88 de Pontual L, Pelet A, Trochet D, Jaubert F, Espinosa-Parrilla Y, Munnich A, et al. Mutations of the RET gene in isolated and syndromic Hirschsprung's disease in human disclose major and modifier alleles at a single locus. Journal of medical genetics. 2006;43(5):419-23.. O RET é um receptor tirosina quinase transmembrana que também está envolvido na neoplasia endócrina múltipla tipo 2 (NEM 2), causando carcinoma medular de tireoide, feocromocitoma e hiperparatireoidismo primário1818 Krampitz GW, Norton JA. RET gene mutations (genotype and phenotype) of multiple endocrine neoplasia type 2 and familial medullary thyroid carcinoma. Cancer. 2014;120(13):1920-31.,2525 Machens A, Dralle H. Multiple endocrine neoplasia type 2: achievements and current challenges. Clinics. 2012;67(S1):113-8.. Entre as variações do gene RET, os polimorfismos rs2435357 e rs1800858, localizados no íntron 1 e no éxon 2 do gene RET, respectivamente, foram amplamente investigados no HSCR. No entanto, os resultados de diferentes estudos são controversos88 de Pontual L, Pelet A, Trochet D, Jaubert F, Espinosa-Parrilla Y, Munnich A, et al. Mutations of the RET gene in isolated and syndromic Hirschsprung's disease in human disclose major and modifier alleles at a single locus. Journal of medical genetics. 2006;43(5):419-23..
Portanto, realizamos revisão sistemática atual e metanálise para esclarecer as associações do SNP rs2435357 e rs1800858 com a susceptibilidade à HSCR.
MÉTODO
Estratégia de pesquisa da literatura
Foi realizada uma pesquisa bibliográfica abrangente utilizando PubMed, EMBASE, Google scholar, banco de dados chinês de biomédica, WanFang e VIP para identificar todos os estudos elegíveis avaliando a associação dos polimorfismos Rs2435357 e rs1800858 com risco de PCR até junho 30, 2018. As palavras-chave foram as seguintes: (‘’Doença de Hirschsprung’’ OU ‘’HSCR’’ OR ‘’megacólon congênito ‘) E (‘’Reorganizar durante transfecção’’ OR ‘’RET Proto-oncogene ‘’ OU ‘’Proto-Oncogene C-Ret’’ OU ‘’gene RET’’ OU ‘’Membro da Família Relacionada com Caderina 16’’ OR ‘’Membro da Família Caderina 12’’) AND (‘’rs1800858 ‘’ OR ‘’c .135G>A’’ OU ‘’Ala45Ala’’) E (‘’rs2435357 ‘’ OU ‘’ IVS1 + 9277C> T’’ OU ‘’c.73 + 9277C>T’’) AND (“polimorfismo” OR “SNPs”OR “variação “OR” locus “OR” mutation”). A pesquisa foi limitada a estudos em humanos e estudos publicados. Além disso, a lista de referências de estudos relevantes de caso-controle e revisões foram manualmente pesquisadas para identificar quaisquer estudos elegíveis adicionais. Se dois ou mais estudos tivessem dados iguais ou sobrepostos, apenas o estudo com a maior amostra ou o estudo publicado mais recentemente foi incluído na meta-análise.
Coleção de dados
Os dados dos estudos publicados relevantes foram extraídos independentemente por dois dos autores e digitados em um questionário personalizado. Em seguida, os dados extraídos foram comparados e os desacordos foram resolvidos por meio de discussão entre os dois pesquisadores. Para cada estudo elegível, os seguintes dados foram extraídos: nome do primeiro autor, ano de publicação, país de origem, etnia, métodos de genotipagem, fonte de controles (base populacional e hospitalar), números de casos e controles, frequência genotípica de SNPs, frequência alélica menor nos controles e equilíbrio de Hardy-Weinberg (HWE) nos controles. A etnia foi dividida em asiáticos e caucasianos ou outros. Além disso, estudos foram realizados em diferentes populações foram considerados como estudos independentes.
Critérios de inclusão e exclusão
Os estudos selecionados foram incluídos na metanálise se atendessem aos seguintes critérios: 1) estudos caso-controle ou coorte; 2) avaliar a associação dos polimorfismos rs2435357 e rs1800858 do gene RET com a susceptibilidade à HSCR; 3) estudos com dados suficientes para realizar uma metanálise. Assim, estudos com as seguintes características foram excluídos: 1) não caso-controle ou coorte; 2) sem população controle; 3) estudos com dados insuficientes disponíveis ou ausência de dados de distribuição de genótipos; 4) resumos, comentários, relatos de casos, cartas, editoriais, revisões e revisões sistemáticas; 5) estudos publicados contendo dados duplicados.
Análise estatística
A força da associação dos polimorfismos rs2435357 e rs1800858 do RET com o risco de HSCR foi medida por odds ratios (OR) com intervalos de confiança de 95% (IC). A significância estatística do resumo OR foi determinada usando o teste-Z. Foram utilizados cinco modelos para avaliar as associações dos polimorfismos rs2435357 e rs1800858 do RET com o risco de HSCR incluindo: modelo de alelo (B vs. A), modelo homozigoto (BB vs. AA), modelo heterozigótico (BB vs. BA), modelo dominante (BB + BA vs. AA) e modelo recessivo (BB vs. AA + BA). A heterogeneidade entre os estudos foi avaliada pelo teste Q baseado no qui-quadrado, em que um valor de p menor que <0,05 foi considerado uma heterogeneidade óbvia. Além disso, o valor de I2 foi utilizado para testar o grau de heterogeneidade, em que I2<25%, sem heterogeneidade; I2 25-50%, heterogeneidade moderada; I2>50%, heterogeneidade grande ou extrema1717 Kamali M, Hantoushzadeh S, Borna S, Neamatzadeh H, Mazaheri M, Noori-Shadkam M, et al. Association between Thrombophilic Genes Polymorphisms and Recurrent Pregnancy Loss Susceptibility in the Iranian Population: a Systematic Review and Meta-Analysis. Iranian biomedical journal. 2018;22(2):78-89.. O modelo de efeitos fixos foi usado para agrupar as OR e 95% de intervalo confidencial (IC) quando não houve heterogeneidade significativa. Caso contrário, o modelo de efeitos aleatórios (o método DerSimonian e Laird) foi usado. O equilíbrio de Hardy-Weinberg foi avaliado pelo teste qui-quadrado de ajuste de bondade. Uma análise de sensibilidade foi realizada principalmente pela omissão de um único estudo de cada vez para avaliar a estabilidade das RUP agrupadas obtidas. Além disso, análises de sensibilidade foram realizadas por omissão de estudos violadores de HWE. O possível viés de publicação foi estimado pelo gráfico de funil, no qual o erro padrão de log (OR) de cada estudo foi plotado contra seu log (OR). Além disso, a assimetria do gráfico de funil foi posteriormente avaliada pelo método do teste de regressão linear de Egger, no qual p<0,05 foi considerado um viés de publicação significativo. A qualidade dos dados genotípicos foi estimada pelo equilíbrio de Hardy-Weinberg (HWE) e estudos de baixa qualidade desviados do HWE foram excluídos na análise de sensibilidade. Todos os testes nesta metanálise foram realizados com o software Comprehensive meta-analysis CMA (versão 2.0; College Station, TX). Valores de p<0,05 foram considerados estatisticamente significativos. A aprovação ética não foi necessária, uma vez que se tratava de uma metanálise baseada em estudos anteriores, e sem a entrega direta de dados pessoais ou o recrutamento de participantes.
RESULTADOS
Características do estudo
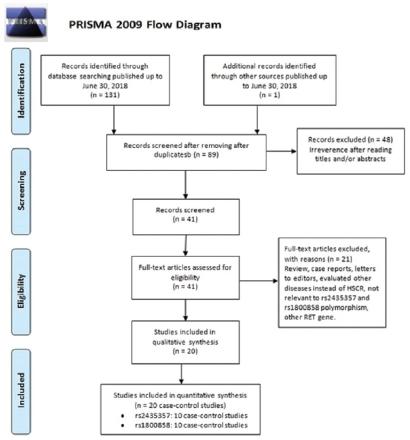
Após a pesquisa on-line de vários bancos de dados, 131 publicações potencialmente relevantes foram recuperadas. Conforme mostrado na Figura 1, após excluir as duplicatas, 89 publicações foram mantidas. Dentre eles, 69 foram excluídas por serem irrelevantes, revisões/resumos, não sobre seres humanos, ou não publicadas em inglês. Finalmente, 20 estudos caso-controle, incluindo nove com 1.136 casos de HSCR 2.420 controles para rs2435357 33 Arnold S, Pelet A, Amiel J, Borrego S, Hofstra R, Tam P, et al. Interaction between a chromosome 10 RET enhancer and chromosome 21 in the Down syndrome-Hirschsprung disease association. Human mutation. 2009;30(5):771-5.,1414 Gunadi, Dwihantoro A, Iskandar K, Makhmudi A, Rochadi. Accuracy of polymerase chain reaction-restriction fragment length polymorphism for RET rs2435357 genotyping as Hirschsprung risk. Journal of Surgical Research. 2016;203(1):91-4.,1919 Li Q, Zhang Z, Diao M, Gan L, Cheng W, Xiao P, et al. Cumulative Risk Impact of RET, SEMA3, and NRG1 Polymorphisms Associated With Hirschsprung Disease in Han Chinese. Journal of Pediatric Gastroenterology and Nutrition. 2017;64(3):385-90.,2727 Miao X, Leon TY-Y, Ngan ES-W, So M-T, Yuan Z-W, Lui VC-H, et al. Reduced RET expression in gut tissue of individuals carrying risk alleles of Hirschsprung's disease. Human Molecular Genetics. 2010;19(8):1461-7.,3030 Phusantisampan T, Sangkhathat S, Phongdara A, Chiengkriwate P, Patrapinyokul S, Mahasirimongkol S. Association of genetic polymorphisms in the RET-protooncogene and NRG1 with Hirschsprung disease in Thai patients. Journal of human genetics. 2012;57(5):286-93.,3232 Prato AP, Musso M, Ceccherini I, Mattioli G, Giunta C, Ghiggeri GM, et al. Hirschsprung Disease and Congenital Anomalies of the Kidney and Urinary Tract (CAKUT). Medicine. 2009;88(2):83-90.,4040 Yang D, Yang J, Li S, Jiang M, Cao G, Yang L, et al. Effects of RET, NRG1 and NRG3 Polymorphisms in a Chinese Population with Hirschsprung Disease. Scientific Reports. 2017;7:43222.,4141 Zhang X-N, Zhou M-N, Qiu Y-Q, Ding S-P, Qi M, Li J-C. Genetic Analysis of RET, EDNRB, and EDN3 Genes and Three SNPs in MCS + 9.7 in Chinese Patients with Isolated Hirschsprung Disease. Biochemical Genetics. 2007;45(7-8):523-7.,4242 Zhang Z, Jiang Q, Li Q, Cheng W, Qiao G, Xiao P, et al. Genotyping analysis of 3 RET polymorphisms demonstrates low somatic mutation rate in Chinese Hirschsprung disease patients. International journal of clinical and experimental pathology. 2015 ;8(5):5528-34. e dez com 917 casos de HSCR 1.159 controles para rs180085855 Burzynski GM, Nolte IM, Osinga J, Ceccherini I, Twigt B, Maas S, et al. Localizing a putative mutation as the major contributor to the development of sporadic Hirschsprung disease to the RET genomic sequence between the promoter region and exon 2. European Journal of Human Genetics. 2004;12(8):604-12.,99 Du H, Wang G, Zhang Y, Tao K, Tang S, Niu Y. [Association between RET proto-oncogene polymorphisms and Hirschsprung disease in Chinese Han population of Hubei district]. Zhonghuaweichangwaikezazhi = Chinese journal of gastrointestinal surgery. 2006;9(2):152-6.,1010 Fitze G, Appelt H, König IR, Görgens H, Stein U, Walther W, et al. Functional haplotypes of the RET proto-oncogene promoter are associated with Hirschsprung disease (HSCR). Human Molecular Genetics. 2003;12(24):3207-14.,1212 Garcia-Barcelo M, Ganster RW, Lui VCH, Leon TYY, So M-T, Lau AMF, et al. TTF-1 and RET promoter SNPs: regulation of RET transcription in Hirschsprung's disease. Human Molecular Genetics. 2005;14(2):191-204.,2323 Liu C, Jin L, Li H, Lou J, Luo C, Zhou X, et al. RET polymorphisms and the risk of Hirschsprung's disease in a Chinese population., Journal of Human Genetics. 2008;53(9):825-33.,2424 Liu C-P, Tang Q-Q, Lou J-T, Luo C-F, Zhou X-W, Li D-M, et al. Association Analysis of the RET Proto-Oncogene with Hirschsprung Disease in the Han Chinese Population of Southeastern China. Biochemical Genetics. 2010;48(5-6):496-503.,3030 Phusantisampan T, Sangkhathat S, Phongdara A, Chiengkriwate P, Patrapinyokul S, Mahasirimongkol S. Association of genetic polymorphisms in the RET-protooncogene and NRG1 with Hirschsprung disease in Thai patients. Journal of human genetics. 2012;57(5):286-93.,3434 Saryono S, Rochadi R, Lestariana W, Artama WT, Sadewa AH. RET single nucleotide polymorphism in Indonesians with sporadic Hirschsprung's disease. UniversaMedicina. 2016;29(2):71-7.,3737 Tou J, Wang L, Liu L, Wang Y, Zhong R, Duan S, et al. Genetic variants in RET and risk of Hirschsprung's disease in Southeastern Chinese: a haplotype-based analysis. BMC Medical Genetics. 2011;12(1):32.,3939 Xiansheng Z, Ying Z, Ya G, Quan X, Yitao D, Xinkui G, et al. The relationship between Hirschsprung disease and single nucleotide polymorphisms of c135 in RET proto-oncogene. JOURNAL OF XI'AN JIAOTONG UNIVERSITY (MEDICAL SCIENCES). 2005 ;26(5):470-472,492. foram incluídos. As características de cada estudo estão resumidas na Tabela 1. Entre os 18 de caso-controle, 14 foram realizados em asiáticos e quatro em caucasianos. Todos incluídos foram publicados entre 2003 e 2017. O tamanho da amostra dos casos da HSCR variou de 16 a 362. Os métodos de genotipagem utilizados incluíram PCR, PCR-RFLP, ensaio TaqMan e PCR-HRM. Quatorze correspondências para os controles foram baseados na população, dois foram hospitalares e dois não declararam. Todos os estudos mostraram que a distribuição dos genótipos no grupo controle estava de acordo com o EHW (p<0,05), com exceção de dois estudos2222 Lo f Granstro m A, Svenningsson A, Hagel E, Oddsberg J, Nordenskjo ld A, Wester T. Maternal Risk Factors and Perinatal Characteristics for Hirschsprung Disease. PEDIATRICS. 2016;138(1):e20154608-e20154608.,2323 Liu C, Jin L, Li H, Lou J, Luo C, Zhou X, et al. RET polymorphisms and the risk of Hirschsprung's disease in a Chinese population., Journal of Human Genetics. 2008;53(9):825-33. para polimorfismos rs2435357 e dois2828 Moore SW. The contribution of associated congenital anomalies in understanding Hirschsprung's disease. Pediatric Surgery International. 2006;22(4):305-15.,2929 Namazi A, Forat-Yazdi M, Jafari MA, Foroughi E, Farahnak S, Nasiri R, et al. Association between polymorphisms of ERCC5 gene and susceptibility to gastric cancer: A systematic review and meta-analysis. Asian Pacific Journal of Cancer Prevention. 2017;18(10). para rs1800858.
Síntese de dados quantitativos
rs2435357
A Tabela 2 listou os principais resultados da metanálise do polimorfismo rs2435357 no proto-oncogene RET e risco de HSCR. Agrupamos todos os dez estudos de caso-controle para avaliar a associação global do polimorfismo rs2435357 com o risco de HSCR. A análise global combinada sugere associação significativa entre o polimorfismo rs2435357 e o risco de HSCR nas estimativas gerais em todos os cinco modelos genéticos, isto é, alelo (C vs. T: OR=0,230, IC 95% 0,178-0,298, p=0,001, Figura 2A), homozigoto (CC vs. TT: OR=0,079, IC 95% 0,048-0,130, p=0,001); heterozigico (CT vs. TT: OR=0,149, IC 95% 0,048-0,130, p=0,001); dominante (CC + CT vs. TT: OR=0,132, IC 95% 0,098-0,179, p=0,001); e recessivo (CC vs. CT + TT: OR=0,239, IC 95% 0,161-0,353, p=0,001).
Plots de floresta dos polimorfismos rs2435357 e rs1800858 no gene RET e risco de HSCR: A) rs2435357 (modelo alelo: C vs. T); B) rs1800858 (modelo heterozigoto: AG vs. GG)
rs1800858
A Tabela 2 listou os principais resultados da metanálise do polimorfismo rs1800858 no proto-oncogene RET e risco de HSCR. A análise global combinada sugere associação significativa do polimorfismo rs1800858 e do risco de HSCR em quatro modelos genéticos, i. e. alelo (A vs. G: OR=5,594, IC 95% 3,653-8,877, p=0,001); homozigoto (AA vs. GG: OR=8,453, IC 95% 3,783-18,890, p=0,001); dominante (AA + AG vs. GG: OR=3,469, IC 95% 1,881-6,396, p=0,001); e recessivo (AA vs. AG + GG: OR=6,120, IC 95% 3,608-10,381, p=0,001), mas não sob modelo heterozigoto (GA vs. GG: OR=1,238, IC 95% 0,575-2,666, p=0,585, Figura 2B).
Análise sensitiva
A análise de sensibilidade foi realizada omitindo cada estudo em cada modelo genético ou removendo certos estudos, tais como os estudos que não estavam em conformidade com o HWE. Após a omissão do estudo individual, a OR combinada correspondente não foi alterada de forma significativa. Isso indica que nossos resultados são estatisticamente robustos em todos os cinco modelos genéticos que examinam associações de polimorfismos rs2435357 e rs1800858 com risco de HSCR.
Viés de publicação
O gráfico de funil de Begg e o teste de Egger foram realizados para avaliar o possível viés de publicação dos estudos incluídos. As formas da trama do funil de Begg não revelaram nenhuma evidência de assimetria óbvia em todos os cinco modelos genéticos. Além disso, a regressão linear de Egger também não mostrou evidência estatística significativa de viés de publicação para rs2435357 em todos os cinco modelos genéticos, ou seja, alelo (C vs. T: PBeggs=0.858 e PEggers=0.209), homozigoto (CC vs. TT: PBeggs=0,371 e PEggers=0,178, Figura 3A), heterozigoto (CT vs. TT: PBeggs=1.000 e PEggers =0,156), dominante (CC + CT vs. TT: PBeggs=0,371 e PEggers=0,068) e recessivo (CC vs CT + TT: PBeggs=0,107 e PEggers=0,219). Além disso, o teste de Egger não revelou polimorfismo rs1800858 de viés de publicação em todos os cinco modelos genéticos, ou seja, alelo (A vs. G: PBeggs=0,210 e PEggers=0,469), homozigoto (AA vs. GG: PBeggs=0,591 e PEggers=0,934 ), heterozigoto (AG vs. GG: PBeggs=1.000 e PEggers=0.883), dominante (AA + AG vs. GG: PBeggs=0.591 e PEggers=0.800) e recessivo (AA vs. AG + GG: PBeggs=1.000 e PEggers=0,798, Figura 3B).
Gráfico de funil para a detecção do viés de publicação para a associação dos polimorfismos rs2435357 e rs1800858 no gene RET com risco de HSCR, foi utilizado um modelo de efeitos aleatórios: A) rs2435357 (modelo homozigoto: CC vs. TT); B) rs1800858 (modelo recessivo: AA vs. AG + GG).
DISCUSSÃO
O gene para o proto-oncogene RET, membros da família do fator neurotrófico derivado da linhagem glial (GDNF), mapeia para o cromossomo 10q11.21, contém 21 exons e cobre 60 kbp DNA3636 Tan L, Hu Y, Tao Y, Wang B, Xiao J, Tang Z, et al. Expression and copy number gains of the RET gene in 631 early and mid stage non-small cell lung cancer cases. Thoracic cancer. 2018;9(4):445-51.. O proto-oncogene RET codifica uma proteína tirosina quinase do receptor trans-membrana com um domínio extracelular rico em cisteína e um domínio intracelular enriquecido em tirosina, que é importante na transferência de sinais de crescimento e diferenciação celular3333 Santos MACG dos, Quedas EP de S, Toledo R de A, Lourenço DM, Toledo SP de A. Screening of RET gene mutations in multiple endocrine neoplasia type-2 using conformation sensitive gel electrophoresis (CSGE). Arquivos brasileiros de endocrinologia e metabologia. 2007;51(9):1468-76.. As mutações de perda de função germinativa proto-oncogênica RET estão associadas ao desenvolvimento de HSCR, enquanto mutações de ganho de função são responsáveis pelo desenvolvimento de vários tipos de câncer humano, incluindo carcinoma medular de tireoide, neoplasia endócrina múltipla tipo 2 (MEN 2) e 2B , feocromocitoma e hiperplasia das paratireóides44 Borrego S, Wright FA, Fernández RM, Williams N, López-Alonso M, Davuluri R, et al. A Founding Locus within the RET Proto-Oncogene May Account for a Large Proportion of Apparently Sporadic Hirschsprung Disease and a Subset of Cases of Sporadic Medullary Thyroid Carcinoma. The American Journal of Human Genetics. 2003;72(1):88-100.. Até o momento, várias correlações genótipo-fenótipo foram definidas em associação de mutações no RET com diferentes variantes da síndrome de MEN2, incluindo MEN 2A, MEN 2B e carcinoma medular de tireoide (FMTC)3838 Wang J, Zhang B, Liu W, Zhang Y, Di X, Yang Y, et al. Screening of RET gene mutations in Chinese patients with medullary thyroid carcinoma and their relatives. Familial Cancer. 2016;15(1):99-104..
Diversos estudos foram publicados explorando a associação dos polimorfismos rs2435357 e rs1800858 no proto-oncogene RET com risco de HSCR. No entanto, os resultados desses estudos foram inconsistentes e inconclusivos, devido às diferenças étnicas e ao pequeno tamanho da amostra. Portanto, a metanálise como uma ferramenta poderosa para resumir os resultados dos diferentes estudos é necessária para alcançar uma conclusão mais abrangente e confiável em ambos os polimorfismos, a fim de fornecer mais informações sobre este assunto debatido. Esta metanálise e revisão sistemática, incluindo dez estudos com 1.136 casos 2.420 controles para rs2435357 e dez com 917 casos 1.159 controles para rs1800858 foram identificados e analisadosnesta metanálise. Descobrimos que os polimorfismos rs2435357 e rs1800858 no gene RET estão associados ao risco de HSCR. Esses achados são consistentes com a metanálise de Liang et al.2020 Liang C, Ji D, Yuan X, Ren L, Shen J, Zhang H. RET and PHOX2B Genetic Polymorphisms and Hirschsprung's Disease Susceptibility: A Meta-Analysis. Leung FCC, editor. PLoS ONE. 2014;9(3):e90091.. Eles realizaram uma metanálise sobre a associação do polimorfismo rs2435357 com cinco estudos (566 casos e 719 controles) e polimorfismo rs1800858 com nove estudos (863 casos e 1.118 controles) com risco de HSCR. Descobriram que os polimorfismos rs2435357 e rs1800858 do RET estão associados à suscetibilidade à HSCR. No entanto, sua metanálise mostra que o tamanho da amostra é pequeno e não é suficiente para detectar as possíveis associações.
A heterogeneidade entre estudos é comum em metanálises e a identificação de fontes potenciais de heterogeneidade é um componente essencial da metanálise2626 Mashhadiabbas F, Neamatzadeh H, Nasiri R, Foroughi E, Farahnak S, Piroozmand P, et al. Association of vitamin D receptor BsmI, TaqI, FokI, and ApaI polymorphisms with susceptibility of chronic periodontitis: A systematic review and meta-analysis based on 38 case-control studies. Dental Research Journal. 2018;15(3):155.,3535 Sobhan MR, Mahdinezhad-Yazdi M, Aghili K, Zare-Shehneh M, Rastegar S, Sadeghizadeh-Yazdi J, et al. Association of TNF-a-308?G?>?A and -238G?>?A polymorphisms with knee osteoarthritis risk: A case-control study and meta-analysis. Journal of Orthopaedics. 2018;15(3):747-53.. As fontes mais potenciais de heterogeneidade em metanálise de associação genética são o desenho do estudo, etnia, métodos de genotipagem, fonte de controles e assim por diante22 Aslebahar F, Neamatzadeh H, Meibodi B, Karimi-Zarchi M, Tabatabaei RS, Noori-Shadkam M, et al. Association of Tumor Necrosis Factor-a (TNF-a) -308G>A and -238G>A Polymorphisms with Recurrent Pregnancy Loss Risk: A Meta-Analysis. International Journal of Fertility & Sterility. 2019;(4).,1111 Forat-Yazdi M, Jafari M, Kargar S, Abolbaghaei SM, Nasiri R, Farahnak S, et al. Association between SULT1A1 Arg213His (Rs9282861) polymorphism and risk of breast cancer: A systematic review and meta-analysis. Journal of Research in Health Sciences. 2017;17(4).,2929 Namazi A, Forat-Yazdi M, Jafari MA, Foroughi E, Farahnak S, Nasiri R, et al. Association between polymorphisms of ERCC5 gene and susceptibility to gastric cancer: A systematic review and meta-analysis. Asian Pacific Journal of Cancer Prevention. 2017;18(10).. O viés de seleção, embora não tenha sido observado viés de publicação, é uma possível fonte importante de heterogeneidade. Portanto, realizamos análise de subgrupo e análise de sensibilidade removendo estudos que violam HWE para descobrir a fonte de heterogeneidade nesta metanálise. No entanto, a heterogeneidade antes e após a análise do subgrupo e o processo de remoção do estudo individual não diminuíram ou desapareceram. Assim, este achado confirmou que os resultados da metanálise foram estatisticamente robustos e que nossos resultados foram confiáveis e estáveis.
Este estudo tem duas vantagens principais: primeiro, esta foi a metanálise mais precisa e abrangente sobre os polimorfismos rs2435357 e rs1800858 do RET com risco de HSCR; segundo, nenhum viés de publicação foi observado nos resultados dela, indicando que nossos resultados podem ser imparciais. No entanto, houve algumas limitações para este estudo que podem ter afetado nossas conclusões. Primeiro, o presente estudo foi limitado pelo número relativamente pequeno de estudos e tamanho da amostra nos polimorfismos rs2435357 e rs1800858, o que levou a trabalhos menores na análise de subgrupos e enfraquecer o poder estatístico; assim, precisa-se de mais estudos. Em segundo lugar, apenas estudos em populações asiáticas e caucasianas foram envolvidos nesta metanálise. Esse viés pode existir porque não conseguimos determinar o papel dos polimorfismos rs2435357 e rs1800858 em populações inteiras. Assim, estudos em outras etnias, como africanos e latinos, devem ser realizados para determinar os efeitos potenciais da variação étnica na suscetibilidade à HSCR. Terceiro, incluímos apenas os dados de estudos publicados, o viés de publicação pode existir, embora nossos resultados de testes de viés de publicação não tenham significado. Quarto, porque as informações relevantes eram insuficientes nos dados originais, não realizamos análises de estratificação por outras co-variáveis como idade, gênero e assim por diante. Isso pode ter causado um viés de confusão. Por fim, sabe-se que o HSCR tem causa multifatorial do envolvimento em gene-gene e interações do ambiente gênico. No entanto, essas interações não puderam ser investigadas na presente metanálise devido a nenhum dado apropriado.
CONCLUSÃO
Esta metanálise sugeriu que os polimorfismos rs2435357 e rs1800858 no proto-oncogene RET podem estar associados à suscetibilidade à HSCR. No entanto, devido ao tamanho relativamente pequeno dos trabalhos incluídos, futuros estudos de larga escala sobre diferentes etnias são necessários para confirmar esses achados.
REFERENCES
-
1Amiel J, Sproat-Emison E, Garcia-Barcelo M, Lantieri F, Burzynski G, Borrego S, et al. Hirschsprung disease, associated syndromes and genetics: a review. Journal of Medical Genetics. 2007;45(1):1-14.
-
2Aslebahar F, Neamatzadeh H, Meibodi B, Karimi-Zarchi M, Tabatabaei RS, Noori-Shadkam M, et al. Association of Tumor Necrosis Factor-a (TNF-a) -308G>A and -238G>A Polymorphisms with Recurrent Pregnancy Loss Risk: A Meta-Analysis. International Journal of Fertility & Sterility. 2019;(4).
-
3Arnold S, Pelet A, Amiel J, Borrego S, Hofstra R, Tam P, et al. Interaction between a chromosome 10 RET enhancer and chromosome 21 in the Down syndrome-Hirschsprung disease association. Human mutation. 2009;30(5):771-5.
-
4Borrego S, Wright FA, Fernández RM, Williams N, López-Alonso M, Davuluri R, et al. A Founding Locus within the RET Proto-Oncogene May Account for a Large Proportion of Apparently Sporadic Hirschsprung Disease and a Subset of Cases of Sporadic Medullary Thyroid Carcinoma. The American Journal of Human Genetics. 2003;72(1):88-100.
-
5Burzynski GM, Nolte IM, Osinga J, Ceccherini I, Twigt B, Maas S, et al. Localizing a putative mutation as the major contributor to the development of sporadic Hirschsprung disease to the RET genomic sequence between the promoter region and exon 2. European Journal of Human Genetics. 2004;12(8):604-12.
-
6Butler Tjaden NE, Trainor PA. The developmental etiology and pathogenesis of Hirschsprung disease. Translational research?: the journal of laboratory and clinical medicine. 2013;162(1):1-15.
-
7Chumpitazi B, Nurko S. Pediatric gastrointestinal motility disorders: challenges and a clinical update. Gastroenterology & hepatology. 2008;4(2):140-8.
-
8de Pontual L, Pelet A, Trochet D, Jaubert F, Espinosa-Parrilla Y, Munnich A, et al. Mutations of the RET gene in isolated and syndromic Hirschsprung's disease in human disclose major and modifier alleles at a single locus. Journal of medical genetics. 2006;43(5):419-23.
-
9Du H, Wang G, Zhang Y, Tao K, Tang S, Niu Y. [Association between RET proto-oncogene polymorphisms and Hirschsprung disease in Chinese Han population of Hubei district]. Zhonghuaweichangwaikezazhi = Chinese journal of gastrointestinal surgery. 2006;9(2):152-6.
-
10Fitze G, Appelt H, König IR, Görgens H, Stein U, Walther W, et al. Functional haplotypes of the RET proto-oncogene promoter are associated with Hirschsprung disease (HSCR). Human Molecular Genetics. 2003;12(24):3207-14.
-
11Forat-Yazdi M, Jafari M, Kargar S, Abolbaghaei SM, Nasiri R, Farahnak S, et al. Association between SULT1A1 Arg213His (Rs9282861) polymorphism and risk of breast cancer: A systematic review and meta-analysis. Journal of Research in Health Sciences. 2017;17(4).
-
12Garcia-Barcelo M, Ganster RW, Lui VCH, Leon TYY, So M-T, Lau AMF, et al. TTF-1 and RET promoter SNPs: regulation of RET transcription in Hirschsprung's disease. Human Molecular Genetics. 2005;14(2):191-204.
-
13Goldstein AM, Hofstra RMW, Burns AJ. Building a brain in the gut: development of the enteric nervous system. Clinical genetics. 2013;83(4):307-16.
-
14Gunadi, Dwihantoro A, Iskandar K, Makhmudi A, Rochadi. Accuracy of polymerase chain reaction-restriction fragment length polymorphism for RET rs2435357 genotyping as Hirschsprung risk. Journal of Surgical Research. 2016;203(1):91-4.
-
15Heuckeroth RO. Hirschsprung disease-integrating basic science and clinical medicine to improve outcomes. Nature Reviews Gastroenterology & Hepatology. 2018;15(3):152-67.
-
16Hofstra RMW, Elfferich P, Osinga J, Verlind E, Fransen E, LópezPisón J, et al. Hirschsprung disease and L1CAM: is the disturbed sex ratio caused by L1CAM mutations? Journal of medical genetics. 2002;39(3):E11.
-
17Kamali M, Hantoushzadeh S, Borna S, Neamatzadeh H, Mazaheri M, Noori-Shadkam M, et al. Association between Thrombophilic Genes Polymorphisms and Recurrent Pregnancy Loss Susceptibility in the Iranian Population: a Systematic Review and Meta-Analysis. Iranian biomedical journal. 2018;22(2):78-89.
-
18Krampitz GW, Norton JA. RET gene mutations (genotype and phenotype) of multiple endocrine neoplasia type 2 and familial medullary thyroid carcinoma. Cancer. 2014;120(13):1920-31.
-
19Li Q, Zhang Z, Diao M, Gan L, Cheng W, Xiao P, et al. Cumulative Risk Impact of RET, SEMA3, and NRG1 Polymorphisms Associated With Hirschsprung Disease in Han Chinese. Journal of Pediatric Gastroenterology and Nutrition. 2017;64(3):385-90.
-
20Liang C, Ji D, Yuan X, Ren L, Shen J, Zhang H. RET and PHOX2B Genetic Polymorphisms and Hirschsprung's Disease Susceptibility: A Meta-Analysis. Leung FCC, editor. PLoS ONE. 2014;9(3):e90091.
-
21Lin Y-C. Nationwide Population-Based Epidemiologic Study of Hirschsprung's Disease in Taiwan. Pediatrics & Neonatology. 2016;57(3):165-6.
-
22Lo f Granstro m A, Svenningsson A, Hagel E, Oddsberg J, Nordenskjo ld A, Wester T. Maternal Risk Factors and Perinatal Characteristics for Hirschsprung Disease. PEDIATRICS. 2016;138(1):e20154608-e20154608.
-
23Liu C, Jin L, Li H, Lou J, Luo C, Zhou X, et al. RET polymorphisms and the risk of Hirschsprung's disease in a Chinese population., Journal of Human Genetics. 2008;53(9):825-33.
-
24Liu C-P, Tang Q-Q, Lou J-T, Luo C-F, Zhou X-W, Li D-M, et al. Association Analysis of the RET Proto-Oncogene with Hirschsprung Disease in the Han Chinese Population of Southeastern China. Biochemical Genetics. 2010;48(5-6):496-503.
-
25Machens A, Dralle H. Multiple endocrine neoplasia type 2: achievements and current challenges. Clinics. 2012;67(S1):113-8.
-
26Mashhadiabbas F, Neamatzadeh H, Nasiri R, Foroughi E, Farahnak S, Piroozmand P, et al. Association of vitamin D receptor BsmI, TaqI, FokI, and ApaI polymorphisms with susceptibility of chronic periodontitis: A systematic review and meta-analysis based on 38 case-control studies. Dental Research Journal. 2018;15(3):155.
-
27Miao X, Leon TY-Y, Ngan ES-W, So M-T, Yuan Z-W, Lui VC-H, et al. Reduced RET expression in gut tissue of individuals carrying risk alleles of Hirschsprung's disease. Human Molecular Genetics. 2010;19(8):1461-7.
-
28Moore SW. The contribution of associated congenital anomalies in understanding Hirschsprung's disease. Pediatric Surgery International. 2006;22(4):305-15.
-
29Namazi A, Forat-Yazdi M, Jafari MA, Foroughi E, Farahnak S, Nasiri R, et al. Association between polymorphisms of ERCC5 gene and susceptibility to gastric cancer: A systematic review and meta-analysis. Asian Pacific Journal of Cancer Prevention. 2017;18(10).
-
30Phusantisampan T, Sangkhathat S, Phongdara A, Chiengkriwate P, Patrapinyokul S, Mahasirimongkol S. Association of genetic polymorphisms in the RET-protooncogene and NRG1 with Hirschsprung disease in Thai patients. Journal of human genetics. 2012;57(5):286-93.
-
31Pini Prato A, Rossi V, Mosconi M, Holm C, Lantieri F, Griseri P, et al. A prospective observational study of associated anomalies in Hirschsprung's disease. Orphanet journal of rare diseases. 2013;8:184.
-
32Prato AP, Musso M, Ceccherini I, Mattioli G, Giunta C, Ghiggeri GM, et al. Hirschsprung Disease and Congenital Anomalies of the Kidney and Urinary Tract (CAKUT). Medicine. 2009;88(2):83-90.
-
33Santos MACG dos, Quedas EP de S, Toledo R de A, Lourenço DM, Toledo SP de A. Screening of RET gene mutations in multiple endocrine neoplasia type-2 using conformation sensitive gel electrophoresis (CSGE). Arquivos brasileiros de endocrinologia e metabologia. 2007;51(9):1468-76.
-
34Saryono S, Rochadi R, Lestariana W, Artama WT, Sadewa AH. RET single nucleotide polymorphism in Indonesians with sporadic Hirschsprung's disease. UniversaMedicina. 2016;29(2):71-7.
-
35Sobhan MR, Mahdinezhad-Yazdi M, Aghili K, Zare-Shehneh M, Rastegar S, Sadeghizadeh-Yazdi J, et al. Association of TNF-a-308?G?>?A and -238G?>?A polymorphisms with knee osteoarthritis risk: A case-control study and meta-analysis. Journal of Orthopaedics. 2018;15(3):747-53.
-
36Tan L, Hu Y, Tao Y, Wang B, Xiao J, Tang Z, et al. Expression and copy number gains of the RET gene in 631 early and mid stage non-small cell lung cancer cases. Thoracic cancer. 2018;9(4):445-51.
-
37Tou J, Wang L, Liu L, Wang Y, Zhong R, Duan S, et al. Genetic variants in RET and risk of Hirschsprung's disease in Southeastern Chinese: a haplotype-based analysis. BMC Medical Genetics. 2011;12(1):32.
-
38Wang J, Zhang B, Liu W, Zhang Y, Di X, Yang Y, et al. Screening of RET gene mutations in Chinese patients with medullary thyroid carcinoma and their relatives. Familial Cancer. 2016;15(1):99-104.
-
39Xiansheng Z, Ying Z, Ya G, Quan X, Yitao D, Xinkui G, et al. The relationship between Hirschsprung disease and single nucleotide polymorphisms of c135 in RET proto-oncogene. JOURNAL OF XI'AN JIAOTONG UNIVERSITY (MEDICAL SCIENCES). 2005 ;26(5):470-472,492.
-
40Yang D, Yang J, Li S, Jiang M, Cao G, Yang L, et al. Effects of RET, NRG1 and NRG3 Polymorphisms in a Chinese Population with Hirschsprung Disease. Scientific Reports. 2017;7:43222.
-
41Zhang X-N, Zhou M-N, Qiu Y-Q, Ding S-P, Qi M, Li J-C. Genetic Analysis of RET, EDNRB, and EDN3 Genes and Three SNPs in MCS + 9.7 in Chinese Patients with Isolated Hirschsprung Disease. Biochemical Genetics. 2007;45(7-8):523-7.
-
42Zhang Z, Jiang Q, Li Q, Cheng W, Qiao G, Xiao P, et al. Genotyping analysis of 3 RET polymorphisms demonstrates low somatic mutation rate in Chinese Hirschsprung disease patients. International journal of clinical and experimental pathology. 2015 ;8(5):5528-34.
-
43Zwink N, Jenetzky E. Maternal drug use and the risk of anorectal malformations: systematic review and meta-analysis. Orphanet journal of rare diseases. 2018;13(1):75
-
Fonte de financiamento:
não há
Datas de Publicação
-
Publicação nesta coleção
21 Out 2019 -
Data do Fascículo
2019
Histórico
-
Recebido
26 Jun 2018 -
Aceito
16 Jan 2019