RESUMO - RACIONAL:
Apesar da recomendação atual que o cistoadenoma seroso deva ser tratado de forma conservadora, significativa parte dos pacientes com essa condição ainda é operada por dúvida diagnóstica.
OBJETIVO:
Analisar causas da baixa acurácia diagnóstica do cistoadenoma seroso.
MÉTODOS:
Estudo retrospectivo de portadores de cistoadenoma seroso de um banco de dados de dois ambulatórios de cirurgia hepatopancreaticobiliar entre 2006 e 2020. Foram incluídos pacientes com lesões típicas de cistoadenoma seroso aos exames de imagem (tomografia computadorizada, ressonância magnética e ecoendoscopia) e pacientes que o anatomopatológico confirmasse esse diagnóstico.
RESULTADOS:
27 pacientes foram incluídos. 85,18% eram do sexo feminino. A idade média foi de 63,4 anos. Apenas um apresentava sintomas típicos de pancreatite. A Ressonância magnética foi o exame mais realizado (62,9%). A lesão era única em 88,9% e o tamanho médio foi 4 cm. O aspecto típico microcístico foi encontrado em 66,6% dos casos, os demais foram considerados atípicos. A ecoendoscopia foi realizada em 29,6%. O valor médio de antígeno carcinoembrionário nos pacientes submetidos à punção do cisto foi de 198,25 ng/mL. O tratamento cirúrgico foi realizado em 10 casos (37%). Em 7, a causa cirúrgica foi a suspeita do cistoadenoma mucinoso mediante identificação de lesões atípicas (unilocular com ou sem septos e macrocística). Em 2, a suspeita de neoplasia papilar intraductal mucinosa com “fatores preocupantes” foi a indicação cirúrgica. O último foi submetido à cirurgia por lesão de aspecto sólido e suspeita de câncer. O índice de complicações > ou = Clavien-Dindo 2 foi 30%, o índice de fístula pancreática clinicamente relevante (B e C) foi 30%. A mortalidade foi nula.
CONCLUSÃO:
A apresentação morfológica atípica do cistoadenoma seroso, particularmente lesões uniloculares e macrocísticas, é a principal responsável pela indicação cirúrgica. Apenas a implementação de novos, eficientes e reprodutíveis métodos diagnósticos poderá reduzir o número de cirurgias desnecessárias nesses pacientes.
DESCRITORES:
Cistoadenoma Seroso; Neoplasias Pancreáticas; Cisto Pancreático
ABSTRACT - BACKGROUND:
Many patients with serous cystadenoma of the pancreas (SCP) underwent surgery due to diagnostic doubt.
AIM:
The aim of this study was to analyze the causes of low accuracy in diagnosing SCP.
METHODS:
This is a retrospective study of patients with SCP from a database of two hepatopancreatic biliary surgery outpatient clinics between 2006 and 2020. Patients with typical SCP lesions in imaging exams (e.g., tomography, magnetic resonance imaging [MRI], and endoscopic ultrasound [EUS]) and patients whose pathological testing confirmed this diagnosis were included.
RESULTS:
A total of 27 patients were included in this study. Most patients were women (85.18%), and the mean age was 63.4 years. Only one patient had typical pancreatitis symptoms. MRI was the most performed method (62.9%). The lesion was single in 88.9%, and the average size was 4 cm. The typical microcystic aspect was found in 66.6%. EUS was performed in 29.6% of cases. The mean carcinoembryonic antigen value in patients undergoing cyst puncture was 198.25 ng/mL. Surgical treatment was performed in 10 cases (37%). The cause of surgery in seven of these cases was due to a suspicion of mucinous cystadenoma based on an identification of atypical lesions (unilocular with or without septa and macrocystic) in imaging exams. A suspicion of intraductal papillary mucinous neoplasm with “worrying factors” was the indication for surgery in two cases. The last case underwent surgical treatment for a solid-looking lesion which was suspected of cancer. The complication rate ≥Clavien-Dindo 2 was 30%, and the clinically relevant pancreatic fistula rate (B and C) was 30%. Mortality was nil.
CONCLUSION:
The atypical morphological presentation of SCP, particularly unilocular and macrocystic lesions, is the main indication for surgery. Only the implementation of new, efficient, and reproducible diagnostic methods can reduce the number of unnecessary surgeries among these patients.
HEADINGS:
Cystadenoma, Serous; Pancreatic Neoplasms; Pancreatic Cyst
INTRODUÇÃO
O Cistoadenoma Seroso (CAS) é um tipo de Neoplasia Cística do Pâncreas (NCP) encontrado com frequência na prática clínica graças ao número crescente de exames de imagem realizados na atualidade. Com um bom curso clínico e risco desprezível de malignização, hoje se reconhece que o tratamento conservador é adequado para a grande maioria dos pacientes. A despeito disso, um significativo número de portadores de CAS ainda são operados e isso decorre, segundo a maioria dos estudos, por uma baixa acurácia dos exames de imagem1313. Del Chiaro M, Segersvärd R, Pozzi Mucelli R, Rangelova E, Kartalis N, Ansorge C, Arnelo U, Blomberg J, Löhr M, Verbeke C. Comparison of Preoperative Conference-Based Diagnosis with Histology of Cystic Tumors of the Pancreas. Ann Surg Oncol. 2014;21(5):1539-44. doi: 10.1245/s10434-013-3465-9.
https://doi.org/10.1245/s10434-013-3465-...
. Em um estudo recente2323. Slobodkin I, Luu AM, Höhn P, Fahlbusch T, Tannapfel A, Uhl W, Belyaev O. Is surgery for serous cystic neoplasms of the pancreas still indicated? Sixteen years of experience at a high-volume center. Pancreatology. 2021;21(5):983-989. doi: 10.1016/j.pan.2021.03.020.
https://doi.org/10.1016/j.pan.2021.03.02...
, por exemplo, dos 133 pacientes portadores de CAS que foram ressecados, apenas um em cada quatro pacientes foram corretamente diagnosticados antes da cirurgia.
Os motivos dessa baixa acurácia ainda não foram esclarecidos. Utilizando uma série de pacientes portadores de CAS e seguidos em nosso ambulatório, o objetivo do presente estudo é :1) analisar a acurácia dos exames de imagem/endoscópicos no diagnóstico do CAS e 2) quando presentes, avaliar as causas dos erros de diagnóstico nestes pacientes.
MÉTODOS
Foram avaliados de forma retrospectiva os pacientes de um banco de dados do primeiro autor (E.C.A.), atendidos entre 2006 e 2020 no Centro de Gastroenterologia e Endoscopia Digestiva de Natal e no Hospital Universitário Onofre Lopes da Universidade Federal do Rio Grande do Norte (HUOL - UFRN), localizados na cidade de Natal, Rio Grande do Norte, Brasil, com diagnóstico de CAS. O estudo foi aprovado através do parecer consubstanciado do Comitê de Ética e Pesquisa de número: 4.382.180 de 05/novembro/2020.
Os pacientes foram diagnosticados com CAS e, portanto, incluídos caso apresentassem uma das seguintes condições: 1) CAS típico aos exames de tomografia computadorizada, ressonância magnética (RM) ou ecoendoscopia (EE). A lesão microcística de acordo com a classificação de Sahani2222. Sahani DV, Kadavigere R, Saokar A, Fernandez-del Castillo C, Brugge WR, Hahn PF. Cystic pancreatic lesions: a simple imaging based classification system for guiding management. Radiographics. 2005;25(6):1471-84. doi: 10.1148/rg.256045161.
https://doi.org/10.1148/rg.256045161...
, ou seja, lesão com múltiplos (usualmente mais de 6) e pequenos (<2cm) cistos agrupados foi considerada típica do CAS. A não comunicação do cisto com os ductos pancreáticos era necessária para o diagnóstico. Uma cicatriz central embora típica, pela sua infrequência, não foi considerada necessária para o diagnóstico; 2) Lesões císticas não típicas, sem comunicação com ductos pancreáticos, submetidas à EE em que a dosagem do antígeno carcinoembrionário fosse < 192mcg/L; 3) CAS confirmada em exame anatomopatológico nos casos submetidos à ressecção cirúrgica.
Para evitar a inclusão de pseudocistos de pâncreas, foram excluídos os pacientes que apresentavam: 1) Ingesta de álcool superior a 40 gramas de etanol/dia por mais de 5 anos; 2) Diagnóstico de pancreatite crônica; 3) Antecedente de pancreatite aguda anterior ao diagnóstico do CAS e; 4) Antecedente de trauma abdominal.
Na investigação dos pacientes portadores de NCP, foi solicitada, inicialmente, uma tomografia computadorizada ou uma RM. A EE, por ser o exame mais invasivo, era indicado apenas em caso de dúvida diagnóstica. Esse último exame tornou-se disponível para os pacientes do Gastrocentro e do Hospital Universitário Onofre Lopes em 2012 e 2017, respectivamente.
A indicação cirúrgica ocorreu nas seguintes situações: 1) Na presença de sintomas típicos relacionados à lesão (pancreatite aguda e sintomas relacionados à compressão pelo cisto das estruturas adjacentes); 2) Na suspeita de NCP (não CAS) com indicação cirúrgica. Uma vez indicada a cirurgia, apenas os pacientes aptos com bom risco cirúrgico, eram de fato encaminhados para o procedimento.
Naqueles pacientes operados, o tipo de cirurgia foi determinado pela localização da lesão no pâncreas e, também, pela relação da lesão com o ducto pancreático principal. A partir de 2013, para as lesões de corpo e cauda de pâncreas, o acesso laparoscópico tornou-se o procedimento de escolha. Drenos (1 ou 2) tubulares ou laminares siliconados foram usados rotineiramente. Os drenos foram mantidos por pelo menos 6 dias e retirados com base no valor de amilase, a partir do sétimo dia. As complicações dos procedimentos foram categorizadas segundo a classificação Clavien-Dindo1414. Dindo D, Demartines N, Clavien PA. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey. Ann Surg. 2004;240(2):205-13. doi: 10.1097/01.sla.0000133083.54934.ae.
https://doi.org/10.1097/01.sla.000013308...
, sendo o diagnóstico de fístula pancreática definido pelo Grupo de Estudo Internacional de Cirurgia Pancreática55. Bassi C, Dervenis C, Butturini G, Fingerhut A, Yeo C, Izbicki J, Neoptolemos J, Sarr M, Traverso W, Buchler M; International Study Group on Pancreatic Fistula Definition. Postoperative pancreatic fistula: an international study group (ISGPF) definition. Surgery. 2005;138(1):8-13. doi: 10.1016/j.surg.2005.05.001.
https://doi.org/10.1016/j.surg.2005.05.0...
. Dessa forma, a fístula pancreática foi definida quando, em qualquer momento a partir do 3º dia de pós-operatório, o valor da amilase do líquido dos drenos fosse maior que três vezes o limite superior para a amilase sérica22. Amico EC, Alves JR, João SA, Guimarães PL, Barreto EJ, Barreto LS, Costa PR, Medeiros JA. Complications after pancreatectomies: prospective study after ISGFP and ISGPS new classifications. Arq Bras Cir Dig. 2013;26(3):213-8. doi: 10.1590/s0102- 67202013000300011.
https://doi.org/10.1590/s0102- 672020130...
. A mortalidade foi considerada até 90 dias de pós-operatório.
Os pacientes sem indicação cirúrgica e que por esse motivo foram tratados de forma conservadora foram submetidos à seguimento clínico e radiológico.
RESULTADOS
No período do estudo, 97 pacientes foram diagnosticados com NCP. Desses, 27 pacientes (27,8%), foram incluídos no estudo por serem portadores de CAS. Haviam 23 (85,18%) mulheres e 4 (14,81%) homens, com uma idade média de 63,4 (31-89) anos. Com relação às comorbidades, a mais prevalente foi a hipertensão arterial sistêmica, relatada por 37,03% dos pacientes (n=10), seguida por diabetes mellitus, em 33,33% dos doentes (n=9). Apenas um paciente apresentava sintomas típicos relacionados ao CAS, tratava-se de uma paciente de 89 anos, com quadro de demência, com exame de imagem típico de CAS de 7,0 x 6,1 cm em cabeça de pâncreas e com 2 episódios de pancreatite.
A tomografia computadorizada foi mais solicitada na primeira metade do estudo e depois substituída pela RM que passou a ser solicitada preferencialmente. Desta forma, a maior parte dos pacientes foi submetida à RM (62,9%), enquanto a tomografia computadorizada foi o segundo exame mais solicitado (37,0%). Em 8 pacientes (29,6%), a EE foi realizada. Desses submetidos à EE, 6 pacientes estavam no grupo de tratamento conservador (6 pacientes) e os outros 2, no grupo de pacientes que foram operados.
A lesão era única em 88,9% dos pacientes (n=24), enquanto em 11,11% (n=3) duas ou mais lesões foram encontradas. Quando mais de uma lesão era encontrada, a neoplasia papilar intraductal mucinosa era tipicamente o segundo diagnóstico. O tamanho médio da lesão foi de 4 cm (1,2-10 cm). Em 18,5% (5/27) dos casos foi identificada calcificação, sendo mais frequentemente localizada no centro da lesão. Quanto à localização da lesão no pâncreas, na maioria dos casos, a lesão estava localizada no corpo/cauda do pâncreas (55,5%), enquanto cabeça/processo uncinado do pâncreas foi a segunda localização mais frequente (44,4%).
Quanto à morfologia, a lesão microcística foi encontrada em 66,6% (18/27) dos casos; a lesão unilocular com ou sem septos, em 22,2% (6/27); a lesão macrocística em 7,4% (2/27), e a lesão sólida em 3,7% (1/27) (Figuras 1 e 2). Em dois casos, um com lesão microcística e outro com lesão unilocular com septo, uma comunicação com o ducto pancreático principal foi sugerida em exame de RM. Em nenhum desses dois casos tal achado foi confirmado no exame anatomopatológico. O ducto pancreático principal estava dilatado (entre 5 e 9 mm) em dois casos (7,4%) e, em ambos, essa dilatação foi atribuída à compressão pela lesão. As características das lesões são apresentadas na Tabela 1 e nas Figuras 1 e 2. A análise do antígeno carcinoembrionário e da amilase do líquido aspirado do cisto foi realizada em 4 pacientes. A dosagem média do antígeno carcinoembrionário foi de 198,25 ng/mL (0,2-530), em 2 pacientes o valor foi considerado típico de CAS por ser inferior a 192 ng/mL. O valor médio da Amilase foi de 6.154 U/L (43-12.458 U/L).
Dois pacientes com CAS típicos ambos em exame de RM. Em 1 é identificado lesão microcística em cabeça do pâncreas medindo 5,8 x 5,2 cm e, em 2, lesão microcística em cauda do pâncreas medindo 4,5 x 4,2 cm.
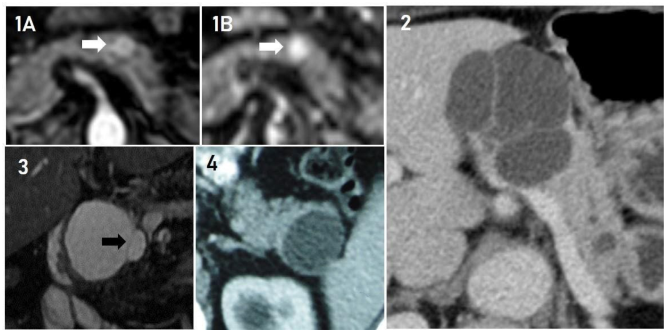
Quatro pacientes com CAS atípicos. 1A e 1B: CAS de aspecto sólido à RM. Em 1A, fase arterial do exame mostrando lesão de 1,0 cm com captação arterial em corpo do pâncreas (seta branca). Em 1B, observa-se que a lesão restringe a difusão (seta branca). 2: Lesão macrocística em corpo do pâncreas. 3: Lesão unilocular de 5,0 cm com septo (septo identificado com a seta preta) em processo uncinado de pâncreas. 4: Lesão unilocular sem septos em cauda do pâncreas medindo 3,7 x 3,2 cm.
O tratamento cirúrgico foi realizado em 10 casos (37,0%; 10/27) e correspondeu à 34,5% (10/29) dos casos de indicação cirúrgica por NCP e à 7,3% (10/136) de todas as pancreatectomias realizadas pelo primeiro autor (ECA), no período do estudo. Em 6 casos a cirurgia foi realizada na avaliação inicial, enquanto em 4 casos, após um período médio de seguimento de 26,2 meses (8-54). A indicação cirúrgica foi motivada em 7 casos, por suspeita de cistoadenoma mucinoso (em 4 desses casos por lesões uniloculares sem septos em corpo/cauda do pâncreas; em 2 casos por lesões macrocísticas e; em 1 caso por lesão unilocular com septo). Em 2 casos, a indicação cirúrgica foi por suspeita de neoplasia papilar intraductal mucinosa (a partir da identificação de suposta comunicação com o ducto pancreático principal) associada a “fatores preocupantes”. E por fim, em 1 caso a indicação se deu por lesão sólida arterializada e suspeita de tumor neuroendócrino. Os procedimentos cirúrgicos indicados foram: pancreatectomia corpo-caudal com esplenectomia (60% (6/10) - 4 dos quais por acesso laparoscópico); gastroduodenopancreatectomia (20%); enucleação (10%) e pancreatectomia central (10%). Os pacientes não apresentaram nenhuma complicação, apresentaram grau I Clavien-Dindo e grau II Clavien-Dindo em, respectivamente, 30%, 40% e 30% dos casos. A fístula pancreática clinicamente relevante (graus B e C) esteve presente em 30% dos casos. O tempo médio de internação foi de 10,1 dias (5 - 29 dias) e a mortalidade foi nula.
DISCUSSÃO
A abordagem da NCP passou por um evidente progresso nos últimos 30 anos. Enquanto nos anos noventa a ressecção cirúrgica sistemática era defendida por grande parte dos autores2626. Warshaw AL, Compton CC, Lewandrowski K, Cardenosa G, Mueller PR. Cystic tumors of the pancreas. New clinical, radiologic, and pathologic observations in 67 patients. Ann Surg. 1990;212(4):432- 43; discussion 444-5. doi: 10.1097/00000658-199010000-00006.
https://doi.org/10.1097/00000658-1990100...
, atualmente graças às melhorias dos exames de imagem e também ao melhor conhecimento das doenças envolvidas, essa conduta é considerada inaceitável.
O CAS é frequente e considerado na maioria das vezes assintomático, com um curso clínico benigno e associado a um desprezível potencial de malignidade. Por esses motivos é considerado um dos melhores exemplos nos quais a pancreatectomia deva ser evitada1717. Jais B, Rebours V, Malleo G, Salvia R, Fontana M, Maggino L, Bassi C, Manfredi R, Moran R, Lennon AM, et al. Serous cystic neoplasm of the pancreas: a multinational study of 2622 patients under the auspices of the International Association of Pancreatology and European Pancreatic Club (European Study Group on Cystic Tumors of the Pancreas). Gut. 2016;65(2):305-12. doi: 10.1136/gutjnl-2015-309638.
https://doi.org/10.1136/gutjnl-2015-3096...
.
Na maior casuística de NCP submetidas à ressecção e, portanto, com confirmação diagnóstica, Valsangkar et al.2525. Valsangkar NP, Morales-Oyarvide V, Thayer SP, Ferrone CR, Wargo JA, Warshaw AL, Fernández-del Castillo C. 851 resected cystic tumors of the pancreas: a 33-year experience at the Massachusetts General Hospital. Surgery. 2012;152(3Suppl1):S4-12.doi: 10.1016/j.surg.2012.05.033.
https://doi.org/10.1016/j.surg.2012.05.0...
estudaram 851 pacientes no Massachusetts General Hospital no período de 1978 a 2011. Quando comparado o primeiro (1978-1989) com o último período do estudo (2005-2011), os autores observaram uma queda, de 26,9% para 11,7% na prevalência de cirurgias por CAS. Séries recentes, no entanto, continuam a apontar que uma parte significativa dos pacientes ainda é operada. Anonsen et al.33. Ånonsen K, Sahakyan MA, Kleive D, Waage A, Verbeke C, Hauge T, Buanes T, Edwin B, Labori KJ. Trends in management and outcome of cystic pancreatic lesions - analysis of 322 cases undergoing surgical resection. Scand J Gastroenterol. 2019;54(8):1051-1057. doi: 10.1080/00365521.2019.1642379.
https://doi.org/10.1080/00365521.2019.16...
, por exemplo, incluindo 322 casos de NCP submetidos à ressecção, encontrou o CAS como causa da cirurgia em praticamente 1/4 (23,9%) de todos os casos. Um número maior de cirurgias em portadores de CAS foi encontrado em um grande estudo multicêntrico realizado em 71 centros de 23 países e que envolveu 2622 pacientes portadores de CAS. Nesse estudo, o índice de pancreatectomias foi de 60%1717. Jais B, Rebours V, Malleo G, Salvia R, Fontana M, Maggino L, Bassi C, Manfredi R, Moran R, Lennon AM, et al. Serous cystic neoplasm of the pancreas: a multinational study of 2622 patients under the auspices of the International Association of Pancreatology and European Pancreatic Club (European Study Group on Cystic Tumors of the Pancreas). Gut. 2016;65(2):305-12. doi: 10.1136/gutjnl-2015-309638.
https://doi.org/10.1136/gutjnl-2015-3096...
.
A pancreatectomia continua sendo um procedimento com alto índice de morbidade e, por esse motivo, estabelecer um diagnóstico correto do CAS sem a necessidade da ressecção do pâncreas tem sido e será, cada vez mais, o objetivo na abordagem desses pacientes. Para tanto, a caracterização do aspecto morfológico da lesão pelos modernos exames de imagem disponíveis, particularmente a RM, é adequada e suficiente na maioria dos casos. Desde sua descrição original por Compagno e Oertel1111. Compagno J, Oertel JE. Microcystic adenomas of the pancreas (glycogen-rich cystadenomas): a clinicopathologic study of 34 cases. Am J Clin Pathol. 1978;69(3):289-98. doi: 10.1093/ajcp/69.1.289.
https://doi.org/10.1093/ajcp/69.1.289...
em 1978, ocasião em que o foi denominado de “adenoma microcístico”, o CAS é tipicamente descrito como uma lesão cística pancreática onde pequenos (poucos milímetros até < 20 mm) e múltiplos (mais que 6) cistos encontram-se agrupados em um aspecto em “cacho de uvas”2222. Sahani DV, Kadavigere R, Saokar A, Fernandez-del Castillo C, Brugge WR, Hahn PF. Cystic pancreatic lesions: a simple imaging based classification system for guiding management. Radiographics. 2005;25(6):1471-84. doi: 10.1148/rg.256045161.
https://doi.org/10.1148/rg.256045161...
. Quando esse aspecto é encontrado, o diagnóstico pode ser feito de forma segura sem a necessidade de outros exames adicionais. O problema é que, há muitos anos, se reconhece outros tipos de características morfológicas no CAS. Há quase 30 anos, Lewandrowski et al.2020. Lewandrowski K, Warshaw A, Compton C. Macrocystic serous cystadenoma of the pancreas: a morphologic variant differing from microcystic adenoma. Hum Pathol. 1992;23(8):871-5. doi: 10.1016/0046-8177(92)90397-l.
https://doi.org/10.1016/0046-8177(92)903...
descreveram 5 casos de “adenoma microcístico” com características macrocísticas e sugeriram já na época que o termo “adenoma microcístico” fosse modificado para CAS, o que acabou ocorrendo. Outras formas atípicas para o CAS como as lesões uniloculares e até sólidas têm sido também descritas. Tais formas atípicas do CAS têm dificultado o diagnóstico do CAS1010. Chu LC, Singhi AD, Haroun RR, Hruban RH, Fishman EK. The many faces of pancreatic serous cystadenoma: Radiologic and pathologic correlation. Diagn Interv Imaging. 2017;98(3):191-202. doi: 10.1016/j.diii.2016.08.005.
https://doi.org/10.1016/j.diii.2016.08.0...
. Sperti et al.2424. Sperti C, Pasquali C, Perasole A, Liessi G, Pedrazzoli S. Macrocystic serous cystadenoma of the pancreas: clinicopathologic features in seven cases. Int J Pancreatol. 2000;28(1):1-7. doi: 10.1385/IJGC:28:1:01.
https://doi.org/10.1385/IJGC:28:1:01...
estudaram 7 casos de pacientes portadores de CAS unilocular. A maioria era mulheres com idade média de 57,1 anos e com lesões predominantemente na cabeça pancreática. O tamanho variou entre 1,3 e 15 cm. Os autores concluíram que ao identificar lesões uniloculares em pacientes sem histórico de pseudocisto, com baixos níveis de marcadores tumorais no sangue e no líquido aspirado do cisto, o diagnóstico de CAS poderia ser sugerido. Da mesma forma, agora incluindo uma série de oito pacientes com CAS macrocísticos, Chatelain et al.99. Chatelain D, Hammel P, O’Toole D, Terris B, Vilgrain V, Palazzo L, Belghiti J, Lévy P, Ruszniewski P, Fléjou JF. Macrocystic form of serous pancreatic cystadenoma. Am J Gastroenterol. 2002;97(10):2566-71. doi: 10.1111/j.1572-0241.2002.06024.x.
https://doi.org/10.1111/j.1572-0241.2002...
observaram uma prevalência do sexo feminino, idade média de 48 anos, prevalência de lesões assintomáticas e com lesões distribuídas uniformemente pelo pâncreas. O tamanho médio das lesões foi de 3 cm sendo considerado inferior àquele encontrado no CAS microcístico. Embora a maioria dos pacientes tenha sido operada por suspeita de cistoadenoma mucinoso, semelhantemente ao estudo de Sperti e cols.2424. Sperti C, Pasquali C, Perasole A, Liessi G, Pedrazzoli S. Macrocystic serous cystadenoma of the pancreas: clinicopathologic features in seven cases. Int J Pancreatol. 2000;28(1):1-7. doi: 10.1385/IJGC:28:1:01.
https://doi.org/10.1385/IJGC:28:1:01...
e ao nosso próprio estudo, em três casos, cistos milimétricos junto à parede do cisto principal foram encontrados durante o exame da EE, o que levaram os autores a suspeitar de CAS atípico.
Nosso estudo sugere, essencialmente, que é frequente o achado morfológico atípico do CAS e que esta é a principal causa para indicação cirúrgica nesses pacientes. Analisando a casuística completa, 33,3% dos pacientes (9/27) apresentavam lesões atípicas. Dessas, a lesão oligocística ou macrocística foi encontrada em 88,8% (8/9) dos casos, enquanto a forma sólida do CAS foi encontrada em 11,1% dos casos (1/9). Quando analisados apenas os casos operados, observamos que em 90% dos casos a indicação cirúrgica foi motivada pela identificação de lesões atípicas confundidas na maioria dos casos com o cistoadenoma mucinoso.
Na maioria das revisões sobre as NCP, a prevalência da apresentação atípica, particularmente as formas oligocística ou macrocística, nos pacientes portadores de CAS, tem sido descrita em 10% ou menos dos pacientes88. Burk KS, Knipp D, Sahani DV. Cystic Pancreatic Tumors. Magn Reson Imaging Clin N Am. 2018;26(3):405-420. doi: 10.1016/j.mric.2018.03.006.
https://doi.org/10.1016/j.mric.2018.03.0...
,1919. Kulzer M, Singhi AD, Furlan A, Heller MT, Katabathina VS, Mcgrath KM, Zeh HJ, Zureikat A, Dasyam AK. Current concepts in molecular genetics and management guidelines for pancreatic cystic neoplasms: an essential update for radiologists. Abdom Radiol (NY). 2018;43(9):2351-2368. doi: 10.1007/s00261-017-1452-5.
https://doi.org/10.1007/s00261-017-1452-...
,2121. Ozaki K, Ikeno H, Kaizaki Y, Maeda K, Higuchi S, Kosaka N, Kimura H, Gabata T. Pearls and pitfalls of imaging features of pancreatic cystic lesions: a case-based approach with imaging-pathologic correlation. Jpn J Radiol. 2021;39(2):118-142. doi: 10.1007/s11604- 020-01032-1.
https://doi.org/10.1007/s11604- 020-0103...
. Essa baixa prevalência, entretanto, não é consenso na literatura.
Jais et al.1717. Jais B, Rebours V, Malleo G, Salvia R, Fontana M, Maggino L, Bassi C, Manfredi R, Moran R, Lennon AM, et al. Serous cystic neoplasm of the pancreas: a multinational study of 2622 patients under the auspices of the International Association of Pancreatology and European Pancreatic Club (European Study Group on Cystic Tumors of the Pancreas). Gut. 2016;65(2):305-12. doi: 10.1136/gutjnl-2015-309638.
https://doi.org/10.1136/gutjnl-2015-3096...
analisaram 2622 pacientes no estudo com o maior número de pacientes com CAS já coletados e encontraram um índice de lesão macrocística e lesões combinadas macro e microcísticas de 32% e 18%, respectivamente. O aspecto típico microcístico foi observado em 45% dos casos. Essa discordância entre os estudos de prevalência de lesões atípicas no CAS sugere que a sua real incidência não seja de fato conhecida. Se por um lado, é de se esperar um índice maior de achados atípicos em séries cirúrgicas, por outro, nas séries com diagnóstico apenas presuntivo, sem a confirmação histológica, é impossível assumir que vários outros casos de lesões atípicas não incluídas não se tratavam de fato de CAS.
Um dos aspectos importantes na análise das lesões císticas pancreáticas é a relação do cisto com o ducto pancreático principal. Típica e diferentemente da neoplasia papilar intraductal mucinosa e do pseudocisto, o CAS não mantém comunicação com o sistema ductal. Embora a RM seja o melhor exame para o diagnóstico dessa comunicação, essa correlação não foi perfeita em nosso estudo. Em dois casos, uma comunicação com o ducto pancreático, que de fato não havia, foi sugerida pelo exame de RM. Esse foi o segundo fator determinante para a indicação de cirurgia em nossa série e foi particularmente importante em pelo menos um dos casos com uma lesão tipicamente microcística. O achado de suposta comunicação entre o cisto e o ducto pancreático principal pode acontecer, principalmente, nos CAS grandes em cabeça do pâncreas, nas quais a simples compressão do ducto pode levar à dilatação. Assim, o cisto grande e próximo do ducto dilatado acaba simulando a comunicação11. Amico EC, Alves JR, de Araújo Lima Liguori A, Sousa RL. Serous Pancreatic Cystadenoma with Compression of Wirsung’s Duct. J Gastrointest Surg. 2019;23(1):176-178. doi: 10.1007/s11605-018- 3794-x.
https://doi.org/10.1007/s11605-018- 3794...
.
A punção com análise do líquido aspirado durante o exame de EE tem sido sugerida por alguns como importante arma para melhorar o diagnóstico em casos duvidosos de cistos de pâncreas44. Ardengh JC, Brunaldi VO, Brunaldi MO, Gaspar AF, Lopes-JÚnior JR, Sankarankutty AK, Kemp R, Santos JSD. Is the new procore 20g double forward-bevel needle capable to obtain better histological samples by endoscopic ultrasound for diagnosing solid pancreatic lesions? Arq Bras Cir Dig. 2021;33(4):e1554. doi: 10.1590/0102-672020200004e1554.
https://doi.org/10.1590/0102-67202020000...
,77. Brugge WR, Lewandrowski K, Lee-Lewandrowski E, Centeno BA, Szydlo T, Regan S, del Castillo CF, Warshaw AL. Diagnosis of pancreatic cystic neoplasms: a report of the cooperative pancreatic cyst study. Gastroenterology. 2004;126(5):1330-6. doi: 10.1053/j.gastro.2004.02.013.
https://doi.org/10.1053/j.gastro.2004.02...
,1212. Costa DAPD, Guerra JG, Goldman SM, Kemp R, Santos JS, Ardengh JC, Ribas CAPM, Nassif PAN, Ribas-Filho JM. Magnetic resonance cholangiopancreatography (MRCP) versus endosonography-guided fine needle aspiration (EUS-FNA) for diagnosis and follow-up of pancreatic intraductal papillary mucinous neoplasms. Arq Bras Cir Dig. 2019;32(4):e1471. doi: 10.1590/0102-672020190001e1471.
https://doi.org/10.1590/0102-67202019000...
. A despeito disso, a maioria dos guidelines recomenda a EE apenas como exame adjuvante à tomografia computadorizada e, preferencialmente, à ressonância magnética1515. Elta GH, Enestvedt BK, Sauer BG, Lennon AM. ACG Clinical Guideline: Diagnosis and Management of Pancreatic Cysts. Am J Gastroenterol. 2018;113(4):464-479. doi: 10.1038/ajg.2018.14.
https://doi.org/10.1038/ajg.2018.14...
,1616. European Study Group on Cystic Tumours of the Pancreas. European evidence-based guidelines on pancreatic cystic neoplasms. Gut. 2018;67(5):789-804. doi: 10.1136/gutjnl-2018- 316027.
https://doi.org/10.1136/gutjnl-2018- 316...
. Enquanto a análise molecular (mutação GNAS, KRAS) é pouco disponível, a dosagem do antígeno carcinoembrionário e amilase são facilmente acessíveis em nosso meio. A EE foi realizada em nosso estudo apenas em 8 casos (29,6%), preferencialmente quando os exames convencionais de imagem eram duvidosos. Em metade desses casos, o diagnóstico de CAS foi confirmado pelo aspecto morfológico típico de lesão microcística, que não era evidente ao exame de imagem previamente realizado. Nessa situação, o endoscopista optou por não puncionar as lesões. Nos outros 4 casos, foi realizada a punção e dosagem de antígeno carcinoembrionário e amilase. Em 2 desses casos, o valor do antígeno carcinoembrionário esteve abaixo de 192 ng/ml, corroborando com o diagnóstico de lesão não-mucinosa e evitando a cirurgia e, nos outros 2 casos, o valor foi superior, o que acabou contribuindo com a indicação da cirurgia por suspeita de lesão cística mucinosa de pâncreas. Nenhuma conclusão sobre a eficácia do EE no diagnóstico diferencial da NCP pôde ser obtida, uma vez que, em apenas um pequeno número de pacientes, o exame foi realizado. A despeito disso, uma vez que a EE foi 4 vezes mais frequente no grupo do tratamento conservador, o presente estudo sugere um efeito protetor em se evitar a cirurgia quando o paciente era submetido à EE.
Vários estudos têm analisado diferentes valores de antígeno carcinoembrionário no líquido aspirado com o objetivo de diferenciar as lesões mucinosas das não-mucinosas. O valor de cut-off do antígeno carcinoembrionário de 192 ng/ml utilizado no presente estudo foi derivado de um importante trabalho multicêntrico que envolveu 341 pacientes submetidos à punção de cisto pancreático e que encontrou nesse valor uma melhor acurácia na diferenciação entre cistos mucinosos e não mucinosos77. Brugge WR, Lewandrowski K, Lee-Lewandrowski E, Centeno BA, Szydlo T, Regan S, del Castillo CF, Warshaw AL. Diagnosis of pancreatic cystic neoplasms: a report of the cooperative pancreatic cyst study. Gastroenterology. 2004;126(5):1330-6. doi: 10.1053/j.gastro.2004.02.013.
https://doi.org/10.1053/j.gastro.2004.02...
. Há, entretanto, muita controvérsia na literatura sobre qual seria o melhor valor de cut-off para definir a natureza desses cistos. Parece existir uma ampla “zona cinzenta” entre um valor baixo bastante específico de lesões não mucinosas e um valor alto, bastante específico de lesões mucinosas. Baixar ou aumentar o cut-off para aumentar a especificidade reduz bastante a sensibilidade para ambos os diagnósticos66. Boot C. A review of pancreatic cyst fluid analysis in the differential diagnosis of pancreatic cyst lesions. Ann Clin Biochem. 2014;51(Pt 2):151-66. doi: 10.1177/0004563213503819.
https://doi.org/10.1177/0004563213503819...
.
É muito provável que novas estratégias endoscópicas modernas, como a microbiópsia da parede do cisto, a endomicroscopia confocal de varredura à laser e a ultrassonografia intraductal1818. Kamata K, Kitano M. Endoscopic diagnosis of cystic lesions of the pancreas. Dig Endosc. 2019;31(1):5-15. doi: 10.1111/den.13257.
https://doi.org/10.1111/den.13257...
, uma vez validadas e tornadas disponíveis na prática clínica, possam ser responsáveis em breve por um melhor refinamento e acurácia do diagnóstico das NCP.
Nosso estudo tem algumas limitações: 1) O número de pacientes incluídos é pequeno; 2) Trata-se de uma série de pacientes extraídos de ambulatórios de cirurgia e por esse motivo se espera que naturalmente haja um viés de seleção de casos de diagnóstico difícil e; 3) A EE foi realizada em pouco menos de 30% dos casos.
CONCLUSÃO
As alternativas disponíveis na atualidade para o diagnóstico do CAS são imperfeitas. A apresentação morfológica atípica do CAS é frequente e é a principal responsável pela indicação de cirurgia nesses casos. A realização mais liberal da EE em todos os cistos uniloculares não-pseudocisto em que há suspeita de cistoadenoma mucinoso, pode ajudar a evitar as cirurgias no CAS atípico. Urge que novos métodos diagnósticos sejam desenvolvidos para que o número de pancreatectomias desnecessárias nesse cenário seja reduzido.
REFERÊNCIAS
-
1Amico EC, Alves JR, de Araújo Lima Liguori A, Sousa RL. Serous Pancreatic Cystadenoma with Compression of Wirsung’s Duct. J Gastrointest Surg. 2019;23(1):176-178. doi: 10.1007/s11605-018- 3794-x.
» https://doi.org/10.1007/s11605-018- 3794-x -
2Amico EC, Alves JR, João SA, Guimarães PL, Barreto EJ, Barreto LS, Costa PR, Medeiros JA. Complications after pancreatectomies: prospective study after ISGFP and ISGPS new classifications. Arq Bras Cir Dig. 2013;26(3):213-8. doi: 10.1590/s0102- 67202013000300011.
» https://doi.org/10.1590/s0102- 67202013000300011 -
3Ånonsen K, Sahakyan MA, Kleive D, Waage A, Verbeke C, Hauge T, Buanes T, Edwin B, Labori KJ. Trends in management and outcome of cystic pancreatic lesions - analysis of 322 cases undergoing surgical resection. Scand J Gastroenterol. 2019;54(8):1051-1057. doi: 10.1080/00365521.2019.1642379.
» https://doi.org/10.1080/00365521.2019.1642379 -
4Ardengh JC, Brunaldi VO, Brunaldi MO, Gaspar AF, Lopes-JÚnior JR, Sankarankutty AK, Kemp R, Santos JSD. Is the new procore 20g double forward-bevel needle capable to obtain better histological samples by endoscopic ultrasound for diagnosing solid pancreatic lesions? Arq Bras Cir Dig. 2021;33(4):e1554. doi: 10.1590/0102-672020200004e1554.
» https://doi.org/10.1590/0102-672020200004e1554 -
5Bassi C, Dervenis C, Butturini G, Fingerhut A, Yeo C, Izbicki J, Neoptolemos J, Sarr M, Traverso W, Buchler M; International Study Group on Pancreatic Fistula Definition. Postoperative pancreatic fistula: an international study group (ISGPF) definition. Surgery. 2005;138(1):8-13. doi: 10.1016/j.surg.2005.05.001.
» https://doi.org/10.1016/j.surg.2005.05.001 -
6Boot C. A review of pancreatic cyst fluid analysis in the differential diagnosis of pancreatic cyst lesions. Ann Clin Biochem. 2014;51(Pt 2):151-66. doi: 10.1177/0004563213503819.
» https://doi.org/10.1177/0004563213503819 -
7Brugge WR, Lewandrowski K, Lee-Lewandrowski E, Centeno BA, Szydlo T, Regan S, del Castillo CF, Warshaw AL. Diagnosis of pancreatic cystic neoplasms: a report of the cooperative pancreatic cyst study. Gastroenterology. 2004;126(5):1330-6. doi: 10.1053/j.gastro.2004.02.013.
» https://doi.org/10.1053/j.gastro.2004.02.013 -
8Burk KS, Knipp D, Sahani DV. Cystic Pancreatic Tumors. Magn Reson Imaging Clin N Am. 2018;26(3):405-420. doi: 10.1016/j.mric.2018.03.006.
» https://doi.org/10.1016/j.mric.2018.03.006 -
9Chatelain D, Hammel P, O’Toole D, Terris B, Vilgrain V, Palazzo L, Belghiti J, Lévy P, Ruszniewski P, Fléjou JF. Macrocystic form of serous pancreatic cystadenoma. Am J Gastroenterol. 2002;97(10):2566-71. doi: 10.1111/j.1572-0241.2002.06024.x.
» https://doi.org/10.1111/j.1572-0241.2002.06024.x -
10Chu LC, Singhi AD, Haroun RR, Hruban RH, Fishman EK. The many faces of pancreatic serous cystadenoma: Radiologic and pathologic correlation. Diagn Interv Imaging. 2017;98(3):191-202. doi: 10.1016/j.diii.2016.08.005.
» https://doi.org/10.1016/j.diii.2016.08.005 -
11Compagno J, Oertel JE. Microcystic adenomas of the pancreas (glycogen-rich cystadenomas): a clinicopathologic study of 34 cases. Am J Clin Pathol. 1978;69(3):289-98. doi: 10.1093/ajcp/69.1.289.
» https://doi.org/10.1093/ajcp/69.1.289 -
12Costa DAPD, Guerra JG, Goldman SM, Kemp R, Santos JS, Ardengh JC, Ribas CAPM, Nassif PAN, Ribas-Filho JM. Magnetic resonance cholangiopancreatography (MRCP) versus endosonography-guided fine needle aspiration (EUS-FNA) for diagnosis and follow-up of pancreatic intraductal papillary mucinous neoplasms. Arq Bras Cir Dig. 2019;32(4):e1471. doi: 10.1590/0102-672020190001e1471.
» https://doi.org/10.1590/0102-672020190001e1471 -
13Del Chiaro M, Segersvärd R, Pozzi Mucelli R, Rangelova E, Kartalis N, Ansorge C, Arnelo U, Blomberg J, Löhr M, Verbeke C. Comparison of Preoperative Conference-Based Diagnosis with Histology of Cystic Tumors of the Pancreas. Ann Surg Oncol. 2014;21(5):1539-44. doi: 10.1245/s10434-013-3465-9.
» https://doi.org/10.1245/s10434-013-3465-9 -
14Dindo D, Demartines N, Clavien PA. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey. Ann Surg. 2004;240(2):205-13. doi: 10.1097/01.sla.0000133083.54934.ae.
» https://doi.org/10.1097/01.sla.0000133083.54934.ae -
15Elta GH, Enestvedt BK, Sauer BG, Lennon AM. ACG Clinical Guideline: Diagnosis and Management of Pancreatic Cysts. Am J Gastroenterol. 2018;113(4):464-479. doi: 10.1038/ajg.2018.14.
» https://doi.org/10.1038/ajg.2018.14 -
16European Study Group on Cystic Tumours of the Pancreas. European evidence-based guidelines on pancreatic cystic neoplasms. Gut. 2018;67(5):789-804. doi: 10.1136/gutjnl-2018- 316027.
» https://doi.org/10.1136/gutjnl-2018- 316027 -
17Jais B, Rebours V, Malleo G, Salvia R, Fontana M, Maggino L, Bassi C, Manfredi R, Moran R, Lennon AM, et al. Serous cystic neoplasm of the pancreas: a multinational study of 2622 patients under the auspices of the International Association of Pancreatology and European Pancreatic Club (European Study Group on Cystic Tumors of the Pancreas). Gut. 2016;65(2):305-12. doi: 10.1136/gutjnl-2015-309638.
» https://doi.org/10.1136/gutjnl-2015-309638 -
18Kamata K, Kitano M. Endoscopic diagnosis of cystic lesions of the pancreas. Dig Endosc. 2019;31(1):5-15. doi: 10.1111/den.13257.
» https://doi.org/10.1111/den.13257 -
19Kulzer M, Singhi AD, Furlan A, Heller MT, Katabathina VS, Mcgrath KM, Zeh HJ, Zureikat A, Dasyam AK. Current concepts in molecular genetics and management guidelines for pancreatic cystic neoplasms: an essential update for radiologists. Abdom Radiol (NY). 2018;43(9):2351-2368. doi: 10.1007/s00261-017-1452-5.
» https://doi.org/10.1007/s00261-017-1452-5 -
20Lewandrowski K, Warshaw A, Compton C. Macrocystic serous cystadenoma of the pancreas: a morphologic variant differing from microcystic adenoma. Hum Pathol. 1992;23(8):871-5. doi: 10.1016/0046-8177(92)90397-l.
» https://doi.org/10.1016/0046-8177(92)90397-l -
21Ozaki K, Ikeno H, Kaizaki Y, Maeda K, Higuchi S, Kosaka N, Kimura H, Gabata T. Pearls and pitfalls of imaging features of pancreatic cystic lesions: a case-based approach with imaging-pathologic correlation. Jpn J Radiol. 2021;39(2):118-142. doi: 10.1007/s11604- 020-01032-1.
» https://doi.org/10.1007/s11604- 020-01032-1 -
22Sahani DV, Kadavigere R, Saokar A, Fernandez-del Castillo C, Brugge WR, Hahn PF. Cystic pancreatic lesions: a simple imaging based classification system for guiding management. Radiographics. 2005;25(6):1471-84. doi: 10.1148/rg.256045161.
» https://doi.org/10.1148/rg.256045161 -
23Slobodkin I, Luu AM, Höhn P, Fahlbusch T, Tannapfel A, Uhl W, Belyaev O. Is surgery for serous cystic neoplasms of the pancreas still indicated? Sixteen years of experience at a high-volume center. Pancreatology. 2021;21(5):983-989. doi: 10.1016/j.pan.2021.03.020.
» https://doi.org/10.1016/j.pan.2021.03.020 -
24Sperti C, Pasquali C, Perasole A, Liessi G, Pedrazzoli S. Macrocystic serous cystadenoma of the pancreas: clinicopathologic features in seven cases. Int J Pancreatol. 2000;28(1):1-7. doi: 10.1385/IJGC:28:1:01.
» https://doi.org/10.1385/IJGC:28:1:01 -
25Valsangkar NP, Morales-Oyarvide V, Thayer SP, Ferrone CR, Wargo JA, Warshaw AL, Fernández-del Castillo C. 851 resected cystic tumors of the pancreas: a 33-year experience at the Massachusetts General Hospital. Surgery. 2012;152(3Suppl1):S4-12.doi: 10.1016/j.surg.2012.05.033.
» https://doi.org/10.1016/j.surg.2012.05.033 -
26Warshaw AL, Compton CC, Lewandrowski K, Cardenosa G, Mueller PR. Cystic tumors of the pancreas. New clinical, radiologic, and pathologic observations in 67 patients. Ann Surg. 1990;212(4):432- 43; discussion 444-5. doi: 10.1097/00000658-199010000-00006.
» https://doi.org/10.1097/00000658-199010000-00006
-
1
Como citar esse artigo: Alves Jr AJT, Goto EFK, Pereira JA, Domingues FA, Ávila MG, Coy CSR, Martinez CAR. Expressão de e-caderina e claudina-3 no epitélio cólico após terapia com infliximabe: modelo experimental de colite de desuso. ABCD Arq Bras Cir Dig. 2021;34(4):e1639. https://doi.org/10.1590/0102-672020210002e1640
-
Financiamento: não há
Datas de Publicação
-
Publicação nesta coleção
31 Jan 2022 -
Data do Fascículo
2021
Histórico
-
Recebido
25 Ago 2021 -
Aceito
30 Out 2021