Resumos
A espécie Calceolaria chelidonioides (Scrophulariaceae), até então inédita nas citações científicas, foi estudada sob o ponto de vista farmacológico buscando-se identificar possíveis atividades antimicrobiana e antioxidante em metodologia in vitro. As partes aéreas dessa espécie demonstraram atividade antioxidante em modelo usando o radical livre DPPH. As flores de C. chelidonioides mostraram grande potencial antibacteriano frente à bactéria Staphylococcus aureus resistente a meticilina MRSA, um dos principais responsáveis em casos de infecção hospitalar.
Calceolaria chelidonioides; Scrophulariaceae; MRSA; DPPH
The species Calceolaria chelidonioides (Scrophulariaceae), not scientific described so for, was studied in pharmacological aspects aiming to identify some anti-microbial and antioxidant activity. The aerial parts showed antioxidant activity using in vitro DPPH model. The flowers from C. chelidonioides showed strong antibacterial potential against meticiline resistant Staphylococcus aureus (MRSA) strains the main responsible for hospital infection complications.
Calceolaria chelidonioides; Scrophulariaceae; MRSA; DPPH
ARTIGO
Atividade antioxidante e antimicrobiana de Calceolaria chelidonioides Humb. Bonpl. & Kunth.
Antioxidant and anti-microbial activity from Calceolaria chelidonioides Humb. Bonpl. & Kunth.
Deborah Q. FalcãoI, * * E-mail: fsmenezes@pharma.ufrj.br, Tel/Fax + 55-21-25626413 ; Edlaine R. CostaII; Daniela S. AlvianoIII; Celuta S. AlvianoIII; Ricardo M. KusterI; Fábio S. MenezesII
INúcleo de Pesquisas de Produtos Naturais, Centro de Ciências da Saúde, Bloco H, Universidade Federal do Rio de Janeiro, Cidade Universitária, 21941-590, RJ, Brasil
IIDepartamento de Produtos Naturais e Alimentos, Faculdade de Farmácia, Centro de Ciências da Saúde, Universidade Federal do Rio de Janeiro, Cidade Universitária, 21941-590, RJ, Brasil
IIIDepartamento de Microbiologia Professor Paulo de Góes, Centro de Ciências da Saúde, Universidade Federal do Rio de Janeiro, Cidade Universitária, 21941-590, RJ, Brasil
RESUMO
A espécie Calceolaria chelidonioides (Scrophulariaceae), até então inédita nas citações científicas, foi estudada sob o ponto de vista farmacológico buscando-se identificar possíveis atividades antimicrobiana e antioxidante em metodologia in vitro. As partes aéreas dessa espécie demonstraram atividade antioxidante em modelo usando o radical livre DPPH. As flores de C. chelidonioides mostraram grande potencial antibacteriano frente à bactéria Staphylococcus aureus resistente a meticilina MRSA, um dos principais responsáveis em casos de infecção hospitalar.
Unitermos:Calceolaria chelidonioides, Scrophulariaceae, MRSA, DPPH.
ABSTRACT
The species Calceolaria chelidonioides (Scrophulariaceae), not scientific described so for, was studied in pharmacological aspects aiming to identify some anti-microbial and antioxidant activity. The aerial parts showed antioxidant activity using in vitro DPPH model. The flowers from C. chelidonioides showed strong antibacterial potential against meticiline resistant Staphylococcus aureus (MRSA) strains the main responsible for hospital infection complications.
Keywords:Calceolaria chelidonioides, Scrophulariaceae, MRSA, DPPH.
INTRODUÇÃO
A espécie Calceolaria chelidonioides Humb. Bonpl. & Kunth, sinonímia Fagelia chelidoniodes Kuntze, é encontrada somente em regiões de altitude elevada. Embora sua composição química e propriedades farmacológicas não tenham sido estudadas cientificamente até o momento, C. chelidonioides é muito usada popularmente no Brasil para o tratamento de diferentes tipos de câncer.
O gênero Calceolaria L. ocorre na América do Sul, nas regiões de clima tropical e temperado, América Central e Nova Zelândia (Di Fabio et al., 1995; Garbarino et al., 2004). É um gênero rico em espécies de importância econômica, por serem usadas como ornamentais, e etnofarmacologicamente. As partes aéreas são usadas popularmente no Chile por suas propriedades adoçante, digestiva, diurética (Sacchetti et al., 1999) e antimicrobiana no tratamento de estomatites (Sacchetti et al., 1999; Garbarino et al., 2004). Alguns desses usos populares puderam ser comprovados cientificamente. Baseando-se nos artigos publicados na literatura, pode-se perceber que algumas espécies desse gênero se caracterizam pela presença de substâncias com potencial farmacológico bastante interessante, tais como: inseticida (Khambay; Jewess, 2000), contra Mycobacterium tuberculosis (Woldemichaelet al., 2003), tripanomicida (ativo contra a forma epimastigota do Trypanosoma cruzi) e antitumoral inibindo o crescimento de células tumorais TA3 e células TA3 resistentes a metotrexato (Morello et al., 1995).
Sob o ponto de vista químico, as espécies desse gênero têm sido bem estudadas sendo identificados diferentes diterpenos e bis-diterpenos (Chamy et al., 1989; Chamy et al., 1990; Chamy et al., 1991a) de diferentes esqueletos: pimarano (Chamy et al., 1989; Piovano et al., 1989; Chamy et al., 1990; Chamy et al., 1995a), isopimaradieno (Chamy et al., 1990; Chamy et al., 1998), pimaradieno (Chamy et al., 1991a), labdano (Garbarino et al., 2004), abietano (Chamy et al., 1987; Chamy et al., 1991b), desidroabietano (Chamy et al., 1987; Chamy et al., 1995a), estemodano (Chamy et al., 1995b), estemarano (Chamy et al., 1990; Garbarino; Molinari, 1990a; Garbarino; Molinari, 1990b; Chamy et al., 1991a; Chamy et al., 1995b) e diterpenos endoperóxidos de esqueleto abietano (Chamy et al., 1993); além de flavonóides não glicosilados (Wollenweber; Mann; Roitman, 1989), fenilpropanóides glicosilados (verbascosídeo, calceolariosídeos A-E, forsitosídeo A e isoarenariosídeo) (Nicoletti et al., 1988; Di Fabio et al., 1995) e naftoquinonas (Khambay; Jewess, 2000).
As partes aéreas de C. chelidonioides foram avaliadas quanto as atividades antioxidante, utilizando a metodologia do radical livre DPPH e antimicrobiana, frente a bactérias (Staphylococcus aureus MRSA e Staphylococcus epidermidis) e fungos (Candida albicans, Cryptococcus neoformans, Fonsecaea pedrosoi e Trychophyton rubrum).
MATERIAL E MÉTODOS
Material vegetal
O material foi coletado em setembro de 2003 no município de Macabú, no estado do Rio de Janeiro, e identificado botanicamente pela Profª. Drª. Élsie Guimarães do Jardim Botânico do Rio de Janeiro, tendo sido depositada uma amostra neste Herbário. As diferentes partes de C. chelidonioides foram separadas (em flores, folhas, caules, raízes, flores com folhas e flores com folhas e raízes) e secas à temperatura ambiente. As partes da planta foram moídas em moinho de facas e submetidas a processo de extração exaustiva por maceração estática com etanol, por 2 meses, renovando-se o solvente a cada 4 dias, obtendo-se dessa forma seis extratos diferentes. Todos os extratos etanólicos foram secos por evaporação sob pressão reduzida para total remoção do solvente. Após secagem, o resíduo vegetal foi submetido à partição líquido-líquido com solventes de diferentes polaridades (hexano, diclorometano, acetato de etila e n-butanol). As partições foram novamente evaporadas sob pressão reduzida e então usadas nos testes farmacológicos.
Atividade antioxidante
Foi testada a atividade seqüestrante de radicais livres dos extratos etanólicos das diferentes partes de C. chelidonioides utilizando o modelo fotocolorimétrico in vitro do radical livre estável DPPH (2,2-difenil-1-picrilidrazila) (Mensor et al., 2001). Nesse modelo 1 mL da solução de DPPH foi adicionado a 2,5 mL de uma solução do extrato suspendido em etanol nas concentrações de 250, 125, 50, 25, 10 e 5 µg/mL. Essa reação transcorreu em temperatura ambiente, por 30 min, e em seguida a absorbância foi lida em 518 nm. O branco foi feito adicionando-se 1 mL de etanol a 2,5 mL de amostra. Como controle negativo usou-se a mistura de 1 mL da solução de DPPH com 2,5 mL de etanol. As atividades antioxidante percentuais foram obtidas por regressão linear para o extrato, chegando-se assim à concentração necessária para se obter 50% do efeito antioxidante máximo estimado em 100% (CE50) (Mensor et al., 2001). A atividade antioxidante dos extratos testados foi comparada com a CE50 obtida ao se realizar o mesmo ensaio com o extrato padronizado de Ginkgo biloba (EGb 761â), controle positivo, reconhecido por sua elevada atividade antioxidante. Os testes foram feitos em duplicata.
Atividade antimicrobiana
Todos os extratos etanólicos e as partições em hexano, diclorometano e acetato de etila dos extratos de flores e a partição em acetato de etila dos caules foram testados frente aos fungos: Candida albicans sorotipo B ATCC 36802, Cryptococcus neoformans T1-444 sorotipo A (Universidade Federal de São Paulo, UNIFESP-SP), Trichophyton rubrum T544, Fonsecaea pedrosoi 5VPL (coleção de fungos do Hospital Clementino Fraga Filho da UFRJ); e bactérias: Staphylococcus aureus MRSA (BMB9393) (Hospital Clementino Fraga Filho da UFRJ) e Staphylococcus aureus ATCC 25923. Foi usada a metodologia de difusão em ágar onde aplica-se o extrato a ser testado diretamente no meio previamente inoculado com o microrganismo, sem a utilização de discos estéreis (Hili; Evans; Veness, 1997). Os extratos foram solubilizados em 500 µl do solvente original e diluidos em 500 µl de água destilada para obtenção de uma concentração final de 50 mg/ml. O controle foi feito com anfotericina B (1 mg/mL) para os fungos e vancomicina (1 mg/mL) para as bactérias. As placas foram incubadas a 37°C durante 24h a 7 dias, variando em função do microrganismo testado. Após esse período o diâmetro do halo de inibição foi medido com régua, em centímetros. A formação do halo de inibição no local onde foi aplicada a amostra indica a sensibilidade do microrganismo ao mesmo, sendo passível de ocorrer resultados atípicos principalmente em testes com microrganismos mutantes ou resistentes. Neste caso, é observado um halo de inibição mas com a presença de algumas colônias na região; a isto se dá o nome de pseudo-halo (Falcão, 2003). Os testes foram feitos em duplicata.
RESULTADOS E DISCUSSÃO
Atividade antioxidante
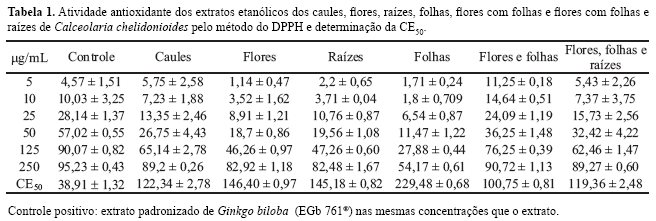
A Tabela 1 demonstra a atividade antioxidante dos extratos etanólicos testados em comparação com o extrato padronizado de Ginkgo biloba usado como controle. Todos os extratos demonstraram certa capacidade de seqüestrar radicais livres na metodologia testada, principalmente na maior concentração usada (250 µg/mL), sendo o extrato de folhas o que apresentou menor potencial. Ao se comparar a concentração efetiva 50% (CE50) dos extratos com a obtida com o controle, pôde-se observar que nenhum extrato de C. chelidonioides foi tão ativo quanto o de Ginkgo biloba (EGb 761®). Vale ressaltar que, embora o extrato de flores e folhas tenha apresentado maior CE50 do que o controle, apresentou alta atividade nas menores concentrações (5 e 10 µg/mL), sendo bem superiores às observadas com o G. biloba e com os extratos de flores e folhas separadamente, indicando que as substâncias responsáveis pela atividade possivelmente se encontram diluídas nos extratos individualizados ou apresentam efeito sinérgico quando misturadas. O mesmo pode ser observado comparando-se a atividade (CE50) observada para o extrato de flores, folhas e raízes com os respectivos extratos individualizados. Esse efeito sinérgico da atividade é em função da comparação das misturas com os extratos isolados, de uma maneira geral.
Atividade antimicrobiana
A Tabela 2 mostrou a atividade antibacteriana e antifúngica dos extratos etanólicos e partições testadas observada através da formação do halo de inibição do crescimento microbiano em diâmetro (cm). Os extratos etanólicos de caules, raízes e partição hexânica de flores não apresentaram atividade frente aos microrganismos testados. Todos os demais extratos e partições apresentaram atividade frente à cepa de S. aureus resistente a meticilina (MRSA), sendo o resultado do extrato de flores superior ao do controle e o de folhas, semelhante ao controle feito com vancomicina na concentração de 1mg/mL. Essa atividade é de grande importância devido ao alto grau de patogenicidade e resistência dessa cepa. MRSA é comumente encontrado em hospitais, sendo o principal responsável em casos de infecção hospitalar (Kantzanou et al., 1999). Embora o extrato etanólico de flores tenha sido o que apresentou melhores resultados dentre os testados, esta atividade mostrou-se diminuída ao ser comparado com suas partições, indicando que possivelmente os metabólitos responsáveis pela atividade sejam de maior polaridade, estando retidos na partição butanólica não testada ou devido ao sinergismo entre as diferentes substâncias presentes no extrato etanólico total.
Embora a composição química da espécie ainda não seja conhecida, pode-se esperar a presença de derivados terpenoídicos, principalmente diterpenos, e de origem biossintética mista, flavonóides.
CONCLUSÃO
Os estudos com C. chelidonioides estão em fase preliminar, mas indicam grande potencial no controle de S. aureus resistente a antibiótico sintético. Os metabólitos responsáveis pela atividade antibacteriana parecem estar presentes em maiores concentrações nas flores e, aqueles responsáveis pela atividade sequestrante de radicais livres predominam nas flores e folhas, usadas juntamente. Esse estudo colabora, portanto, para o conhecimento de uma espécie originalmente brasileira, até então inédita cientificamente.
Recebido em 06/06/05
Aceito em 15/12/05
- Chamy MC, Piovano M, Gambaro V, Garbarino JA, Nicoletti M 1987. Dehydroabietane diterpenoids from Calceolaria ascendens. Phytochemistry 26: 1763-1765.
- Chamy MC, Piovano M, Garbarino JA, Gambaro V, Miranda C 1989. Foliosate, a bis-diterpene and 9-epi-ent-7,15-isopimaradieneˇderivatives from Calceolaria foliosa Phytochemistry 28: 571-574.
- Chamy MC, Piovano M, Garbarino JA, Miranda C, Gambaro V 1990. Diterpenes from Calceolaria lepida. Phytochemistry 29: 2943-2946.
- Chamy MC, Piovano M, Garbarino JA, Gambaro V 1991a. Diterpenes from Calceolaria polifolia. Phytochemistry 30: 3365-3368.
- Chamy MC, Piovano M, Garbarino JA, Miranda C, Gambaro V, Rodriuguez ML, Ruiz-Perez C, Brito I 1991b. Diterpenoids from Calceolaria thyrsiflora. Phytochemistry 30: 589-592.
- Chamy MC, Piovano M, Garbarino JA, Pascard C, Cesario M 1993. Endoperoxide diterpenes from Calceolaria purpurea. Phytochemistry 34: 1103-1106.
- Chamy MC, Piovano M, Garbarino JA, Chaparro A 1995a. Diterpenoids from Calceolaria hypericina. Phytochemistry 40: 1209-1212.
- Chamy MC, Piovano M, Garbarino JA, Vargas C 1995b. Diterpenoids from Calceolaria dentata. Phytochemistry 40: 1751-1754.
- Chamy MC, Piovano M, Garbarino JA, Amestica MP 1998. Diterpenoids from Calceolaria glandulifera. Phytochemistry 49: 2595-2597.
- Di Fabio A, Bruni A, Poli F, Garbarino JA, Chamy MC, Piovano M, Nicoletti M 1995. The distribution of phenylpropanoid glycosides in chilean Calceolaria spp. Biochem Syst Ecol 23: 179-182.
- Falcăo DQ 2003. Estudo químico e farmacológico de quatro espécies de Hyptis do estado do Rio Grande do Sul Rio de Janeiro, 147p. Dissertaçăo de Mestrado - Programa de Pós-Graduaçăo em Cięncias Farmacęuticas, Universidade Federal do Rio de Janeiro.
- Garbarino JA, Chamy MC, Piovano M, Espinoza L, Belmonte E 2004. Diterpenoids from Calceolaria inamoena Phytochemistry 65: 903-908.
- Garbarino JA, Molinari A 1990a. A stemarane diterpene from Calceolaria kingii. Phytochemistry 29:3040-3041.
- Garbarino JA, Molinari A 1990b. Diterpenoids from Calceolaria latifolia. Phytochemistry 29: 3037-3039.
- Hili P, Evans CS, Veness RG 1997. Antimicrobial action of essential oils: the effect of dimethylsulphoxide on the activity of cinnamon oil. Lett Appl Microb 24: 269-275.
- Kantzanou M, Panayotis T, Tseleni A, Maniatis AN, Vatopoulos ACE, Legakis NJ 1999. A multi-centre study of nosocomial methicillinresistant Staphylococcus aureus in Greece. Int J Antimicrob Agents 12: 115-119.
- Khambay BPS, Jewess P 2000. The potential of natural naphthoquinones as the basis for a new class of pest control agents - an overview of research at IACR-Rothamsted. Crop Prot 19: 597-601.
- Mensor LL, Menezes FS, Leităo GG, Reis AS, dos Santos TC, Coube CS, Leităo SG 2001. Screening of Brazilian plant extracts for antioxidant activity by the use of DPPH free radical method. Phytother Res 15: 127-130.
- Morello A, Pavani M, Garbarino JA, Chamy MC, Frey C, Mantilla J, Guerrero A, Repetto Y, Ferreira J 1995. Effects and mode of action of 1,4-naphthoquinones isolated from Calceolaria sessilis on tumoral cells and Trypanosoma parasites. Comp Biochem Physiol 112C: 119-128.
- Nicoletti M, Galeffi C, Messana I, Marini-Bettolo GB, Garbarin JA, Gambaro V 1988. Phenylpropanoid glycosides from Calceolaria hypericina Phytochemistry 27: 639-641.
- Piovano M, Chamy MC, Garbarino JA, Gambaro V 1989. 9-epi-ent-7,15-Isopimaradiene derivatives from Calceolaria glandulosa Phytochemistry 28: 2844 - 2845.
- Sacchetti G, Romagnoli C, Nicoletti M, Di Fabio A, Bruni A, Poli F 1999. Glandular trichomes of Calceolaria adscendens Lidl. (Scrophulariaceae): Histochemistry, development and ultrastructure. Ann Bot 83: 87-92.
- Woldemichael GM, Franzblau SG, Zhang F, Wang Y, Timmermann BN 2003. Inhibitory effect of sterols from Ruprechtia triflora and diterpenes from Calceolaria pinnifolia on the growth of Mycobacterium tuberculosis Planta Med 69: 628-631.
- Wollenweber E, Mann K, Roitman JN 1989. Flavonoid aglycones excreted by three Calceolaria species. Phytochemistry 28: 2213-2214.
Datas de Publicação
-
Publicação nesta coleção
26 Fev 2008 -
Data do Fascículo
Mar 2006
Histórico
-
Aceito
15 Dez 2005 -
Recebido
06 Jun 2005